文章信息
- 杨春勐, 张树斌, 陈爱国, 杨大新
- YANG Chunmeng, ZHANG Shubin, CHEN Aiguo, YANG Daxin
- 干热河谷稀树灌丛优势植物叶片热值及养分特征
- Caloric value and nutrients in the leaves of dominant savanna plant species in Yuanjiang dry-hot valley
- 森林与环境学报,2019, 39(1): 54-60.
- Journal of Forest and Environment,2019, 39(1): 54-60.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2019.01.010
-
文章历史
- 收稿日期: 2018-03-21
- 修回日期: 2018-05-18
2. 中国科学院西双版纳热带植物园元江干热河谷生态站, 云南 元江 653300
2. Yuanjiang Savanna Ecosystem Research Station, Xishuangbanna Tropical Botanical Garden, Chinese Academy of Sciences, Yuanjiang, Yunnan 653300, China
热值是指单位质量干物质完全燃烧所释放的热量,反映绿色植物在光合作用中转化光能的能力[1]及各种环境因子对植物的影响,体现了植物的能量代谢水平,可作为评价植物生长状况的一个有效指标[2]。热值还是生态系统研究过程中的必要参数之一,与植物干物质结合可以评价生态系统初级生产力[1]。因此,热值在研究生态系统的物质循环和能量转化中发挥重要作用。养分是影响植物生长发育的主要因素之一,尤其是C、N、P、K作为植物生长发育所必需的元素,在植物体构成和生理代谢方面发挥不可替代的作用[3], 植物热值的高低与营养元素的组成和种类有密切关系[4]。国外对热值的研究较早[5-6],国内关于热值的研究较晚,最早主要针对草原草甸生态系统[7-8],随后,学者们开始研究森林生态系统中各种植物及其营养器官之间的热值[9]。热值的大小不仅仅与植物各营养器官有关,还与矿质元素[10]、气候和土壤类型[11-12]、纬度和海拔[12]等密切相关。
我国西南干热河谷地区,由于受到气流局部环流和焚风效应的影响,形成了特殊的干热气候[13],在极端干热生境下发育形成了典型的稀树灌草丛的植被,又称为河谷型萨王纳(valley-type savanna),它是世界萨王纳植被的河谷残存者,有着重要的研究价值[14-15]。然而,对于稀树灌丛植物热值、灰分以及养分特征的研究鲜见报道,本课题组选择云南省元江干热河谷稀树灌丛植被为研究对象,测定不同生活型植物热值、灰分和C、N、P等养分元素含量,探讨不同生活型植物的热值和养分的差异,有助于阐述干热河谷不同生活型植物能量储存特征,可为干热河谷植物热值、能量转化和养分循环规律的研究提供基础数据,并为我国西南地区干热河谷退化生态系统的恢复提供参考。
1 研究区概况与研究方法 1.1 研究区概况研究区位于中国科学院西双版纳热带植物园元江干热河谷生态站,北纬23°27′56″,东经102°10′40″,海拔481 m。根据2012—2017年的气象观测,该区年平均气温24. 7 ℃,年平均降水量732. 8 mm (其中雨季5—10月的降水量占78%),潜在蒸发量1 750 mm。土层较薄,土壤主要以燥红壤和赤红壤为主。基于样地调查,该区稀树灌丛的乔木以厚皮树[Lannea coromandelica (Houtt.) Merr.]、细基丸[Polyalthia cerasoides (Roxb.) Benth. et Hook. f. ex Bedd.]、心叶木[Haldina cordifolia (Roxb.) Ridsd.]等为优势种,高度3~8 m,盖度20%~30%;灌木以虾子花[Woodfordia fruticosa (L.) Kurz.]、白皮乌口树[Tarenna depauperata Hutchins.]、马松子[Melochia corchorifolia L.]等为优势种,高度0. 5~3 m,盖度35%~45%;草本多以扭黄茅[Heteropogon contortus (Linn.) P. Beauv. ex Roem. et Schult.]、锈色蛛毛苣苔[Paraboea rufescens (Franch.) Burtt.]等为优势种,高度10~60 cm,盖度60%~80%。
1.2 样品采集与制备2015年9月,植物处于生长旺盛期,在研究区内50 m×50 m的植物样地进行取样。根据样地内各层植物种的重要值确定优势种,植物重要值=相对频度+相对密度+相对显著度(或相对盖度),群落内各层排名靠前的植物定为优势种。按照中国生态系统研究网络(Chinese ecosystem research network,CERN)的生物观测规范进行采样,在样地内选取5个10 m×10 m的样方,每个样方内按照平均木标准选择同种乔木和灌木2~3株,草本在每个10 m×10 m的样方中随机选择3个1 m×1 m的小样方进行采样,同一植物混合为1个重复,每个物种重复5次。采集植物包括乔木(厚皮树、细基丸和心叶木)、灌木(虾子花、白皮乌口树、马松子)和草本(扭黄茅和锈色蛛毛苣苔)。乔木和灌木取样标准如下[16]:将树冠从上到下分3层,采集大小基本一致,东南西北中5个方向的新叶和老叶,按1 : 1进行采集,样品鲜质量约500 g;草本植物直接剪取叶片。采集好的样品风干后在80 ℃下烘干至恒重,小型粉碎机进行粉碎过孔缝0. 250 mm筛后用于热值、灰分和养分的测定。
1.3 指标测定干质量热值(gross caloric value, GCV)采用热值分析仪(IKA C5000,德国)测定,灰分含量(content of ash, AC)采用干灰化法测定[8-9],去灰分热值(ash free caloric value, AFCV)采用干质量热值和灰分含量计算得到[17],去灰分热值=干质量热值/ (1-灰分含量×0. 001)。碳(C)和氮(N)含量采用碳氮分析仪测定;磷(P)、钾(K)、钙(Ca)、镁(Mg)和硫(S)含量采用硝酸-高氯酸消煮法测定(CERN观测规范)。
1.4 数据分析数据分析采用SPSS 19. 0软件进行,利用单因素方差分析(one-way ANOVA)比较不同生活型植物的热值、灰分及养分含量的差异,并采用Student-Newman-Keuls (SNK)检验进行多重比较,显著水平设为0. 05。
2 结果与分析 2.1 不同生活型植物叶片热值元江干热河谷稀树灌丛8种优势植物叶的灰分含量、干质量热值和去灰分热值如表 1所示。8种优势植物叶的平均干质量热值和去灰分热值分别为16. 71和20. 21 kJ · g-1,去灰分热值大小为细基丸>白皮乌口树>心叶木>厚皮树>虾子花>马松子>扭黄茅>锈色蛛毛苣苔。不同生活型中,种间的干质量热值和去灰分热值存在显著差异。从乔木来看,细基丸的干质量热值和去灰分热值最高,分别为20. 33和21. 79 kJ · g-1,且显著高于心叶木2. 83%和1. 87%,显著高于厚皮树8. 83%和6. 24% (P < 0. 05),而灰分含量则反之。从灌木来看,虾子花的干质量热值最小(P < 0. 05);白皮乌口树干质量热值最高(P < 0. 05),同时,其去灰分热值也是最高的(P < 0. 05)。从草本来看,扭黄茅叶的干质量热值和去灰分热值均显著高于锈色蛛毛苣苔(P < 0. 05),而灰分含量则相反。
| 生活型 Life form |
植物名称 Plant name |
灰分含量 Content of ash/% |
干质量热值 Gross caloric value/(kJ·g-1) |
去灰分热值 Ash free caloric value/(kJ·g-1) |
| 乔木Trees | 厚皮树L. coromandelica | 8.94±0.05c | 18.68±0.07a | 20.51±0.07a |
| 心叶木Haldina cordifolia | 7.56±0.02b | 19.77±0.03b | 21.39±0.03b | |
| 细基丸Polyalthia cerasoides | 6.72±0.86a | 20.33±0.01c | 21.79±0.01c | |
| 平均Average | 7.74±0.25A | 19.59±0.19B | 21.23±0.15C | |
| 灌木Shrubs | 白皮乌口树T. depauperata | 6.80±0.032b | 20.12±0.01c | 21.59±0.01b |
| 虾子花W. fruticosa | 8.68±0.49c | 18.31±0.03a | 20.06±0.09a | |
| 马松子M. corchorifolia | 5.44±0.04a | 18.95±0.01b | 20.04±0.01a | |
| 平均Average | 6.97±0.39A | 19.13±0.20B | 20.56±0.20B | |
| 草本Herbs | 扭黄茅Heteropogon contortus | 11.78±0.29a | 16.94±0.05b | 19.20±0.04b |
| 锈色蛛毛苣苔Paraboea rufescens | 68.28±0.82b | 5.87±0.22a | 18.48±0.37a | |
| 平均Average | 40.30±9.43B | 11.41±1.85A | 18.84±0.21A | |
| 注:表中不同小写字母表示同一生活型不同植物间的差异显著(P < 0.05);表中不同大写字母表示不同生活型间的差异显著(P < 0.05)。Note: different small letters mean significant difference between different plants of the same life type at 0. 05 level; different capital letters mean significant difference between different life types at 0. 05 level. | ||||
从不同生活型来看,平均干质量热值和平均去灰分热值从高到低排序均为乔木>灌木>草本,其中乔木显著高于草本71. 84%和67. 81% (P < 0. 05),灌木显著高于草本12. 69%和9. 13% (P < 0. 05)。对于灰分含量而言,草本的平均灰分含量最高(P < 0. 05),灌木最低,从高到低为草本>乔木>灌木。
2.2 不同生活型植物叶片养分元江干热河谷稀树灌丛8种优势植物叶片的养分含量特征如图 1所示。从图 1可知,C在植物各种元素组成中占比较大,除锈色蛛毛苣苔外,植物叶片中的C含量均高于其他元素。C含量大小为细基丸>白皮乌口树>心叶木>厚皮树>马松子>虾子花>扭黄茅>锈色蛛毛苣苔,其中,细基丸C含量最高(483. 00 g · kg-1),锈色蛛毛苣苔最低。N含量的大小为白皮乌口树>细基丸>心叶木>厚皮树>马松子>虾子花>锈色蛛毛苣苔>扭黄茅,以白皮乌口树的平均N含量最高,扭黄茅最低。P含量表现为细基丸>心叶木>厚皮树>马松子>虾子花>白皮乌口树>锈色蛛毛苣苔>扭黄茅,其中心叶木、厚皮树和细基丸显著高于其他植物(P < 0.05)。K含量表现为心叶木最高,为28. 15 g · kg-1,细基丸次之,最小的是锈色蛛毛苣苔,为5. 17 g · kg-1。Ca含量表现为锈色蛛毛苣苔>厚皮树>虾子花>白皮乌口树>马松子>细基丸>心叶木>扭黄茅。Mg和S含量在各植物叶片中的含量较其它元素低,Mg含量表现为锈色蛛毛苣苔显著高于扭黄茅(P < 0.05),细基丸显著高于心叶木和厚皮树(P < 0.05),说明Mg在不同的植物层次之中的分布也不相同。S的含量表现为细基丸最高,厚皮树次之,锈色蛛毛苣苔最低。
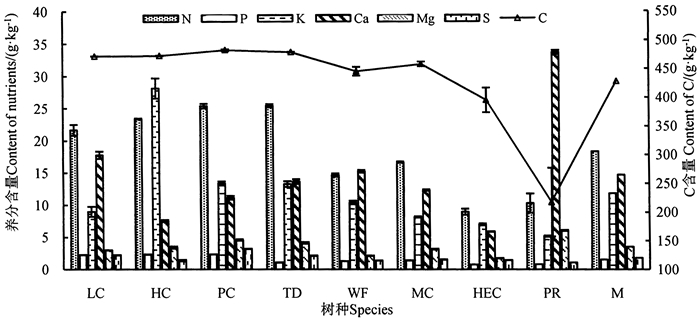
|
注:LC表示厚皮树;HC表示心叶木;PC表示细基丸;TD表示白皮乌口树;WF表示虾子花;MC表示马松子;HEC表示扭黄茅;PR表示锈色蛛毛苣苔;M表示所有物种的平均值。Note:LC is L. coromandelica;HC is Haldina cordifolia;PC is Polyalthia cerasoides;TD is T. depauperata;WF is W. fruticosa;MC is M. corchorifolia;HEC is Heteropogon contortus;PR is Paraboea rufescens;M is mean value of all the sampled species. 图 1 8种优势植物叶片的养分含量 Fig. 1 Nutrient contents in the leaves of the eight dominant species |
元江干热河谷稀树灌丛不同生活型植物叶片的养分含量如图 2所示。由图 2可知,N、P和K含量表现为乔木最高,草本层最低,Ca含量则是草本最高,而Mg和S含量在不同生活型之间差异不显著。乔木C含量略高于灌木,草本最低(P < 0.05)。从整体来看,乔木和灌木的C含量最高,N、K和Ca次之,P、Mg和S较低;草本中C含量最高,Ca次之,其他元素较低。
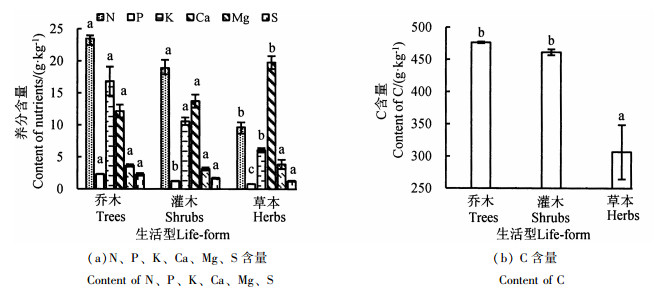
|
注:图中不同小写字母表示不同生活型间的差异显著(P < 0.05)。Note: the significant difference between different life types are expressed by different letters (P < 0.05). 图 2 不同生活型植物叶片养分元素含量 Fig. 2 Nutrient contents in the leaves of different life type plants |
元江干热河谷稀树灌丛8种优势植物热值与养分相关性分析(表 2)表明,干质量热值与全C、全N、全P、全K和全S含量呈极显著正相关(P < 0.01),与全Ca、全Mg和灰分含量呈极显著负相关(P < 0.01)。去灰分热值与全C、全N、全P、全K、全S含量和干质量热值呈极显著正相关(P < 0.01),与全Ca和灰分含量呈极显著负相关(P < 0.01),与全Mg含量呈负相关(P>0.05)。灰分含量与全Ca和全Mg含量呈极显著正相关(P < 0.01),与全C、全N、全P和全S含量呈极显著负相关(P < 0.01),与全K含量呈显著负相关(P < 0.05)。
| 因素Factor | 全碳 Total C |
全氮 Total N |
全磷 Total P |
全钾 Total K |
全钙 Total Ca |
全镁 Total Mg |
全硫 Total S |
灰分含量 AC |
干质量热值 GCV |
去灰分热值 AFCV |
| 全碳Total C | 1 | |||||||||
| 全氮Total N | 0.704** | 1 | ||||||||
| 全磷Total P | 0.530** | 0.714** | 1 | |||||||
| 全钾Total K | 0.420** | 0.592** | 0.595** | 1 | ||||||
| 全钙Total Ca | -0.685** | -0.312 | -0.295 | -0.469** | 1 | |||||
| 全镁Total Mg | -0.447** | 0.176 | 0.019 | -0.020 | 0.699** | 1 | ||||
| 全硫Total S | 0.499** | 0.686** | 0.588** | 0.099 | -0.282 | 0.134 | 1 | |||
| 灰分含量AC | -0.850** | -0.524** | -0.452** | -0.387* | 0.875** | 0.680** | -0.459** | 1 | ||
| 干质量热值GCV | 0.866** | 0.648** | 0.532** | 0.472** | -0.847** | -0.561** | 0.543** | -0.986** | 1 | |
| 去灰分热值AFCV | 0.638** | 0.886** | 0.669** | 0.645** | -0.522** | -0.009 | 0.686** | -0.671** | 0.785** | 1 |
| 注:* *在0. 01水平上显著相关,*在0. 05水平上显著相关。Note: * * means significant correlation at 0. 01 level;* means significant correlation at 0. 05 level. | ||||||||||
热值的高低能够反映植物把光能转化为化学能的效率。对不同物种或不同生境下的同一物种的热值比较时,应采用去灰分热值[18],去灰分热值能够消除灰分含量对热值的影响,较准确地反映植物利用光能的效率[1]。由于植物的灰分含量与热值密切关联,研究表明:灰分含量每升高1%,其热值约降低0. 2 MJ · kg-1[19]。元江干热河谷稀树灌丛8种优势植物平均去灰分热值为20. 21 kJ · g-1,明显高于世界陆生植物的平均去灰分热值(17. 79 kJ · g-1) [20]。不同生活型植物的平均去灰分热值大小顺序为乔木>灌木>草本,这与前人研究一致[21-22],不同生活型植物储存能量的表现是相对稳定的,基本都遵循从上而下减少的规律。稀树灌丛群落冠层开阔,乔木株高根深,叶片较大,比灌木更有利于获取光能,而草本植株矮小,处于灌木丛下荫蔽生境,可利用的光能较少,热值相对较低。可见,乔木光能的吸收和转化利用能力高于灌木和草本[23]。同一层次中,不同植物去灰分热值存在差异,体现了种间差异性[11],不同层次间植物的热值差异,因植物种类、生境、植物器官以及空间时间的不同而发生变化[24]。西双版纳热带季节雨林和哀牢山中山湿性常绿阔叶林优势植物鲜叶热值范围较大,不同种类间存在差异[25]。元江干热河谷稀树灌丛不同生活型中各植物热值也存在较大差异,植物热值与自身的遗传特性和生活节律等因素有关[26]。如白皮乌口树的去灰分热值要高于心叶木和厚皮树,由于植物个体的自身差异,捕捉光能的能力不同,白皮乌口树为常绿植物,能够长期捕捉更多的光能,积累热值。
元素含量对于热值的影响较大[27],特别是全C含量,植物的热值与全C含量呈正相关关系,全C含量越高,去灰分热值越大[10-28]。C是构成植物体内有机物碳支架的基本元素,它的多少能够反映有机物的含量,并与热值呈显著正相关[29]。元江干热河谷稀树灌丛8种植物的去灰分热值与C含量呈极显著正相关(P < 0.01),各植物C含量的大小排序与去灰分热值基本一致,说明植物体内的C含量对植物去灰分热值影响较大。植物的热值不仅与有机物含量有关,也与N、P、K等养分含量有关[30]。研究表明,厚荚相思(Acacia crassicapa)叶的去灰分热值与N和P含量呈极显著正相关关系[11]。元江干热河谷稀树灌丛8种植物平均去灰分热值与全N、K、P、S含量呈极显著正相关(P < 0.01),与Ca、灰分含量呈极显著负相关(P < 0.01),可能由于N、P、K、S含量是植物多种氨基酸的组成部分,是合成蛋白质、高能有机物的必须元素,而Ca和Mg不易燃烧,不能产生大量能量。
当植物长期处于胁迫环境时,热值表现为下降[31]。有研究表明[27],年平均温度与叶片热值显著负相关,叶片热值与年降水量、干燥度均呈极显著负相关。然而,元江干热河谷稀树灌丛8种优势植物的平均去灰分热值(20.21 kJ · g-1)接近于美国萨瓦纳群落(20.27 kJ · g-1) [5],高于新疆额尔齐斯河流域典型地区灌木的热值[32],与福州鼓山季风常绿阔叶林叶片热值接近[33]、高于福建东山岛季风常绿阔叶林植物热值[11]。这与常绿乔木或灌木热值一般高于落叶乔木或灌木不一致[34],这是因为,元江干热河谷日照充足,雨季集中在5—10月,土壤中含有相对其他稀树草原高的N、P、K、Ca和Mg等[35],有利于光合作用,迫使落叶植物在较短的生长季节里积累含能量较高的物质,并储存在各个器官来应对干旱与高温胁迫。研究表明[36],叶片C含量的增加,可减缓植物生长,水分消耗降低,有利于对干旱环境的适应。光照有效性是植物叶热值最重要的影响因素[37],同时气候干热也有利于叶片热能的积累[27]。热值不仅与植物的种类有关,还与纬度[23, 38]、日照强度和长短、土壤[11]和系统发育、气候等关系密切[39]。热值越高表示植物的能量代谢水平高,对生长的适应能力越强[31],而在退化的生态系统中需要以对环境适应能力强的物种作为先锋物种。落叶习性是植物适应干旱、高温环境的一种策略[35]。元江干热河谷植物经过长期的生态适应,在生长旺盛期通过产生高效的叶片,叶片营养浓度和光合能力较高,表现出抗旱适应性[35]。但由于更新快,死亡率高,对于人为干扰比较敏感,生态系统脆弱,一旦破坏,很难恢复。因此,对于退化的元江干热河谷生态系统的植被恢复要高度重视,元江干热河谷稀树灌丛8种优势植物具有较高的热值,生长适应能力较强,可为干热河谷退化的生态系统恢复和重建提供参考。
4 结论元江干热河谷8种优势植物叶的平均去灰分热值表现为乔木>灌木>草本,灰分含量为草本>乔木>灌木。种间去灰分热值大小顺序为细基丸>白皮乌口树>心叶木>厚皮树>虾子花>马松子>扭黄茅>锈色蛛毛苣苔。相关性分析表明,元江干热河谷优势植物热值与C、N、P、K和S呈极显著正相关,与全Ca和灰分含量呈极显著负相关。元江干热河谷年太阳辐射较强,植物经过长期的自然选择,产生高光合的叶片,积累较高的热值,对环境适应能力强,所测植物可为该区域生态恢复和水土保持提供参考。
| [1] | 鲍雅静, 李政海, 韩兴国, 等. 植物热值及其生物生态学属性[J]. 生态学杂志, 2006, 25(9): 1095–1103. DOI:10.3321/j.issn:1000-4890.2006.09.017 |
| [2] | 林鹏, 林光辉. 几种红树植物的热值和灰分含量研究[J]. 植物生态学与地植物学学报, 1991, 15(2): 114–120. |
| [3] | MARSCHNER H. Marschner's mineral nutrition of higher plants[M]. 3rd ed. London: Academic Press, 2011. |
| [4] | 徐永荣, 张万均, 冯宗炜, 等. 天津滨海盐渍土上几种植物的热值和元素含量及其相关性[J]. 生态学报, 2003, 23(2): 450–455. |
| [5] | LONG F L. Application of calorimetric methods to ecological research[J]. Plant Physiology, 1934, 9(2): 323–337. DOI:10.1104/pp.9.2.323 |
| [6] | GOLLEY F B. Energy values of ecological materials[J]. Ecology, 1961, 42(3): 581–584. DOI:10.2307/1932247 |
| [7] | 杨福囤, 何海菊. 高寒草甸地区常见植物热值的初步研究[J]. 植物生态学与地植物学丛刊, 1983, 7(4): 280–288. |
| [8] | 龙瑞军, 徐长林, 胡自治, 等. 天祝高山草原15种饲用灌木的热值及季节动态[J]. 生态学杂志, 1993, 12(5): 13–16. |
| [9] | 林华, 曹敏, 张建侯. 中国西南地区热带季节雨林及山地常绿阔叶林热值及能量分配格局[J]. 植物生态学报, 2007, 31(6): 1103–1110. |
| [10] | 叶功富, 高伟, 陈增鸿, 等. 滨海沙地主要优势树种凋落物热值与养分特征[J]. 东北林业大学学报, 2014, 42(8): 57–60. DOI:10.3969/j.issn.1000-5382.2014.08.012 |
| [11] | 朱美琴, 叶功富, 游水生, 等. 东山岛海岸带季风常绿阔叶林各层次优势种的热值[J]. 福建农林大学学报(自然科学版), 2012, 41(3): 248–252. DOI:10.3969/j.issn.1671-5470.2012.03.005 |
| [12] | 汪洋, 苗琳琳, 于丹, 等. 青藏高原3种生活型水生植物的热值及环境的影响[J]. 植物生态学报, 2017, 41(2): 209–218. |
| [13] | 姜汉侨. 云南植被分布的特点及其地带规律性[J]. 云南植物研究, 1980, 2(1): 22–32. |
| [14] | 许再富, 陶国达, 禹平华, 等. 元江干热河谷山地五百年来植被变迁探讨[J]. 云南植物研究, 1985, 7(4): 403–412. |
| [15] | 金振洲, 欧晓昆. 元江、怒江、金沙江、澜沧江干热河谷植被[M]. 昆明: 云南大学出版社, 2000. |
| [16] | 杨国平, 巩合德, 郑征, 等. 哀牢山常绿阔叶林优势树种热值与养分特征[J]. 浙江农林大学学报, 2010, 27(2): 251–258. DOI:10.3969/j.issn.2095-0756.2010.02.015 |
| [17] | 陈美玲, 上官周平. 四种园林植物的热值与养分特征[J]. 应用生态学报, 2008, 19(4): 747–751. |
| [18] | 林益明, 林鹏, 王通. 几种红树植物木材热值和灰分含量的研究[J]. 应用生态学报, 2000, 11(2): 181–184. DOI:10.3321/j.issn:1001-9332.2000.02.006 |
| [19] | CASSIDA K A, MUIR J P, HUSSEY M A, et al. Biofuel component concentrations and yields of switch grass in south central U.S. environments.(Forage & Grazing Lands)[J]. Crop Science, 2005, 45(2): 682–692. DOI:10.2135/cropsci2005.0682 |
| [20] | WHITTAKER R H.群落与生态系统[M].姚壁君, 译.北京: 科学出版社, 1977. |
| [21] | 田苗, 宋广艳, 赵宁, 等. 亚热带常绿阔叶林和暖温带落叶阔叶林叶片热值比较研究[J]. 生态学报, 2015, 35(23): 7709–7717. |
| [22] | SONG G Y, HOU J H, LI Y, et al. Leaf caloric value from tropical to cold-temperate forests:latitudinal patterns and linkage to productivity[J]. PLoS One, 2016, 11(6): e0157935. DOI:10.1371/journal.pone.0157935 |
| [23] | 何介南, 康文星, 王东. 不同年龄阶段杉木人工林植物热值分析[J]. 生态学报, 2015, 35(2): 449–459. |
| [24] | JORDAN C F. Productivity of a tropical forest and its relation to a world pattern of energy storage[J]. Journal of Ecology, 1971, 59(1): 127–142. DOI:10.2307/2258457 |
| [25] | 黄钰辉, 官丽莉, 周国逸, 等. 西双版纳热带季节雨林和哀牢山中山湿性常绿阔叶林优势植物及地表凋落物层的热值[J]. 植物生态学报, 2007, 31(3): 457–463. DOI:10.3321/j.issn:1005-264X.2007.03.016 |
| [26] | 官丽莉, 周小勇, 罗艳. 我国植物热值研究综述[J]. 生态学杂志, 2005, 24(4): 452–457. DOI:10.3321/j.issn:1000-4890.2005.04.022 |
| [27] | 宋广艳, 何念鹏, 侯继华. 中国不同地带性森林乔木叶片热值特征及其影响因素[J]. 林业科学研究, 2016, 29(1): 133–139. DOI:10.3969/j.issn.1001-1498.2016.01.019 |
| [28] | 龙世友, 鲍雅静, 李政海, 等. 内蒙古草原67种植物碳含量分析及与热值的关系研究[J]. 草业学报, 2013, 22(1): 112–119. |
| [29] | 杨贵福, 邢坤, 李耕, 等. 大叶藻(Zostera marina)的热值和元素含量(碳、氮、磷)及其相关性[J]. 海洋与湖沼, 2015, 46(1): 212–220. |
| [30] | NÚÑEZ-REGUEIRA L, RODRÍGUEZ-AÑÓN J, PROUPÍN J, et al. Calorimetry as a tool to design campaigns to prevent and fight forest fires originating from shrub species[J]. Thermochimica Acta, 2002, 394(1/2): 279–289. |
| [31] | 吴家森, 张立钦, 吴进才, 等. 南方红豆杉幼苗营养元素质量分数与分布[J]. 浙江林学院学报, 2008, 25(2): 195–199. DOI:10.3969/j.issn.2095-0756.2008.02.013 |
| [32] | 张和钰, 周华荣, 叶琴, 等. 新疆额尔齐斯河流域典型地区优势种灌木的热值[J]. 水土保持通报, 2016, 36(5): 299–305, 311. |
| [33] | 林承超. 福州鼓山季风常绿阔叶林及其林缘几种植物叶热值和营养成分[J]. 生态学报, 1999, 19(6): 832–836. DOI:10.3321/j.issn:1000-0933.1999.06.011 |
| [34] | 徐永荣, 冯宗炜, 朱敬恩. 武汉和天津园林植物叶片热值比较研究[J]. 生态学杂志, 2004, 23(6): 11–14. DOI:10.3321/j.issn:1000-4890.2004.06.003 |
| [35] | ZHANG J L, POORTER L, CAO K F. Productive leaf functional traits of Chinese savanna species[J]. Plant Ecology, 2012, 213(9): 1449–1460. DOI:10.1007/s11258-012-0103-8 |
| [36] | 张立恒, 贾志清, 王学全, 等. 共和盆地15种植物叶片的元素化学计量学特征[J]. 森林与环境学报, 2018, 38(2): 216–221. |
| [37] | 林恬, 黄儒珠, 郑怀舟, 等. 福建万木林12种优势植物叶热值与养分特征[J]. 亚热带资源与环境学报, 2010, 5(1): 34–41. DOI:10.3969/j.issn.1673-7105.2010.01.006 |
| [38] | 王金旺, 陈秋夏, 李效文, 等. 红树植物秋茄与无瓣海桑叶片热值比较研究[J]. 湿地科学, 2016, 14(3): 376–381. |
| [39] | SONG G Y, LI Y, ZHANG J H, et al. Significant phylogenetic signal and climate-related trends in leaf caloric value from tropical to cold-temperate forests[J]. Scientific Reports, 2016, 6: 36674. DOI:10.1038/srep36674 |

 2019, Vol. 39
2019, Vol. 39


