文章信息
- 白旭明, 伍建榕
- BAI Xuming, WU Jianrong
- 新肥菇原生地土壤有机碳氮测定条件优化
- Optimization of determination conditions of soil organic carbon and nitrogen in the habitat of Agaricus sinodeliciosus
- 森林与环境学报,2017, 37(3): 360-365.
- Journal of Forest and Environment,2017, 37(3): 360-365.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2017.03.019
-
文章历史
- 收稿日期: 2016-11-21
- 修回日期: 2017-03-20
2. 西南林业大学云南省高校森林灾害预警控制重点实验室, 云南 昆明 650224
2. Key Laboratory of Forest Disaster Early Warning Control in Universities of Yunnan Province, Southwest Forestry University, Kunming, Yunnan 650224, China
新疆气候干旱,自然环境独特,有沙漠、盐漠、沼泽和盐湖等丰富多样的地貌景观并表现为多样化的地带性土壤[1]。新疆艾比湖湿地国家级自然保护区和博斯腾湖湿地内的芦苇地和红柳地发现一野生食用菌新种——新肥菇(Agaricus sinodeliciosus Z.R. Wang & R.L. Zhao)[2],营养价值和口感均属上乘,具有潜在的栽培价值。当地独特的土壤类型可能对其生长繁殖起重要作用。土壤碳素由土壤无机碳和有机碳两部分组成。土壤无机碳主要是指土壤风化成土过程中形成的碳酸盐矿物态碳。土壤有机碳不是单一的化合物,它包括动植物及微生物的遗体、排泄物、分泌物和土壤腐殖质。就两大类碳的更新速度而言,土壤有机碳的更新速度要显著高于无机碳,因此有机碳对碳循环具有显著影响[3]。土壤可溶性有机碳(total organic carbon,DOC),是指能通过孔径为0.45 μm滤膜的有机分子[4],主要由碳水化合物、蛋白质、长链脂肪族化合物和大分子的腐殖质组成[5],其在土壤总有机碳中含量小,但易被土壤微生物分解利用,在提供土壤养分方面具有重要的作用[6]。土壤可溶性总氮(total nitrogen, TN)包括可溶性有机氮、铵态氮和硝态氮[7],其中硝态氮和铵态氮是土壤速效氮,能够被植物直接吸收利用。铵态氮可被土壤胶体吸附,而硝态氮不能被土壤胶体吸附,易随水流失[8]。土壤DOC、TN的含量及比例是土壤肥力的重要指标,在养分供给、调节土壤淋溶、土壤微生物活动等方面起着重要的作用[9]。因此,土壤DOC和TN的测定已成为土壤理化分析的一项重要内容[10]。
目前,我国土壤碳、氮的测定尚无国家或农业行业统一标准,致使浸提方法各异,数据间缺乏可比性。杨金钰等[11]认为土壤研磨粒径大小对浸提结果有重要影响,以新疆灌耕土、灰漠土为研究对象,将土壤样品研磨处理为2.00、1.00和0. 25 mm三种粒径,结果表明, 土壤研磨粒径为2.00 mm时,新疆灌耕土和灰漠土的DOC测定结果良好。于向华等[12]用氯化钾做浸提剂研究了样品形态、浸提液浓度、浸提温度和浸提时间对土壤铵态氮测定值的影响。文中采用总有机碳氮分析仪测定土壤可溶性有机碳氮的含量。其原理是将土壤中的有机物全部高温燃烧生成的二氧化碳即总碳(total carbon, TC)与使用磷酸作为反应酸反应生成的二氧化碳即无机碳(inorganic carbon, IC)分别通过非分散红外线吸收检测器进行测定,二者的差值即为DOC的含量[13]。把蛋白质和氨基酸等含氮物高温燃烧,氧化为NO2来测定总氮值。由于可溶性有机碳氮实质上就是指能够通过浸提溶解在浸提液中的那一部分有机碳氮,因此测定含量时所用浸提液不同,也就有不同的结果。不同研究目的试验所使用的浸提条件也有所不同[14]。研究的土样取自地理地貌和气候环境独特的新疆,而且课题组正在进行新疆野生蘑菇仿生栽培研究,亟需准确测定该地区土壤中可溶性有机碳氮含量,以便指导仿野生栽培和堆料发酵。
1 材料与方法 1.1 供试土壤土壤采自新疆北部艾比湖湿地和南部博斯腾湖湿地内芦苇地和红柳地新肥菇生长的基部,均于2015年10月采取距表层0~20 cm土壤约200 g,去除土壤中可见的动植物残体和石子,用自封袋封装带回实验室,过2 mm筛进行测定。
1.2 试验方法室温下测定不同浸提剂、浸提剂浓度、样液比和浸提时间4个因素对土壤可溶性有机碳氮含量的影响。浸提剂分别为KCl、K2SO4、CaCl2和蒸馏水;浸提剂浓度分别为0.5,1.0,1.5,2.0,2.5 mol·L-1 ,5个水平;样液比设置1:3,1:4,1:5,1:6,4个水平;浸提时间为10,20,30,40 min,4个水平。试验3次重复。浸提液经0.45 μm滤膜抽滤,用德国Elementar总有机碳分析仪进行测定[15]。
1.3 数据处理数据处理分析和绘图采用Excel 2003,SPSS17.0软件。重复性试验结果用平均值±标准误差表示。
2 结果与讨论 2.1 不同浸提剂对土壤DOC和TN含量的影响土壤DOC和TN常用蒸馏水、稀盐溶液等试剂提取,但蒸馏水提取会导土壤粘粒分散,不易获得分析所用的清澈溶液[13],所以,目前常用稀盐溶液提取土壤DOC和TN含量。在样液比为1:5,浸提时间为30 min时,测试蒸馏水和1.0 mol·L4-1 的KCl、K2SO4、CaCl2浸提剂下土壤DOC和TN的含量见图 1。用K2SO4浸提剂测得的2份土样的DOC含量明显多于其他处理,另外3种浸提剂的浸提结果差异不显著[图 1(a)]。不同浸提剂提取土壤DOC含量的差异,或许是由于浸提剂本身的性质决定的。杨小燕等[16]在对东北地区黑土浸提试验研究表明,用去离子水做浸提剂测得的DOC含量高于盐溶液,是1. 0 mol·L-1 KCl浸提量的2.04倍。在相同浓度下,K2SO4的DOC浸提量多于KCl和NaCl,这可能是由于阴离子能将土壤有机质交换下来使DOC量增多,而因SO2-优先于Cl-被交换,致使K2SO4浸提的DOC量多于KCl和NaCl[17-18]。在4种浸提剂下测得的TN含量差异均不显著[图 1(b)]。产生这种结果的原因可能是土壤中的可溶性氮素主要以硝酸盐、亚硝酸盐和铵盐的形式存在,浸出主要受土壤水分的影响,与稀盐溶剂关系不大。K2SO4浸提剂优于其他浸提剂,结果良好。采自博斯腾湖湿地土样的DOC,TN含量都显著多于艾比湖湿地,随后的试验也得到同样的结果,一定程度上说明博斯腾湖湿地的土壤比艾比湖湿地的更肥沃。而用蒸馏水做浸提剂,土壤DOC和TN的含量与KCl、CaCl2为浸提剂的测定值差异不显著,所以在不具备K2SO4的条件下,可用纯净水做浸提剂。
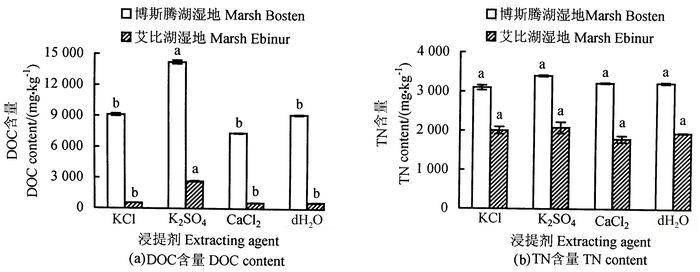
|
图 1 不同浸提剂下的土壤DOC和TN含量 Fig. 1 Effects of different extracting agent on DOC and TN determination 注:图中不同小写字母表示差异达0.05显著水平。 Note: significant (P < 0.05) differences are indicated by alphabetic letters above the bars. |
在样液比为1:5,浸提时间为30 min时,测定5个浓度K2SO4溶液对土壤DOC和TN含量的影响(图 2)。浸提过程实质上是土壤胶体中的离子从吸附状态到交换的动态过程,整个过程复杂多变,既受到土壤本身的理化性质束缚,同时受环境温、湿度、气压、溶剂pH值以及土壤微生物活动影响。选择新鲜土样,就是因为土壤水分状况会影响有机碳的溶出,且一定范围内水分越多,溶出的有机碳越多,同时也符合田间实际需要。在其它条件相同的情况下,随着K2SO4浸提剂浓度升高,土壤DOC含量逐渐增多,当K2SO4浸提剂浓度升至1.5 mol·L-1 时,土壤的DOC含量达到最多,随后略微减少[图 2(a)]。K2SO4浓度为1.5、2.0、2.5 mol·L-1 时测得的土壤DOC含量显著多于其他处理,而其三者间差异不显著,但K2SO4浓度为1.5 mol·L-1 时测定结果均一性好、稳定性高。可见浸提剂浓度是影响土壤DOC提取率的一个重要因素。5种浓度测得的土壤TN含量差异均不显著[图 2(b)]。K2SO4浸提剂浓度从低到高升高时,土壤TN的提取量先增多后减少,这可能是随着浓度升高,溶剂的置换能力逾强,再增高则导致土壤胶体的凝聚特性变化,发生絮凝使溶解态碳被土壤胶体再吸附,进而降低提取效率[19]。此外,有机分子的阴离子功能团与土壤溶液阳离子发生化学作用,降低了有机分子的表面电荷密度,改变了有机分子的构型,从而降低了有机分子的溶解性。故试验选择K2SO4的浓度为1.5 mol·L-1 。
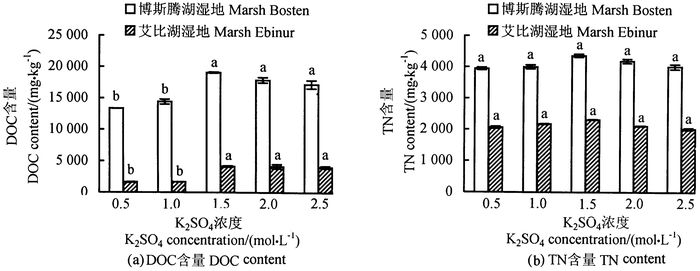
|
图 2 不同浓度K2SO4浸提剂下的土壤DOC和TN含量 Fig. 2 Effects of different K2SO4 concentrations on DOC and TN determination 注:图中不同小写字母表示差异达0.05显著水平。 Note: significant (P < 0.05) differences are indicated by alphabetic letters above the bars. |
用1.5 mol·L-1 K2SO4浸提剂,浸提时间为30 min,按4种不同的样液比测定土壤DOC和TN含量(图 3)。每组处理间差异均不显著,说明样液比对土壤DOC和TN含量提取效果影响不大,与他人的试验结果不同。李忠佩等[19]研究不同年代的红壤水稻土表明,DOC含量受水土比影响极大, 3 a稻田土壤的DOC含量随水土质量比变大而增多的幅度大于80 a稻田土壤,可能是由于3 a水田耕作和施肥利用的时间较短,新形成的土壤有机质黏合程度较低,较易在水中溶出。杨小燕等[16]在对东北地区不同类型的黑土浸提试验研究表明,在水土质量比分别为10:1和20:1时,土壤DOC浸提量的差异不明显,只有当水土质量比达到40:1时,土壤DOC浸提量才差异显著。差异产生的可能原因:一是浸提效果与土壤团粒结构有关,虽是相同比例,不同类型的土壤与浸提剂的吸附交换速率大不相同;二是根据俞仁培等[20]对中国盐渍土分布的研究理论,文中试验土壤为硫酸盐-氯化物型盐渍土,不同于松嫩平原地区主要为苏打盐渍土和黄淮海平原与华北地区主要为氯化物型盐渍土,新疆的盐渍土壤像是在硫酸盐里“浸泡”,故用K2SO4浸提影响不显著。样液比为1:4时测试结果稳定性好,故设样液比为1:4。
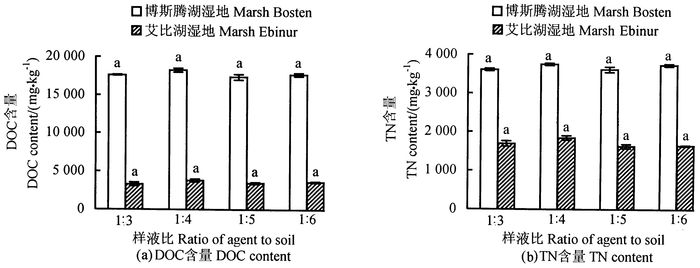
|
图 3 不同样液比K2SO4浸提剂下的土壤DOC和TN含量 Fig. 3 Effects of different ratios of agent to soil on DOC and TN determination 注:图中不同小写字母表示差异达0.05显著水平。 Note: significant (P < 0.05) differences are indicated by alphabetic letters above the bars. |
1.5 mol·L-1 K2SO4为浸提剂,样液比为1:4,浸提时间分别为10、20、30、和40 min进行土壤DOC和TN含量测定(图 4)。浸提20、30、40 min时土壤的DOC和TN含量显著多于10 min,后三者间差异不显著。也有的研究浸提时间设置从10 min到5 h不等[19, 21],李忠佩等[19]试验振荡时间在0.25-5.00 h,提取出DOC量没有明显变化,但文中的试验,浸提时间对DOC含量影响较大。QUALLS et al[22-23]报道DOC在土壤固相和浸提液之间的吸附分散达到平衡需要5 d,但是如果浸提时间太长,则浸提过程中微生物的活动会消耗部分DOC,从而降低含量。综合考量测定效率和准确性,确定浸提时间为20 min。
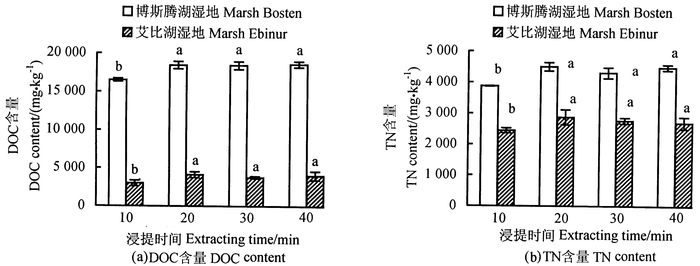
|
图 4 不同浸提时间下的土壤DOC和TN含量 Fig. 4 Effects of different extracting time on DOC and TN determination 注:图中不同小写字母表示差异达0.05显著水平。 Note: significant (P < 0.05) differences are indicated by alphabetic letters above the bars. |
文中试验为单因素试验,测定过程中逐步筛选出合适的浸提条件用于后续试验,选取各条件下最优结果(表 1)。随着浸提条件的优化,DOC/TN总体呈逐渐增大趋势。随着浸提条件的优化,土壤DOC、TN含量都有所增多,而各因素对土壤TN含量影响较小,故DOC/TN增大。博斯腾湖湿地土样DOC/TN比约为4.63,大于艾比湖湿地土样。由于土壤中DOC/TN揭示了不同作物在不同生长时期,吸收运用碳氮元素的偏好,在生产实践中DOC/TN具有重要的指导意义。准确合理把握作物各生长间断的DOC/TN,可有效促进其生长速率和保持健壮。我国土壤类型丰富,生产实践中人为操控需求多样,以及碳氮存在形式复杂,更要求实验人员在参考这一指标时,应因地制宜地设计测定方法,以期获得较为真实的数据。
| 条件Conditions | DOC/TN Ratios of DOC and TN concentrations | |
| 博斯腾湖湿地Marsh Bosten | 艾比湖湿地Marsh Ebinur | |
| 浸提剂K2SO4 Extractant K2SO4 | 4.18 | 1.49 |
| K2SO4浓度1.5 mol·L-1 Concentration of K2SO4 1.5 mol·L-1 | 4.37 | 1.95 |
| 样液比1:4 Ratio of soil to agent 1:4 | 5.06 | 2.05 |
| 时间20 min Extracting time 20 min | 4.93 | 2.08 |
| 平均值Average | 4.63±0.21 | 1.89±0.14 |
分别移取不同用量标准溶液稀释成浓度适宜的系列标准溶液至艾比湖湿地和博斯腾湖湿地的2个新鲜样品中,浸提液加入量相应减少,按上述改进条件进行测定。加标回收率在95.3%~106.8%之间,方法准确度可满足检测要求。
2.6.2 稳定性试验按选择的浸提条件,对艾比湖湿地和博斯腾湖湿地的新鲜样品进行8次测定。2份样品的标准偏差平均值分别为0.14和0.07, 相对标准偏差分别为1.36%和1.21%,均小于5%,符合稳定性检验的要求。
3 结论采自新疆的新肥菇原生地土壤DOC含量测定值与浸提剂、浸提液浓度密切相关,浸提结果差异与浸提溶液本身性质有关,与样液比、浸提时间关系不大。而土壤TN含量测定值与浸提剂、浸提液浓度、样液比、浸提时间均无显著相关性。以新鲜土样为测定对象,在室温,1.5 mol·L-1 的K2SO4浸提剂,样液比1:4,浸提时间20 min的条件下,浸提液经总有机碳氮仪测定的土壤DOC、TN值重复性好、精确性高,符合检测要求。研究结果优化了新疆特殊环境下土壤有机碳氮含量的测定方法,为课题组后续测量确定方法,同时也可给相关研究提供参考。另一方面,由于土壤性质的差异导致浸提条件对土壤DOC、TN含量的影响时有不同,因此,在实际操作过程中要针对不同的土壤类型和研究目的建立适用的、准确快速的测定方法。
致谢: 中国科学院微生物研究所真菌学国家重点实验室周杰民博士对本实验的支持;感谢新疆生产建设兵团第五师农科所和巴音郭楞蒙古自治州科技局、农科院的工作人员在采样过程中的帮助。| [1] | 金海龙, 白祥, 满中龙, 等. 新疆艾比湖湿地自然保护区土壤空间异质性研究[J]. 干旱区资源与环境, 2010, 24(2): 150–157. |
| [2] | WANG Z R, PARRA L A, CALLAC P, et al. Edible species of Agaricus (Agaricaceae) from Xinjiang Province (Western China)[J]. Phytotaxa, 2015, 202(3): 185–197. DOI:10.11646/phytotaxa.202.3 |
| [3] | 于贵瑞. 全球变化与陆地生态系统碳循环和碳蓄积[M]. 北京: 气象出版社, 2003: 275-297. |
| [4] | MOORE T R, DE SOUZA W, KOPRIVNJAK J F. Controls on the sorption of dissolved organic carbon by soils[J]. Soil Science, 1992, 154(2): 120–129. DOI:10.1097/00010694-199208000-00005 |
| [5] | KALBITZ K, SOLINGER S, PARK J H, et al. Controls on the dynamics of dissolved organic matter in soils:a review[J]. Soil Science, 2000, 165(4): 277–304. DOI:10.1097/00010694-200004000-00001 |
| [6] | 汪伟, 杨玉盛, 陈光水, 等. 罗浮栲天然林土壤可溶性有机碳的剖面分布及季节变化[J]. 生态学杂志, 2008, 27(6): 924–928. |
| [7] | FOLLETT R. Nitrogen management and ground water protection[M]. Amsterdam: Elsevier, 1989: 473-481. |
| [8] | 沈灵凤, 白玲玉, 曾希柏, 等. 施肥对设施菜地土壤硝态氮累积及pH的影响[J]. 农业环境科学学报, 2012, 31(7): 1350–1356. |
| [9] | 倪进治, 徐建民, 谢正苗. 土壤水溶性有机碳的研究进展[J]. 生态环境, 2003, 12(1): 71–75. |
| [10] | 吕国红, 周广胜, 周莉, 等. 土壤溶解性有机碳测定方法与应用[J]. 气象与环境学报, 2006, 22(2): 51–55. |
| [11] | 杨金钰, 马雪琴, 唐光木, 等. 土壤研磨粒径和硫酸钾浸提浓度对可溶性有机碳测定的影响[J]. 新疆农业科学, 2015, 52(1): 151–156. |
| [12] | 于向华, 张明. 氯化钾浸提法测定土壤中铵态氮含量条件研究[J]. 农业科技与装备, 2013(3): 11–12. |
| [13] | MURPHY D V, MACDONALD A J, STOCKDALE E A, et al. Soluble organic nitrogen in agricultural soils[J]. Biology and Fertility of Soils, 2000, 30(5/6): 374–387. |
| [14] | 李小涵, 李富翠, 王朝辉. 影响TOC有机碳分析仪测定土壤碳含量的因素[J]. 分析仪器, 2011(5): 8–12. |
| [15] | 李淑芬, 俞元春, 何晟. 土壤溶解有机碳的研究进展[J]. 土壤与环境, 2002, 11(4): 422–429. |
| [16] | 杨小燕, 范瑞英, 王恩姮, 等. 浸提条件对黑土表层土壤溶解性有机碳浸提量的影响[J]. 北京林业大学学报, 2013, 35(5): 68–72. |
| [17] | GU B H, SCHMITT J, CHEN Z H, et al. Adsorption and desorption of natural organic matter on iron oxide:mechanisms and models[J]. Environmental Science & Technology, 1994, 28(1): 38–46. |
| [18] | REEMTSMA T, BREDOW A, GEHRING M. The nature and kinetics of organic matter release from soil by salt solutions[J]. European Journal of Soil Science, 1999, 50(1): 53–64. DOI:10.1046/j.1365-2389.1999.00212.x |
| [19] | 李忠佩, 焦坤, 吴大付. 不同提取条件下红壤水稻土溶解有机碳的含量变化[J]. 土壤, 2005, 37(5): 512–516. |
| [20] | 俞仁培, 陈德明. 我国盐渍土资源及其开发利用[J]. 土壤通报, 1999, 30(4): 158–159, 177. |
| [21] | ZSOLNAY Á. Dissolved organic matter:artefacts, definitions, and functions[J]. Geoderma, 2003, 113(3/4): 187–209. |
| [22] | QUALLS R G. Comparison of the behavior of soluble organic and inorganic nutrients in forest soils[J]. Forest Ecology and Management, 2000, 138(1/2/3): 29–50. |
| [23] | GREGORICH E G, BEARE M H, STOKLAS U, et al. Biodegradability of soluble organic matter in maize-cropped soils[J]. Geoderma, 2003, 113(3/4): 237–252. |

 2017, Vol. 37
2017, Vol. 37


