文章信息
- 庄正, 李艳娟, 刘青青, 杨振, 刘博, 刘爱琴
- ZHUANG Zheng, LI Yanjuan, LIU Qingqing, YANG Zhen, LIU Bo, LIU Aiqin
- 凋落物浸提液对杉木种子萌发及幼苗的影响
- Effects of Chinese fir litter extracts on the seed germination and seedlings
- 森林与环境学报,2017, 37(1): 29-33.
- Journal of Forest and Environment,2017, 37(1): 29-33.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2017.01.005
-
文章历史
- 收稿日期: 2016-06-15
- 修回日期: 2016-07-26
2. 国家林业局杉木工程技术研究中心, 福建 福州 350002
2. State Forestry Administration Engineering Research Center of Chinese Fir, Fuzhou, Fujian 350002, China
杉木是我国长江流域及秦岭淮河以南地区主要的造林树种之一,具有生长快、 经济价值高等优势,但杉木连栽会导致杉木林地力衰退、 生产力下降等问题,在一定程度上阻碍杉木人工林的发展[1]。 前人研究表明[2-5],由杉木种内的化感效应引起的自毒作用是导致杉木连栽障碍的重要原因之一。 林思祖等[2]在杉木自毒作用研究中发现,高浓度杉木水浸液对杉木种子萌发有明显的抑制作用,曹光球等[5]通过研究不同腐解阶段的杉木枯枝落叶对杉木种子的化感效应发现,杉木凋落物浸提液对杉木种子的发芽率、 发芽势及胚根长、 胚茎长等方面的抑制作用随着浓度的升高而逐渐加强。
目前我国学者在杉木凋落物浸提液对杉木种子萌发及化感作用方面的研究较多[2, 5],可是研究内容基本局限在种子的发芽指标和形态学指标等方面,在杉木凋落物浸提液对杉木幼苗的抗氧化酶活性影响方面的研究较少。 有研究表明[6-7],植物体内抗氧化酶活性的变化与其化感效应息息相关,有鉴于此,本文选择不同浓度杉木凋落物浸提液为研究材料,以福建省漳平五一国有林场种子园内优良速生的杉木种子为研究对象,在研究杉木凋落物浸提液对杉木种子发芽指标和形态学指标影响的基础上,进一步探讨杉木幼苗内部抗氧化酶活性的反应机制,为探讨杉木凋落物对杉木的化感作用提供一定的生理学理论依据。
1 材料与方法 1.1 试验材料以福建漳平五一林场种子园内采集的当年生优良速生杉木种子为试验材料,供试凋落物为福建农林大学莘口教学林场杉木人工林内22年生成龄林的新鲜凋落物。
1.2 试验方法 1.2.1 浸提液制备称取杉木凋落物(枝、 叶、 果均匀混合)80 g,剪碎装入棕色广口瓶,加1 L纯水充分摇匀震荡,于暗处在室温下置浸提48 h,浸提过程中间歇摇匀震荡,48 h后经4层纱布过滤,得80 g·L-1浸提液,再稀释配制10、 20、 40 g·L-1的浸提液,121 ℃高压灭菌15 min后备用。
1.2.2 种子萌发试验选取大小均匀且颗粒饱满的杉木种子,用20%的过氧化氢溶液消毒浸泡1.5 h,以 45 ℃温水自然冷却浸种24 h后放入培养皿,每个培养皿内放50颗种子。 试验设置10、 20、 40和80 g·L-1杉木凋落物浸提液4个浓度处理,每个处理设置重复4次,同时以纯水处理为对照。 将培养皿放入人工气候箱,设置光照14 h,温度为25 ℃; 黑暗10 h,温度为20 ℃; 全天湿度75%。
1.3 测定方法 1.3.1 发芽指标和形态学指标测定以种子放入人工气候箱的当天为第一天,之后每天固定时间观察记录并用浸提液处理种子,以种子的胚根长出种皮2 cm及以上为发芽标准,连续5天无种子发芽视为发芽结束。 从培养第一天起至第28天后清点记录种子发芽数,并测量杉木幼苗的根长、 茎长、 叶长及鲜重,测量结束后将幼苗放入超低温冰箱保存待用。
| ${\rm{发芽率}}/\% = {G_{\rm{i}}} \div G \times 100$ | (1) |
| ${\rm{发芽势}}/\% = {G_{\rm{j}}} \div G \times 100$ | (2) |
式中: Gi表示发芽结束后的发芽总数,Gj表示规定时间内发芽种子数,G表示供试种子数。
1.3.2 生理学指标测定称取0.2 g的杉木幼苗放入预冷研钵中,加入5 mL的磷酸缓冲液(0.05 mol·L-1 PBS,pH=7.8) 冰浴充分研磨,研磨至匀浆后转入离心管,冷冻离心(8 000 r·min-1,4 ℃)20 min,上清液即为待测酶液,置于4 ℃冰箱待用。 超氧化物歧化酶(SOD)采用氮蓝四唑法[8]测定; 过氧化氢酶(CAT)采用紫外吸收法测定[9]; 过氧化物酶(POD)采用愈创木酚法[10]测定; 丙二醛(MDA)采用硫代巴比妥酸法[11]测定。 每个样品的生理指标测定皆重复3次。
1.4 数据统计分析数据处理采用Excel 2003软件; 数据显著性分析采用SPSS(20) 软件。
2 结果与分析 2.1 凋落物浸提液对杉木种子发芽的影响由图 1可知,不同浓度杉木凋落物浸提液对杉木种子的发芽率影响不同,总体趋势为随着浸提液浓度增加,种子的发芽率随之降低,以10 g·L-1浓度的浸提液处理的种子发芽率最高。 在10和20 g·L-1浓度时种子发芽率较高,与对照相比分别上升了19.2%和18.4%,与对照和另外两个处理相比差异显著。 当浸提液浓度上升到40和80 g·L-1时其对种子的抑制作用显现出来,发芽率开始逐渐下降。
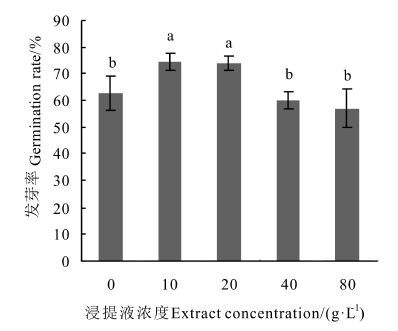
|
图 1 凋落物浸提液对杉木种子发芽率的影响 Fig. 1 Effect of the extracts on the germination rate 注: 不同小写字母代表在P<0.05水平下达到显著性差异。 Note: different small letters represent significant difference (P<0.05) . |
发芽势用于测试种子的发芽速度和整齐度,是检测种子质量的重要指标之一。 由图 2可以看出,发芽势随浸提液浓度升高而降低,10 g·L-1浓度的浸提液处理的种子发芽势最高,较对照高出55.33%,存在显著差异,由此可见低浓度浸提液处理促进了种子的发芽质量,但是浓度上升后其对种子的抑制作用随之增强,发芽势逐渐降低且显著低于10 g·L-1浓度所对应的发芽势。
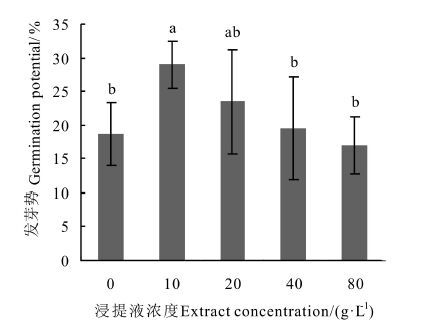
|
图 2 凋落物浸提液对杉木种子发芽势的影响 Fig. 2 Effect of the extracts on the germination potential of Chinese fir seed of Chinese fir seed 注: 不同小写字母代表在P<0.05水平下达到显著性差异。 Note: different small letters represent significant difference (P<0.05) . |
由表 1可知,总体上根长、 茎长、 叶长及鲜重随着浸提液浓度的上升而下降,但是不同部位对浸提液的反应程度不同。 根长对浸提液的反应最敏感,低浓度浸提液处理的幼苗根部较长,当浸提液浓度为10和20 g·L-1时根长显著高于对照,分别比对照高43.67%和42.72%,当浓度上升到80 g·L-1根长大幅下降,与对照相比下降了69.48%,存在显著差异。 鲜重对浸提液的反应也很敏感,10 g·L-1浓度的浸提液处理的种子鲜重最高,较对照高出26.10%,随后随浓度上升而下降,当浓度为80 g·L-1时鲜重较对照低36.13%,差异显著。 茎长和叶长总体上是随着浓度增加而下降,但下降幅度小,茎长和叶长分别在80和20 g·L-1时与对照相比各下降了17.30%和15.65%,存在显著差异。
| 浓 度Concentrations/(g·L-1) | 根 长Root length/cm | 茎 长Stem length/cm | 叶 长Leaf length/cm | 鲜 重Fresh weight/g |
| 0 | 2.13±0.25b | 1.85±0.08a | 1.47±0.14a | 1.06±0.29b |
| 10 | 3.06±0.17a | 1.80±0.09a | 1.45±0.09a | 1.50±0.08a |
| 20 | 3.04±0.16a | 1.79±0.11a | 1.24±0.11b | 1.37±0.05ab |
| 40 | 2.38±0.95ab | 1.77±0.07a | 1.29±0.12ab | 1.13±0.26b |
| 80 | 0.65±0.17c | 1.53±0.27b | 1.37±0.14ab | 0.64±0.27c |
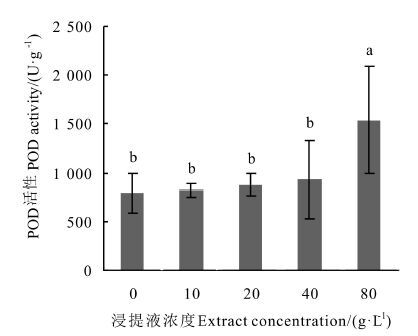
由图 3可知,SOD活性总体呈现出随浓度上升而下降的趋势,在10 g·L-1浓度时SOD活性最高,但与对照相比差异不显著,浓度上升后SOD活性开始低于对照,在80 g·L-1浓度时SOD活性显著降低,相比于对照降低了35.84%,可见高浓度浸提液对SOD活性抑制作用显著。 由图 4可知,CAT活性随浓度上升而上升,在10 g·L-1浓度时CAT活性比对照低了43.88%,在80 g·L-1浓度时比对照高45.45%,且与对照相比皆存在显著差异。 由图 5可知,浸提液浓度的上升会促进幼苗POD活性的上升,在80 g·L-1浓度时上升幅度明显增大且显著高于对照,较对照上升了94.35%,可见低浓度浸提液对POD活性无显著抑制作用,达到80 g·L-1浓度后抑制作用才显著增强。
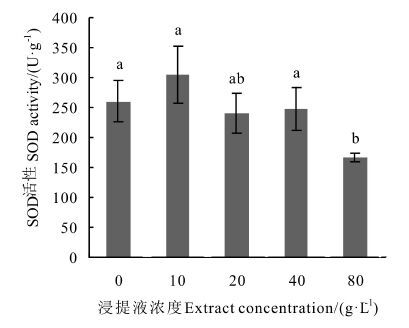
|
图 3 凋落物浸提液对杉木幼苗SOD活性的影响 Fig. 3 Effects of extracts on SOD activity of Chinese fir seedling 注: 不同小写字母代表在P<0.05水平下达到显著性差异。 Note: different small letters represent significant difference (P < 0.05) . |
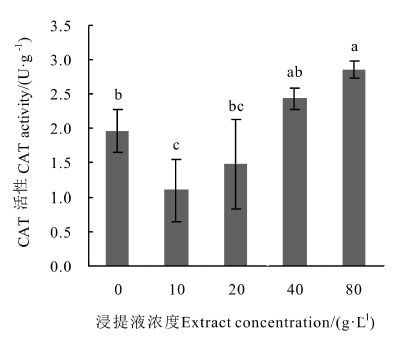
|
图 4 凋落物浸提液对杉木幼苗CAT活性的影响 Fig. 4 Effects of extracts on CAT activity of Chinese fir seedling 注: 不同小写字母代表在P<0.05水平下达到显著性差异。 Note: different small letters represent significant difference (P < 0.05) . |
|
图 5 凋落物浸提液对杉木幼苗POD活性的影响 Fig. 5 Effects of extracts on POD activity of Chinese fir seedling 注: 不同小写字母代表在P<0.05水平下达到显著性差异。 Note: different small letters represent significant difference (P < 0.05) . |
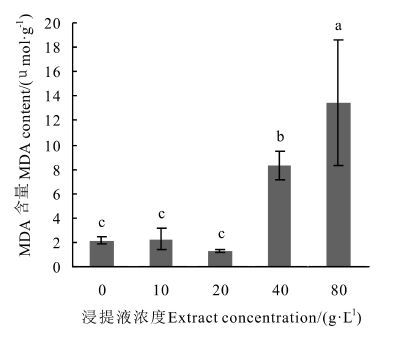
由图 6可以看出,MDA含量总体上随着浓度升高而升高,但在20 g·L-1浓度时MDA含量低于对照和其他处理组,10和20 g·L-1浓度对应的MDA含量与对照相比无显著差异,浓度上升到40和80 g·L-1后MDA含量显著上升并与对照存在显著差异,且80 g·L-1浓度所对应的MDA含量显著高于40 g·L-1,可见高浓度浸提液会使幼苗细胞中产生更多的MDA。
|
图 6 凋落物浸提液对杉木幼苗MDA含量的影响 Fig. 6 Effects of extracts on MDA content of Chinese fir seedling 注: 不同小写字母代表在P<0.05水平下达到显著性差异。 Note: different small letters represent significant difference (P < 0.05) . |
本次试验表明,不同浓度杉木凋落物浸提液对杉木种子的发芽率和发芽势的影响表现出低促高抑的规律,即低浓度浸提液对种子萌发起到促进作用,高浓度则起到抑制作用,这与前人[2, 5]的研究结果类似。 杉木凋落物不仅含有各种化感物质,也有植物生长所需要的养分物质,故在杉木栽培的初期凋落物对杉木种子的萌发和生长是起到促进作用的,但在连栽数代之后,土壤中的化感物质不断积累,它对杉木的抑制作用开始显现出来,转而表现为自毒现象。
杉木幼苗的形态学指标总体上随着浸提液浓度上升而下降,但是杉木幼苗的不同部位对浸提液的反应有所差异。 杉木幼苗的根部对浸提液反应最为敏感,低浓度时根长显著高于对照且高浓度时显著低于对照,而茎长、 叶长的显著性差异则远不及根长,本研究结论与前人的研究结果相似[12-14],这可能是因为种子在萌发期间由胚乳提供能量,在胚乳的能量消耗完后幼苗开始由根部向外界汲取生长所需能量,当用浸提液处理幼苗时,根系首先受到影响且影响程度比其他部分更加显著[6]; 也有观点认为这可能与根的自身生理特性有关,一般根部对植物激素等代谢产物或其他外部刺激的生理反应往往比地上部分更为敏感[15]。
抗氧化酶是植物受到胁迫时体内活细胞产生的一种生物催化剂,它可以通过氧化还原作用将过氧化物转换成低毒或无毒物质,以此来清除氧自由基,但当活性氧超出其清除能力时,抗氧化酶的活性就会受到抑制[16]。 SOD是生物体内清除自由基的首要物质,CAT可清除生物体内的过氧化氢,避免细胞受到过氧化氢的危害,是生物防御系统的关键酶之一,POD对植物细胞也是有着重要的保护作用,同时也被当做组织老化的生理指标之一。 在本研究中,杉木幼苗SOD活性随浸提液浓度上升而下降,林静雯等[17]认为,随着幼苗受到胁迫的增加,对幼苗的损害作用逐渐增强,幼苗合成抗氧化酶的能力会逐渐减弱。 相反,随着浸提液浓度的上升,幼苗CAT和POD呈上升趋势,这可能是高浓度浸提液加大了对幼苗的胁迫,使幼苗合成更多的CAT和POD以清除体内的氧自由基,避免细胞受到过氧化氢的危害[6]。
MDA是重要的膜脂过氧化指标,所以常用来衡量膜系统的伤害程度,本次试验中,幼苗的MDA含量总体呈随浓度增加而上升的趋势,以10和20 g·L-1浓度的浸提液处理的杉木幼苗MDA含量很低,与对照无显著差异,由此可知在这两种浓度下膜系统的损伤程度不大,当以40和80 g·L-1浓度的浸提液处理时MDA含量骤然上升,与对照相比差异显著,可推测高浓度浸提液使幼苗细胞的生物膜受到了严重的损伤。 研究表明[3, 17]用草甘膦和邻羟基苯甲酸处理杉木种子后其保护酶活性及MDA含量也呈类似规律,可见不同化感物质处理杉木种子都会对其抗氧化酶系统产生一定的影响。
综合发芽指标、 形态学指标及生理学指标来看,不同浓度杉木凋落物浸提液对种子杉木萌发及幼苗生长起到低促高抑的作用,浸提液内的化感物质会通过抑制其酶活性从而加大了氧自由基对杉木幼苗的伤害,可见杉木凋落物浸提液对杉木种子萌发及抗氧化酶活性的化感作用随着浸提液浓度的上升而逐渐增强。
| [1] | 陈楚莹. 改善杉木人工林林地质量和提高生产力的研究[J]. 应用生态学报, 1990, 1(2): 97–106. |
| [2] | 林思祖, 黄世国, 曹光球, 等. 杉木自毒作用研究[J]. 应用生态学报, 1999, 10(6): 661–664. |
| [3] | 曹光球, 杨梅, 林思祖, 等. 邻羟基苯甲酸对不同化感型杉木无性系抗氧化酶活性的化感效应[J]. 中国生态农业学报, 2010, 18(6): 1267–1271. |
| [4] | 曹光球, 林思祖, 刘雁, 等. 几个树种化感物质的初步分离与生物测定[J]. 中国生态农业学报, 2002, 10(2): 22–25. |
| [5] | 曹光球, 林思祖, 胡宗庆, 等. 腐解3个月后杉木枯枝落叶及腐殖土中的化感成分对杉木种子的化感效应[J]. 植物资源与环境学报, 2007, 16(4): 56–60. |
| [6] | 张志忠, 孙志浩, 陈文辉, 等. 有机酸类化感物质对甜瓜的化感效应[J]. 生态学报, 2013, 33(15): 4591–4598. |
| [7] | 徐胜利, 陈青云, 陈小青, 等. 酚酸类物质对嫁接伽师瓜植株生长及保护酶活性的影响[J]. 果树学报, 2004, 21(5): 452–455. |
| [8] | 沈文飚, 徐朗莱, 叶茂炳, 等. 氮蓝四哇光化还原法测定超氧化物歧化酶活性的适宜条件[J]. 南京农业大学学报, 1996, 19(2): 101–102. |
| [9] | 杨兰芳, 庞静, 彭小兰, 等. 紫外分光光度法测定植物过氧化氢酶活性[J]. 现代农业科技, 2009(20): 364–366. |
| [10] | 周金燕, 张发群, 舒远才. 愈创木酚法测定锰过氧化物酶活力[J]. 纤维素科学与技术, 1993(1): 34–37. |
| [11] | 杨伟宗, 刘明. 硫代巴比妥酸测定脂质过氧化物方法的改进[J]. 九江医学, 1995(1): 25–27. |
| [12] | 刘长坤, 邓洪平, 尹灿. 土荆芥水浸提液对小麦和水稻的生长及抗氧化酶活性的影响[J]. 贵州农业科学, 2010, 38(4): 39–42. |
| [13] | GHAREIB H R A, ABDELHAMED M S, IBRAHIM O H. Antioxidative effects of the acetone fraction and vanillic acid from chenopodium murale on tomato plants[J]. Weed Biology and Management, 2010, 10(1): 64–72. |
| [14] | HESAMMI E. Effect of allelopathic weeds on characteristics seed growth in maize(Zea mays L.)[J]. Advances in Environmental Biology, 2012, 6(10): 297–301. |
| [15] | CHON S U, CHOI S K, JUNG S, et al. Effects of alfalfa leaf extracts and phenolic allelochemicals on early seedling growth and root morphology of alfalfa and barnyard grass[J]. Crop Protection, 2002, 21(10): 1077–1082. |
| [16] | 王轶夫, 孙玉军, 郭孝玉. 基于BP神经网络的马尾松立木生物量模型研究[J]. 北京林业大学学报, 2013, 35(2): 17–21. |
| [17] | 林静雯, 李莹, 罗洁文, 等. 草甘膦对杉木种子萌发及幼苗生长的毒性效应[J]. 江西农业大学学报, 2015, 37(5): 843–848. |

 2017, Vol. 37
2017, Vol. 37


