文章信息
- 郑雅娴, 吕文华
- ZHENG Yaxian, LÜ Wenhua
- 黄藤材主要变色菌的生物学特性
- Biological characteristics of stain fungi on Daemonorops margaritae cane
- 森林与环境学报, 2016, 36(02): 236-239
- Journal of Forest and Environment, 2016, 36(02): 236-239.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2016.02.018
-
文章历史
- 收稿日期: 2015-07-29
- 修订日期: 2015-12-28
黄藤[Daemonorops margaritae (Hance) Becc.]为中国特有藤种,是华南地区的优良商用棕榈藤种,分布广,产量大,推广栽培多[1, 2]。新采伐的黄藤材藤条原色多为乳白色或米黄色,但伐后颜色加深很快,呈黄色、红黄色或棕黄色,在运输、存放、加工及使用过程中,容易发生蓝变、褐变、红变或黑斑等现象,大大降低藤材使用价值[3, 4]。有研究表明[5],黄藤材的变色主要由真菌引起,真菌变色不仅影响藤材外观,而且降低藤材抗腐能力,缩短其使用寿命[6, 7]。真菌生长繁殖需要一定的环境条件,研究环境因素对变色菌的影响,有助于寻求有效防止黄藤材真菌变色的措施。 本研究基于前期研究中筛选出的对藤材颜色有重大影响的6种真菌,分别分析了营养因子、温度、酸碱度和光照条件等对菌丝生长和色素分泌的影响,以指导藤材真菌变色的防治。
1 材料与方法 1.1 菌株培养将前期研究中筛选出的6种典型黄藤材变色真菌:青霉菌(Penicillium sumatrense和P. Sclerotiorum v. Beyma,分别记为F1和F2),萨氏曲霉[Aspergillus sydowii (Bain. & Sart.) Thom & Church,记为F3],色二孢菌[Lasiodiplodia theobromae (Pat.) Griff. Maubl,记为F4],球二孢菌[Botryodiplodia rhodina (Cke.) Arx,记为F5]和镰孢菌(Fusarium kyushuense O’Donnell. & T. Aoki,记为F6),分别采取单孢或单根菌丝纯化得到菌株。在无菌操作台上,将直径约为5 mm的变色菌块,接种到PDA培养基的中央,在不同的营养条件和环境条件下,每种条件每个菌种设置3个重复,放入26-28 ℃、相对湿度约为75%的恒温恒湿箱中培养,每隔1 d观察菌落的生长直径、菌落形态、颜色和培养基的变色等情况,记录培养6 d时的菌落直径[8]。试验采用菌饼法,菌株菌丝体生长测定采用生长速率法[9]。
1.2 营养因子以察氏培养基为基础培养基[10],分别用等质量的不同碳源或氮源化合物代替其中的蔗糖或硝酸钠,考察不同碳源和氮源对变色菌生长的影响。所选用的碳源有葡萄糖、蔗糖、纤维二糖、淀粉、结晶纤维素,缺碳作对照;所用的氮源有硝酸钠、硫酸铵、尿素、蛋白胨、氨基乙酸,缺氮作对照。
1.3 环境因子在不同温度(5、15、25、30、35、40、45 ℃)、pH值(2、3、4、5、6、7、8、9、10、11)和光照条件(日光灯、自然光和黑暗)下培养,观测菌落的生长直径、菌落形态、颜色及培养基变色等。分别对绝干、气干、饱湿和饱水藤材进行变色菌接种试验,考察藤材水分对变色菌生长性状的影响。绝干材为在103 ℃鼓风干燥机中烘至质量恒重的藤材;气干材为在20-30 ℃、相对湿度为20%-50%(北京9-12月)大气环境中平衡后的藤材,平均含水率约为8%;饱湿材是在20-30 ℃、相对湿度100%的干燥器中恒重后的藤材,平均含水率约为70%;饱水材是充分浸水至下沉后的藤材,平均含水率约为360%;每组试材20个。
2 结果与分析 2.1 碳源对菌株生长的影响如图1所示,色二孢菌F4、球二孢菌F5和镰孢菌F6不到6 d已长满平板,青霉(F1、F2)和曲霉(F3)则生长较慢。不同碳源对青霉(F1、F2)和曲霉(F3)菌株的生长影响较大,而对色二孢菌F4、球二孢菌F5和镰孢菌F6影响很小。6种菌株均是以葡萄糖和纤维二糖为碳源的培养基上生长最快,在无碳源培养基中菌落稀疏,未见明显生长。所有菌株基本都能够以单糖、二糖、淀粉为碳源进行生长发育,但生长状态、菌丝颜色或色素分泌有一定差异。由于单糖和二糖等小分子碳源易被吸收利用,菌落生长密集,培养基变色严重。而微晶纤维素的分解利用较难,菌落稀薄,生长慢,培养基色浅或不变色。6种真菌都能分解利用微晶纤维素,但青霉F1和F2、曲霉F3较弱,色二孢菌F4、球二孢菌F5和镰孢菌F6较强。菌落形态和菌落颜色随着培养时间延长逐渐发生变化,10-15 d基本稳定,培养基变色和藤材变色基本一致。综上所述,这些变色真菌主要利用藤材细胞内含物中丰富的单糖、二糖和淀粉等碳源,但在外界营养缺乏的情况下,也可能对细胞壁主成分半纤维素和纤维素加以分解利用。
2.2 氮源对菌株生长的影响如图2所示,不同氮源对6种藤材侵染真菌的生长影响不大,但对色素的形成和分泌有较大影响。相对而言,蛋白胨和氨基乙酸是6种真菌生长的最佳氮源,对其生长速率、菌丝发育、色素分泌几乎没有影响;以硝酸钠、硫酸铵和尿素作为氮源,菌株生长不稳定,多数菌株的生长速度和菌丝发育受到影响;缺氮培养基上的菌株菌丝稀薄、色素分泌受到一定影响,但在缺氮培养基上各菌株生长速率未见减缓。可见,这几种氮源均能被这些藤材侵染真菌所利用。
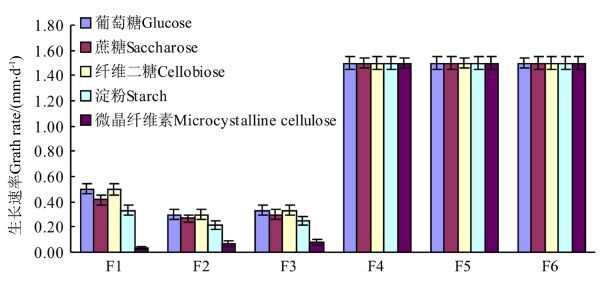
|
图1 菌株菌丝在不同碳源培养基中的生长情况 Figure.1 Growth of hyphae in different carbon-source media |
温度对黄藤材的变色起重要作用[11, 12]。黄藤材各变色菌能适应的温度范围较广,尤其某些变色菌对较高温度的适应性较强。在不同温度条件下培养6 d后的生长直径如图3所示,6种菌株的适宜生长温度均为15-35 ℃, 青霉菌(F1和F2)和曲霉菌(F3)的菌落生长较慢,色二孢菌F4和球二孢菌F5在40 ℃条件下仍生长良好(25-45 ℃ F4和F5线段重合),分析认为可能由于黄藤材产地温度 较高使其侵染真菌对高温适应性较强。这6种菌株生长的最适温度大致相同(25-30 ℃),当温度低至5 ℃或高达45 ℃时不再生长。温度影响菌落生长速度及形态:在适宜温度下菌丝生长旺盛,菌落致密;在较低温度下菌落致密以致形成菌丝垫;高温时菌丝纤弱,菌落稀薄。色二孢菌F4和球二孢菌F5在40 ℃条件下仍生长快速,但出现菌株白化现象,需培养足够长时间才会变色,表明温度影响变色菌的色素形成或分泌,在较低和较高温度下培养基变色滞后。
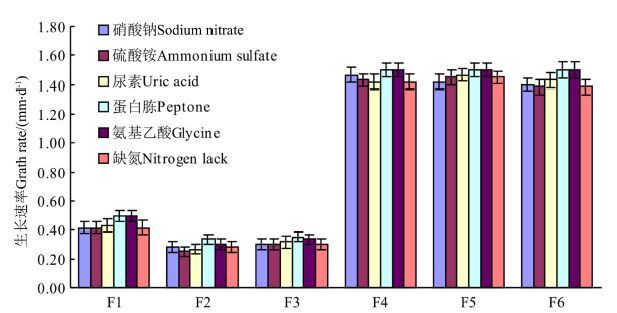
|
图2 菌株菌丝在不同氮源培养基中的生长情况 Figure.2 Growth of hyphae in different nitrogen-source media |
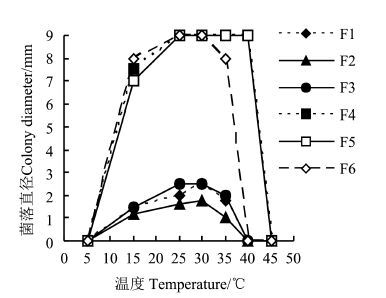
|
图3 菌株菌丝在不同温度条件下的生长情况 Figure.3 Influence of environmental temperature on the fungal growth |
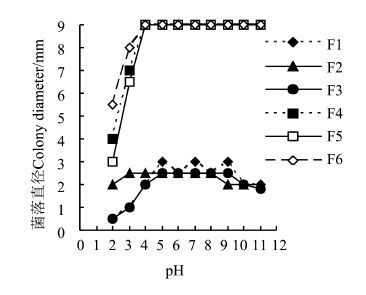
|
图4 菌株菌丝在不同pH值条件下的生长情况 Figure.4 Influence of environmental pH value on the fungal growth |
环境中的酸碱度即pH值对微生物的生长、繁殖有很大影响[13]。基于PDA培养基,不同pH值条件下培养6 d后的菌落直径如图4所示。菌株菌丝在pH值2-11的范围均能生长,在pH值5-9均生长良好;在pH值为2的较酸环境,各菌株生长较弱,甚至不能生长;pH值为11的碱性环境对各菌株生长没有明显影响,表明6种真菌均能适应较广范围的酸碱度,尤其能耐受较强碱性环境。在不同pH值条件下,菌丝颜色或其所分泌的色素略有差异。在最适pH值条件下,菌丝或培养基变色更快,颜色更深。培养6 d的镰孢菌F6,在PDA的pH值为2时,除在平板中部接种点周围的培养基变黄外未见颜色变化,且培养12 d后菌丝仍为白色;在pH值为4时,开始产生红色素并使培养基颜色变红;在pH值为5-7时,培养基颜色最深呈紫红色;在pH值为11时,菌株仍能分泌色素使培养基变红。这些变色菌对酸碱度的适应范围较广,表明很难通过酸碱度调控有效防止黄藤材的真菌侵染变色。
2.5 光照条件对菌株生长的影响自然光、日光灯和黑暗条件对各菌株的生长影响大致相同。培养3 d后,在黑暗条件下,菌落生长最快,菌丝或培养基基本不变色;在自然光及日光灯下的菌落生长性状相同,直径较小,菌丝密实,菌丝和培养基均发生变色。随着培养时间延长,黑暗条件下的菌落颜色加深,培养10 d后,在不同光照条件下的菌落生长直径及颜色基本相同。另外,自然光和日光灯下的菌落比黑暗条件下的更易于产孢,但随着培养时间延长,最终产孢量相当。可见,光照主要促进菌株的色素形成、分泌和产孢,但总体上对菌株生长影响不大[14]。
2.6 藤材含水率对变色菌生长的影响将4种具有不同含水率的藤材,即绝干材、气干材、饱湿材和饱水材,分别进行接种试验,考察藤材含水率对变色菌生长的影响。藤材含水率对侵染真菌的生长有重要影响,表1是各菌株接种2周后的生长情况。在绝干材和气干材上,均未见各菌株明显生长,表明各侵染真菌的生长均需要一定水分。在饱湿材上,各菌株均能生长,且生长良好。在饱水材上,青霉菌和曲霉菌均未见生长,色二孢菌F4、球二孢菌F5和镰孢菌F6偶见生长,但生长很弱,这可能与饱水材缺氧有关。结果表明,将藤材含水率及时控制在气干含水率以下,可以有效控制藤材真菌侵染;对藤材进行水浸或水喷等饱水处理,能在一定程度上控制藤材的真菌侵染变色。
| 含水率Moisture content | 变色菌Stain fungi | |||||
| F1 | F2 | F3 | F4 | F5 | F6 | |
| 绝干Oven-dried | - | - | - | - | - | - |
| 气干Air-dried | - | - | - | - | - | - |
| 饱湿Moisture saturated | +++ | +++ | +++ | +++ | +++ | +++ |
| 饱水Water saturated | - | - | - | + | + | + |
| 1)“+++”和“+”分别表示生长良好和偶见,“-”表示未见生长。Note: "+++" and "+" indicate good growth and rare growth separately, "-" indicates no growth. | ||||||
黄藤材主要变色菌的生物学特性研究,可为有效防止藤材变色提供理论依据。6种典型的黄藤材变色菌生物学特性研究结果表明,(1)6种侵染黄藤材的变色真菌主要利用藤材细胞内含物中丰富的单糖、二糖和淀粉等碳源,但在营养缺乏的情况下,也可能对细胞壁主成分半纤维素和纤维素加以分解利用;能利用多种氮源;(2)温度条件对菌株生长影响较大,黄藤材主要变色菌的适温范围较广,最佳生长温度为15-30 ℃,在适温条件下菌丝或培养基变色较快,在较低温度和较高温度条件下菌丝或培养基变色较慢;(3)黄藤材变色菌对酸碱度的适应范围较广,在pH值2-11的范围均能生长,最适pH值范围为5-7,对碱的耐受性较强,pH值影响菌株色素的形成或分泌速度;(4)光照对菌株生长的影响不大,主要影响菌株色素的产生和合成速度;(5)藤材含水率对变色菌的生长有重要影响。由此可见碳素营养、氮素营养、温度、酸碱度和藤材水分均影响菌丝的生长及色素形成。在实际生产中,通过控制温度、酸碱度和光照条件等很难对藤材真菌变色进行有效防止;可通过碳源的封闭或毒化、及时干燥等手段有效防止藤材真菌侵染。
| [1] | JIANG Z H. Bamboo and rattan in the world[M]. Beijing:China Forestry Publishing House,2007:286-289. |
| [2] | 江泽慧,吕文华,任海青,等. 棕榈藤材性研究综述[J]. 世界林业研究,2007,20(4):35-40. |
| [3] | 吕文华,江泽慧,吴玉章. 黄藤藤材的化学组成特性[J]. 林业科学,2009,45(7):96-100. |
| [4] | LV W H,JIANG Z H,LIU X E,et al. Causes and Removal of Daemonorops margaritae canes discoloration[J]. Advances in Chemical,Material and M etallurgical Engineering,2013,634-638:909-912. |
| [5] | 吕文华,刘杏娥,刘君良. 黄藤材的真菌变色[J]. 林业科学,2011,47(8):196-200. |
| [6] | 吴玉章,周宇. 3种棕榈藤藤材防变色的研究[J]. 林业科学,2006,42(3):116-120. |
| [7] | 吕文华,江泽慧,任海青,等. 藤材的防护和综合利用[J]. 世界竹藤通讯,2007,5(2):9-11. |
| [8] | 陈全助,陈慧洁,郭文硕,等. 桉树焦枯病菌(Calonectria pseudoreteaudii)生物学特性测定[J]. 福建林学院学报,2014,34(4):328-332. |
| [9] | 范晓龙,朱建华,周旭,等. 南方红豆杉炭疽病病原鉴定及其生物学特性[J]. 福建林学院学报,2006,26(2):117-122. |
| [10] | 夏冬亮,任玉,李潞滨,等. 毛竹内生细菌分离培养基的选择[J]. 北京农学院学报,2009,24(1):15-19. |
| [11] | 宋微,吴小芹. 12种林木外生菌根真菌的培养条件[J]. 南京林业大学学报(自然科学版),2007,31(3):133-135. |
| [12] | 马星霞,蒋明亮,吕文华,等. 竹材主要变色菌霉菌的生长特性研究[J]. 林业科学研究,2009,22(6):819-823. |
| [13] | 杨卫君,王有科,赵桂华,等. 杨木变色菌的分离鉴定及其生物学特性的研究[J]. 湖北农业科学,2009,48(5):1225-1228. |
| [14] | HUANG S W, SUN X Q. Biological studies on Pythium guiyangense, a fungal pathogen of mosquito larvae[J]. Mycosystema,2007,26(3):380-388. |

 2016, Vol. 36
2016, Vol. 36


