2. 国家远洋渔业工程技术研究中心, 上海 201306;
3. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
4. 农业农村部大洋渔业资源环境科学观测实验站, 上海 201306
银姑鱼(Pennahia argentata)也称白姑鱼, 隶属鲈形目(Perciformes)石首鱼科(Sciaenidae)银姑鱼属(Pennahia), 喜暖温水, 栖息于40~100 m深的海岸海湾的沙质或泥质底部[1]。广泛分布于我国南海、东海、黄海、渤海和日本海[2]。银姑鱼是我国近海重要的经济鱼类, 1983年记录东海海域银姑鱼捕捞量高达2 080 t [3], 至2000年捕捞量下滑至22 t, 到2020年全国范围内捕捞量不到9 t[4], 渔业资源呈急速下滑趋势, 对其开展资源评估将有助于其资源的养护和可持续发展。
迄今, 对银姑鱼的研究包括生物学特性研究[5]、种群识别[6-7]、渔场布局[2]以及食性分析[8]等方面。在年龄和生长方面, 最早为学者张汉科[9]、胡雅竹等[10]利用耳石轮纹特征鉴定东海水域白姑鱼的年龄, 近年来陈作志等[11]根据体长数据基于ELEFAN模型估算南海北部银姑鱼生长和死亡参数。当前针对东海海域银姑鱼年龄鉴定已年代久远, 无法为当前高捕捞强度下鱼类的资源评估提供科学参考。浙江南部近海属于东海中南部海域, 受沿岸上升流及台湾暖流的影响, 水域内营养盐和饵料生物丰富, 是众多经济鱼类的栖息场所[12], 更是银姑鱼主要的索饵场和产卵场[2]。本文以该水域银姑鱼为研究对象, 选择其矢耳石作为年龄鉴定材料, 开展银姑鱼年龄与生长研究, 旨在为今后银姑鱼的洄游习性、资源评估以及渔业管理决策提供基础参考资料。
1 材料与方法 1.1 材料来源按照海洋调查规范(GB12763.3—91)[13], 2019年8月和11月在浙江南部近海(120°00′E~123°00′E和27°20′N~29°00′N)利用大型单船网板底拖调查船开展定点拖网调查(图 1)。调查船为吨位305 t的浙洞渔船10109号, 调查网具为底拖网, 网口宽40 m, 高7.5 m, 底纲和浮子纲为80 m。渔获冷冻后带回实验室测量分析。
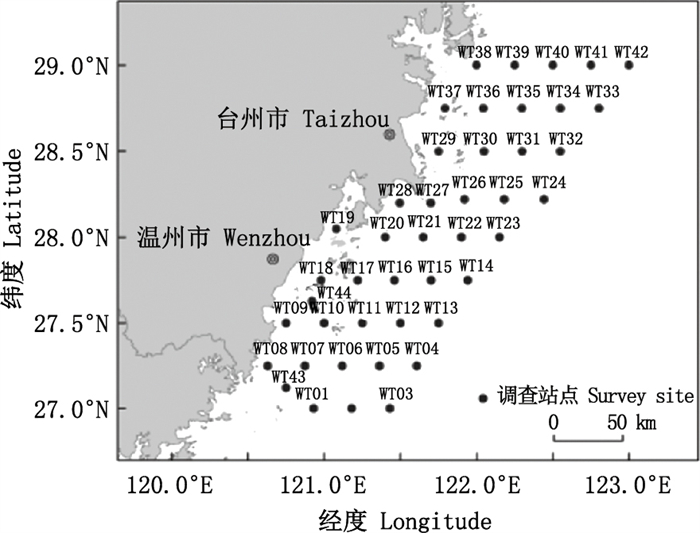
|
图 1 浙江南部近海采样点 Fig. 1 Survey stations in the offshore waters of southern Zhejiang |
在实验室内采集银姑鱼样品生物学数据, 采集数据类型包括体长、体质量和性别, 长度测量精确至1 mm, 质量测量精确至0.1 g。使用镊子于银姑鱼内耳囊中摘取左、右矢耳石, 去除表面结缔组织后放入装有体积分数为95%的乙醇溶液的离心管中编号保存。
1.3 耳石磨片制备及年龄鉴定耳石有听沟的一面(即内侧面)朝下放置于冷镶嵌模具中, 使用环氧树脂包埋固定风干后沿短轴切割, 依次使用80、120、600、2 000、4 000目的砂纸于磨抛机(StruersLaboPol-5)上将耳石样品打磨至核心暴露, 厚度约0.5 mm的薄片。置于光学显微镜(OlympusCX23)下拍照,利用系统自带显微图像分析处理软件(FCSnap)测量耳石轮径和半径(精确到0.01 mm)。
银姑鱼年轮鉴定参考胡雅竹等[10]和何雄波等[14]的研究, 采用三人观测法[15]读取年轮判断年龄。年龄鉴定采用每一研究者对每一个样品进行2次独立读龄, 对比所有年龄结果吻合率, 利用平均误差百分比(I)判定年龄读数的精确度[16]。I是比较鉴定者之间年龄鉴定的重复指标, 当I小于10%时, 表明年龄鉴定精确度较高, 否则需重新鉴定。
1.4 分析方法 1.4.1 体长与体质量关系采用幂函数拟合体长与体质量关系, 公式如下:
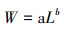 (1)
(1)
式中: L为样品体长, mm; W为相应体质量, g; a为常数; b为异速生长参数, 可反映鱼类生长。当b=3时, 说明鱼类处于等速生长状态, b>3或b < 3则处于异速生长。
1.4.2 体长与耳石半径关系参考胡雅竹等[10]的研究, 核心到内侧面边缘的垂直距离为短半径(SR), 核心到各年轮的长度为轮径(ri)。利用线性函数、指数函数、对数函数和幂函数拟合体长与耳石半径的关系, 选取R2值最大的方程作为最适方程。
1.4.3 生长方程分别采用Logistic、Gompertz和Von Bertalanffy 3种生长模型拟合银姑鱼的生长, 公式如下:
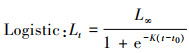 (2)
(2)
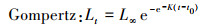 (3)
(3)
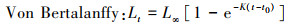 (4)
(4)
式中: t为样品年龄; Lt为t龄时的体长, mm; L∞为渐近体长, mm; K为生长曲线的平均速率; t0为理论生长起点龄。利用最小二乘法估计以上参数, 选取赤池信息准则(akaike information criterion, AIC), AIC值最小的模型作为最适生长模型, 公式如下:
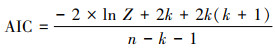 (5)
(5)
式中: Z为似然函数; k为参数数量; n为样本数量。
1.4.4 生长过程的特征变化采用Von Bertalanffy生长方程来描述浙江南部近海银姑鱼的生长特性, 生长速度方程:
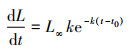 (6)
(6)
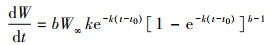 (7)
(7)
生长加速度方程:
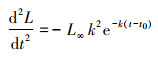 (8)
(8)
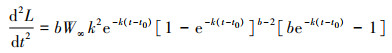 (9)
(9)
生长拐点:
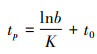 (10)
(10)
式中: tp为生长拐点年龄; W∞为渐近体质量, g。
1.5 数据处理采用独立样本t检验对不同性别体长、体质量进行均值差异显著性检验; 利用协方差分析(analysis of covariance, ANCOVA)检验不同性别间体长与体质量、体长与耳石短半径关系是否存在显著性差异; 运用残差平方和分析(residual sum of squares analysis, ARSS)检验雌、雄样本生长方程的差异性。
利用Microsoft Excel 2019、SPSS 26和R 4.1.2进行数据处理、分析和图表构建, 运用Photoshop CC软件处理耳石轮纹图片。
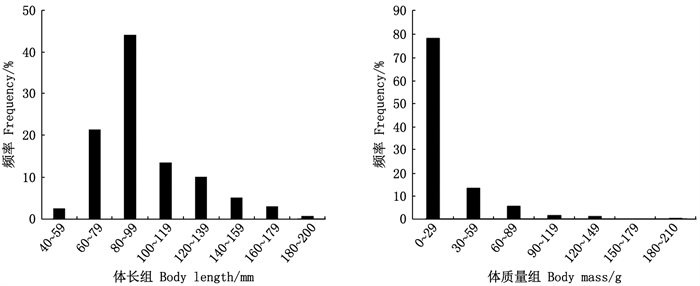
2 结果 2.1 样品组成2019年共调查渔获银姑鱼样本655尾, 体长范围为40~200 mm, 平均体长为(96.73±26.27) mm, 其中优势体长组为80~99 mm, 个体数占样本总数44.12%;体质量为0.8~185.9 g, 平均体质量为(23.79±23.67) g, 其中优势体质量组为0~29 g, 个体数占样本总数78.32%(图 2)。
|
图 2 浙江南部近海银姑鱼的体长和体质量分布 Fig. 2 Body length and body mass distribution of Pennahia argentata in the offshore waters of southern Zhejiang |
调查样本中共发现148尾雌性、128尾雄性和379尾性别不明, 其中雌性体长为69~200 mm, 平均体长为(112.40±26.81) mm; 雄性个体体长为51~194 mm, 平均体长为(118.62±28.14) mm; 经独立样本t检验, 雌雄个体间体长均值无显著性差异(P>0.05)。雌性个体体质量为7.0~185.9 g, 平均体质量为(36.45±30.33) g; 雄性个体体质量为5.2~146.8 g, 平均体质量为(41.32±28.46) g; 经独立样本t检验, 雌雄个体间的体质量均值无显著性差异(P>0.05)。
2.2 体长与体质量关系根据协方差分析, 检验出雌雄银姑鱼样品体长与体质量关系无显著性差异(F=1.344, P>0.05), 故拟合时无需区分雌雄, 拟合出体长-体质量幂函数为W=2×10-5×L3.002 1, R2=0.980 0;其中b≈3, 表明银姑鱼的生长呈匀速生长(图 3)。
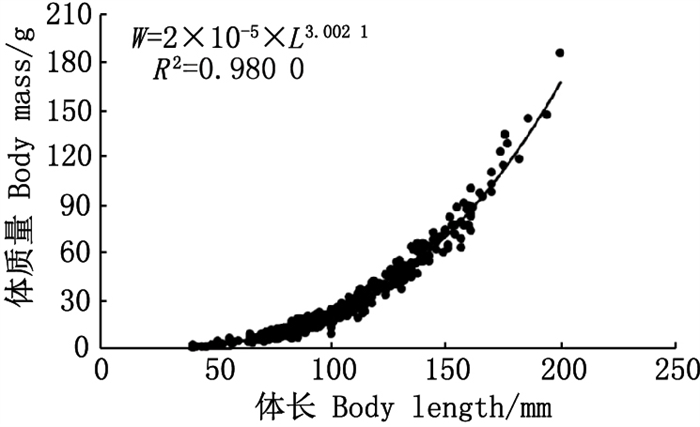
|
图 3 浙江南部近海银姑鱼体长与体质量关系 Fig. 3 Relation between body length and body mass of Pennahia argentata in the offshore waters of southern Zhejiang |
银姑鱼耳石轮纹呈单或双或多带形, 以透明带开始向不透明带过渡的部位为年轮, 每年形成一次, 且与斑鳍白姑鱼耳石十分类同。在显微镜下观察银姑鱼耳石磨片, 由图版-1可以看出矢耳石磨片下半部分有一条明显区别与其他纹路的深色宽轮纹, 鉴定其为1龄, 测量耳石半径与轮距的方法见图版-2。
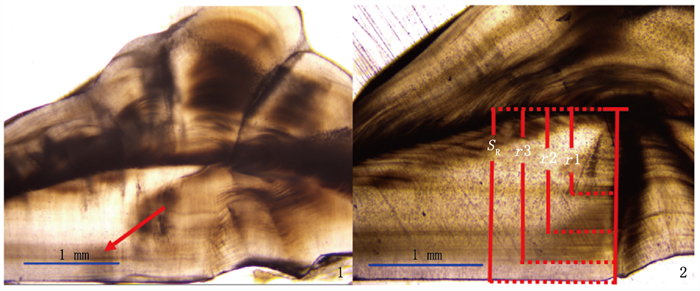
|
1.1龄鱼耳石磨片(箭头示年轮); 2.3龄鱼耳石磨片(r1、r2、r3为耳石轮距, SR为耳石半径)。 1.Otolith grinding template of age-1 (the annual ring was indicated by the red arrow); 2.Otolith grinding template of age-3 (r1, r2, r3 represent annual ring radius, and SR represents the short radius of otolith). 图版 浙江南部近海银姑鱼耳石磨片 Plate Otolith grinding template of Pennahia argentata in the offshore waters of southern Zhejiang |
观察167个耳石打磨样品, 未达到鉴定一致性的样本有20尾, 其中10尾由于鉴定结果未达一致性, 舍弃。计算出平均百分比误差指数为7.57%(I < 10%), 鉴定精确度较好, 结果可信。其中有54个样品具有年轮特征, 1龄有29尾, 2龄10尾, 3龄12尾, 4龄3尾, 无5龄以上样品(表 1)。0龄银姑鱼占比最多, 达65.60%, 其次是1龄鱼占18.47%, 2龄鱼占6.37%, 3龄鱼占7.64%, 4龄鱼最少, 占1.91%。
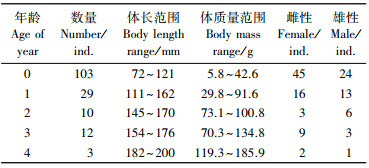
|
表 1 银姑鱼样品的年龄组成 Tab.1 Age distribution of Pennahia argentata |
协方差分析检验可知, 雌雄个体间体长(L)与耳石短半径(SR)关系无显著性差异(F=0.363, P>0.05), 故拟合时不区分雌雄。将银姑鱼的体长数据与矢耳石短半径数据进行线性函数(R2=0.876 6)、指数函数(R2=0.852 4)、对数函数(R2=0.859 7)和幂函数(R2=0.803 6)回归分析, 其中线性函数的R2最大, 拟合程度最高, 故用线性函数描述两者回归关系。如图 4所示, 银姑鱼矢耳石短半径(SR)随着体长的增长而增大, 与体长(L)呈显著正相关, 表达式为SR=0.010 8L-0.310 6(R2=0.876 6, n=157)。
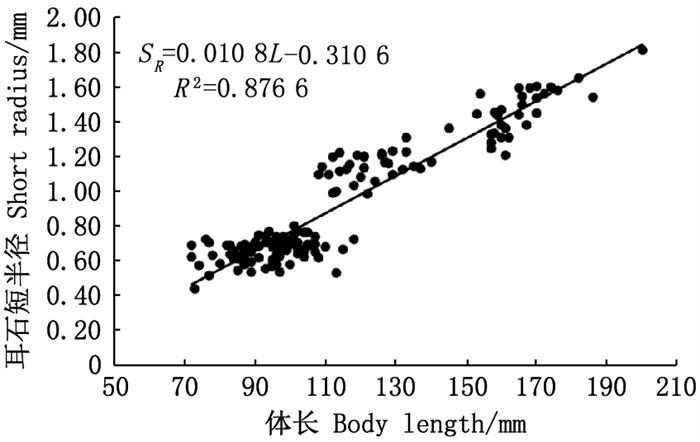
|
图 4 浙江南部近海银姑鱼体长与矢耳石短半径的关系 Fig. 4 Regression linear between body length and otolith radius of Pennahia argentata in the offshore waters of southern Zhejiang |
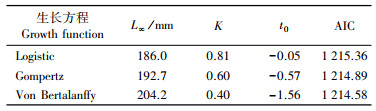
残差平方和分析检验可知, 雌、雄样本的生长方程无显著性差异(ASSR, F=0.412 3, P=0.524>0.05), 所以将雌、雄银姑鱼数据合并分析, 分别采用3种模型拟合并计算其AIC值。结果表明: Von Bertalanffy生长模型(VBGF)的AIC值最小(表 2), 因而Von Bertalanffy生长模型是研究银姑鱼生长的最适模型, 生长方程为Lt=204.2[1-e-0.4(t+1.56)], 生长曲线见图 5。
|
表 2 浙江南部近海银姑鱼生长模型参数比较与检验 Tab.2 Comparison of growth models of Pennahia argentata in the offshore waters of southern Zhejiang |
|
图 5 浙江南部近海银姑鱼体长生长曲线 Fig. 5 Growth curve of body length of Pennahia argentata in the offshore waters of southern Zhejiang |
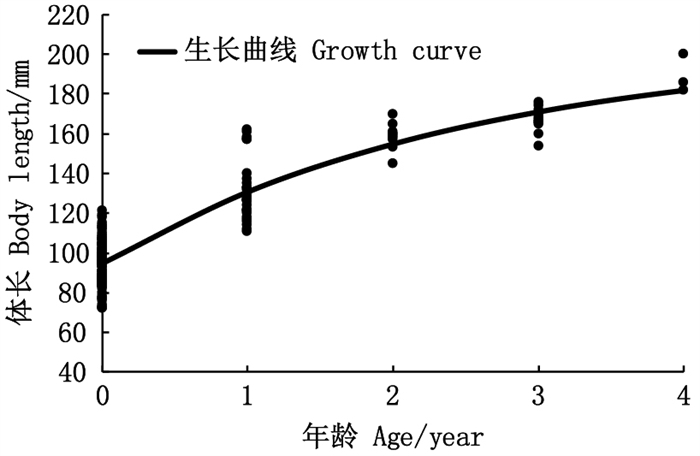
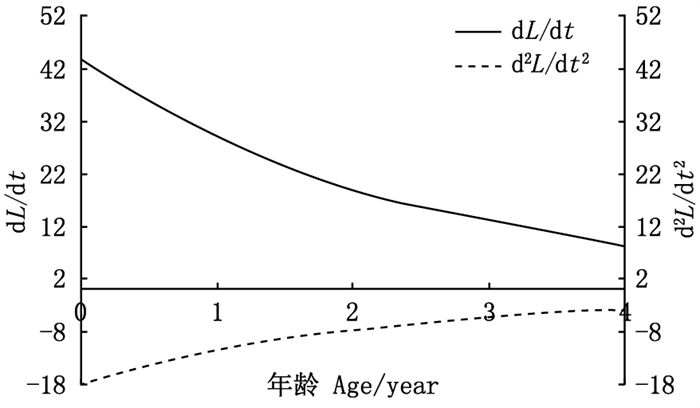
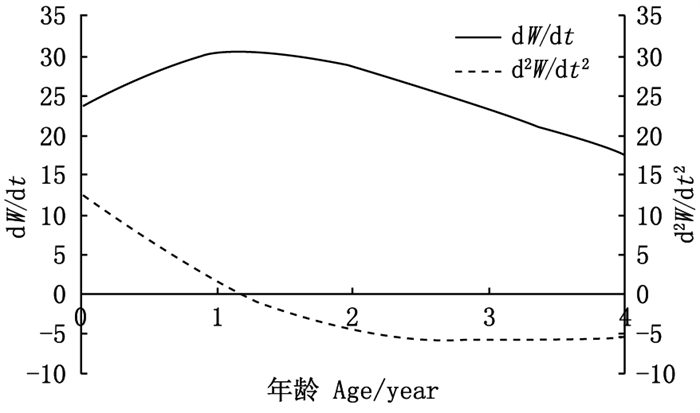
生长方程曲线属于积分曲线, 将体长的VBGF对年龄求一阶段和二阶导数, 得到体长生长速度和加速度的方程: dL/dt=81.60e-0.4(t+1.56); d2L/dt2=-32.64e-0.4(t+1.56)。根据L∞和体长与体质量关系式求得W∞, 计算出体质量生长速度和加速度的方程: dW/dt=206.18e-0.4(t+1.56)[1-e-0.4(t+1.56)]2.002 1; d2W/dt2=82.47e-0.4(t+1.56)[1-e-0.4(t+1.56)]1.002 1[3.002 1e-0.4(t+1.56)-1]。
图 6中两条渐近线分别为银姑鱼体长生长速度与加速度, 体长生长速度在年龄越小时生长速度越快, 年龄越大生长速度越缓慢, 观察加速度曲线可以发现, 生长速度递减,随着年龄增长,曲线平缓趋向零。图 7可看出体质量生长速度具有明显生长拐点, 体质量生长速度在拐点前随着年龄递增而增大, 加速度则随着年龄的增长而减慢; 拐点后, 体质量生长速度随着年龄递增而逐渐减慢。基于公式(10)计算生长拐点, 可得银姑鱼生长拐点年龄为1.19龄, 对应体长L=136 mm, W=50.8 g。
|
图 6 浙江南部近海银姑鱼体长生长 速度和生长加速度曲线 Fig. 6 Growth rate and growth acceleration curve of body length of Pennahia argentata in the offshore waters of southern Zhejiang |
|
图 7 浙江南部近海银姑鱼体质量生长 速度和生长加速度曲线 Fig. 7 Growth rate and growth acceleration curve of body mass of Pennahia argentata in the offshore waters of southern Zhejiang |
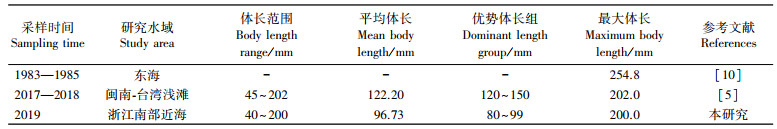
浙江南部近海银姑鱼的体长为40~200 mm (MD=96.73 mm), 优势体长组为80~99 mm (表 3), 与20世纪80年代调查相比, 胡雅竹等[10]渔获到的东海银姑鱼最大体长达254.80 mm, 远高于本调查, 究其原因, 东海海域持续的高强度捕捞导致鱼类出现小型化、低龄化趋势[17], 如林龙山等[18-19]研究发现东海区小黄鱼、带鱼等资源均表现出明显的渔获结构小型化、性成熟提前、低龄化的生物学特征转变现象。与其他区域相比, 马超等[5]2017—2019年闽南-台湾海域的样品体长范围与本研究相似, 但其平均体长和优势体长均明显高于本研究, 这是由于本调查水域是东海银姑鱼种群的产卵场和越冬场之一, 此次调查样本主要来源于8月的调查, 根据徐兆礼等[6]的研究, 东海银姑鱼种群在浙江南部近海5—6月产卵生长, 11月部分群体游至外海, 部分群体随冷空气南下至浙江中部近海, 因此浙江南部近岸调查银姑鱼可能多为补充群体, 体型相对较小, 较大个体多游往外海海域, 可能出现大个体偏少的情况, 但另一方面调查水域的差异性也可能会导致银姑鱼体长组成的差异。
|
表 3 不同年份与海域银姑鱼体长比较 Tab.3 Body length of Pennahia argentata in different years and survey areas |
鱼类体长与体质量关系式(W=aLb)在渔业资源评估[20]、鱼类生物学和生态学等研究领域多有应用, 例如计算单位补充量模型[21]、了解鱼类生长状况[22]、比较不同鱼类种群间体形特征差异[23]等。式中参数b可以采用频率论方法和贝叶斯方法进行估计, 本研究采用频率论方法估算得b=3.002 1, 表明浙江南部近海银姑鱼属匀速生长鱼类, 与胡雅竹等[10]、马超等[5]使用频率论估算的结果相一致, 朱立新等[24]利用贝叶斯方法估算b值, 结果认为威海近海白姑鱼属正异速生长种类, 与本研究结果不一致, 究其原因, 可能是不同水域经历的人为活动和环境要素差异所致, 也可能是2种参数估算方法存在一定的差异。
3.2 年龄鉴定鱼龄是研究鱼类生物学和生态学的基础, 除常用的鳞片、耳石、脊椎骨、鳍条等硬组织外[25], 匙骨、鳃盖骨等骨质材料也可作为鉴定鱼龄的材料[26]。国内学者多利用矢耳石鉴定银姑鱼年龄, 基于鳞片或其他硬组织研究银姑鱼鱼龄的研究较为少见, 这主要是因为耳石存在于鱼类内耳囊中, 较鳞片不易受到外力的破坏、不会在鱼体饥饿时被重吸收[26], 能完整记录鱼类生理信息; 其次银姑鱼是石首鱼类, 耳石较普通鱼类更大, 易于采集和观察。不过在利用耳石开展年龄鉴定时也需要注意耳石生长易受环境影响, 可能产生假轮影响分析结果的准确性[27], 因此需要通过多种材料相互对比, 最终选择研究鱼类年龄的最佳材料。目前国内采用鱼类微耳石、星耳石、鳞片以及骨质材料等鉴定银姑鱼鱼龄的研究尚属空白, 建议今后研究者在开展年龄和生长研究时可以利用多种硬组织材料共同鉴定, 以提高年龄鉴定的精确度。此外, 年龄鉴定准确度验证是一项重要的工作, 近年来微化学技术的发展为年龄鉴定验证提供了可行性[28], 通过轮纹的微化学差异性判断年龄,提高鉴定的准确性将会是未来年龄研究的发展趋势。
本研究结果表明, 2019年浙江南部近海银姑鱼0龄鱼占多数, 最大年龄只有4龄且占比很低, 而1983—1985年东海海域捕获银姑鱼的最大年龄为5龄[10], 1982—1987闽中渔场最大年龄为5龄[9], 由此可见, 东海海域银姑鱼样品的最大年龄基本在5龄左右, 本研究的银姑鱼最大年龄低于20世纪80年代的研究, 究其原因, 其一, 可能是高强度捕捞引起鱼类种群结构的低龄化现象[29], 在浙江南部近海小黄鱼的研究[12]中也发现, 在高捕捞压力下鱼类生物学表型特征会发生变化, 从而达到维持种群稳定的目的; 其二, 可能是调查水域的差异性, 本研究水域位于东海中南部近海, 与闽中渔场、东海外海水域的银姑鱼栖息环境不同, 因此在鱼类生长上可能存在差异, 陈作志等[11]发现20世纪90年代采集的南海北部银姑鱼最大年龄可达8龄, 可见南海的银姑鱼年龄更高, 说明不同水域银姑鱼的生长具有差异性。
3.3 生长方程鱼类生长方程是开展渔业资源评估工作的重要方法之一, 方程中的各类生长参数能定量描述鱼类生长特性, Von Bertalanffy生长方程、Logistic生长方程和Gompertz等是常用的生长模型。VBGF因灵活、拟合度好等优点被广泛应用于鱼类生长研究中[30], 不过也有研究认为VBGF拟合鱼体生长初期较差, 不适合拟合生长全过程[31]; 在描述水生动物的绝对增长方面, Logistic生长方程拟合效果优于VBGF[32], 而Gompertz生长方程能较好地拟合生长后期的特性[33], 如南海蓝圆鲹生长规律以Gompertz生长方程拟合最佳; 沈伟等[34]认为VBGF方程在拟合短生命周期物种时结果往往不够准确, 东海发光鲷采用Ricker生长模型的拟合效果更好, 可见目前尚无能完全描述所有鱼类生长特征的方程, 建议选择多种类型的生长方程拟合, 比较并筛选出最优生长方程。本文选用Logistic、Gompertz和Von Bertalanffy 3种生长模型拟合浙江南部近海银姑鱼生长情况, 通过AIC值检验发现VBGF是拟合银姑鱼生长的最适方程。本研究中银姑鱼体长-体质量参数b=3, 表明其生长呈匀速增长, 满足使用VBGF的前提(即b=3)[32], 且张汉科[9]、胡雅竹等[10]、陈作志等[11]也是选择VBGF来分析银姑鱼生长特性。总体上, Von Bertalanffy生长方程是渔业资源管理和评估中最为常用的生长模型, 大部分东海鱼类如黄姑鱼[35]、黄、刺鲳[36]等也是使用VBGF拟合生长, 然而, 在实际研究中, 研究者还需根据实际情况选择最适方程进行科学研究。
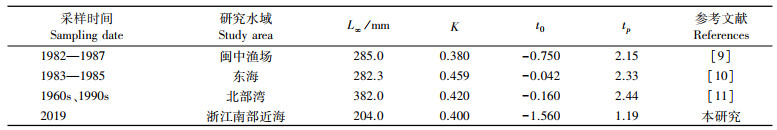
3.4 生长特性生长方程中的各项参数能反映鱼类种群的生长特性, 本研究与其他研究海域的生长参数比较发现(表 4), L∞、K以及t0等均有所差异, 与胡雅竹等[10]对东海银姑鱼的研究相比, 本研究的渐近体长和拐点年龄均有所减小, 说明东海海域银姑鱼出现小型化、生命周期缩短等现象, 总体生长性能降低。
|
表 4 不同年份与海域银姑鱼生长特性 Tab.4 Growth characteristics of Pennahia argentata in different years and China's seas |
生长参数K能够反映鱼类的生长速率, 当K值为0.05到0.10时, 表明鱼类生长缓慢; 大于0.10到0.20时鱼类匀速生长; 大于0.20到0.50时鱼类生长快速[20]。目前银姑鱼相关研究(表 4)中的K值在0.38~0.46, 表明银姑鱼为快速生长鱼类。
对比张汉科[9]、胡雅竹等[10]和陈作志等[11]研究中银姑鱼的生长曲线, 大致呈现类似的趋势: 体长生长曲线无拐点, 体质量生长曲线有拐点, 而本研究中银姑鱼的生长拐点年龄(1.19龄)显著小于其他研究(>2龄),见表 4, 再次表明浙江南部近海银姑鱼的生长周期缩短, 并且研究发现银姑鱼生长拐点年龄已经达到了性成熟年龄[10], 显示出银姑鱼的性成熟有所提前。因此, 可以推断在高强度的捕捞以及环境驱动下, 浙江南部近海水域银姑鱼的生物学特征已经发生适应性变化。
| [1] |
SUN D Q, XU T J, WANG R X. Characterization of microsatellites in white croaker (Pennahia argentata) through cross species amplification of Miichthys miiuy[J]. Journal of Genetics, 2011, 90(3): 110-113. |
| [2] |
陈佳杰, 徐兆礼. 东黄渤海白姑鱼(Argyrosomus argentatus)渔场空间格局的研究[J]. 自然资源学报, 2011, 26(4): 666-673. CHEN J J, XU Z L. Spatial-temporal pattern to fishing ground of white croaker in Bohai, Yellow and East China Seas[J]. Journal of Natural Resources, 2011, 26(4): 666-673. |
| [3] |
秦忆芹, 宓崇道, 张汉科. 东海区渔业资源调查报告[M]//农牧渔业部水产局. 东海区渔业资源调查和区划. 上海: 华东师范大学出版社, 1987: 366-374. QIN Y Q, MI C D, ZHANG H K. Investigation report on fishery resources in the East China Sea[M]//Bureau of Fisheries. Ministry of Agriculture and Rural Affairs. Shanghai: East China Normal University Press, 1987: 366-374. |
| [4] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2021中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2021: 41. Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. 2021 China fishery statistical yearbook[M]. Beijing: China Agriculture Press, 2021: 41. |
| [5] |
马超, 沈长春, 庄之栋, 等. 闽南-台湾浅滩白姑鱼渔业生物学特性研究[J]. 渔业研究, 2019, 41(1): 34-41. MA C, SHEN C C, ZHUANG Z D, et al. Study on fishery biological characteristics of Argyrosomus argentatus in Minnan-Taiwan Bank Fishing Ground[J]. Journal of Fisheries Research, 2019, 41(1): 34-41. |
| [6] |
徐兆礼, 陈佳杰. 依据大规模捕捞统计资料分析东黄渤海白姑鱼种群划分和洄游路线[J]. 生态学报, 2010, 30(23): 6442-6450. XU Z L, CHEN J J. Analysis to population division and migratory routine of Populations and migratory routines of Argyrosomus argentatus in the north China waters[J]. Acta Ecologica Sinica, 2010, 30(23): 6442-6450. |
| [7] |
侯刚, 刘丹丹, 冯波, 等. 基于地标点几何形态测量法识别北部湾4种白姑鱼矢耳石形态[J]. 中国水产科学, 2013, 20(6): 1293-1302. HOU G, LIU D D, FENG B, et al. Using landmark-based geometric morphometrics analysis to identify sagittal otolith of four Pennahia fish species[J]. Journal of Fishery Sciences of China, 2013, 20(6): 1293-1302. |
| [8] |
陈颖涵. 北部湾主要鱼类食性的初步研究[D]. 厦门: 厦门大学, 2013. CHEN Y H. Preliminary study on the feeding habit of dominant fish species in Beibu Gulf[D]. Xiamen: Xiamen University, 2013. |
| [9] |
张汉科. 闽中渔场白姑鱼的年龄与生长特性[J]. 台湾海峡, 1987, 6(3): 269-274. ZHANG H K. Age and growth of white croaker in the center Fujian fishing ground[J]. Journal of Oceanography in Taiwan Strait, 1987, 6(3): 269-274. |
| [10] |
胡雅竹, 钱世勤. 白姑鱼年龄和生长的研究[J]. 海洋渔业, 1989, 11(4): 158-162. HU Y Z, QIAN S Q. A study on the age and growth of white Chinese croaker[J]. Marine Fisheries, 1989, 11(4): 158-162. |
| [11] |
陈作志, 邱永松, 黄梓荣. 南海北部白姑鱼生长和死亡参数的估算[J]. 应用生态学报, 2005, 16(4): 712-716. CHEN Z Z, QIU Y S, HUANG Z R. Estimation of growth and mortality parameters of Argyrosomus argentatus in northern South China Sea[J]. Chinese Journal of Applied Ecology, 2005, 16(4): 712-716. DOI:10.3321/j.issn:1001-9332.2005.04.025 |
| [12] |
高春霞, 麻秋云, 田思泉, 等. 浙江南部近海小黄鱼生长、死亡和单位补充量渔获量[J]. 中国水产科学, 2019, 26(5): 925-937. GAO C X, MA Q Y, TIAN S Q, et al. Growth, mortality and yield per recruitment of small yellow croaker in offshore waters of southern Zhejiang[J]. Journal of Fishery Sciences of China, 2019, 26(5): 925-937. |
| [13] |
国家技术监督局. 海洋调查规范[M]. 北京: 中国标准出版社, 1992. The State Bureau of Quality and Technical Supervision. Specifications for oceanographic survey[M]. Beijing: Standards Press of China, 1992. |
| [14] |
何雄波, 陶雅晋, 侯刚, 等. 北部湾斑鳍白姑鱼群体结构特征与时空分布[J]. 广东海洋大学学报, 2015, 35(3): 35-42. HE X B, TAO Y J, HOU G, et al. Population structure and spatio-temporal distribution of Pennahia pawak in the Beibu Gulf, South China Sea[J]. Journal of Guangdong Ocean University, 2015, 35(3): 35-42. DOI:10.3969/j.issn.1673-9159.2015.03.006 |
| [15] |
高春霞, 戴小杰, 吴峰, 等. 北大西洋大青鲨年龄和生长初步研究[J]. 上海海洋大学学报, 2013, 22(1): 120-127. GAO C X, DAI X J, WU F, et al. A preliminary study on age and growth of the blue shark (Prionace glauca) in the North Atlantic Ocean[J]. Journal of Shanghai Ocean University, 2013, 22(1): 120-127. |
| [16] |
王浩展. 热带大西洋拟锥齿鲨的生物学特征及其资源分布与环境关系的研究[D]. 上海: 上海海洋大学, 2017. WANG H Z. Preliminary study on Crocodile Shark (Pseudocarcharias kamoharai) regarding to its biological characteristics and the relationship between resource distribution and the environment in Tropical Atlantic Ocean[D]. Shanghai: Shanghai Ocean University, 2017. |
| [17] |
卢昌彩, 赵景辉. "东海无鱼"应对措施探讨[J]. 中国渔业经济, 2013, 31(6): 27-32. LU C C, ZHAO J H. An investigation on the countermeasures against "No fish in East China Sea"[J]. Chinese Fisheries Economics, 2013, 31(6): 27-32. DOI:10.3969/j.issn.1009-590X.2013.06.005 |
| [18] |
林龙山. 黄海南部和东海小黄鱼渔业生物学及其管理策略研究[D]. 青岛: 中国海洋大学, 2009. LIN L S. Study on the fishery biology and management strategy of Larimichthys polyactis in the southern Yellow Sea and the East China Sea[D]. Qingdao: Ocean University of China, 2009. |
| [19] |
林龙山, 程家骅, 李惠玉. 东海区带鱼和小黄鱼渔业生物学的研究[J]. 海洋渔业, 2008, 30(2): 126-134. LIN L S, CHENG J H, LI H Y, et al. The fishery biology of Trichiurus japonicus and Larimichthys polyactis in the East China Sea region[J]. Marine Fisheries, 2008, 30(2): 126-134. DOI:10.3969/j.issn.1004-2490.2008.02.005 |
| [20] |
田波, 吴金明, 梁孟, 等. 长江中游武汉江段铜鱼的年龄与生长[J]. 水产学报, 2021, 45(1): 68-78. TIAN B, WU J M, LIANG M, et al. Age and growth of Coreius heterodon from Wuhan stretch of the middle Yangtze River[J]. Journal of Fisheries of China, 2021, 45(1): 68-78. |
| [21] |
刘逸文, 张崇良, 刘淑德, 等. 山东近海口虾蛄单位补充量渔获量评估[J]. 水产学报, 2020, 44(2): 213-221. LIU Y W, ZHANG C L, LIU S D, et al. Yield per recruitment evaluation of Oratosquilla oratoria in coastal waters of Shandong[J]. Journal of Fisheries of China, 2020, 44(2): 213-221. |
| [22] |
魏凯, 陈春山, 郑伟, 等. 二、三倍体细鳞鲑幼鱼生长特性的研究[J]. 水产学杂志, 2019, 32(3): 1-4. WEI K, CHEN C S, ZHENG W, et al. Growth comparison between diploid and triploid lenok Brachymystax lenok[J]. Chinese Journal of Fisheries, 2019, 32(3): 1-4. DOI:10.3969/j.issn.1005-3832.2019.03.001 |
| [23] |
施永海, 徐嘉波, 刘永士, 等. 敞口池塘和遮荫池塘养殖美洲鲥当年鱼种的生长规律和差异[J]. 上海海洋大学学报, 2019, 28(2): 161-170. SHI Y H, XU J B, LIU Y S, et al. Growth regularity and difference of young fish American shad Alosa sapidissima cultured in outdoor and shaded ponds[J]. Journal of Shanghai Ocean University, 2019, 28(2): 161-170. |
| [24] |
朱立新, 刘金殿, 梁振林. 一种稳健的贝叶斯方法在威海近海白姑鱼体长与体重关系研究中的应用[J]. 海洋湖沼通报, 2017(1): 109-121. ZHU L X, LIU J D, LIANG Z L. Application of a robust Bayesian method in studying on the weight-length relationship of silver croaker Pennahia argentata inhabiting the coastal water of Weihai[J]. Transactions of Oceanology and Limnology, 2017(1): 109-121. |
| [25] |
李强, 胡继飞, 蓝昭军, 等. 利用鱼类钙化组织鉴定年龄的方法[J]. 生物学教学, 2010, 35(6): 51-52. LI Q, HU J F, LAN Z J, et al. Fish age identification by means of calcific tissues[J]. Biology Teaching, 2010, 35(6): 51-52. DOI:10.3969/j.issn.1004-7549.2010.06.034 |
| [26] |
李宗栋, 沈建忠, 李霄, 等. 滇池红鳍原鲌4种年龄鉴定材料的比较[J]. 水产科学, 2017, 36(3): 330-335. LI Z D, SHEN J Z, LI X, et al. Comparison of four structures for age determination of redfin culter Cultrichthys erythropterus in Dianchi Lake in Yunnan, China[J]. Fisheries Science, 2017, 36(3): 330-335. |
| [27] |
张学健, 程家骅. 鱼类年龄鉴定研究概况[J]. 海洋渔业, 2009, 31(1): 92-99. ZHANG X J, CHENG J H. Survey on study of the fish age determination[J]. Marine Fisheries, 2009, 31(1): 92-99. DOI:10.3969/j.issn.1004-2490.2009.01.014 |
| [28] |
HALE L F, DUDGEON J V, MASON A Z, et al. Elemental signatures in the vertebral cartilage of the round stingray, Urobatis halleri, from Seal Beach, California[J]. Environmental Biology of Fishes, 2006, 77(3): 317-325. |
| [29] |
梁振林, 孙鹏, 唐衍力, 等. 鱼类小型化、性早熟的元凶: 捕捞? 环境?[C]//2009年中国水产学会学术年会论文摘要集. 海口: 中国水产学会, 2009: 218-218. LIANG Z L, SUN P, TANG Y L, et al. Prime culprit for fish miniaturization and early sexual maturity: fishing? Environment?[C]//Proceedings of the Abstracts of academic annual meeting of China Fisheries Society in 2009. Haikou: China Society of Fisheries, 2009: 218-218. |
| [30] |
徐海龙, 陈勇, 陈新军, 等. 引入不确定性对Von Bertalanffy生长方程关系参数估算的影响[J]. 水产科学, 2016, 35(2): 169-173. XU H L, CHEN Y, CHEN X J, et al. Impacts of uncertainty on estimated parameters in Von Bertalanffy growth function[J]. Fisheries Science, 2016, 35(2): 169-173. |
| [31] |
陆小萏, 陆文杰, 郑光明, 等. 鱼类生长的幂指数生长方程[J]. 水产学报, 2002, 26(3): 281-284. LU X D, LU W J, ZHENG G M, et al. Power-exponential growth equation of fish growth[J]. Journal of Fisheries of China, 2002, 26(3): 281-284. |
| [32] |
颜云榕, 侯刚, 卢伙胜, 等. 北部湾斑鳍白姑鱼的年龄与生长[J]. 中国水产科学, 2011, 18(1): 145-155. YAN Y R, HOU G, LU H S, et al. Age and growth of pawak croaker Pennahia pawak in Beibu Gulf[J]. Journal of Fishery Sciences of China, 2011, 18(1): 145-155. |
| [33] |
陈毅峰, 何德奎, 曹文宣, 等. 色林错裸鲤的生长[J]. 动物学报, 2002, 48(5): 667-676. CHEN Y F, HE D K, CAO W X, et al. Growth of selincuo schizothoracini (Gymnocypris selincuoensis) in selincuo lake, Tibeten platean[J]. Acta Zoologica Sinica, 2002, 48(5): 667-676. |
| [34] |
沈伟, 姜亚洲, 程家骅. 东海发光鲷的年龄与生长特性[J]. 中国水产科学, 2009, 16(4): 588-595. SHEN W, JIANG Y Z, CHENG J H. Age and growth characters of Acropoma japonicum in the East China Sea[J]. Journal of Fishery Sciences of China, 2009, 16(4): 588-595. DOI:10.3321/j.issn:1005-8737.2009.04.015 |
| [35] |
吴常文, 赵淑江, 胡春春. 东海黄姑鱼年龄与生长的初步研究[J]. 海洋渔业, 2005, 27(3): 193-199. WU C W, ZHAO S J, HU C C. Age and growth of Nibea albiflora in the East China Sea[J]. Marine Fisheries, 2005, 27(3): 193-199. DOI:10.3969/j.issn.1004-2490.2005.03.004 |
| [36] |
胡芬, 严利平, 李圣法. 东海区刺鲳生长、死亡及资源利用状况评价[J]. 水产学报, 2006, 30(5): 662-668. HU F, YAN L P, LI S F. Growth and mortality of Psenopsis anomala and evaluation on resource utilization in the East China Sea[J]. Journal of Fisheries of China, 2006, 30(5): 662-668. |
2. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
3. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


