2. 国家远洋渔业工程技术研究中心, 上海 201306;
3. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
4. 农业农村部大洋渔业开发重点实验室, 上海 201306;
5. 农业农村部大洋渔业资源环境科学观测实验站, 上海 201306
洪堡洋流系统(Humboldt current system, HCS)范围为4°S~40°S, 该系统受到季节性或永久性海岸上升流影响[1]。HCS在局部[2]、季节内[3-4]、年际[5]、年代际[6]及世纪尺度下[7-8]均是以自下而上调控其内部生态平衡。在与东边界上升流(eastern boundary currents, EBCs)相关的几个生态系统: 加利福尼亚洋流、加那利洋流、洪堡洋流和本格拉洋流中[9], 洪堡洋流生态系统(Humboldt current ecosystem, HCES)具有几个特征: 第一, 它是4个系统中最接近赤道线的; 第二, 它是受厄尔尼诺南方涛动(El Niño-Southern Oscillation, ENSO)影响最大的EBCs系统, ENSO现象是全球气候年际变动的最大缘由; 第三, 尽管其初级生产力与其他系统的初级生产力在同一范围内, 但其浮游生物和鱼类的生产力较高, 特别是中上层鱼类[1, 10]。HCES北部海域是世界上单位面积鱼类产量最高的系统, 它的面积仅占了世界海洋的0.1%, 但该系统渔获量可达全球渔获量的10%[11]; 第四, HCS海域具有浅而强烈的最小含氧区(oxygen minimum zone, OMZ)。
据FAO数据统计, HCS主要的中上层鱼类, 如秘鲁鳀(Engraulis ringens)、远东拟沙丁鱼(Sardinops melanosticta)、智利竹鱼(Trachurus murphyi)以及代表性头足类茎柔鱼(Dosidicus gigas), 在1950—2018年东南太平洋渔区仅有这4种渔业年最高产量超过100万t, 可见4种生物在HCS中的关键作用(图 1)。对于这些生物, 由于其生命周期较短, 对海洋环境及气候变化较为敏感, 能够做出快速的反应。鱼类种群在不同时间和空间尺度下的空间分布具有较高的动态性, 对于小型中上层鱼类更甚[12-15]。由于其处于洪堡生态系统的中间营养层, 高度动态性使得其对生态系统的影响显著, 一方面影响其捕食者例如海鸟、大型鱼类、哺乳动物的种群变动, 另一方面浮游生物的种类组成和丰度往往影响中上层鱼类的变动, 由此自下而上控制生态系统的变动[16]。为此, 本文重点关注HCS 4种代表性渔业物种与气候环境变化之间的关系, 探究气候对生态系统的影响, 为未来气候变化背景下更好地利用HCS渔业资源提供科学依据。
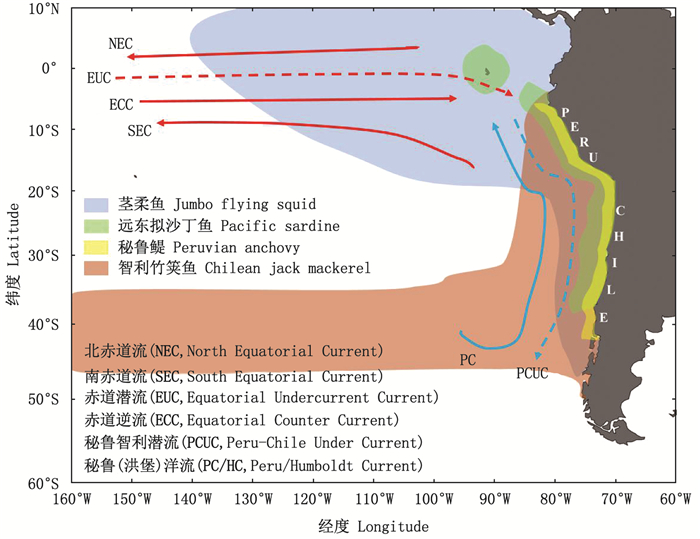
|
图 1 东南太平洋海流及4种代表性渔业分布 Fig. 1 Currents distribution and four representative fisheries in the Southeast Pacific Ocean |
在大尺度上, 信风系统是海洋环流的主要驱动力。南太平洋副热带涡流和赤道海气环流驱动着HCS, 南美洲西海岸沿岸风产生的埃克曼输送使得水体向离岸方向运动, 造成营养丰富的冷水上涌, 进而增加了该海域的生产[17]。另一方面, 沃克环流与东太平洋热带温跃层变浅有关, 有助于由地球自转形成的赤道环流, 并影响沿岸风引起营养物质流向表层。
洪堡洋流(秘鲁寒流)源自40°S左右的西风漂流, 作为科氏力诱发的南太平洋环流的一部分, 它沿着太平洋东海岸向北流动。洪堡洋流向北流动过程中, 将营养盐丰富的亚极地表层水与智利峡湾的淡水混合, 流向智利中部近岸时流速较高; 在秘鲁近海与中小尺度涡流混合, 到5°S~10°S与SEC汇合[1, 18]。环流系统中还有一个关键的洋流是PCUC, 靠近大陆架和上陆坡向极地流动[19]。PCUC从北部输送含氧低且营养丰富的赤道亚表层水, 是秘鲁大部分沿岸上升流的主要来源。流向秘鲁南部海域过程中氧气越来越少, 但在智利附近由于南极中层水向北平流, 亚表层水团特质被稀释[20]。
由于热带东南太平洋风力较弱且上升流使得含氧量低的海水上涌, HCS具有较浅的OMZ[21]。在世界大洋的6个永久性缺氧区中, 东南太平洋的OMZ面积位居第4, 为(2.18×106±0.66×106)km3, 占全球OMZ海域的11%。它的上边界比其他海域的边界浅, 并且在秘鲁中部海域达到最浅的深度。从秘鲁中北部海域到赤道海域, OMZ范围变宽(达1000km), 且深度变深(达700m), 由于有机物分解消耗氧气, 氧气进一步减少;而从秘鲁中部往南, OMZ逐渐缩小, 主要原因为上升流系统减弱、风力增强以及富氧的南极海水混合而导致[20]。上升流促使CO2浓度高的海水上涌, 进而造成表层水pH下降。另一方面, 由于缺氧的特质, OMZ有利于反硝化和厌氧氨氧化细菌进行生化反应, 使得上升流海域氮缺失和硝酸盐缺乏[22]。因此OMZ的上边界海域是一个氧、碳、氮循环的生物化学热点区, 与海洋生物共生关系、代谢等特质与栖息地多种生化反应密切相关[23]。
根据上升流强弱和年际变化以及初级生产力大小, HCS可以分为3个子上升流系统[24]: 秘鲁全年高生产力的上升流系统(4°S~16°S), 沿岸生产带的离岸范围延伸至100~200km, 年平均初级生产率(primary production rate, PPR)约为1.2 kg·C/(m2·y)[25]; 智利的上升流系统可分为2个主要海域[26], 北部上升流海域(18°S~30°S)常年受到持续的弱间歇性上升流的影响[27-28], 生产带范围最窄(< 50km), 具有“高营养、低叶绿素a质量浓度”的特征, 年均PPR约为0.66 kg·C/(m2·y)[25], 而中南部上升流海域(30°S~40°S)表现出强烈的季节性变化, 具体表现为春季、夏季强烈的上升流和秋季、冬季的下降流, 生产带范围延伸至100km左右, 年均PPR约为1.0kg·C/(m2·y)[29-30]。
2 东南太平洋洪堡洋流系统中的渔业现状根据FAO海洋捕捞生产统计数据, 分析了1950—2018年东南太平洋渔区产量数据(图 2), 总体上东南太平洋渔业在20世纪60年代迅速发展, 到70年代初出现了衰退, 70年代中期到90年代中期整体呈现稳定增长趋势, 进入21世纪产量整体呈现下降的趋势。进一步分析发现, 东南太平洋渔业到1994年达到历史最高产量, 为2 042.24万t。1994年后产量下降, 1998年产量下降至821.44万t, 为20世纪90年代以来的产量最低值。尽管1998年后东南太平洋渔业有一定的恢复, 但21世纪10年代产量下降。据计算, 即使1998年产量较低, 东南太平洋20世纪90年代的平均年产量为1506.50万t, 而21世纪初为1 343.07万t, 21世纪10年代为877.16万t。此外, 东南太平洋渔区捕捞产量占世界海洋捕捞总产量的比重总体上也呈现出与产量相同的趋势(图 2), 20世纪60年代其所占比重相对较高, 1962—1971年平均年产量为1033.22万t, 但其年平均比重达18.91%。近年来随着产量下降, 其所占比重也降低, 21世纪10年代平均所占比重缩减为9.34%。
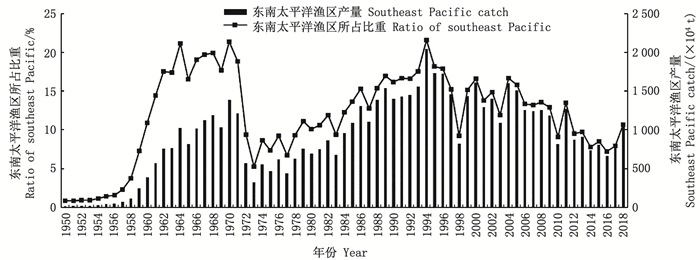
|
图 2 1950—2018年东南太平洋渔区捕捞产量及其占海洋捕捞总产量比重分布图 Fig. 2 Annual catch in the southeast Pacific fishing area and its ratio of total marine capture output in the world from 1950 to 2018 |
根据FAO东南太平洋渔区产量统计数据, 对比分析该渔区年最高产量超过10万t以上的国家, 从20世纪50年代到21世纪, 秘鲁和智利在东南太平洋渔区的产量均处于前两位(除20世纪80年代秘鲁处于第二位), 厄瓜多尔产量均处于第三位。哥伦比亚产量在20世纪50年代处于第四位, 60年代处于第五位, 70—80年代有所下降, 90年代后一直处于第五位。日本从1964年开始在东南太平洋大规模生产, 20世纪60年代处于第四位, 70年代处于第五位, 而此后仅处于6~10位。80年代苏联解体前产量位于第五位, 俄罗斯位于第四位。中国大陆于2000年开始在东南太平洋渔区进行作业生产, 21世纪初产量均位于第四位。
分析21世纪东南太平洋渔区10种年最高产量高于10万t的重要经济渔业种类(图 3和4)。据计算, 2018年东南太平洋渔区年产量排名前五的物种依次为秘鲁鳀(704.50万t)、茎柔鱼(89.06万t)、智利竹鱼(54.29万t)、鲱鱼(34.54万t)、鲣(17.27万t), 它们占了东南太平洋渔区年总产量的85.23%。1950—2018年东南太平洋渔区年最高产量超过200万t的种类仅有秘鲁鳀、远东拟沙丁鱼和智利竹鱼3种, 茎柔鱼在2014年产量超过100万t, 其余种类在东南太平洋渔区的年最高产量均未超过100万t。由图 4可以看出, 鲱鱼渔业在20世纪60年代到70年代中期初步发展, 90年代进一步开发, 2008—2012年均产量达到82.73万t, 近年来产量有所下降维持在30万t左右。鲣鱼年产量在20世纪末期前均低于10万t, 20世纪末至21世纪10年代产量逐渐上升, 近年来保持在20万t左右。鲭在1978年达到最高年产量83.60万t。黄鳍金枪鱼产量波动稳定, 2001年达最高年产量17.14万t。鳕鱼产量波动较为稳定, 年产量在6~19万t波动。智利狐鲣在20世纪60、70年代年产量保持在7万t左右, 1974年产量骤减,到2014年产量一直低于5万t, 近年保持在8万t左右。
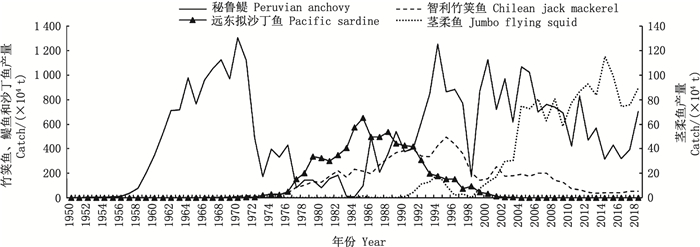
|
图 3 1950—2018年东南太平洋4种代表性渔业(年最高产量超过100万t)产量分布图 Fig. 3 Catch of four representative fisheries (with the maximum annual catch exceeding 1×106t) in the Southeast Pacific Ocean from 1950 to 2018 |
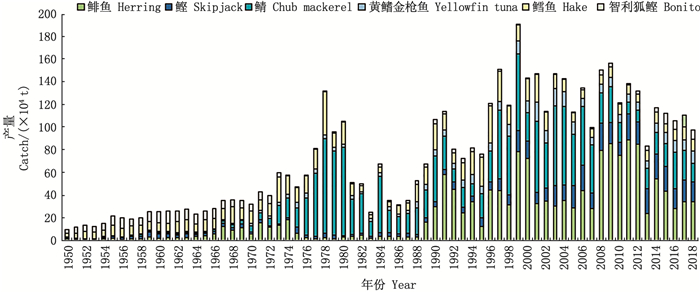
|
图 4 1950—2018年东南太平洋其他代表性渔业产量分布图 Fig. 4 Catch of other representative fisheries in the Southeast Pacific Ocean from 1950 to 2018 |
种群对气候变化的响应是多方面的, 例如丰度、繁殖、洄游模式、空间分布等方面的变化[31-32]。HCS接近赤道, 受到ENSO现象的影响较大。ENSO现象周期为2~7年, 当南方涛动弱时, 海洋水温处于温暖条件(即厄尔尼诺现象: 较高的海表面温度、较弱的上升流生产力和较深的氧跃层); 而当南方涛动强时, 海洋水温处于寒冷条件(即拉尼娜现象: 较低的海表面温度、较强的上升流和较浅的氧跃层), 进而影响生态系统的所有组成部分[3, 29, 33]。太平洋年代际涛动(pacific decadal oscillation, PDO) 是以年代际尺度变化的气候现象, 以海表面温度异常定义不同PDO时期, PDO冷期时, HCS所处的东太平洋海域异常变冷; PDO暖期东太平洋海域则异常变暖[34-35]。
厄尔尼诺事件可能会影响秘鲁鳀的性腺发育, 降低产卵量并且影响其生长, 但对于远东拟沙丁鱼产卵量和补充量似乎没有不利影响。有关厄尔尼诺事件对HCS智利竹鱼的研究较少, 对于茎柔鱼厄尔尼诺事件可能会降低其成熟期个体胴长。CONTRERAS-REYES等[36]研究了1990—2010年智利北部秘鲁鳀性腺月平均指数(gonadsomatic monthly mean, GMM)与洪堡海流指数(humboldt current index, HCI)和多变量ENSO指数(multivariate ENSO index, MEI)之间的关系, 结果表明秘鲁鳀栖息地在发生厄尔尼诺事件时, 海洋环境由寒冷转为温暖条件(HCI与MEI发生显著变化), 影响其性腺的发育, 雌性的GMM与MEI呈负相关, 表明环境变暖时(MEI为正值), 秘鲁鳀的繁殖水平下降。HERNÁNDEZ-SANTORO等[37]结合1988—2017年的海表面温度数据和智利北部秘鲁鳀的生物学数据研究发现, 温度的升高会使秘鲁鳀的大小减少15%, 并降低繁殖力, 影响秘鲁鳀的资源变动。NIQUEN等[38]对秘鲁海域的中上层渔业进行了研究, 发现厄尔尼诺事件期间, 秘鲁鳀的产卵量较低, 而远东拟沙丁鱼与太平洋鲭的产卵量高。POLITIKOS等[39]利用生态模型研究了加利福尼亚洋流系统厄尔尼诺事件对远东拟沙丁鱼补充量的影响, 研究发现厄尔尼诺年温暖的海洋环境使得远东拟沙丁鱼有向北洄游产卵的趋势, 这样更有利于卵和幼鱼存活, 此外模型分析显示1992和2003年为厄尔尼诺年,尽管远东拟沙丁鱼捕食条件不利, 但补充量较好。研究[40]认为, 厄尔尼诺事件可能会影响茎柔鱼的摄食和洄游中营养模式的变化。KEYL等[41]研究认为茎柔鱼成熟期的体长大小取决于温度和食物的供应量, 茎柔鱼在温暖的条件下(例如厄尔尼诺)成熟期个体较小, 在寒冷的条件下(例如拉尼娜)成熟期个体较大, 从而洄游距离更远。
依据商业性捕捞的地理位置以及不同的产卵区域, 可以将秘鲁鳀分为3个主要种群, 分别为秘鲁中北部种群、秘鲁南部-智利北部种群和智利南部种群; 将远东拟沙丁鱼分为4个主要种群, 分别为秘鲁中北部种群、秘鲁南部-智利北部种群、智利中部种群和智利南部种群[42]。厄尔尼诺事件对秘鲁鳀和远东拟沙丁鱼的种群结构有重要影响, 1997—1998年厄尔尼诺事件使得秘鲁中北部秘鲁鳀种群相较于事件发生前体长偏小, 未成熟的稚鱼比例增多, 性腺成熟度也较往年偏低[38]; 通过体长组成分析, 智利北部秘鲁鳀种群平均体长也出现明显的下降[43]。智利竹鱼在洪堡洋流系统分布较为广泛, HCS智利竹鱼种群可能均来自于智利中部产卵群体, BERTRAND等[44]通过三维栖息地模型研究发现智利和秘鲁沿岸均有适宜的智利竹鱼栖息地存在, 但由于19°S~22°S栖息地面积季节性缩小(可能是由于秘鲁中南部附近较浅的氧跃层造成), 从而将部分群体孤立地分布在秘鲁近海。厄尔尼诺事件对智利海域智利竹鱼种群具有影响, 研究发现厄尔尼诺事件使得海洋环境异常变化, 进而影响智利竹鱼种群的洄游路径, 并且异常气候还会对智利竹鱼产生负面影响[45]。根据茎柔鱼角质颚的形态差异, HCS的茎柔鱼可以分为秘鲁和智利外海两个地理种群[46]。厄尔尼诺事件的影响下秘鲁海域茎柔鱼群体的生长较为缓慢, 可能是由于厄尔尼诺事件期间致使茎柔鱼可获得的食物不充足, 而当厄尔尼诺事件过后秘鲁海域恢复较低的温度及高生产力, 仅有增长速度较快的群体能达到较大体长[47]。
4 气候及海洋环境变化对渔业资源的影响1972—1973、1982—1983、1997—1998年的3次厄尔尼诺事件均使得秘鲁鳀渔业受到严重影响, 从而迫使渔民的渔获多样化, HCS渔业从单一品种转变为多品种, 渔船开始捕获其他中上层资源, 如远东拟沙丁鱼、智利竹鱼、太平洋鲭等[38]。虽然厄尔尼诺事件期间HCS渔业向多品种转变, 促使对其他中上层资源捕捞增加, 但相关研究发现厄尔尼诺事件对远东拟沙丁鱼、智利竹鱼、太平洋鲭的影响与秘鲁鳀相反, 它们的生物量在厄尔尼诺事件期间和事件后会出现增加趋势[48]。
秘鲁鳀的资源变动与厄尔尼诺事件密切相关[49], 其具有较为明显的年际波动。其机制可能为: 厄尔尼诺现象盛行时, HCS生产力较低, 溶解氧浓度较高, 秘鲁鳀生物量减少, 厄尔尼诺事件后随着温度下降, 上升流逐渐强势, 秘鲁鳀生物量渐渐恢复[50]。然而秘鲁鳀生物量恢复模式有所不同, 在1972—1973年、1977—1978年和1982—1983年的厄尔尼诺事件之后, 生物量恢复速度较慢; 但在1987年和1997—1998年的厄尔尼诺事件之后, 恢复速度较快; 1992—1993年和2002—2003年的厄尔尼诺事件似乎没有显著影响[42, 51]。MORON等[52]研究表明厄尔尼诺事件期间, 秘鲁鳀集中分布在秘鲁近岸(12°S~14°S), 进而使得种内竞争增加捕捞压力增大, 研究[50]认为该海域可能对秘鲁鳀的生存至关重要, 应对其进行保护。此外秘鲁鳀丰度与年代际尺度的气候现象PDO相关, PDO冷期增加, PDO暖期减少。
厄尔尼诺事件对远东拟沙丁鱼的影响与秘鲁鳀密不可分, 1997—1998年厄尔尼诺事件期间由于秘鲁鳀生物量显著减少, 远东拟沙丁鱼承受着较高的捕捞压力, 对远东拟沙丁鱼的捕获增加并主要集中于幼鱼(0~3龄), 因此在1998年受到显著的负面影响[53]。此外, 远东拟沙丁鱼也受到PDO现象的影响, 远东拟沙丁鱼上岸量距平值与PDO指数呈正相关, 1961—1975年低上岸量与PDO冷位相相关, 1979—1990年上岸量增长与PDO正位相相关, 并且上岸量距平值与南方涛动指数(southern oscillation index, SOI)呈现负相关关系[53]。
ENSO现象会影响HCS智利竹鱼的渔业状况, 智利竹鱼捕捞渔船具有S型捕捞模式, 但由于厄尔尼诺事件的影响, 渔船的捕获率会降低, 对于相同的智利竹鱼生物量, 在厄尔尼诺年间捕捞量低于拉尼娜和正常情况的捕捞量[54]。此外, 智利竹鱼的上岸量与PDO指数和SOI之间具有相关性[55]。茎柔鱼的丰度受到ENSO现象的显著影响, 1997—1998年极强的厄尔尼诺现象期间, 上升流幅度很低, 导致秘鲁茎柔鱼的捕获量非常低[56]。茎柔鱼渔业于20世纪90年代初开始被大规模开发, 产量变动与PDO指数之间的关系目前研究较少, 但已有研究表明, 全球变暖、ENSO以及PDO等气候变化可能通过改变环境条件、种群结构和食物获得来影响茎柔鱼的洄游模式, 进而影响资源变动[41, 57-58]。
HCS特别是秘鲁近海北部, 有一个极浅的OMZ[20, 59]。气候会影响OMZ深度, MOGOLLÓN等[60]研究发现厄尔尼诺事件期间OMZ的上边界相较正常气候条件增加了大约60km的离岸距离及大约150m的深度。在HCS中, 溶解氧是调节中上层生态系统结构的基本属性, 海水中溶解氧浓度与鱼类分布相关[61]。例如远东拟沙丁鱼需要相对较高的溶解氧浓度和更深的氧跃层深度才能繁殖, 而秘鲁鳀能耐受较低的溶解氧条件[61], 智利竹鱼的分布与远东拟沙丁鱼均与亚表层溶解氧浓度有关, 由于其也会受到低氧环境的影响, 所以它们会避开低氧水柱以上较薄的氧饱和度高的表层[44, 62]。BERTRAND等[61]研究结果显示, 秘鲁鳀似乎不会受到非常浅的氧跃层(< 10 m)的影响, 而远东拟沙丁鱼和智利竹鱼则会避开这些海域。茎柔鱼可以长期忍受寒冷、低氧的环境, 可能比大多数中上层竞争者和捕食者耐受时间更长, OMZ的存在反而有利于茎柔鱼的生存[63-64]。茎柔鱼适应缺氧环境具有昼夜垂直洄游特点, 并且在白天占据OMZ[65-66]。秘鲁鳀为冷水性物种, 常栖息在冷的沿岸上升流和其他相似的具有高生产力的冷水团区域[67-68]。远东拟沙丁鱼能够适应的温度范围较大(大约为9~25 ℃), 并且根据其栖息的水团区域发现其分布较为广泛, 在秘鲁近海远东拟沙丁鱼较秘鲁鳀分布广泛, 常处于上升流边界区域。智利竹鱼能适应的温度范围为9~28℃[62, 69]。茎柔鱼属于广温性物种, 通常能适应的范围为15~28℃[56]。海水温度已被证实是解释洪堡洋流系统秘鲁鳀和远东拟沙丁鱼波动的重要因素[42]。温度和食物对秘鲁鳀和远东拟沙丁鱼种群很重要, 进而自下而上地受到气候的控制。厄尔尼诺事件下海表面温度异常偏高使得秘鲁鳀向南部及近岸偏移, 栖息地的减少加剧了秘鲁鳀的种内竞争, 并且更便于天敌的捕食和人类捕捞[38, 42]。茎柔鱼在厄尔尼诺事件下由于温度升高适宜栖息地会减少, 从而影响其丰度[56]。ARCOS等[45]研究认为由于智利竹鱼属于高度洄游物种, 对温度的适宜范围广, 厄尔尼诺事件下使得15℃等温线向南偏移, 进而影响智利竹鱼幼鱼向南迁移。
厄尔尼诺事件期间上升流势力减弱, 导致生产力下降和生物种群变动[26]。近海区域由被困沿岸的开尔文波向极地传播引发的风应力旋度的减少和罗士贝波的向西传播, 使得温跃层加深并且初级生产力降低[70-71]。沿岸上升流的减弱使得表层亚热带温暖且营养盐水平较低的海水向海岸推进, 致使沿岸生产区的面积缩小[72]。CHAVEZ等[73]提出与气候相关的以年代际尺度的生态系统周期变化, 20世纪50年代初到70年代末为“秘鲁鳀位相”(La Vieja), 该期间内海洋物理变化为温跃层浅上升流增强, 海表面温度较低并且营养盐水平较高, 对应的生化变化为浮游动物生物量增加, 初级生产力升高, 秘鲁鳀产量增加, 远东拟沙丁鱼产量减少; 而20世纪70年代末到90年代初为“远东拟沙丁鱼位相”(El Viejo), 该时期与秘鲁鳀位相变化相反。
5 总结与展望HCS具有复杂的海洋环境并受到多尺度气候变化的影响, 了解HCS代表性中上层物种的渔业对气候变化的响应过程, 不仅对于理解它们在生态系统中的生态作用至关重要, 而且鉴于气候强迫和过度捕捞的渔业管理战略, 也对于提高种群评估准确性和可持续发展至关重要。气候对HCS代表性渔业的影响研究, 主要集中在秘鲁鳀与远东拟沙丁鱼的交替变化以及个别强厄尔尼诺年间渔业的变化。随着智利竹鱼与远东拟沙丁鱼资源的衰退, 茎柔鱼作为目前东南太平洋渔获量第二位的渔业, 其在HCS中的生态作用不可忽视。多尺度气候影响下智利竹鱼与茎柔鱼的资源丰度研究较少, 未来应厘清多种代表性渔业与大尺度气候间的关系, 大尺度气候位相转变(PDO位相及“秘鲁鳀位相”和“远东拟沙丁鱼位相”)似乎对生态系统不同阶段的生态变化有影响, 因此对于气候位相转变对代表性渔业的影响需要进行进一步研究。此外, 目前研究均未考虑到不同尺度气候间的交互作用对渔业的影响。
研究和评估气候对生态系统动态的影响需要建立机械模型(mechanistic models), 机械模型主要有与时间序列无关的均衡模型(equilibrium models)和与时间序列相关的模型[74]。均衡模型例如Ecopath和其相关类型的模型, 常被用来表征生态系统中的食物网, 并且可以评估气候和捕捞对生态系统造成的影响。相关学者利用Ecopath模型对北加州生态系统进行了动态模拟[75-76], 证明了气候可以由下而上(通过初级和次级生产的短期和长期变化)以及由上而下(通过主要捕食者的丰度和空间分布的变化)影响生态系统的生产力和动态。而与时间序列相关的端对端模型(end-to-end model)使用大量的参数, 能够再现鱼种动态的重要特征[77-78]。端对端模型基于4个子模型: 区域海洋模型描述水动力、营养-浮游植物-浮游动物模型描述基本生物地球化学、基于个体的生物能量模型描述上层营养层和基于人工智能的捕捞船队模型描述人为捕捞影响。FIECHTER等[77]和ROSE等[78]再现了加州洋流系统秘鲁鳀和远东拟沙丁鱼的变动, 并研究了气候对生态系统的影响。研究气候对HCS生态系统影响的模型构建甚少, 可能由于相关模型的参数较多以及所需数据的可得性, 但为了更好地了解未来气候对生态系统的影响, 需要以生态系统建模为基础, 对整个生态系统的研究尤为重要。
全球变暖可能会改变大气-海洋-陆地的能量和物质交换, 改变气压梯度、近岸和离岸风场以及海流、海表面温度、热层结构以及沿海上升流的强度和时空分布。全球模型预测, 全球变暖可能会导致海洋初级生产力下降, 海洋生物多样性显著丧失, 特别是在热带和极地纬度地区[79]。另一方面, 人类行为使得CO2向海洋的大量涌入正在引起海洋酸化, 这可能会引发海洋生态系统的一系列生物地球化学和生态变化[1]。但目前还不确定这些多重物理生化变化将如何影响HCES的生产力和生物多样性。联合国政府间气候变化专门委员会(intergovernmental panel on climate change, IPCC)模拟了不同典型浓度路径(representative concentration pathways, RCPs)下未来气候变化以便于建立模型进行预测, 但在与人类行为相关的十年至百年时间尺度的气候变化上, 通过比较和观测来预测的能力是有限的, 对于生态系统的预测更甚。与季节到年际时间尺度变化的预测工作不同, 不可能快速获得必要的数据来建模预测未来几十年气候变化对生态系统的影响。但可以先通过探究未来气候对代表性渔业的影响来扩展HCS未来的动态信息。此外, 对HCS渔业管理尤为重要, 管理中既要考虑气候变化的影响, 又要考虑未来人类活动导致的全球变暖对中上层代表性渔业的影响[80]。通过减少气候变化的负面影响来提高生态系统的恢复力稳定性, 是目前确保对HCES进行可持续管理的挑战。
| [1] |
GUTIÉRREZ D, AKESTER M, NARANJO L. Productivity and sustainable management of the Humboldt current large marine ecosystem under climate change[J]. Environmental Development, 2016, 17(s1): 126-144. |
| [2] |
BERTRAND A, GRADOS D, COLAS F, et al. Broad impacts of fine-scale dynamics on seascape structure from zooplankton to seabirds[J]. Nature Communications, 2014, 5: 5239. DOI:10.1038/ncomms6239 |
| [3] |
BERTRAND S, DEWITTE B, TAM J, et al. Impacts of Kelvin wave forcing in the Peru Humboldt current system: scenarios of spatial reorganizations from physics to fishers[J]. Progress in Oceanography, 2008, 79(2/4): 278-289. |
| [4] |
PASSUNI G, BARBRAUD C, CHAIGNEAU A, et al. Seasonality in marine ecosystems: peruvian seabirds, anchovy, and oceanographic conditions[J]. Ecology, 2016, 97(1): 182-193. DOI:10.1890/14-1134.1 |
| [5] |
BARBER R T, CHAVEZ F P. Biological consequences of El Niño[J]. Science, 1983, 222(4629): 1203-1210. DOI:10.1126/science.222.4629.1203 |
| [6] |
AYÓN P, SWARTZMAN G, BERTRAND A, et al. Zooplankton and forage fish species off Peru: large-scale bottom-up forcing and local-scale depletion[J]. Progress in Oceanography, 2008, 79(2/4): 208-214. |
| [7] |
GUTIÉRREZ D, SIFEDDINE A, FIELD D B, et al. Rapid reorganization in ocean biogeochemistry off Peru towards the end of the Little Ice Age[J]. Biogeosciences, 2009, 6(5): 835-848. DOI:10.5194/bg-6-835-2009 |
| [8] |
SALVATTECI R. Multi-decadal to millennial scale variability in oxygen minimum zone intensity, export production and pelagic fish abundance from marine laminated sediments off Pisco, Peru during the las 25000 years[J]. Paris: Université Pierre et Marie Curie, 2013, 286. |
| [9] |
ABRAHAMS A, SCHLEGEL R W, SMIT A J. Variation and change of upwelling dynamics detected in the world's eastern boundary upwelling systems[J]. Frontiers in Marine Science, 2021, 8: 626411. DOI:10.3389/fmars.2021.626411 |
| [10] |
FRÉON P, ARÍSTEGUI J, BERTRAND A, et al. Functional group biodiversity in eastern boundary upwelling ecosystems questions the wasp-waist trophic structure[J]. Progress in Oceanography, 2009, 83(1/4): 97-106. |
| [11] |
CHAVEZ F P, BERTRAND A, GUEVARA-CARRASCO R, et al. The northern humboldt current system: brief history, present status and a view towards the future[J]. Progress in Oceanography, 2008, 79(2/4): 95-105. |
| [12] |
BELLIER E, PLANQUE B, PETITGAS P. Historical fluctuations in spawning location of anchovy (Engraulis encrasicolus) and sardine (Sardina pilchardus) in the Bay of Biscay during 1967-73 and 2000-2004[J]. Fisheries Oceanography, 2007, 16(1): 1-15. DOI:10.1111/j.1365-2419.2006.00410.x |
| [13] |
GUTIÉRREZ M, SWARTZMAN G, BERTRAND A, et al. Anchovy (Engraulis ringens) and sardine (Sardinops sagax) spatial dynamics and aggregation patterns in the Humboldt current ecosystem, Peru, from 1983-2003[J]. Fisheries Oceanography, 2007, 16(2): 155-168. DOI:10.1111/j.1365-2419.2006.00422.x |
| [14] |
SARAUX C, FROMENTIN JM, BIGOT JL, et al. Spatial structure and distribution of small pelagic fish in the northwestern Mediterranean Sea[J]. PLoS One, 2014, 9(11): e111211. DOI:10.1371/journal.pone.0111211 |
| [15] |
PECK M A, ALHEIT J, BERTRAND A, et al. Small pelagic fish in the new millennium: a bottom-up view of global research effort[J]. Progress in Oceanography, 2021, 191: 102494. DOI:10.1016/j.pocean.2020.102494 |
| [16] |
CURY P, BAKUN A, CRAWFORD R J M, et al. Small pelagics in upwelling systems: patterns of interaction and structural changes in "wasp-waist" ecosystems[J]. ICES Journal of Marine Science, 2000, 57(3): 603-618. DOI:10.1006/jmsc.2000.0712 |
| [17] |
ALBERT A, ECHEVIN V, LÉVY M, et al. Impact of nearshore wind stress curl on coastal circulation and primary productivity in the Peru upwelling system[J]. Journal of Geophysical Research: Oceans, 2010, 115(C12): C12033. DOI:10.1029/2010JC006569 |
| [18] |
MONTECINO V, LANGE C B. The Humboldt current system: ecosystem components and processes, fisheries, and sediment studies[J]. Progress in Oceanography, 2009, 83(1/4): 65-79. |
| [19] |
ESPINOZA-MORRIBERÓN D, ECHEVIN V, COLAS F, et al. Impacts of El Niño events on the Peruvian upwelling system productivity[J]. Journal of Geophysical Research: Oceans, 2017, 122(7): 5423-5444. DOI:10.1002/2016JC012439 |
| [20] |
FUENZALIDA R, SCHNEIDER W, GARCÉS-VARGAS J, et al. Vertical and horizontal extension of the oxygen minimum zone in the eastern south Pacific Ocean[J]. DeepSea Research Part Ⅱ: Topical Studies in Oceanography, 2009, 56(16): 992-1003. DOI:10.1016/j.dsr2.2008.11.001 |
| [21] |
VALDÉS J, SIFEDDINE A, GUIÑEZ M, et al. Oxygen minimum zone variability during the last 700 years in a coastal upwelling area of the Humboldt system (Mejillones, 23°S, Chile). A new approach from geochemical signature[J]. Progress in Oceanography, 2021, 193: 102420. |
| [22] |
LAM P, LAVIK G, JENSEN M M, et al. Revising the nitrogen cycle in the Peruvian oxygen minimum zone[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(12): 4752-4757. DOI:10.1073/pnas.0812444106 |
| [23] |
FARÍAS L, BESOAIN V, GARCÍA-LOYOLA S. Presence of nitrous oxide hotspots in the coastal upwelling area off central Chile: an analysis of temporal variability based on ten years of a biogeochemical time series[J]. Environmental Research Letters, 2015, 10(4): 044017. DOI:10.1088/1748-9326/10/4/044017 |
| [24] |
CHAVEZ F P, MESSIÉ M. A comparison of eastern boundary upwelling ecosystems[J]. Progress in Oceanography, 2009, 83(1/4): 80-96. |
| [25] |
LIU K K, ATKINSON L, QUIÑONES R, et al. Carbon and nutrient fluxes in continental margins. Berlin: Springer, 2010: 44-64.
|
| [26] |
ESCRIBANO R, DANERI G, FARÍAS L, et al. Biological and chemical consequences of the 1997-1998 El Niño in the Chilean coastal upwelling system: a synthesis[J]. DeepSea Research Part Ⅱ: Topical Studies in Oceanography, 2004, 51(20/21): 2389-2411. |
| [27] |
THOMAS A C, BLANCO J L, CARR M E, et al. Satellite-measured chlorophyll and temperature variability off northern Chile during the 1996-1998 La Niña and El Niño[J]. Journal of Geophysical Research: Oceans, 2001, 106(C1): 899-915. DOI:10.1029/1999JC000052 |
| [28] |
BLANCO J L, THOMAS A C, CARR M E, et al. Seasonal climatology of hydrographic conditions in the upwelling region off northern Chile[J]. Journal of Geophysical Research: Oceans, 2001, 106(C6): 11451-11467. DOI:10.1029/2000JC000540 |
| [29] |
MCCREARYJRJ P, ANDERSON D L T. An overview of coupled ocean-atmosphere models of El Niño and the southern Oscillation[J]. Journal of Geophysical Research: Oceans, 1991, 96(s1): 3125-3150. |
| [30] |
SOBARZO M, BRAVO L, DONOSO D, et al. Coastal upwelling and seasonal cycles that influence the water column over the continental shelf off central Chile[J]. Progress in Oceanography, 2007, 75(3): 363-382. DOI:10.1016/j.pocean.2007.08.022 |
| [31] |
STENSETH N C, MYSTERUD A, OTTERSEN G, et al. Ecological effects of climate fluctuations[J]. Science, 2002, 297(5585): 1292-1296. DOI:10.1126/science.1071281 |
| [32] |
WALTHER G R, POST E, CONVEY P, et al. Ecological responses to recent climate change[J]. Nature, 2002, 416(6879): 389-395. DOI:10.1038/416389a |
| [33] |
FIEDLER P C. Environmental change in the eastern tropical Pacific Ocean: review of ENSO and decadal variability[J]. Marine Ecology Progress Series, 2002, 244: 265-283. DOI:10.3354/meps244265 |
| [34] |
MILLER A J, CHAI F, CHIBA S, et al. Decadal-scale climate and ecosystem interactions in the north Pacific Ocean[J]. Journal of Oceanography, 2004, 60(1): 163-188. DOI:10.1023/B:JOCE.0000038325.36306.95 |
| [35] |
WU C R. Interannual modulation of the Pacific decadal oscillation (PDO) on the low-latitude western north Pacific[J]. Progress in Oceanography, 2013, 110: 49-58. DOI:10.1016/j.pocean.2012.12.001 |
| [36] |
CONTRERAS-REYES J E, CANALES T M, ROJAS P M. Influence of climate variability on anchovy reproductive timing off northern Chile[J]. Journal of Marine Systems, 2016, 164: 67-75. DOI:10.1016/j.jmarsys.2016.08.006 |
| [37] |
HERNÁNDEZ-SANTORO C, CONTRERAS-REYES J E, LANDAETA M F. Intra-seasonal variability of sea surface temperature influences phenological decoupling in anchovy (Engraulis ringens)[J]. Journal of Sea Research, 2019, 152: 101765. DOI:10.1016/j.seares.2019.101765 |
| [38] |
ÑIQUEN M, BOUCHON M. Impact of El Niño events on pelagic fisheries in Peruvian waters[J]. DeepSea Research Part Ⅱ: Topical Studies in Oceanography, 2004, 51(6/9): 563-574. |
| [39] |
POLITIKOS D V, CURCHITSER E N, ROSE K A, et al. Climate variability and sardine recruitment in the California current: a mechanistic analysis of an ecosystem model[J]. Fisheries Oceanography, 2018, 27(6): 602-622. DOI:10.1111/fog.12381 |
| [40] |
胡贯宇, 方舟, 陈新军. 东太平洋茎柔鱼生活史研究进展[J]. 水产学报, 2018, 42(8): 1315-1328. HU G Y, FANG Z, CHEN X J. Review on the life history of jumbo squid (Dosidicus gigas) inthe eastern Pacific Ocean[J]. Journal of Fisheries of China, 2018, 42(8): 1315-1328. |
| [41] |
KEYL F, ARGUELLES J, WOLFF M, et al. A hypothesis on range expansion and spatio-temporal shifts in size-at-maturity of jumbo squid (Dosidicus gigas) in the eastern Pacific Ocean[J]. CaLifornia Cooperative Oceanic Fisheries Investigations Reports, 2008, 49: 119-128. |
| [42] |
ALHEIT J, NIQUEN M. Regime shifts in the Humboldt current ecosystem[J]. Progress in Oceanography, 2004, 60(2/4): 201-222. |
| [43] |
CANALES T M, LAW R, WIFF R, et al. Changes in the size-structure of a multispecies pelagic fishery off northern Chile[J]. Fisheries Research, 2015, 161: 261-268. DOI:10.1016/j.fishres.2014.08.006 |
| [44] |
BERTRAND A, HABASQUE J, HATTAB T, et al. 3-D habitat suitability of jack mackerel Trachurus murphyi in the southeastern Pacific, a comprehensive study[J]. Progress in Oceanography, 2016, 146: 199-211. DOI:10.1016/j.pocean.2016.07.002 |
| [45] |
ARCOS D F, CUBILLOS L A, NÚÑEZ S P. The jack mackerel fishery and El Niño 1997-98 effects off Chile[J]. Progress in Oceanography, 2001, 49(1/4): 597-617. |
| [46] |
LIU B L, FANG Z, CHEN X J, et al. Spatial variations in beak structure to identify potentially geographic populations of Dosidicus gigas in the eastern Pacific Ocean[J]. Fisheries Research, 2015, 164: 185-192. DOI:10.1016/j.fishres.2014.12.001 |
| [47] |
KEYL F, ARGVELLES J, TAFUR R. Interannual variability in size structure, age, and growth of jumbo squid (Dosidicus gigas) assessed by modal progression analysis[J]. ICES Journal of Marine Science, 2011, 68(3): 507-518. DOI:10.1093/icesjms/fsq167 |
| [48] |
BERTRAND A, SEGURA M, GUTIERREZ M, et al. From small-scale habitat loopholes to decadal cycles: a habitat-based hypothesis explaining fluctuation in pelagic fish populations off Peru[J]. Fish and Fisheries, 2004, 5(4): 296-316. DOI:10.1111/j.1467-2679.2004.00165.x |
| [49] |
CANALES T M, LIMA M, WIFF R, et al. Endogenous, climate, and fishing influences on the population dynamics of small pelagic fish in the southern Humboldt current ecosystem[J]. Frontiers in Marine Science, 2020, 7: 82. DOI:10.3389/fmars.2020.00082 |
| [50] |
GUIÑEZ M, VALDÉS J, SIFEDDINE A, et al. Anchovy population and ocean-climatic fluctuations in the Humboldt current system during the last 700 years and their implications[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2014, 415: 210-224. DOI:10.1016/j.palaeo.2014.08.026 |
| [51] |
BAKUN A, BROAD K. Environmental 'loopholes' and fish population dynamics: comparative pattern recognition with focus on El Niño effects in the Pacific[J]. Fisheries Oceanography, 2003, 12(4/5): 458-473. |
| [52] |
MORON G, GALLOSO P, GUTIERREZ D, et al. Temporal changes in mesoscale aggregations and spatial distribution scenarios of the Peruvian anchovy (Engraulis ringens)[J]. DeepSea Research Part Ⅱ: Topical Studies in Oceanography, 2019, 159: 75-83. DOI:10.1016/j.dsr2.2018.11.009 |
| [53] |
CÁRDENAS-QUINTANA G, FRANCO-MELÉNDEZ M, SALCEDO-RODRÍGUEZ J, et al. The Peruvian sardine, Sardinops sagax: historical analysis of the fishery (1978-2005)[J]. Ciencias Marinas, 2015, 41(3): 203-216. DOI:10.7773/cm.v41i3.2466 |
| [54] |
LIMA M, CANALES T M, WIFF R, et al. The interaction between stock dynamics, fishing and climate caused the collapse of the jack mackerel stock at humboldt current ecosystem[J]. Frontiers in Marine Science, 2020, 7: 123. DOI:10.3389/fmars.2020.00123 |
| [55] |
ESPINO M. El jurel Trachurus murphyi y las variables ambientales de macroescala[J]. Revista Peruana de Biología, 2013, 20(1): 9-20. |
| [56] |
WALUDA C M, RODHOUSE P G. Remotely sensed mesoscale oceanography of the central eastern Pacific and recruitment variability in Dosidicus gigas[J]. Marine Ecology Progress Series, 2006, 310: 25-32. DOI:10.3354/meps310025 |
| [57] |
GILLY W F, MARKAIDA U, BAXTER C H, et al. Vertical and horizontal migrations bythe jumbo squid Dosidicus gigas revealed by electronic tagging[J]. Marine Ecology Progress Series, 2006, 324: 1-17. DOI:10.3354/meps324001 |
| [58] |
BAZZINO G, GILLYW F, MARKAIDA U, et al. Horizontal movements, vertical-habitat utilization and diet of the jumbo squid (Dosidicus gigas) in the Pacific Ocean off baja California sur, Mexico[J]. Progress in Oceanography, 2010, 86(1/2): 59-71. |
| [59] |
BERTRAND A, BALLÓN M, CHAIGNEAU A. Acoustic observation of living organisms reveals the upper limit of the oxygen minimum zone[J]. PLoS One, 2010, 5(4): e10330. DOI:10.1371/journal.pone.0010330 |
| [60] |
MOGOLLÓN R, CALIL P H R. On the effects of ENSO on ocean biogeochemistry in the northern Humboldt current system (NHCS): a modeling study[J]. Journal of Marine Systems, 2017, 172: 137-159. DOI:10.1016/j.jmarsys.2017.03.011 |
| [61] |
BERTRAND A, CHAIGNEAU A, PERALTILLA S, et al. Oxygen: a fundamental property regulating pelagic ecosystem structure in the coastal southeastern tropical Pacific[J]. PLoS One, 2011, 6(12): e29558. DOI:10.1371/journal.pone.0029558 |
| [62] |
BERTRAND A, BARBIERI M A, GERLOTTO F, et al. Determinism and plasticity of fish schooling behaviour as exemplified by the south Pacific jack mackerel Trachurus murphyi[J]. Marine Ecology Progress Series, 2006, 311: 145-156. DOI:10.3354/meps311145 |
| [63] |
STEWART J S, FIELD J C, MARKAIDA U, et al. Behavioral ecology of jumbo squid (Dosidicus gigas) in relation to oxygen minimum zones[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2013, 95: 197-208. DOI:10.1016/j.dsr2.2012.06.005 |
| [64] |
STEWART J S, HAZEN E L, BOGRAD S J, et al. Combined climate- and prey-mediated range expansion of Humboldt squid (Dosidicus gigas), a large marine predator in the California current system[J]. Global Change Biology, 2014, 20(6): 1832-1843. DOI:10.1111/gcb.12502 |
| [65] |
SEIBEL B A. The jumbo squid, Dosidicus gigas (Ommastrephidae), living in oxygen minimum zones Ⅱ: blood-oxygen binding[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2013, 95: 139-144. DOI:10.1016/j.dsr2.2012.10.003 |
| [66] |
ROSA R, SEIBEL B A. Metabolic physiology of the Humboldt squid, Dosidicus gigas: implications for vertical migration in a pronounced oxygen minimum zone[J]. Progress in Oceanography, 2010, 86(1/2): 72-80. |
| [67] |
SWARTZMAN G, BERTRAND A, GUTIÉRREZ M, et al. The relationship of anchovy and sardine to water masses in the Peruvian Humboldt current system from 1983 to 2005[J]. Progress in Oceanography, 2008, 79(2/4): 228-237. |
| [68] |
陈芃, 陈新军. 秘鲁近海秘鲁鳀渔场变化与海洋环境因子的关系[J]. 上海海洋大学学报, 2020, 29(4): 611-621. CHEN P, CHEN X J. Relationship between the variation of Peru coastal Engraulis ringens fishing ground and oceanic environmental factors[J]. Journal of Shanghai Ocean University, 2020, 29(4): 611-621. |
| [69] |
BERTRAND A, BARBIERI M A, CÓRDOVA J, et al. Diel vertical behaviour, predator-prey relationships, and occupation of space by jack mackerel (Trachurus murphyi) off Chile[J]. ICES Journal of Marine Science, 2004, 61(7): 1105-1112. DOI:10.1016/j.icesjms.2004.06.010 |
| [70] |
HALPERN D. Offshore ekman transport and ekman pumping off peru during the 1997-1998 El Niño[J]. Geophysical Research Letters, 2002, 29(5): 1075. |
| [71] |
CORREA-RAMIREZ M A, HORMAZABAL S E, MORALES C E. Spatial patterns of annual and interannual surface chlorophyll-a variability in the Peru-Chile current system[J]. Progress in Oceanography, 2012, 92-95: 8-17. DOI:10.1016/j.pocean.2011.07.008 |
| [72] |
NIXON S, THOMAS A. On the size of the Peru upwelling ecosystem[J]. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 2001, 48(11): 2521-2528. DOI:10.1016/S0967-0637(01)00023-1 |
| [73] |
CHAVEZ F P, RYAN J, LLUCH-COTA S E, et al. From anchovies to sardines and back: multidecadal change in the Pacific Ocean[J]. Science, 2003, 299(5604): 217-221. DOI:10.1126/science.1075880 |
| [74] |
CHECKLEY JR D M, ASCH R G, RYKACZEWSKI R R. Climate, anchovy, and sardine[J]. Annual Review of Marine Science, 2017, 9: 469-493. DOI:10.1146/annurev-marine-122414-033819 |
| [75] |
FIELD J C, FRANCIS R C, AYDIN K. Top-down modeling and bottom-up dynamics: linking a fisheries-based ecosystem model with climate hypotheses in the northern California current[J]. Progress in Oceanography, 2006, 68(2/4): 238-270. |
| [76] |
RUZICKA J J, BRODEUR R D, EMMETT R L, et al. Interannual variability in the northern California current food web structure: changes in energy flow pathways and the role of forage fish, euphausiids, and jellyfish[J]. Progress in Oceanography, 2012, 102: 19-41. DOI:10.1016/j.pocean.2012.02.002 |
| [77] |
FIECHTER J, ROSE K A, CURCHITSER E N, et al. The role of environmental controls in determining sardine and anchovy population cycles in the California current: analysis of an end-to-end model[J]. Progress in Oceanography, 2015, 138: 381-398. DOI:10.1016/j.pocean.2014.11.013 |
| [78] |
ROSE K A, FIECHTER J, CURCHITSER E N, et al. Demonstration of a fully-coupled end-to-end model for small pelagic fish using sardine and anchovy in the California current[J]. Progress in Oceanography, 2015, 138: 348-380. DOI:10.1016/j.pocean.2015.01.012 |
| [79] |
ECHEVIN V, GÉVAUDAN M, ESPINOZA-MORRIBERÓN D, et al. Physical and biogeochemical impacts of RCP8.5 scenario in the Peru upwelling system[J]. Biogeosciences, 2020, 17(12): 3317-3341. DOI:10.5194/bg-17-3317-2020 |
| [80] |
CHEVALLIER A, BROITMAN B R, BARAHONA N, et al. Diversity of small-scale fisheries in Chile: environmental patterns and biogeography can inform fisheries management[J]. Environmental Science & Policy, 2021, 124: 33-44. |
2. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
3. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
5. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31

