2. 上海海洋大学 极地研究中心, 上海 201306;
3. 大洋渔业资源可持续开发教育部重点实验室极地海洋生态系统研究室, 上海 201306;
4. 国家远洋渔业工程技术研究中心, 上海 201306
狭鳕(Gadus chalcogrammus)隶属硬骨鱼纲(Actinopterygii)鳕形目(Gadiformes)鳕科(Gadidae)狭鳕属(Gadus),为冷水性中下层鱼类,广泛分布于北太平洋海域,其资源密度在白令海水域最为集中,是白令海数量最多、最具商业价值的底层鱼类之一[1]。除了经济重要性外,由于其广泛的分布范围和丰富的数量,狭鳕也是横跨陆架的白令海食物网中关键的组成部分[2]。狭鳕占据着北太平洋海洋食物链的中心位置,主要捕食中层浮游生物和小型鱼类[2-3],并作为大型底栖鱼类、海鸟和海洋哺乳动物的摄食对象,是下层和上层营养级之间的关键联系,在北太平洋生态系统的物质循环和能量流动中起到关键作用[4-5]。
狭鳕具有洄游的习性,西白令海水域狭鳕常在春季到达近岸的产卵场进行繁殖,夏季向西北外陆架及陆坡方向洄游进行索饵,之后再前往越冬场[4]。进入繁殖期后,狭鳕会减缓个体生长将能量用于性腺发育,但冬季由于周围环境中能获取的食物来源十分有限,加之狭鳕产卵时基本会停止进食[6],繁殖行为大量消耗了自身的能量储备,故狭鳕的体况由冬季开始下降,直至春季和夏季繁殖期结束后摄入足够的能量才得以恢复[3, 7-8]。因此,夏季摄食对成年狭鳕繁殖期之后体况迅速恢复以及越冬能量累积具有重要意义。与此同时,夏季富脂饵料的可获得性会影响当年0龄幼体的能量储存和越冬生存,以及随后狭鳕种群的补充[9-10]。
夏季,西白令海狭鳕进行索饵洄游时,不同世代在空间分布上无明显的隔离,这也导致西白令海狭鳕种内较为激烈的食物竞争,包括狭鳕幼体对浮游动物的竞争,以及成年狭鳕对幼体的摄食,甚至是幼体间的同类相食[11-12]。这种激烈的食物竞争会对产卵群体的恢复以及补充群体的形成产生影响。目前,国内外关于西白令海夏季狭鳕摄食的研究较少。为此,本研究分析了西白令海夏季狭鳕胃含物组成及其影响因素,以期为西白令海狭鳕摄食生物学特性以及种群动力学研究提供参考,为进一步探讨白令海食物网结构提供基础数据。
1 材料与方法 1.1 样本来源狭鳕样本由大型拖网加工船“新宇1号”于2019年6—8月采样于西白令海外陆架至陆坡海域(178°33′E~177°32′W,60°56′N~61°33′N),见图 1。采集的样本于-20 ℃冷冻保存,待运回实验室后开展进一步分析。

|
图 1 西白令海及采样站点 Fig. 1 Western Bearing Sea with showing sampling locations |
将样本(n=62)于实验室解冻后,进行体长(L)、体质量(MB)、性腺等级、性腺质量(MG)等生物学测量,样本分布情况如表 1所示。体长精确至0.1 cm,体质量精确至0.1 g,性腺质量精确至0.01 g。基础生物学数据采集后将胃囊收集于有标记号的塑料试管中,用于后续胃含物分析。

|
表 1 各月份体长组狭鳕样本量 Tab.1 Monthly sample size of walleye pollock by standard length class |
实验室中,将冷冻的胃放在一个充满水的培养皿中切开,然后将胃和幽门中的内容物取出,称量胃含物质量,精确至0.01 g。在解剖镜下,将胃含物分类和鉴定到最低的分类单元,清点各种类的个体数,并根据胃含物中狭鳕鳞片的存在确定其是否存在同类相食的情况。为了判断狭鳕胃含物中的鳞片是否来自于狭鳕,本研究将狭鳕样本体表的鳞片与胃含物中随机获取的鳞片在解剖镜下进行对比确认。对比结果显示,胃含物中的鱼类鳞片均属于狭鳕。
1.2.3 性腺指数的计算按照以下公式计算狭鳕性腺指数(gonadosomatic index, GSI):
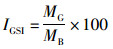
式中:IGSI为性腺指数,%;MG为性腺质量,g;MB为狭鳕体质量,g。
1.3 数据处理采用广义狄利克雷多项分布模型(generalized dirichlet-multinomial model, GDM)[13-14]探究狭鳕胃含物组成和狭鳕自身因素(体长、体质量、性腺指数和胃含物质量)以及时间因素(月份)之间的关系。利用方差膨胀因子(variance inflation factor, VIF)对自变量之间的多重共线性进行分析,发现体长与体质量存在显著的共线性,故在后续分析中剔除体质量。利用Pearson相关性分析检测因变量之间的相关性,如r>0.7则认为具有相关性;本研究中所有因变量之间的相关性均小于0.7。采用逐步加入变量的方式寻找最适模型,并利用赤池信息准则(akaike information criterion,AIC)确定最适模型,其值越小表明模型的拟合效果越佳[15]。GDM模型的运算运用R(版本4.1.2)程序包“MGLM”实现。
2 结果 2.1 胃含物组成狭鳕空胃率仅为0.03%,共识别出5种浮游动物类群,分别为磷虾类(Euphausiacea)、端足类(Amphipods)、桡足类(Copepods)、毛颚类(Chaeteognths)和甲壳动物幼体(Crustacean larvae)。其中,桡足类和磷虾类的数量占比最高,分别为46.04%和39.10%,甲壳动物幼体和端足类数量较少,数量百分比分别为7.76%和6.99%,毛颚类最少,仅占0.11%。样本的体长为23.8~59.5 cm,共29.03%的狭鳕出现了同类相食的现象,出现同类相食的个体体长为28.6~59.5 cm。出现同类相食的个体中,胃含物中浮游动物数量明显减少,体长大于50 cm的狭鳕胃含物中几乎全部为狭鳕肌肉组织。由于体长大于50 cm的狭鳕胃含物中浮游动物仅零星出现,且该体长组样本量较少,所以后续在分析胃含物中浮游动物组成随体长变化时将该体长组略去。
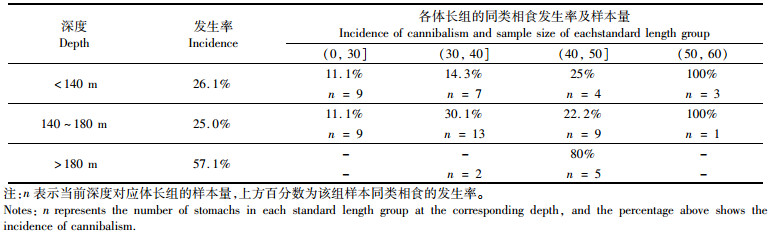
西白令海狭鳕主要集中分布在水深140~180 m的中层水域(n=32),其次为140 m以浅的浅层水域(n=23),仅部分中等体长(30~50 cm)的个体会出现在180 m以深水层(n=7)。深层水域同类相食最为严重(57.1%),浅层水域同类相食主要为大体长个体,中层水域同类相食现象有所减少(表 2)。
|
表 2 狭鳕同类相食发生率与体长、分布深度的关系 Tab.2 Relationship between incidence of cannibalism and length and fishing depth of walleye pollock |
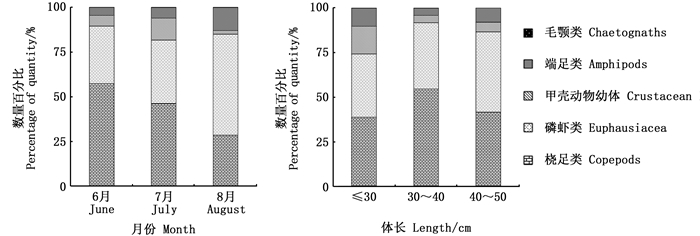
各月之间,胃含物组分存在一定变化(图 2)。随采样时间变化,桡足类数量占比稳步减少。磷虾类和端足类的数量占比随月份变化均呈现增加的趋势,且于8月增加明显,分别达到了56.43%和12.87%。甲壳动物幼体于7月集中出现,数量占比达到12.25%,而6和8月分别仅占5.99%和2.01%。6—8月,毛颚类均有零星出现,并非狭鳕的主要摄食对象。
|
图 2 狭鳕胃含物组成随月份及体长的变化 Fig. 2 Variation in stomach content composition of walleye pollock with month and standard length |
不同体长组之间,胃含物组成也存在一定差异。随体长增加,磷虾类的数量占比略微增加。30~40 cm体长组对桡足类的摄食强度最大,而较少摄食端足类和甲壳动物幼体。体长小于30 cm的个体则更多地摄食端足类和甲壳动物幼体,桡足类和磷虾类在胃含物中的占比均少于其他两个体长组。
2.2 影响胃含物组成的因素GDM分析结果表明,性腺指数(Wald=10.52, P=0.033)和胃含物质量(Wald=11.24, P=0.024)对胃含物的组成影响显著,而月份(Wald=0.71, P>0.05)和体长(Wald=6.94, P>0.05)对胃含物的组分无显著影响。
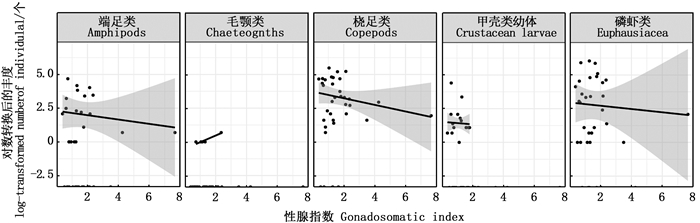
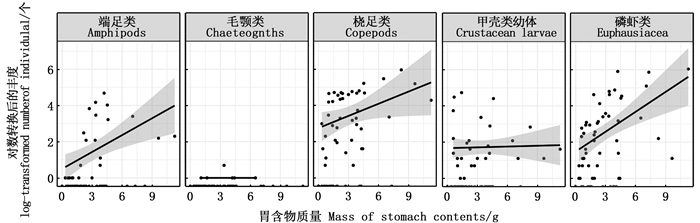
5种胃含物类别中,端足类、桡足类和磷虾类的数目均随着性腺指数的增加而减少;摄食甲壳动物幼体和毛颚类的情况仅出现于性腺指数较小的个体,甲壳动物幼体的数量随性腺指数的变化不显著(图 3)。随着胃含物质量的增加,磷虾类数量的增加最为显著;端足类和桡足类的数目也有明显增加的趋势;甲壳动物幼体的数目随胃含物质量的增加略微上升(图 4)。
|
图中阴影部分为95%置信区间。 Shaded areas signify 95% confident intervals. 图 3 西白令海狭鳕胃含物种类丰度与性腺指数之间的关系 Fig. 3 Relationship between abundance of stomach contents and GSI for walleye pollock in the Western Bering Sea |
|
图中阴影部分为95%置信区间。 Shaded areas signify 95% confident intervals. 图 4 西白令海狭鳕胃含物种类丰度与胃含物质量之间的关系 Fig. 4 Relationship between abundance of stomach contents and mass of stomach contents for walleye pollock in the Western Bering Sea |
狭鳕是机会主义型捕食者,其摄食对象存在广泛的个体及季节性差异,这反映了狭鳕胃含物的组成是由捕食者对被捕食者的获取能力以及捕食者与被捕食者的时空关系两方面共同决定[16-18]。不同海域狭鳕的胃含物组成因当地食物来源可获得性不同而有所差异,春季至夏季白令海狭鳕的主要胃含物组成由桡足类转向磷虾类的过程已有广泛报道[18-19]。YAMAMURA等[3]发现,桡足类在狭鳕胃含物中的出现与其生活史过程密切相关,即每年4—6月,桡足类会广泛地分布在整个温跃层(20~80 m)至250 m的深度水域进行繁殖和发育,恰好与此时狭鳕的分布水层重合,使其成为狭鳕最重要的食物来源。进入夏季之后,桡足类会向更深的水层迁移转而进入滞育期,其分布范围与狭鳕分布范围的重合逐渐减少,因此狭鳕胃含物中桡足类减少。研究发现,狭鳕胃含物中桡足类数量随月份增加而减少,较好地反映了西白令海桡足类空间分布的季节性变化。BUCKLEY等[2]曾表示,狭鳕摄食对象中桡足类和磷虾类相对组成的变化趋势主要由对桡足类的消费驱动,即当桡足类和磷虾类资源量均充足时,狭鳕会优先选择桡足类,磷虾类则作为广泛存在而易获得的潜在捕食对象为狭鳕提供稳定的食物来源。夏季至冬季,磷虾类的资源量不断减少,但其在狭鳕摄食中占据重要地位[3]。GDM结果显示,随着胃含物质量增加,胃含物中磷虾类丰度增加最为明显,说明狭鳕通过摄食磷虾类可以获得更大的摄食成功性,即相对于其他浮游生物,磷虾类在研究海域的丰度较高。所以,在夏季转入秋季的过程中,狭鳕偏好的桡足类丰度减少,转而增强对磷虾类的摄食。端足类在狭鳕摄食中的重要性主要体现在秋、冬两季[20-21],其于8月狭鳕胃含物组成的增加也是浮游动物群落季节性变化的重要体现。狭鳕胃含物中甲壳动物幼体集中出现于7月,这可能也与甲壳动物的季节性生长发育有关。
3.2 体长对狭鳕胃含物组成的影响个体发育会导致狭鳕对饵料资源的利用模式发生改变,其摄食对象会由浮游动物转向鱼类,摄食对象所处水层由水体转向底栖[22]。以往研究中有一些关于白令海陆架区狭鳕摄食对象随体长变化的报道,如BUCKLEY等[2]调查了夏季东白令海狭鳕的摄食情况,指出桡足类在外陆架海域狭鳕胃含物组成中具有重要地位,且占比随体长增加而减少,同时体长大的狭鳕会摄食更多的磷虾类;DWYER等[16]在对白令海狭鳕摄食情况的研究中发现,夏季西北陆架狭鳕主要胃含物随体长增加呈现由桡足类至磷虾类再到狭鳕同类的变化趋势,同类相食在体长大于50 cm的狭鳕胃含物中占比较高。尽管GDM结果显示,体长对狭鳕胃含物组成无显著影响,但本研究结果仍能够部分反映以上规律。研究结果表明,磷虾类在胃含物中的数量占比随体长增加也呈现增加的趋势,体长大于50 cm的个体也出现对鱼类明显的摄食偏好。
桡足类未呈现随狭鳕体长增加而减少的趋势,可能的原因除了实验样本量较少引起的误差之外,还可能是由于小体长组(L≤30 cm)更多地摄食了端足类和甲壳动物幼体所致。作为夏季狭鳕重要的摄食对象,桡足类和磷虾类具有最高的能量密度,甲壳动物幼体次之,而端足类和毛颚类的能量密度最低[23]。一般地,鱼类的体型越大,获取更优食物来源的可能性就越大,而小体长个体的竞争能力较弱,无法获取充足的富脂饵料。本研究海域可能存在较多的端足类和甲壳动物幼体,这些浮游动物游泳能力较弱,且易于被发现[24],更容易被狭鳕捕获;因此,狭鳕通过增加对它们的摄食以获得补充。40~50 cm体长组减少了对桡足类的摄食,可能与狭鳕鳃耙的生长变化有关。BUCKLEY等[2]曾指出,体长变化导致的摄食模式变化可能是因为狭鳕鳃耙间距的变化:狭鳕的鳃耙间距会随体长的增大而增大,导致鳃耙对桡足类截留效率降低,体积较大的磷虾类反而会是较大狭鳕更易获得的食物来源;因此,胃含物中磷虾类的数目占比随狭鳕体长的增加而增加。
3.3 同类相食与深度分布不同体长组的狭鳕在水层分布上的混合较为明显,且均出现了同类相食现象。COONEY等[25]表示,狭鳕成体主要以桡足类和磷虾类为食,仅在浮游动物资源丰度不足时,才开始摄食鱼类。林景宏等[26]调查了夏季白令海中部的浮游动物分布(采样区域覆盖本研究海域),发现100~200 m水层的日均浮游生物量在各水层中最低,该水层范围恰好包含了狭鳕主要分布的水层。因此,研究中出现较普遍的同类相食可能是因为该海域浮游动物丰度不足。YAMAMURA等[3]在比较了同类相食个体和它们摄食对象的体长及深度分布后发现,深海中狭鳕成体在饥饿状态下会进入浅水区以捕食幼体,研究中也观察到了这一现象:大体长组(L>50 cm)的个体会出现在浅层水域(<140 m)捕食同类(表 1)。
DWYER等[16]的研究发现,白令海东南陆架和西北陆架均会出现同类相食现象,东南陆架上的同类相食发生在秋季和冬季,被摄食的狭鳕均为0龄幼体;西北陆架上的同类相食除春季外其他3个季节中均有出现,夏季被摄食狭鳕的个体体长范围最广,包含了0~3龄的个体。不同体长狭鳕垂直分布的重叠是发生同类相食的一个重要条件[16, 27],本研究中出现的不同体长组水层分布的充分混合,似乎可以解释夏季西白令海被摄食狭鳕较大的体长范围。同时,研究中并未发现狭鳕摄食其他小型鱼类的现象,但是DWYER等[16]的研究中,小型鱼类也较少作为夏季西白令海狭鳕的摄食对象,而在其他三个季节较为常见,由此推测狭鳕对同类及其他小型鱼类的摄食选择可能与两者的季节性分布变化有关。
3.4 性腺发育与狭鳕摄食的关系GDM结果显示,夏季狭鳕摄食各类别浮游动物的数量均随性腺指数的增加而减少,这可能由狭鳕产卵时停止摄食引起。西白令海狭鳕的产卵高峰期为每年4—6月[4, 7],尽管存在分批产卵现象,狭鳕性腺恢复的速度较难实现当年的再次产卵,所以大多数狭鳕繁殖期间仅产卵一次,但也会有全年处于繁殖期的个体[28]。本研究采样的时间为6—8月,而模型结果显示,此时性腺指数仍影响着狭鳕能量摄入的情况[8],故样本中可能包含再次产卵的个体。其中1个雄性个体的性腺指数达到接近产卵期峰值,明显大于其他个体的性腺指数,其胃含物数量较少,使得模型中各类别胃含物数目随性腺指数增大而减小的趋势更加明显。
狭鳕的摄食情况也会影响性腺的发育。对比白令海其他海域,位于研究区域东南的阿留申海盆中的狭鳕产卵群体体长较小且繁殖力最低,造成这一现象的原因可能是食物供应的减少[28],DWYER等[16]发现,阿留申海盆中的狭鳕胃含物质量相比于其他海域较小。TRAYNOR等[29]则表示,海盆中狭鳕较差的生长状况与其摄食对象中鱼类,尤其是狭鳕幼体的缺失有关。因此,同类相食会减少狭鳕群体的补充,但又在某种程度上有利于狭鳕的繁殖,这其中两种作用相互影响的机制与结果目前尚不清楚,有待进一步研究。此外,影响鱼类摄食及食性的因素较多,如鱼类分布区域的温、盐结构,水团特征以及初级生产力等,但考虑数据可获得性,本研究仅考虑了狭鳕自身的生物学特性以及月份与水层的因素的影响,后续工作将进一步加强其他因素带来的影响,并增加调查区域的范围与时间跨度,以期全面地阐释该区域狭鳕的摄食机制。
| [1] |
UCHIYAMA T, MUETER F J, KRUSE G H. Multispecies biomass dynamics models reveal effects of ocean temperature on predation of juvenile pollock in the eastern Bering Sea[J]. Fisheries Oceanography, 2020, 29(1): 10-22. DOI:10.1111/fog.12433 |
| [2] |
BUCKLEY T W, ORTIZ I, KOTWICKI S, et al. Summer diet composition of walleye pollock and predator-prey relationships with copepods and euphausiids in the eastern Bering Sea, 1987-2011[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2016, 134: 302-311. DOI:10.1016/j.dsr2.2015.10.009 |
| [3] |
YAMAMURA O, HONDA S, SHIDA O, et al. Diets of walleye pollock Theragra chalcogramma in the Doto area, northern Japan: ontogenetic and seasonal variations[J]. Marine Ecology Progress Series, 2002, 238: 187-198. DOI:10.3354/meps238187 |
| [4] |
SPRINGER A M. A review: Walleye pollock in the North Pacific-how much difference do they really make?[J]. Fisheries Oceanography, 1992, 1(1): 80-96. DOI:10.1111/j.1365-2419.1992.tb00026.x |
| [5] |
林倩倩, 朱国平. 北极阿拉斯加水域鱼类生态特征及其重要性评价[J]. 水产学报, 2019, 43(7): 1581-1592. LIN Q Q, ZHU G P. Ecological characteristics and importance evaluation of fish species in the Arctic Alaska[J]. Journal of Fisheries of China, 2019, 43(7): 1581-1592. |
| [6] |
SMITH R L, PAUL A J, PAUL J M. Seasonal changes in energy and the energy cost of spawning in Gulf of Alaska Pacific cod[J]. Journal of Fish Biology, 1990, 36(3): 307-316. DOI:10.1111/j.1095-8649.1990.tb05611.x |
| [7] |
韦贝贝, 黄开, 朱国平. 西白令海狭鳕夏季卵巢发育特征[J]. 上海海洋大学学报, 2021, 30(2): 331-338. WEI B B, HUANG K, ZHU G P. Ovary development of walleye pollock (Gadus chalcogrammus) in the western Bering Sea summer[J]. Journal of Shanghai Ocean University, 2021, 30(2): 331-338. |
| [8] |
黄开, 韦贝贝, 朱国平. 西白令海夏季狭鳕性腺组织能量密度的影响因素分析[J]. 大连海洋大学学报, 2020, 35(4): 564-569. HUANG K, WEI B B, ZHU G P. Evaluation of factors affecting energy density of gonad of Alaska pollock Gadus chalcogrammus in the Western Bering Sea during summer[J]. Journal of Dalian Ocean University, 2020, 35(4): 564-569. DOI:10.16535/j.cnki.dlhyxb.2019-198 |
| [9] |
HEINTZ R A, SIDDON E C, FARLEY JR E V, et al. Correlation between recruitment and fall condition of age-0 pollock (Theragra chalcogramma) from the eastern Bering Sea under varying climate conditions[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2013, 94: 150-156. DOI:10.1016/j.dsr2.2013.04.006 |
| [10] |
MOSS J H, FARLEY E V JR, FELDMANN A M, et al. Spatial distribution, energetic status, and food habits of eastern Bering Sea age-0 walleye pollock[J]. Transactions of the American Fisheries Society, 2009, 138(3): 497-505. DOI:10.1577/T08-126.1 |
| [11] |
DUFFY-ANDERSON J T, CIANNELLI L, HONKALEHTO T, et al. Distribution of age-1 and age-2 walleye pollock in the Gulf of Alaska and Eastern Bering Sea: sources of variation and implications for higher trophic levels[M]//BROWMAN H I, SKIFTESVIK A B. The Big Fish Bang. Proceedings of the 26th Annual Larval Fish Conference. Bergen: Institute of Marine Research, 2003: 381-394.
|
| [12] |
STEPANENKO M A, GRITSAY E V. Assessment of stock, spatial distribution, and recruitment of walleye pollock in the northern and eastern Bering Sea[J]. Izvestiya TINRO, 2016, 185(2): 16-30. DOI:10.26428/1606-9919-2016-185-16-30 |
| [13] |
BOUGUILA N. Clustering of count data using generalized Dirichlet multinomial distributions[J]. IEEE Transactions on Knowledge and Data Engineering, 2008, 20(4): 462-474. DOI:10.1109/TKDE.2007.190726 |
| [14] |
ZHOU H, LANGE K. MM algorithms for some discrete multivariate distributions[J]. Journal of Computational and Graphical Statistics, 2010, 19(3): 645-665. DOI:10.1198/jcgs.2010.09014 |
| [15] |
AGRESTI A. Categorical data analysis[M]. 2nd ed. New York: John Wiley & Sons, 2002: 73-88.
|
| [16] |
DWYER D A, BAILEY K M, LIVINGSTON P A. Feeding habits and daily ration of walleye pollock (Theragra chalcogramma) in the eastern Bering Sea, with special reference to cannibalism[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1987, 44(11): 1972-1984. DOI:10.1139/f87-242 |
| [17] |
BRODEUR R D. Prey selection by age-0 walleye pollock, Theragra chalcogramma, in nearshore waters of the Gulf of Alaska[J]. Environmental Biology of Fishes, 1998, 51(2): 175-186. DOI:10.1023/A:1007455619363 |
| [18] |
COONEY R T. Bering Sea zooplankton and micronekton communities with emphasis on annual production[M]//HOOD D W, CALDER J A. Eastern Bering Sea shelf: Oceanography and Resources. Seattle: University of Washington Press, 1981, 2: 947-974.
|
| [19] |
BAILEY K M, DUNN J. Spring and summer foods of walleye pollock, Theragra chalcogramma, in the eastern Bering Sea[J]. Fishery Bulletin, 1979, 77: 304-308. |
| [20] |
ADAMS C F, PINCHUK A I, COYLE K O. Seasonal changes in the diet composition and prey selection of walleye pollock (Theragra chalcogramma) in the northern Gulf of Alaska[J]. Fisheries Research, 2007, 84(3): 378-389. DOI:10.1016/j.fishres.2006.11.032 |
| [21] |
KO A R, LEE S J, YANG J H, et al. Diet of the walleye pollock Gadus chalcogrammus in the East Sea, Korea[J]. Korean Journal of Fisheries and Aquatic Sciences, 2020, 53(3): 456-463. |
| [22] |
GORBATENKO K M, KIYASHKO S I, LAZHENTSEV A Y, et al. Benthic-pelagic trophic interactions within the fish assemblage in the western Bering Sea shelf area according to stomach content analysis and ratios of C and N stable isotopes[J]. Russian Journal of Marine Biology, 2008, 34(7): 497-506. DOI:10.1134/S1063074008070092 |
| [23] |
KOOKA K, HAMATSU T, YAMAMURA O. Transported zooplankton from the Okhotsk Sea facilitate feeding and growth of juvenile walleye pollock on a continental shelf along the Oyashio Current, western subarctic Pacific[J]. Marine Biology, 2018, 165(6): 100. DOI:10.1007/s00227-018-3360-9 |
| [24] |
KOOKA K, TAKATSU T, KAMEI Y, et al. Vertical distribution and prey of walleye pollock in the northern Japan Sea[J]. Fisheries Science, 1998, 64(5): 686-693. DOI:10.2331/fishsci.64.686 |
| [25] |
COONEY R T, ALLEN J R, BISHOP M A, et al. Ecosystem controls of juvenile pink salmon (Onchorynchus gorbuscha) and Pacific herring (Clupea pallasi) populations in Prince William Sound, Alaska[J]. Fisheries Oceanography, 2001, 10(s1): 1-13. |
| [26] |
林景宏, 戴燕玉, 林茂, 等. 夏季白令海浮游动物的分布[J]. 极地研究, 2002, 14(2): 126-135. LIN J H, DAI Y Y, LIN M, et al. Distribution of the zooplankton in Bering sea in summer[J]. Chinese Journal of Polar Research, 2002, 14(2): 126-135. |
| [27] |
MUETER F J, LADD C, PALMER M C, et al. Bottom-up and top-down controls of walleye pollock (Theragra chalcogramma) on the Eastern Bering Sea shelf[J]. Progress in Oceanography, 2006, 68(2/4): 152-183. |
| [28] |
HINCKLEY S. The reproductive biology of walleye pollock, Theragra chalcogramma, in the Bering Sea, with reference to spawning stock structure[J]. Fishery Bulletin, 1987, 85(3): 481-498. |
| [29] |
TRAYNOR J J, NELSON M O. Results of the US hydroacoustic survey of pollock on the continental shelf and slope[M]//BAKKALA R G, WAKABAYASHI K. Results of cooperative US-Japan groundfish investigations in the Bering Sea during May-August, 1979. Bulletin of International North Pacific Fisheries Commission, 1985, 44: 192-199.
|
2. Center for Polar Research, Shanghai Ocean University, Shanghai 201306, China;
3. Polar Marine Ecosystem Laboratory, Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31

