2. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
3. 农业农村部大洋渔业开发重点实验室, 上海 201306
水产品是人类重要的优质动物蛋白来源, 渔业捕捞是人类获取水产品的重要途经之一。然而, 随着人类捕捞效率的增强和大型商业捕捞的出现, 全球很多地区都出现了过度捕捞现象, 造成了渔业资源的衰退[1]。为了平衡渔业捕捞和资源保护的关系, 科学有效的渔业资源评估与管理被证明是实现渔业资源可持续开发和利用的重要保障[2]。在过去一百多年的渔业科学发展历程中, 渔业资源评估与管理通常基于不变性(stationarity)假设, 即认为鱼类种群的关键动力学过程(内禀生长率、亲体-补充量关系等)不随时间变化。这一不变性假设广泛地存在于渔业资源评估方法和管理理念中, 是支撑传统渔业资源评估与管理的重要依据[3]。
近年来随着全球气候变化和人类活动影响的加剧, 鱼类种群经常发生大规模、突发性和持续性的变化, 形成所谓的种群模态转变(population regime shift)[4-5]。这些大规模、长周期的系统性变化可能会改变鱼类种群的关键动力学过程, 形成非静态种群动力学过程(non-stationary population dynamics), 从而对传统的基于不变性假设的渔业资源评估与管理产生影响[6]。非静态种群动力学过程对渔业资源评估与管理的影响是近年来渔业科学的研究热点之一, 但是国内对于这方面的研究还处于起步阶段。本文旨在结合近年来国际相关领域的研究成果系统性阐述非静态种群动力学过程的形成机制以及其对渔业资源评估与管理的影响。
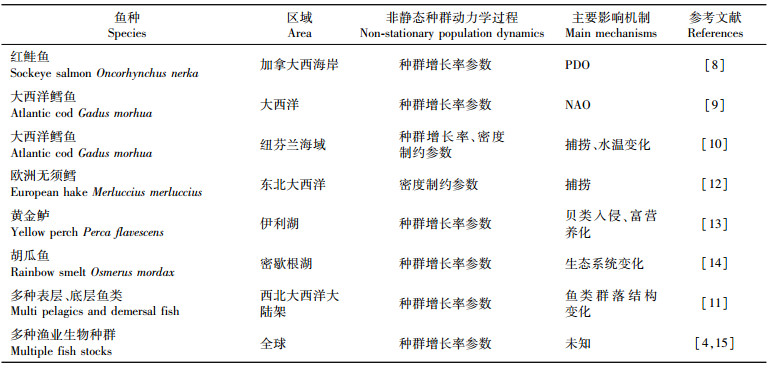
1 非静态种群动力学过程的形成机制非静态种群动力学过程是指种群的关键动力学过程随时间发生系统性的变化从而改变种群的动态特征的现象。一个典型的非静态种群动力学过程是非静态亲体-补充量关系[7]。亲体-补充量关系描述的是未来种群补充量与当前种群亲体量之间的关系, 是决定种群未来变动趋势的关键动力学过程。通常用亲体-补充量模型(比如Ricker模型、Beverton-Holt模型等)来描述这一过程, 而种群增长率参数和密度制约参数是亲体-补充量模型的两个重要参数, 代表的是种群数量的内在增长潜力和受种群密度影响的大小。在不变性假设下, 通常认为这两个参数是不随时间变化的。但是, 近年来越来越多的研究表明, 种群增长率和密度制约参数可能会随着时间发生显著的改变(表 1)。例如, 加拿大西海岸64个三文鱼(Oncorhynchus nerka)种群的增长率参数呈现长期的下降趋势[8]。加拿大东海岸和欧洲的21个大西洋鳕鱼(Gadus morhua)种群的增长率参数也呈现出显著的时间变化[9]。尤其, 加拿大纽芬兰海域的鳕鱼种群增长率和密度制约参数均发生了变化, 导致其亲体-补充量关系出现了模态转变[10]。美国东北大陆架的25个表层和底层鱼类种群的增长率参数也显现出明显的年代纪变动[11]。对东北大西洋的欧洲无须鳕(Merluccius merluccius)种群的研究, 发现其密度制约参数随时间发生变化而呈现出非静态的亲体-补充量关系[12]。在北美五大湖区域, 伊利湖黄金鲈(Perca flavescens)和密歇根湖胡瓜鱼(Osmerus mordax)的亲体-补充量关系随着生态系统的变化也发生明显的年代纪变化[13-14]。在全球尺度的多项研究也发现全球超过半数的渔业生物种群增长率随时间发生了系统性的变化[4, 15]。
|
表 1 全球主要产生非静态种群动力学过程的鱼种、分布和主要影响机制 Tab.1 Global patterns of species, area and main mechanism of stocks showing non-stationary population dynamics |
虽然非静态种群动力学过程在渔业生物种群中普遍存在, 但是其产生机制却十分复杂, 在不同种群间也存在着较大的差异。分布范围较广的海洋鱼类种群通常受到大尺度气候变化的影响。例如, 太平洋年代际涛动(Pacific decadal oscillation, PDO)被认为是导致加拿大西海岸三文鱼产生非静态亲体-补充量关系的重要原因[16], 而北大西洋涛动(north Atlantic oscillation, NAO)则对大西洋鳕鱼的种群动力学过程产生了显著的影响[17]。分布范围较小的淡水鱼类种群则更多地受到当地生态系统变化的影响, 如由贝类入侵和富营养化导致的生态系统变化是造成伊利湖黄金鲈产生非静态种群动力学过程的重要原因[13]。贝类入侵增强了湖泊生态系统的水质净化能力, 而更清澈的水下环境提高了捕食性鱼类的捕捞效率, 不利于黄金鲈幼鱼的存活。富营养化造成湖泊大量区域缺氧, 不利于鱼卵的孵化和幼鱼的存活。这些环境变化共同影响鱼类早期生活史的存活率, 最终导致其亲体-补充量关系发生系统性改变, 形成了非静态亲体-补充量关系[13]。另外, 人类捕捞活动也是导致非静态种群动力学过程的重要机制。例如, 由选择性捕捞引起的种群年龄结构改变影响了欧洲无须鳕的补充量密度制约参数, 形成了非静态亲体-补充量关系[12]。对大部分鱼类物种来说, 年龄大的个体可以生产更多的鱼卵, 而且鱼卵个体更大, 内含营养更丰富, 对食物匮乏条件的耐受力更强, 孵化后的存活率也就更高[18]。因此, 如果渔业捕捞选择性地移除年龄大的个体, 亲体种群会被小龄的个体主导, 导致未来的补充量出现系统性的下降。
总体来讲, 大尺度的气候环境变化、中小尺度的生态系统变化和人类捕捞是造成非静态种群动力学过程的重要机制。目前对非静态种群动力学过程的研究主要集中在亲体-补充量关系, 对于其他潜在的非静态种群动力学过程(个体生长、性成熟过程等)的研究还有待加强。另外需要注意的是, 渔业生物种群通常是受到多个机制同时影响的, 而且不同的机制之间可能会发生相互作用, 最后其各自的影响可能会部分抵消, 也有可能会相互放大[19]。因此, 对非静态种群动力学过程及其产生机制的研究在未来很长一段时间内将依然充满挑战。
2 非静态种群动力学过程影响下的渔业资源评估模型作为渔业资源评估的核心工具之一, 渔业资源评估模型也有着较长的发展历史。从20世纪初的巴拉诺夫(Baranov)模型到20世纪中叶的剩余产量模型、实际种群分析(virtual population analysis)模型, 再到21世纪的综合评估模型(integrated stock assessment models), 渔业资源评估模型在理论和方法上不断完善和改进, 形成了包括生物量模型、年龄结构模型和体长结构模型在内的多种类型[20]。这些评估模型通常根据种群生态和生物学过程搭建数学模型, 然后运用统计学方法拟合观测数据后估算模型的参数。在传统的不变性假设前提下, 渔业资源评估模型通常认为关键的种群动力过程是恒定的, 意味着我们对种群的每一次观测都是对种群动力过程的一次重复取样。因此, 通常认为长时间序列的数据能够有效地增加样本量, 从而增大参数估算的准确性[21]。渔业资源评估中逐渐形成一个潜在的共识: 认为用于评估模型的数据时间序列越长越好。
非静态种群动力学过程的出现在很大程度上颠覆了这一观念。如果种群的关键动力学过程随着时间发生了系统性的变化, 那么历史数据可能并不能反映现在的种群状态。在这种情况下, 只用近期的数据可能会得到更准确的评估结果, 而使用所有的历史数据反而会令估算的结果变得不准确。以剩余产量模型为例, 计算机模拟研究发现当种群内禀增长率随时间发生系统性改变时, 模型估算结果的准确性可能随着数据时间长度的增加而减小[22]。因此, 在非静态种群动力学过程影响下, 不能盲目地追求长时间序列的数据, 而是应该充分考虑历史数据与当前种群动态的相关性。
随着非静态种群动力学过程关注度的提升, 越来越多的资源评估模型开始考虑到将其融入到模型结构中, 允许不变性假设下的固定参数随时间发生变化。具体变化的参数因模型结构和非静态种群动力学过程的不同而有差异。以剩余产量模型为例, 内禀生长率参数(r)和环境容纳量参数(K)是传统评估中固定的两个参数。为了描述非静态种群动力学过程, 可以将内禀生长率参数设定为随时间变化的随机变量, 而其变化趋势可以运用状态-空间模型方法进行估算[22]。对于年龄结构模型, 我们通常认为自然死亡率系数(M)和亲体-补充量的陡度参数(steepness)是不随时间变化的[23]。近年来,越来越多的研究者在积极探索将随时间变化的自然死亡率参数引入到评估模型中[24]。其方法主要可分为两类: (1)通过引入随时间变化的外在变量关联自然死亡率的变动过程。比如可以将自然死亡率与水温关联, 或者将自然死亡率与个体饥饿程度相关联[25]。使用这类方法的前提是对自然死亡率的影响机制有较深的了解, 并且有相关影响因子的观测数据。(2)允许模型自由估算随时间变化的自然死亡率。后一种方法难度较大, 仅在数据充足且质量比较高的时候, 可以结合渔业捕捞和科学调查数据来估算自然死亡率随时间的变化趋势[26-27]。使用这类方法的前提是要有高质量的种群调查数据(相对丰度指数, 标记-重捕数据等)来补充自然死亡率的信息。目前大部分研究都是使用资源评估模型估算出的亲体和补充量数据来研究非静态亲体-补充量关系[9, 13, 15], 在评估模型中直接引入非静态亲体-补充量关系的研究较少, 通常仅通过补充残差来模拟补充量的时间变化。而且即使假设亲体-补充量关系不随时间变化, 在评估模型中估算其参数的不确定性也很高, 很多模型选择将亲体-补充量参数(比如陡度参数)固定在某一值来帮助模型收敛[28]。因此, 在评估模型中估算亲体-补充量参数随时间的变化趋势难度较大, 需要有进一步的模型理论和技术创新作为支撑。
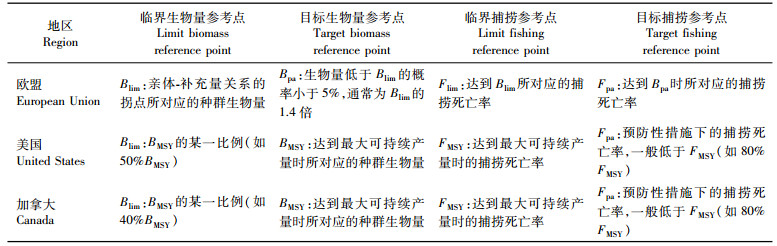
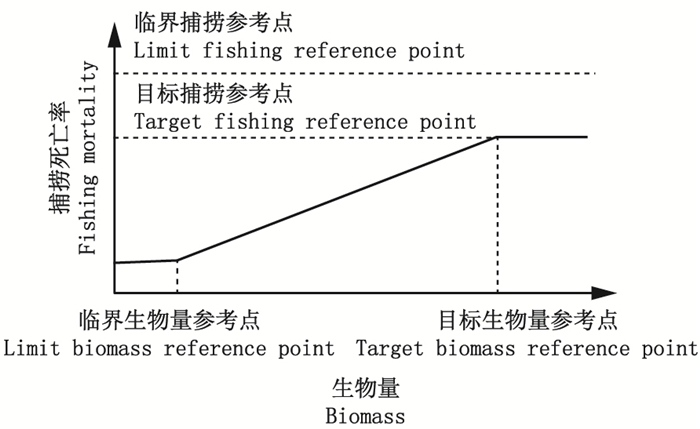
3 非静态种群动力学过程影响下的生物学参考点生物学参考点是对渔业管理目标进行量化的关键指标, 是制定渔业管理策略的重要依据[29]。目前渔业管理中常见的生物学参考点可分为目标参考点和临界参考点, 而这两类参考点中又分别包括生物量参考点和捕捞参考点(表 2)。具体参考点的选择因不同的国家和地区而有所差异[30]。生物学参考点可以用临界生物量参考点(Blim)为基础, 而目标生物量参考点设为Blim的倍数(如1.4倍)。另外, 生物学参考点也可以用最大可持续产量(MSY)为基础。通常将BMSY(产生MSY时的种群生物量)作为目标生物学参考点, 而Blim则根据BMSY的某一比例(比如50%或40%)进行推算。虽然全球不同国家和地区对具体生物学参考点的选择不同, 但是一般都认为这些生物学参考点是不随时间变化的, 而且他们所定义的捕捞控制规则(harvest control rule)非常相似(图 1)。当实际种群生物量低于目标生物量参考点时, 捕捞死亡率应随生物量的减小而降低。当种群生物量下降到临界生物量参考点时, 则应当将捕捞死亡率控制在所能够实现的最小值(对有些渔业而言意味着停止捕捞)。捕捞死亡率应始终低于临界捕捞参考点。
|
表 2 不同地区对生物学参考点的定义 Tab.2 Definitions of biological reference points in different regions |
|
图 1 各类生物学参考点在捕捞控制规则中的应用 Fig. 1 Application framework of biological reference points in harvest control rule |
在非静态种群动力学过程存在时, 生物学参考点需要随着时间变化以适应当前的种群动力学特征, 形成所谓的“动态参考点”(dynamic reference points)。动态参考点通常有3种计算方式: (1)如果非静态种群动力学过程的产生机制较为明确, 则在计算生物参考点的时候可以将相关的环境和生态因子考虑进去。例如, 日本沙丁鱼(Sardinops melanostictus)的临界参考点中引入了其育幼场冬季的表层海水温度的变化[31]。这种方法基于生态学机制, 具有较强的科学依据。但是很多种群的非静态动力学过程的产生机制并不明确, 且影响机制本身也可能随时间发生变化[32-33]。(2)只选取近期的、种群动力学机制相对稳定的时间段的数据来计算生物参考点。美国的Magnuson-Stevens法案提出渔业管理要基于当前主导的生态和环境状态(prevailing ecological and environmental conditions), 因此有些渔业将生物学参考点的计算局限在近期的某一特定时间段内[34]。该方法的缺点是这一特定时间段的定义不好掌握, 很多渔业缺少充足的数据来准确判定这一时间段的起始时间, 而所选取的时间长短对生物学参考点的数值有显著的影响[35]。(3)根据连续变化的种群动力学参数来计算连续变化的动态参考点。例如, 通过估算亲体-补充量关系参数随时间的变化趋势, 可以计算出连续变化的基于MSY的生物学参考点[36]。利用移动时间窗等方法也可以计算出随时间连续变化的B0(捕捞死亡率为零时的种群生物量)[34]。虽然对动态参考点的研究已经有了较长的时间, 但是其在实际渔业管理中的应用依然很少[37]。
4 非静态种群动力学过程影响下基于弹性的渔业管理传统的渔业管理基于最优性原则(optimization), 其目的是通过寻求最优的管理策略来达到预期的管理目标, 例如以实现最大可持续产量为目的的渔业管理体系[3]。在非静态种群动力学过程下, 渔业生物种群可以在多个稳定态之间转换, 对于最优性原则的解读需要发生改变。相应的, 渔业管理的目标应该转为追求适应性(adaptation), 即根据种群状态变化来不断改变管理策略以适应渔业的变化[38]。而适应性的渔业管理又分为被动性适应和主动性适应。被动性适应的渔业管理根据种群动态的改变提出相应的应对措施, 因此管理策略通常滞后于种群的变化。例如, 西北大西洋鳕鱼资源崩溃后, 加拿大政府实施了长期的禁渔策略来恢复鳕鱼资源[39]。但是, 由于管理策略实施的滞后性, 在禁渔几十年后其鳕鱼资源依然没有完全恢复[40]。主动性适应则要求我们根据未来可能的种群变化情况同时提出多种管理策略, 根据实际管理效果对各种策略进行评估和改进。例如, 渔业管理策略评估(management strategy evaluation)通过构造多个运行模型来模拟未来可能存在的种群动态模式, 并进一步在各个运行模型中对多个管理策略的实际效果进行评估和比较[41]。
渔业管理理念从最优化向适应性的过度是我们应对非静态种群动力学过程的重要举措[38], 而基于弹性的管理理念则能够进一步提高渔业管理对非静态种群动力学过程的适应性[42]。在这里我们先介绍两个重要的概念: 社会-生态系统(social-ecological system)和生态弹性(ecological resilience)。社会-生态系统是一个广义的包括生态系统和人类社会的自适应性的复杂系统, 而渔业包含着自然种群和人类捕捞活动, 是一个典型的社会-生态系统[43]。生态弹性是指系统在不发生模式转变的情况下可以吸收的外部扰动量, 代表的是系统维持在某一稳定状态的能力[44]。基于弹性的渔业管理(resilience-based fisheries management)要求我们将管理目标定义为通过提高渔业社会-生态系统的弹性来将渔业维持在对人类更加有利的状态[45]。这一管理理念是对传统的单鱼种渔业管理和基于生态系统的渔业管理的补充, 其特点是将人类社会作为系统的内部组分, 通过渔业管理将整个社会-生态系统维持在我们想要的状态。例如, 对阿拉斯加渔业的研究发现通过增加渔业捕捞的多样性可以增强整个渔业社会-生态系统的稳定性[46]。
5 结语非静态种群动力学过程的发现在一定程度上颠覆了基于不变性假设的传统渔业资源评估与管理, 对渔业资源评估模型、渔业管理的生物学参考点和渔业管理理念都产生了重要的影响。在非静态种群动力学过程影响下, 渔业资源评估模型和生物学参考点都需要考虑到关键种群动力学过程的时间变化, 通过引入外部环境变量或者随时间变化的种群动力学参数来应对其带来的影响。在渔业管理方面, 基于弹性的管理理念将是我们应对非静态种群动力学过程的重要研究方向。通过管理渔业社会-生态系统的弹性将其维持在对我们有利的系统状态, 有利于实现渔业资源的可持续开发和利用, 保障渔业社会-生态系统的稳定和健康。
我国目前对非静态种群动力学过程影响下的渔业资源评估与管理研究较少, 建议未来从以下几个方面开展相应研究: (1)开展对非静态种群动力学过程的研究。从种群生态学的角度重点分析渔业生物种群的关键动力学过程随时间的变化规律, 并对其产生机制进行深入研究。(2)开展基于非静态种群动力学过程的渔业资源评估模型的研究。我国目前主要以使用国外开发的渔业资源评估模型为主, 自主开发模型的研究很少。未来可以以非静态种群动力学过程的研究为契机, 将其引入到传统的资源评估模型中, 加入到渔业资源评估模型开发的国际前沿领域。同时需要加强基于物种水平的基本渔业数据统计和管理, 解决制约我国近海和淡水渔业开展资源评估研究的数据问题。(3)开展基于非静态种群动力学过程的渔业管理的研究。我国在近海和淡水渔业管理中依然处于粗放型的输入控制(禁渔、网具控制等)为主, 精细化的输出控制(设置捕捞限额等)为辅的阶段。未来随着国家渔业管理水平和强度的提高, 对于精细化管理的需求会越来越高。在气候变化和人类影响的背景下, 对于基于弹性的渔业管理的研究将为我国渔业资源可持续开发和利用提供重要的科学依据。
| [1] |
WORM B, HILBORN R, BAUM J K, et al. Rebuilding global fisheries[J]. Science, 2009, 325(5940): 578-585. DOI:10.1126/science.1173146 |
| [2] |
HILBORN R, OVANDO D. Reflections on the success of traditional fisheries management[J]. ICES Journal of Marine Science, 2014, 71(5): 1040-1046. DOI:10.1093/icesjms/fsu034 |
| [3] |
HILBORN R, WALTERS C J. Quantitative fisheries stock assessment: Choice, dynamics and uncertainty[J]. Reviews in Fish Biology and Fisheries, 1992, 2(2): 177-178. DOI:10.1007/BF00042883 |
| [4] |
VERT-PRE K A, AMOROSO R O, JENSEN O P, et al. Frequency and intensity of productivity regime shifts in marine fish stocks[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(5): 1779-1784. DOI:10.1073/pnas.1214879110 |
| [5] |
ZHANG F. Early warning signals of population productivity regime shifts in global fisheries[J]. Ecological Indicators, 2020, 115: 106371. DOI:10.1016/j.ecolind.2020.106371 |
| [6] |
SZUWALSKI C S, HOLLOWED A B. Climate change and non-stationary population processes in fisheries management[J]. ICES Journal of Marine Science, 2016, 73(5): 1297-1305. DOI:10.1093/icesjms/fsv229 |
| [7] |
WALTERS C J. Nonstationarity of production relationships in exploited populations[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1987, 44(S2): s156-s165. DOI:10.1139/f87-319 |
| [8] |
PETERMAN R M, DORNER B. A widespread decrease in productivity of sockeye salmon (Oncorhynchus nerka) populations in western North America[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2012, 69(8): 1255-1260. DOI:10.1139/f2012-063 |
| [9] |
MINTO C, FLEMMING J M, BRITTEN G L, et al. Productivity dynamics of Atlantic cod[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2014, 71(2): 203-216. DOI:10.1139/cjfas-2013-0161 |
| [10] |
TANG X Z, ZHENG N, RIDEOUT R M, et al. Identification of recruitment regime shifts with a hidden Markov stock-recruitment model[J]. ICES Journal of Marine Science, 2021, 78(7): 2591-2602. DOI:10.1093/icesjms/fsab141 |
| [11] |
TABLEAU A, COLLIE J S, BELL R J, et al. Decadal changes in the productivity of New England fish populations[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2019, 76(9): 1528-1540. DOI:10.1139/cjfas-2018-0255 |
| [12] |
HIDALGO M, OLSEN E M, OHLBERGER J, et al. Contrasting evolutionary demography induced by fishing: the role of adaptive phenotypic plasticity[J]. Ecological Applications, 2014, 24(5): 1101-1114. DOI:10.1890/12-1777.1 |
| [13] |
ZHANG F, REID K B, NUDDS T D. Ecosystem change and decadal variation in stock-recruitment relationships of Lake Erie yellow perch (Perca flavescens)[J]. ICES Journal of Marine Science, 2018, 75(2): 531-540. DOI:10.1093/icesjms/fsx188 |
| [14] |
FEINER Z S, BUNNELL D B, HÖÖK T O, et al. Non-stationary recruitment dynamics of rainbow smelt: the influence of environmental variables and variation in size structure and length-at-maturation[J]. Journal of Great Lakes Research, 2015, 41(1): 246-258. DOI:10.1016/j.jglr.2014.11.029 |
| [15] |
SZUWALSKI C S, VERT-PREK A, PUNT A E, et al. Examining common assumptions about recruitment: a meta-analysis of recruitment dynamics for worldwide marine fisheries[J]. Fish and Fisheries, 2015, 16(4): 633-648. DOI:10.1111/faf.12083 |
| [16] |
DORNER B, PETERMANR M, HAESEKER S L. Historical trends in productivity of 120 Pacific pink, chum, and sockeye salmon stocks reconstructed by using a Kalman filter[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2008, 65(9): 1842-1866. DOI:10.1139/F08-094 |
| [17] |
BRANDER K M. Cod recruitment is strongly affected by climate when stock biomass is low[J]. ICES Journal of Marine Science, 2005, 62(3): 339-343. DOI:10.1016/j.icesjms.2004.07.029 |
| [18] |
BIRKELAND C, DAYTON P K. The importance in fishery management of leaving the big ones[J]. Trends in Ecology &Evolution, 2005, 20(7): 356-358. |
| [19] |
COLLIE J, ROCHET M J, BELL R. Rebuilding fish communities: the ghost of fisheries past and the virtue of patience[J]. Ecological Applications, 2013, 23(2): 374-391. DOI:10.1890/12-0877.1 |
| [20] |
QUINN T J. Ruminations on the development and future of population dynamics models in fisheries[J]. Natural Resource Modeling, 2003, 16(4): 341-392. |
| [21] |
MAGNUSSON A, HILBORN R. What makes fisheries data informative?[J]. Fish and Fisheries, 2007, 8(4): 337-358. DOI:10.1111/j.1467-2979.2007.00258.x |
| [22] |
ZHANG F, REID K B, NUDDS T D. The longer the better? Trade-offs in fisheries stock assessment in dynamic ecosystems[J]. Fish and Fisheries, 2021, 22(4): 789-797. DOI:10.1111/faf.12550 |
| [23] |
JOHNSON K F, MONNAHAN C C, MCGILLIARD C R, et al. Time-varying natural mortality in fisheries stock assessment models: identifying a default approach[J]. ICES Journal of Marine Science, 2015, 72(1): 137-150. DOI:10.1093/icesjms/fsu055 |
| [24] |
JIAO Y, SMITH E P, O'REILLY R, et al. Modelling non-stationary natural mortality in catch-at-age models[J]. ICES Journal of Marine Science, 2012, 69(1): 105-118. DOI:10.1093/icesjms/fsr184 |
| [25] |
REGULAR P M, BUREN A D, DWYER K S, et al. Indexing starvation mortality to assess its role in the population regulation of Northern cod[J]. Fisheries Research, 2022, 247: 106180. DOI:10.1016/j.fishres.2021.106180 |
| [26] |
CADIGAN N G. A state-space stock assessment model for northern cod, including under-reported catches and variable natural mortality rates[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2016, 73(2): 296-308. DOI:10.1139/cjfas-2015-0047 |
| [27] |
ZHANG F, RIDEOUT R M, CADIGAN N G. Spatiotemporal variations in juvenile mortality and cohort strength of Atlantic cod (Gadus morhua) off Newfoundland and Labrador[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2020, 77(3): 625-635. DOI:10.1139/cjfas-2019-0156 |
| [28] |
KOLODY D S, EVESONJ P, PREECE A L, et al. Recruitment in tuna RFMO stock assessment and management: a review of current approaches and challenges[J]. Fisheries Research, 2019, 217: 217-234. DOI:10.1016/j.fishres.2018.11.031 |
| [29] |
CADDY J F, MAHON R. Reference points for fisheries management. Rome: FAO, 1995: 83.
|
| [30] |
ICES. Workshop of fisheries management reference points in a changing environment (WKRP Change, outputs from 2020 meeting). Copenhagen: ICES, 2021: 39.
|
| [31] |
HURTADO-FERRO F, HIRAMATSU K, SHIRAKIHARA K. Allowing for environmental effects in a management strategy evaluation for Japanese sardine[J]. ICES Journal of Marine Science, 2010, 67(9): 2012-2017. DOI:10.1093/icesjms/fsq126 |
| [32] |
MYERS R A. When do environment-recruitment correlations work?[J]. Reviews in Fish Biology and Fisheries, 1998, 8(3): 285-305. DOI:10.1023/A:1008828730759 |
| [33] |
LITZOW M A, CIANNELLI L, CUNNINGHAM C J, et al. Nonstationary effects of ocean temperature on Pacific salmon productivity[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2019, 76(11): 1923-1928. DOI:10.1139/cjfas-2019-0120 |
| [34] |
PUNT A E, TERESA A, BOND N, et al. Fisheries management under climate and environmental uncertainty: control rules and performance simulation[J]. ICES Journal of Marine Science, 2014, 71(8): 2208-2220. DOI:10.1093/icesjms/fst057 |
| [35] |
VAN DEURS M, BROOKS M E, LINDEGREN M, et al. Biomass limit reference points are sensitive to estimation method, time-series length and stock development[J]. Fish and Fisheries, 2021, 22(1): 18-30. DOI:10.1111/faf.12503 |
| [36] |
COLLIE J S, BELL R J, COLLIE S B, et al. Harvest strategies for climate-resilient fisheries[J]. ICES Journal of Marine Science, 2021, 78(8): 2774-2783. DOI:10.1093/icesjms/fsab152 |
| [37] |
ZHANG F, EDDY T, DUPLISEA D, et al. Report on ocean frontier institute workshop on fisheries management reference points in highly dynamic ecosystems. 2021.
|
| [38] |
LINKOV I, SATTERSTROM F K, KIKER G A, et al. From optimization to adaptation: Shifting paradigms in environmental management and their application to remedial decisions[J]. Integrated Environmental Assessment and Management, 2006, 2(1): 92-98. DOI:10.1002/ieam.5630020116 |
| [39] |
MYERS R A, HUTCHINGS J A, BARROWMAN N J. Why do fish stocks collapse? The example of cod in Atlantic Canada[J]. Ecological Applications, 1997, 7(1): 91-106. DOI:10.1890/1051-0761(1997)007[0091:WDFSCT]2.0.CO;2 |
| [40] |
ROSE G A, ROWE S. Northern cod comeback[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2015, 72(12): 1789-1798. DOI:10.1139/cjfas-2015-0346 |
| [41] |
PUNT A E, BUTTERWORTH D S, DE MOOR C L, et al. Management strategy evaluation: best practices[J]. Fish and Fisheries, 2016, 17(2): 303-334. DOI:10.1111/faf.12104 |
| [42] |
FOLKE C, CARPENTER S, WALKER B, et al. Regime shifts, resilience, and biodiversity in ecosystem management[J]. Annual Review of Ecology, Evolution, and Systematics, 2004, 35: 557-581. DOI:10.1146/annurev.ecolsys.35.021103.105711 |
| [43] |
OSTROM E. A general framework for analyzing sustainability of social-ecological systems[J]. Science, 2009, 325(5939): 419-422. DOI:10.1126/science.1172133 |
| [44] |
GUNDERSON L H. Ecological resilience-in theory and application[J]. Annual Review of Ecology and Systematics, 2000, 31: 425-439. DOI:10.1146/annurev.ecolsys.31.1.425 |
| [45] |
FOLKE C, HAHN T, OLSSON P, et al. Adaptive governance of social-ecological systems[J]. Annual Review of Environment and Resources, 2005, 30: 441-473. DOI:10.1146/annurev.energy.30.050504.144511 |
| [46] |
CLINE T J, SCHINDLER D E, HILBORN R. Fisheries portfolio diversification and turnover buffer Alaskan fishing communities from abrupt resource and market changes[J]. Nature Communications, 2017, 8: 14042. DOI:10.1038/ncomms14042 |
2. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
3. Key Laboratory of Oceanic Fisheries Exploitation, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


