2. 上海市水产动物良种创制与绿色养殖协同创新中心, 上海 201306;
3. 江苏省沿海开发有限公司, 江苏 东台 224200
近年来,我国沿海池塘养殖面积迅速扩大,水产养殖已成为沿海地区土地复垦的重要途径之一[1]。然而,随着产业的发展和经济效益的提高,沿海自然栖息地遭到破坏、原生湿地萎缩或消失等一系列问题随之出现[2]。许多水产养殖系统会产生大量富含氮、磷和有机物的废水,对外排放到河流、湖泊和海洋中[3]。由于承受能力有限,大量的养分在受纳水域中积累并最终导致生态失衡[4-5]。条子泥垦区为江苏省代表性的垦区之一,自2014年开发至今,内部条南片区已累计开垦池塘约1 000 hm2。目前,片区所有的池塘养殖尾水均经由一排水河道向外排出,并依赖河道自身的生态系统进行水质净化。然而,在尾水的长期作用下,河道内的生态环境如何尚未进行过研究。
作为河流系统的两个重要组成,水体和沉积物之间紧密联系。水系中的污染物可通过交换反应在固相和液相间迁移,水溶性污染物可转为固相向沉积物中沉积,沉积物中污染物又会重新释放影响上覆水体水质[6-7]。细菌在水和沉积物间的物质循环和能量流动中起关键作用[8],其不仅参与有机物的生产和分解,还有助于水生生态系统的养分循环[9-10]。本研究采用16S rRNA高通量测序技术,对条子泥垦区池塘养殖尾水净化河道内的环境因子和细菌群落进行研究,可为我国沿海垦区的水产养殖尾水治理提供参考。
1 材料与方法 1.1 采样地点和方法试验点位于江苏省东台市条子泥垦区条南片区(32°45′25″N,120°56′0″ E)。2020年9月,片区实际养殖水面约800 hm2。各养殖池塘排放的尾水经3条东西走向的排水渠汇入净化河道,并经由河道由北向南流入黄海。河道全长约4.2 km,水面最窄处约100 m,最宽处可达600 m以上。根据3个排水渠的汇入点,将河道划分为3段,每段选取中间位置结合入海闸口设立4个取样点(图 1)。分别于2020年9月1日、2020年11月7日和2021年1月4日使用有机玻璃采水器和抓斗式采泥器采集河道内表层水体(0~50 cm)和表层沉积物(0~10 cm),每个采样点随机采集3~4个样本进行混合。在样本编号中,首字母W和S分别代表水体和沉积物,第二位字母S、N和J分别代表 9月、11月和1月,第三位数字代表采样点序号。

|
图 1 河道内采样点的分布 Fig. 1 Distribution of sampling sites in the channel |
利用便携式多参数水质测量仪(Multi 3430,德国WTW公司)测定水体的pH、溶解氧(DO)、盐度(SAL)和水温(T)。水体的总氮(TN)、总磷(TP)和高锰酸盐指数(CODMn)分别采用碱性过硫酸钾消解紫外分光光度法、过硫酸钾消解-钼锑抗分光光度法和酸性高锰酸盐指数法直接测定[11]。水样经滤膜(0.45 μm)抽滤后,分别采用紫外分光光度法和钼锑抗分光光度法测定硝态氮(NO3--N)和可溶性活性磷酸盐(SRP)。叶绿素a(Chl.a)采用丙酮分光光度法测定[12]。水样经滤膜(0.45 μm)抽滤后,测定硝态氮(NO3--N)和可溶性活性磷酸盐(SRP)。沉积物样本经冷冻干燥后,研磨过100目筛网。沉积物pH按照泥水质量比1∶ 2.5混合后测定,总氮和总碳(TC)用元素分析仪(Elmenter Vario Max,德国)测定,总磷按SMT方法测定[13]。沉积物中氨氮(NH4+-N)、NO3--N使用氯化钾溶液浸提后测定[14-15],使用不同浸提液提取后测定水溶性磷(WSP)、易解析磷(RDP)、藻类可利用磷(AAP)和碳酸氢钠可提取磷(Olsen-p)4种生物可利用磷(BAP)含量[16]。
1.3 细菌群落分析根据E.Z.N.A.Ⓡ soil DNA kit(Omega Bio-tek, Norcross, GA, U.S.)说明书进行微生物群落总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA浓度和纯度。使用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA基因V3-V4可变区进行PCR扩增。扩增程序为:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后在4 ℃进行保存。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
将所有序列读数聚类到操作分类单位(OTU, 相似性阈值为97%),使用NCBI数据库(http://www.ncbi.nlm.nih.gov)确定每个16S rRNA基因测序得到的OTU的代表性序列的分类分配,设置比对阈值为70%。为了消除不同测序深度造成的偏差,将所有测序样本分别稀化到最低序列后分析。
1.4 数据分析使用SPSS 19.0进行单因素方差分析(One-way ANOVA),当差异显著时再使用Ducan氏法进行多重比较,显著水平取P<0.05。微生物数据在Majorbio I-Sanger云在线平台上进行分析。
2 结果与分析 2.1 水体理化特征除SAL外,河道水体的各项水质指标在不同位点间的差异均不显著。不同月份河道水体的理化性质见表 1。T处于3.60~29.23 ℃范围,不同月份间的差异显著(P < 0.05)。SAL、pH、TP、NO3--N和Chl.a在不同月份间的差异均不显著。DO均可达9 mg/L以上,在11月和1月间的差异显著(P < 0.05)。TN在1月水中的含量最高,而SRP和CODMn在9月的含量最高。
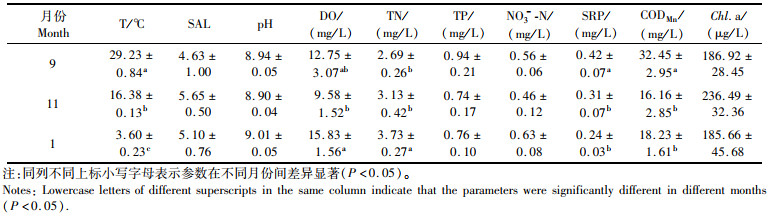
|
表 1 不同月份河道水体的理化性质 Tab.1 Physical and chemical properties of channel water in different months |
不同位点河道沉积物的理化性质见表 2。pH、TC、TN、TP、NH4+-N和NO3--N在不同位点间的差异均不显著。4种BAP在各位点的含量顺序是一致的,均为AAP>Olsen-p>WSP>RDP。其中,APP在不同位点间的差异不显著。WSP、RDP、Olsen-P均在4号点的含量最高,并显著高于1号和2号点(P < 0.05)。河道沉积物所有的理化指标在不同月份间的差异均不显著。

|
表 2 不同位点河道沉积物的理化性质 Tab.2 Physical and chemical properties of channel sediments at different sites |
所有样本的稀释曲线都接近平缓, 表明试验抽样充分, 测序深度足以反映每个样本的生物信息。利用mothur软件,计算水体(表 3)和沉积物(表 4)中细菌群落的香农、辛普森、Ace和Chao指数[17]。其中,香农指数越大,说明群落的多样性越高,辛普森指数越大,说明群落多样性越低。Ace和Chao指数均为群落丰度指数,二者的值越大,说明群落丰富度越高。香农和辛普森指数均表明水中细菌群落的多样性在11月最高,与1月的差异显著(P < 0.05)。Chao和Ace指数表明1、2号点沉积物中细菌群落的丰富度显著高于4号点(P < 0.05)。整体而言,沉积物中细菌群落的多样性和丰富度均显著高于水体(P < 0.05)。

|
表 3 水中细菌群落的α多样性指数 Tab.3 Alpha diversity of bacterial communities in the water |

|
表 4 沉积物中细菌群落的α多样性指数 Tab.4 Alpha diversity of bacterial communities in the sediments |
使用主坐标分析(PCoA)在OTU水平展示细菌群落的β多样性。ANOSIM相似性分析表明,水中细菌群落组成在不同位点间的差异不显著,但在不同月份间的差异显著(P < 0.05, 图 2a)。沉积物中细菌群落组成在不同位点间的差异显著(P < 0.05,图 2b),在不同月份间的差异不显著。整体而言,水体和沉积物中的细菌群落组成存在显著差异(P < 0.05,图 2c)。水中细菌样本按月份聚集,不同月份间距离较远,各沉积物样本紧密聚集。
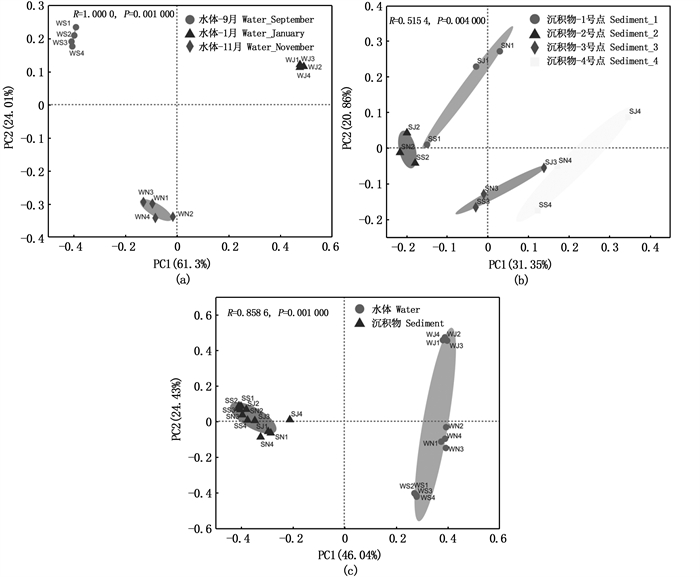
|
图 2 水体和沉积物中细菌群落的PCoA分析 Fig. 2 PCoA analysis of bacterial communities in water and sediments |
将相对丰度低于1%的群落都归为稀有种,并为“Others”,共有11类菌门在水中的相对丰度超过1%(图 3a)。变形菌门(Proteobacteria)、蓝细菌门(Cyanobacteria)、放线菌门(Actinobacteriota)和拟杆菌门(Bacteroidota)的相对丰度最高,均达10%以上。为了便于区分,将相对丰度高于10%的菌门视为优势菌[18]。方差分析表明,4类优势菌门的相对丰度在不同月份间均存在显著差异(P < 0.05,表 5)。变形菌门在1月显著富集,相对丰度高达43.48%。蓝细菌门在9月显著富集,相对丰度高达39.33%。放线菌门和拟杆菌门的相对丰度均在11月最高,在9月最低。共有18类菌门在沉积物中的相对丰度超过1%(图 3b)。变形菌门、绿弯菌门(Chloroflexi)、脱硫菌门(Desulfobacterota)和放线菌门的相对丰度均达10%以上,为沉积物中的优势菌。变形菌门在所有样本中均占据优势,相对丰度超过20%。方差分析表明,沉积物中各优势菌门的相对丰度在不同位点和不同月份间的差异均不显著。

|
图 3 水体和沉积物中细菌群落在门水平上的组成 Fig. 3 Composition of bacterial communities in water and sediments at the phylum level |

|
表 5 水中优势菌门在不同月份中的相对丰度 Tab.5 Relative abundance of dominant bacteria phyla in water in different months |
共有54类菌属在水中的相对丰度超过1%(图 4a)。属水平上,将相对丰度高于3%的菌属视为优势菌[19]。蓝细菌属(Cyanobium_PCC-6307)、海源菌属(Idiomarina)、Candidatus_Aquiluna、浮丝藻属(Planktothrix_NIVA-CYA_15)和CL500-3的相对丰度均达3%以上,为水中优势菌属。其中,蓝细菌属在9月显著富集(P < 0.05),相对丰度高达31.46%(表 6)。CL500-3与蓝细菌属的相对丰度在月份间的变化一致,海源菌属和浮丝藻属一致。共有51类菌属在沉积物中的相对丰度超过1%(图 4b)。仅有蓝细菌属和硫杆菌属(Thiobacillus)的平均相对丰度达3%以上。方差分析表明,2类菌属的相对丰度在不同位点和不同月份间的差异均不显著。

|
图 4 水体和沉积物中细菌群落在属水平上的组成 Fig. 4 Composition of bacterial communities in water and sediments at the genus level |
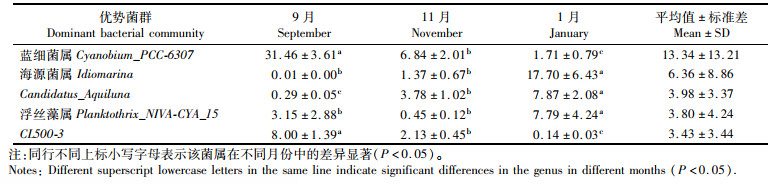
|
表 6 水中优势菌属在不同月份中的相对丰度 Tab.6 Relative abundance of dominant bacteria genera in water in different months |
图 5列举了河道内相对丰度前10的门和属,以及它们在水体和沉积物间的丰度差异。门水平上,变形菌门在水体和沉积物中的相对丰度均最高,差异不显著。放线菌门在水中的相对丰度显著高于沉积物(P < 0.05)。除此之外,优势菌蓝细菌门、拟杆菌门在水中显著富集,绿弯菌门、脱硫菌门在沉积物中显著富集(P < 0.05)。属水平上,蓝细菌属在水体和沉积物的相对丰度均最高,差异不显著。包括海源菌属、浮丝藻属等7类菌属在水中显著富集,仅有硫杆菌属在沉积物中显著富集(P < 0.05)。

|
图 5 水体和沉积物中细菌群落在门、属水平上的组成差异 Fig. 5 Differences in the composition of bacterial communities in water and sediments at phylum and genus levels |
使用冗余分析(RDA)分别比较水体(图 6a)和沉积物(图 6b)中环境因子与细菌群落之间的关系。Envfit测试表明,水体T(R2=0.960,P=0.001)、CODMn(R2=0.897,P=0.001)、SRP(R2=0.532,P=0.027)和TN(R2=0.577,P=0.030)与细菌群落显著相关。蓝细菌属对菌群结构的影响最大,并与T、CODMn和SRP呈正相关,与TN呈负相关。沉积物中TC(R2=0.482,P=0.038)、WSP(R2=0.560,P=0.031)和RDP(R2=0.769,P=0.003)与细菌群落显著相关。蓝细菌属仍为对菌群结构影响最大的菌属,并与硫杆菌属呈负相关。4种BAP均与蓝细菌属呈正相关,TN、TC呈共线性,二者均与蓝细菌属呈负相关。
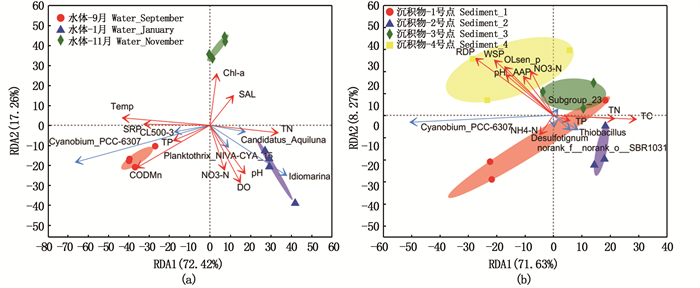
|
图 6 细菌群落与环境因子之间的RDA分析 Fig. 6 RDA bioplot of the distribution of bacterial community and environmental variables |
可能受水流过快的影响,河道水质在不同位点间的差异并不显著。T、DO和TN等水质指标在不同月份间的差异,可能是天气、温度、池塘尾水质量等多因素变化的结果。整体而言,各月份河道水体的TN、TP均远超国际上广泛认可的水体富营养化临界浓度[20]。参照江苏省《池塘养殖尾水排放标准》[21],水体的TN、TP均不满足一级排放标准,但满足二级排放标准。
相比于水体,沉积物的扩散能力更弱,不易受到外界环境的干扰,其理化性质在不同位点间的差异更大。WSP、RDP和OLsen_p在4号点的含量最高,与该处特殊的位置有关。宽阔的水面使水流变缓,垦区所有的养殖尾水均在此处汇集,更有利于磷的沉积。沉积物中4种BAP的占比顺序为AAP>Olsen-p>WSP>RDP,这与其他河流一致[22]。Olsen-P被认为是衡量土壤养分状况的良好指标,当每kg干土中Olsen-P的含量大于46 mg时,表明土壤具有高营养水平[23]。照此标准,河道各点的沉积物均不处于高营养水平。
3.2 细菌群落的多样性蓝细菌属和海源菌属的富集削减了其他菌群的生长空间,致9月和1月水中细菌群落多样性降低。4号点沉积物中菌群的丰富度最低,与该点高含量的WSP、RDP等营养盐有关,因为细菌群落会受高营养盐、高有机质等外界条件的选择作用[24]。香农和辛普森指数均表明沉积物中细菌群落的多样性高于水体,Ace和Chao指数显示其丰富度是水体的3~4倍,均因为沉积物更适合微生物的繁殖栖息[25]。β多样性表明,水体和沉积物中细菌群落的组成分别在不同月份和不同位点间存在显著差异,同理化性质一致,再次证明了细菌群落和环境因子之间的紧密关系。
3.3 细菌群落组成河道水中的优势菌门为变形菌门、蓝细菌门、放线菌门和拟杆菌门。变形菌门在水体和沉积物中均保持优势,主要因为其在原核生物表型分类或分子生物学分类中占据绝对优势[26]。放线菌门在生物体的循环分解和形成腐殖质中发挥关键作用[27],拟杆菌门能产生胞外水解酶以降解琼脂、几丁质等生物大分子[28],二类菌门的富集有利于尾水中营养物质的分解。蓝细菌门相对较高的丰度并不代表蓝藻的绝对含量也很高[29],但河道水中TN、TP和Chl.a均远超蓝藻水华暴发的一般条件[30]。蓝藻水华不仅会降低水体的美学价值,还会对人类和动物的健康造成威胁[31],必须引起关注。蓝细菌属在蓝藻水华中常作为优势类别出现[32],浮丝藻属也可引起水华并导致水体产生异味[33]。二类菌属均为河道水中蓝细菌门的主要构成,尤其是蓝细菌属的相对丰度最高。
除变形菌门和放线菌门外,绿弯菌门和脱硫菌门也属于沉积物中的优势菌门。硫杆菌属中的多数种类可将硫化物、氢气等作为电子供体,亚硝酸盐氮、硝态氮作为受体实现硫酸盐的还原和反硝化作用[34]。其在沉积物中的富集不仅提高了脱硫菌门的丰度,还可促进氮硫污染物的去除。尽管蓝细菌门并不属于沉积物中的优势菌门,但蓝细菌属仍属于优势菌属。
3.4 细菌群落变化影响因素河道水体T、TN、SRP和CODMn均与细菌群落显著相关,蓝细菌属对群落的影响最大。同温度一样,CODMn对于菌群的重要影响已经被证实[35]。浮游生物在利用磷作为繁殖生长的营养时,SRP通常被优先选择[36]。因此,水体SRP的显著变化会对细菌群落产生直接影响。9月河道水体高水平的T、SRP和CODMn提供了适宜条件,促进了蓝细菌属和蓝细菌门的富集。湖泊中蓝藻水华的暴发是由氮、磷营养物的过量排放引起的,减少水中氮、磷是控制的关键[37]。本研究发现,SRP和TN同为影响河道水中细菌群落的关键因子,但SRP与蓝细菌属呈正相关,TN与蓝细菌属呈负相关。那么,从限制蓝细菌属富集的角度,河道水体中磷的控制要比氮更重要。
在沉积物中,WSP、RDP和TC与细菌群落显著相关,蓝细菌属仍是对群落影响最大的菌属。沉积物中BAP的转化涉及微生物复杂的相互作用[38],WSP被认为是即时可用磷的最佳估计,RDP代表容易解析和释放的磷[39]。在4种BAP中,WSP和RDP与细菌群落显著相关,可能因为其更有利于细菌的直接摄取。WSP和RDP与蓝细菌属呈正相关,TC与蓝细菌属呈负相关。这就说明,磷也是促进沉积物中蓝细菌属富集的关键因子。因此,为了减少水体和沉积物中磷的含量,进而限制蓝细菌属在河道中的富集,养殖尾水中磷的控制尤为必要。
4 结论在条子泥垦区池塘养殖尾水的净化河道中,水体和沉积物的理化性质分别在不同月份和不同位点间存在显著差异,细菌群落组成的变化同理化性质一致。水中T、TN、SRP和CODMn与细菌群落显著相关,沉积物中WSP、RDP和TC与细菌群落显著相关。蓝细菌属是水体和沉积物中丰度最高的属,对细菌群落的影响最大。水体中T、CODMn和SRP与蓝细菌属呈正相关,沉积物中WSP和RDP与蓝细菌属呈正相关。应加强对养殖尾水中磷的控制,以限制蓝细菌属在河道中的富集。
| [1] |
REN C Y, WANG Z M, ZHANG Y Z, et al. Rapid expansion of coastal aquaculture ponds in China from Landsat observations during 1984-2016[J]. International Journal of Applied Earth Observation and Geoinformation, 2019, 82: 101902. DOI:10.1016/j.jag.2019.101902 |
| [2] |
DUAN Y Q, LI X, ZHANG L P, et al. Mapping national- scale aquaculture ponds based on the Google Earth Engine in the Chinese coastal zone[J]. Aquaculture, 2020, 520: 734666. DOI:10.1016/j.aquaculture.2019.734666 |
| [3] |
TURCIOS A, PAPENBROCK J. Sustainable treatment of aquaculture effluents-what can we learn from the past for the future?[J]. Sustainability, 2014, 6(2): 836-856. DOI:10.3390/su6020836 |
| [4] |
JOHN E M, KRISHNAPRIYA K, SANKAR T V. Treatment of ammonia and nitrite in aquaculture wastewater by an assembled bacterial consortium[J]. Aquaculture, 2020, 526: 735390. DOI:10.1016/j.aquaculture.2020.735390 |
| [5] |
张饮江, 张筱, 程梦雨, 等. 人工湿地处理滨海养殖水效果及机理[J]. 上海海洋大学学报, 2019, 28(5): 643-650. ZHANG Y J, ZHANG X, CHENG M Y, et al. Improving performance and removal mechanism of coastal aquaculture water by constructed wetlands[J]. Journal of Shanghai Ocean University, 2019, 28(5): 643-650. |
| [6] |
彭柯, 董志, 邸琰茗, 等. 基于16S rRNA高通量测序的北运河水体及沉积物微生物群落组成对比分析[J]. 环境科学, 2021, 42(11): 5424-5432. PENG K, DONG Z, DI Y M, et al. Contrasting analysis of microbial community composition in the water and sediments of the north canal based on 16S rRNA high-throughput sequencing[J]. Environmental Science, 2021, 42(11): 5424-5432. |
| [7] |
陈文松, 宁寻安, 李萍, 等. 底泥污染物的环境行为研究进展[J]. 水资源保护, 2007, 23(4): 1-5. CHEN W S, NING X A, LI P, et al. Environmental behavior of pollutants in sediments[J]. Water Resources Protection, 2007, 23(4): 1-5. |
| [8] |
FRIES J S, CHARACKLIS G W, NOBLE R T. Sediment-water exchange of Vibrio sp. and fecal indicator bacteria: implications for persistence and transport in the Neuse River Estuary, North Carolina, USA[J]. Water Research, 2008, 42(4/5): 941-950. |
| [9] |
ABRAHAM T J, GHOSH S, NAGESH T S, et al. Distribution of bacteria involved in nitrogen and sulphur cycles in shrimp culture systems of West Bengal, India[J]. Aquaculture, 2004, 239(1/4): 275-288. |
| [10] |
韩政, 汤春宇, 邵留, 等. 多营养层级淡水生态系统构建对微生物的影响[J/OL]. 上海海洋大学学报: 1-13[2022-02-17]. http://kns.cnki.net/kcms/detail/31.2024.S.20220114.1607.012.html. HAN Z, TANG C Y, SHAO L, et al. The effect of multi-trophic freshwater ecosystem construction on microorganisms[J/OL]. Journal of Shanghai Ocean University: 1-13[2022-02-17]. http://kns.cnki.net/kcms/detail/31.2024.S.20220114.1607.012.html. |
| [11] |
魏复盛. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. WEI F S. Water and wastewater monitoring and analysis methods[M]. 4th ed. Beijing: China Environmental Science Press, 2002. |
| [12] |
中华人民共和国水利部. SL 88-2012水质叶绿素的测定分光光度法[S]. 北京: 中国水利水电出版社, 2012. Ministry of Water Resources of the People's Republic of China. SL 88-2012 Water quality-Determination of chlorophyll by spectrophotometry[S]. Beijing: China Water & Power Press, 2012. |
| [13] |
RUBAN V, BRIGAULT S, DEMARE D, et al. An investigation of the origin and mobility of phosphorus in freshwater sediments from Bort-Les-Orgues Reservoir, France[J]. Journal of Environmental Monitoring, 1999, 1(4): 403-407. DOI:10.1039/a902269d |
| [14] |
中华人民共和国环境保护部. HJ 634-2012土壤氨氮、亚硝酸盐氮、硝酸盐氮的测定氯化钾溶液提取-分光光度法[S]. 北京: 中国环境科学出版社, 2012. Ministry of Environmental Protection of the People's Republic of China. HJ 634-2012 Soil-Determination of ammonium, nitrite and nitrate by extraction with potassium chloride solution-spectrophotometric methods[S]. Beijing: China Environmental Science Press, 2012. |
| [15] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 32737-2016土壤硝态氮的测定紫外分光光度法[S]. 北京: 中国标准出版社, 2017. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 32737-2016 Determination of nitrate nitrogen in soil-Ultraviolet spectrophotometry method[S]. Beijing: China Standard Press, 2017. |
| [16] |
徐玉慧, 姜霞, 金相灿, 等. 太湖东北部沉积物生物可利用磷的季节性变化[J]. 环境科学, 2006, 27(5): 869-873. XU Y H, JIANG X, JIN X C, et al. Seasonal variation of bioavailable phosphorus in sediments in northeast part of Taihu lake[J]. Environmental Science, 2006, 27(5): 869-873. DOI:10.3321/j.issn:0250-3301.2006.05.009 |
| [17] |
黄锦, 成永旭, 王海锋, 等. 不同施肥模式下的稻-克氏原螯虾田块水体菌群初探[J]. 上海海洋大学学报, 2020, 29(4): 516-525. HUANG J, CHENG Y X, WANG H F, et al. A preliminary study on the water bacteria of rice-crayfish co-culture paddy field in different fertilization modes[J]. Journal of Shanghai Ocean University, 2020, 29(4): 516-525. |
| [18] |
周元清, 李秀珍, 李淑英, 等. 不同类型人工湿地微生物群落的研究进展[J]. 生态学杂志, 2011, 30(6): 1251-1257. ZHOU Y Q, LI X Z, LI S Y, et al. A review on soil microbial community in different type constructed wetlands[J]. Chinese Journal of Ecology, 2011, 30(6): 1251-1257. |
| [19] |
贾丽娟, 王广军, 夏耘, 等. 不同地区稻虾综合种养系统的微生物群落结构分析[J/OL]. 水产学报: 1-13[2022-01-10]. http://kns.cnki.net/kcms/detail/31.1283.s.20211122.1401.004.html. JIA L J, WANG G J, XIA Y, et al. Analysis of microbial community structure in rice-shrimp integrated culture system of three different areas[J/OL]. Journal of Fisheries of China: 1-13[2022-01-10]. http://kns.cnki.net/kcms/detail/31.1283.s.20211122.1401.004.html. |
| [20] |
李如忠, 刘科峰, 钱靖, 等. 合肥市区典型景观水体氮磷污染特征及富营养化评价[J]. 环境科学, 2014, 35(5): 1718-1726. LI R Z, LIU K F, QIAN J, et al. Nitrogen and phosphate pollution characteristics and eutrophication evaluation for typical urban landscape waters in Hefei city[J]. Environmental Science, 2014, 35(5): 1718-1726. |
| [21] |
江苏省生态环境厅, 江苏省市场监督管理局. DB 32/4043-2021池塘养殖尾水排放标准[S]. 2021. Department of Ecology and Environment of Jiangsu Province, Jiangsu market supervision and Administration Bureau. DB 32/4043-2021 Discharge standard of water from aquaculture ponds[S]. 2021. |
| [22] |
BO L J, WANG D J, ZHANG G, et al. Evaluating the relationship between phosphorus bioavailability and phosphorus speciation in sediments from rural rivers in the Taihu Lake Area, China[J]. Polish Journal of Environmental Studies, 2014, 23(6): 1933-1940. |
| [23] |
LI D P, HUANG Y, FAN C X, et al. Contributions of phosphorus on sedimentary phosphorus bioavailability under sediment resuspension conditions[J]. Chemical Engineering Journal, 2011, 168(3): 1049-1054. DOI:10.1016/j.cej.2011.01.082 |
| [24] |
刘晶晶, 曾江宁, 陈全震, 等. 象山港网箱养殖区水体和沉积物的细菌生态分布[J]. 生态学报, 2010, 30(2): 377-388. LIU J J, ZENG J N, CHEN Q Z, et al. The bacterial ecological distribution in water and sediment of cage culture area in Xianshangang Bay[J]. Acta Ecologica Sinica, 2010, 30(2): 377-388. |
| [25] |
RAM N M, ZUR O, AVNIMELECH Y. Microbial changes occurring at the sediment-water interface in an intensively stocked and fed fish pond[J]. Aquaculture, 1982, 27(1): 63-72. DOI:10.1016/0044-8486(82)90110-7 |
| [26] |
GUPTA R S. The phylogeny of proteobacteria: Relationships to other eubacterial phyla and eukaryotes[J]. FEMS Microbiology Reviews, 2000, 24(4): 367-402. |
| [27] |
STACH E M, BULL A T. Estimating and comparing the diversity of marine actinobacteria[J]. Antonie van Leeuwenhoek, 2005, 87(1): 3-9. |
| [28] |
白洁, 李海艳, 赵阳国. 黄海北部不同站位海洋细菌群落分布特征[J]. 微生物学报, 2009, 49(3): 343-350. BAI J, LI H Y, ZHAO Y G. Bacterial distribution at different stations in the Northern Yellow Sea[J]. Acta Microbiologica Sinica, 2009, 49(3): 343-350. |
| [29] |
成永旭, 刘洪天, 常东, 等. 稻蟹共作与蟹单作模式下中华绒螯蟹肠道及养殖环境细菌群落组成比较[J]. 上海海洋大学学报, 2017, 26(5): 682-690. CHENG Y X, LIU H T, CHANG D, et al. A comparative study of microbiota from the intestine of Chinese mitten crab (Eriocheir sinensis) and their culture environment, between rice-crab co-culture and crab monoculture models[J]. Journal of Shanghai Ocean University, 2017, 26(5): 682-690. |
| [30] |
马健荣, 邓建明, 秦伯强, 等. 湖泊蓝藻水华发生机理研究进展[J]. 生态学报, 2013, 33(10): 3020-3030. MA J R, DENG J M, QIN B Q, et al. Progress and prospects on cyanobacteria bloom-forming mechanism in lakes[J]. Acta Ecologica Sinica, 2013, 33(10): 3020-3030. |
| [31] |
GUPTA V, RATHA S K, SOOD A, et al. New insights into the biodiversity and applications of cyanobacteria (blue-green algae)—Prospects and challenges[J]. Algal Research, 2013, 2(2): 79-97. |
| [32] |
杨柳燕, 杨欣妍, 任丽曼, 等. 太湖蓝藻水华暴发机制与控制对策[J]. 湖泊科学, 2019, 31(1): 18-27. YANG L Y, YANG X Y, REN L M, et al. Mechanism and control strategy of cyanobacterial bloom in Lake Taihu[J]. Journal of Lake Sciences, 2019, 31(1): 18-27. |
| [33] |
SU M, YU J W, ZHANG J Z, et al. MIB-producing cyanobacteria (Planktothrix sp.) in a drinking water reservoir: Distribution and odor producing potential[J]. Water Research, 2015, 68: 444-453. |
| [34] |
于妍, 王悦悦, 方杜贤, 等. 白洋淀表层沉积物细菌多样性及影响因素[J]. 环境工程学报, 2021, 15(3): 1121-1130. YU Y, WANG Y Y, FANG D X, et al. Bacterial diversity in surface sediments of Baiyangdian lake and its influencing factors[J]. Chinese Journal of Environmental Engineering, 2021, 15(3): 1121-1130. |
| [35] |
王新, 汤江武, 吴逸飞, 等. 京杭运河杭州段水体污染和细菌群落结构特征[J]. 环境污染与防治, 2020, 42(6): 760-766. WANG X, TANG J W, WU Y F, et al. Characteristics of water pollution and bacterial community structure in Hangzhou section of Jinghang Grand Canal[J]. Environmental Pollution and Control, 2020, 42(6): 760-766. |
| [36] |
叶琳琳, 朱燕, 徐圣友. 微生物对巢湖沉积物生物可利用磷的稳定性影响[J]. 资源环境与工程, 2007, 21(3): 339-343. YE L L, ZHU Y, XU S Y. Effect of microbe on stability of bioavailable phosphorus in sediment of Chaohu Lake[J]. Resources Environment & Engineering, 2007, 21(3): 339-343. |
| [37] |
SCHINDLER D W. Recent advances in the understanding and management of eutrophication[J]. Limnology and Oceanography, 2006, 51: 353-363. |
| [38] |
ZHOU J, LI D P, ZHAO Z H, et al. Phosphorus bioavailability and the diversity of microbial community in sediment in response to modified calcium peroxide ceramsite capping[J]. Environmental Research, 2021, 195: 110682. |
| [39] |
ZHOU Q X, GIBSON C E, ZHU Y M. Evaluation of phosphorus bioavailability in sediments of three contrasting lakes in China and the UK[J]. Chemosphere, 2001, 42(2): 221-225. |
2. Shanghai Collaborative Innovation Center for Cultivating Elite Breeds and Green-culture of Aquaculture Animals, Shanghai 201306, China;
3. Jiangsu Coast Development Co., Ltd., Dongtai 224200, Jiangsu, China
 2023,
Vol. 32
2023,
Vol. 32


