2. 上海海洋大学 国家海洋生物科学国际联合研究中心, 上海 201306
瘤背石磺隶属软体动物门(Mollusca)腹足纲(Gastropoda)肺螺亚纲(Pulmonata)柄眼目(Stylommatophora)[1],广泛分布于我国江苏、上海、广州等东南沿海地区[2]。瘤背石磺作为由海洋向陆地过渡的贝类生物,在水下主要用表皮和鳃呼吸,陆上用肺囊呼吸,导致水下摄氧能力有限。野生瘤背石磺在海边栖息模式一般为潮水退去时出来摄食,潮水即将上涨前返回栖息洞穴中规避海浪[3],具有准确感知潮汐水位的独特能力[4],因此,有研究者[5]提出瘤背石磺可以通过其特殊结构平衡囊和耳石感知潮汐产生的低频声音去准确规避潮水对自身生存环境所造成的威胁。然而,对于瘤背石磺如何感知低频声音的相关研究却较少。
NXN基因全名为核氧化还原蛋白基因,于1996年被KUROOKA等[6]首次发现并克隆所得。NXN是一种氧化还原蛋白,NXN含有3个硫氧还蛋白结构域,中心结构域包括1个催化活性的WCPPC(Trp Cys Pro Cys)结构,该结构参与靶蛋白中二硫键的氧化和还原[6],该结构最初是在细胞核中检测到的,但后来主要定位于细胞质[6-7]。最近的一项蛋白质组学研究发现,在缺乏NXN的神经细胞中还原蛋白的比例较高,研究[8]表明缺乏NXN的神经细胞培养条件下,NXN具有明显的氧化酶样活性。目前对NXN的研究主要集中于其在WNT信号通路中的作用[9],NXN借助氧化还原功能与WNT抑制剂DVL相互作用从而抑制WNT信号通路[10-11]。NXN参与调节的WNT信号通路调节胃肠上皮细胞的生理性自我更新[12-13],氧化还原稳态的丧失导致了多种胃肠道疾病的产生与恶化,氧化还原信号在胃肠道生理和病理中起着重要作用[14]。在小鼠体内胚胎期NXN基因的缺失导致颅骨缺陷以及畸形,这说明NXN相比其他氧化还原蛋白具有独特功能,在小鼠体内主要分布在脑和心脏,主要在海马神经元表达。最新研究[15]发现NXN参与钙调激酶Camk2的相互作用,以维持Camk2的氧化状态,从而保持其活性。此外,NXN支持其他突触和线粒体蛋白的氧化,以及线粒体自身呼吸。NXN的促氧化功能缺陷会导致小鼠探索动力的丧失和奖励兴趣的降低,并且NXN缺陷的小鼠在社交、学习记忆方面均存在缺陷,小鼠的探索行为需要依赖NXN的氧化功能[15]。有研究者[8]利用缺失NXN的SH-SY5Y神经母细胞瘤细胞,对神经源性细胞中受影响的生物学过程和分子功能进行分析,结果表明,NXN在代谢途径、细胞形态和信号转导的氧化还原调节中具有多种功能。NXN在结构和功能上都是特别的,但迄今为止对其结构和功能的研究很少。
无论是NXN基因还是瘤背石磺低频听力相关基因的筛选研究都很少,本文从小鼠表型数据库中选择与听觉脑干反应相关的基因,与100、300、500 Hz低频声音处理瘤背石磺转录组中具有显著差异表达的基因进行比对,进行关于低频声音的初步筛选,以获得瘤背石磺体内可能与声音相关的基因OrNXN,并克隆其全长,以qPCR技术验证其在低频声音处理下是否有差异表达,并结合潮汐对其感知低频声音躲避潮水的功能进行探究。实验对贝类动物瘤背石磺进化发展中产生的独特低频声音感知能力进行初步探究,也为深入研究低频听力相关基因的进化做了铺垫。
1 材料与方法 1.1 实验材料2021年5月从盐城采集瘤背石磺,于实验室内培养,每日浇水以防土壤干涸,每日定时投喂适量玉米粉,维持培养温度25 ℃,暂养7 d后取生物学表现健康,大小均匀的瘤背石磺进行实验。
1.2 候选基因法筛选低频声音相关基因从本实验室曾进行低频声音处理转录组中筛选显著性差异的注释基因,对比IMPC(国际小鼠表型分型协会https://www.mousephenotype.org/)中与ABR类别相关的基因,包括影响小鼠与人类听觉感知和耳聋相关基因,共289个,通过Excel中if count算法筛得转录组中与声音刺激相关的具有显著差异的基因。
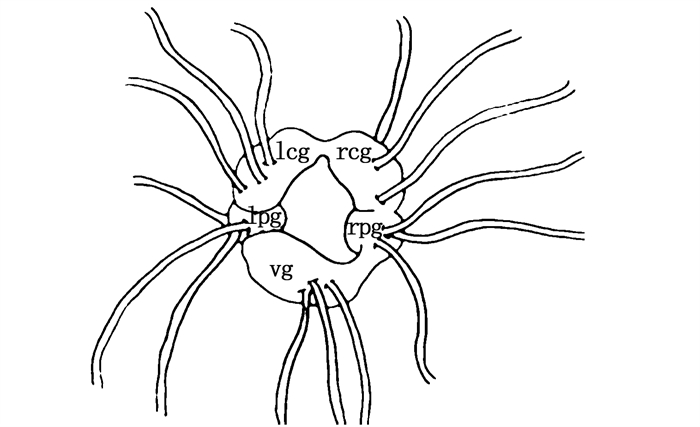
1.3 RNA提取并反转cDNA使用Trizol法提取神经节、肝、肠、口器、性腺、背皮、腹足总RNA,神经节构造如图 1所示,取瘤背石磺完整神经节进行后续实验,通过10 mg/mL琼脂糖凝胶电泳以及NanoDrop ND1000(Thermo Scientific,US)紫外分光光度计测定各组织RNA质量浓度并分析纯度。使用HiScriptRQRT SuperMix for qPCR (Vazyme, 美国)试剂按说明书操作反转录合成cDNA,-20 ℃保存。
1.4 OrNXN片段验证与克隆从本实验室构建的瘤背石磺转录组文库中筛选获得注释为NXN基因的unigene序列,利用Primer Premier 5.0软件设计特异性引物NXN-1F、NXN-1R、Outer Primer、Inner Primer(表 1),NXN-1F、NXN-1R按照上下游引物各0.6 μL、cDNA模板0.8 μL、2×SuperTaqMix(novoprotein,苏州)10 μL、ddH2O 8 μL普通PCR体系进行片段验证。参照生工3′RACE、5′RACE试剂盒(BBI公司)的说明书,制备5′RACE和3′RACE模板。用巢式PCR对3′和5′进行扩增。获得PCR产物后,经过割胶回收试剂盒(天根,北京)回收目的条带,并与pGEM-TEasy vector(Promega, 美国)进行连接,接着转化到感受态DH5α大肠杆菌细胞后涂布于含有氨苄的选择性培养基上,37 ℃培养16~24 h,经过和蓝白斑筛选后,选取白斑菌落,进行菌液PCR反应检测,挑取与目的片段一致的菌液送上海生工公司测序。

|
表 1 引物名称及序列 Tab.1 Primer names and sequences |
利用NCBI ORFfinder寻找序列中开放阅读框(ORF),在predictprotein上预测基因OrNXN编码蛋白的二级结构,Swiss Model建立蛋白三级结构模型,NCBI-Blast比对同源性,http://smart.embl-heidelberg.de/上查找蛋白结构域,ProtParam上估测蛋白理化性质,MEGA X构建进化树,bioedit进行多重序列比对。
1.6 组织差异表达分析选取9只健康有活力的瘤背石磺分成3个样品组,每组3只瘤背石磺进行混样,解剖取瘤背石磺的神经节、口器、肝、肠、性腺、背皮和腹足等7个组织进行RNA提取,检测完RNA质量浓度及OD值合格后,用HiScriptR Ⅱ Q RT SuperMix for qPCR (+gDNA wiper)试剂盒反转录7个组织RNA制备cDNA,运用genscript网站在线工具,在OrNXN开放阅读框范围内设计荧光定量引物RT-NXN-F和RT-NXN-R,选择β-actin作为内参引物。荧光定量反应在QuantStudioTM 6 Flex(Thermo Scientific,US)中进行,按Taq Pro Universal SYBR qPCR Master Mix说明书配制PCR体系:2×Taq Pro Universal SYBR qPCR Master Mix 10 μL、RT-NXN-F 0.4 μL、RT-NXN-R 0.4 μL、模板cDNA 2 μL、ddH2O 7.2 μL。按照说明书三步法进行程序设置。得出基因的相对表达量使用SPSS 19.0进行单因素方差分析(One-Way ANOVA),P < 0.05表示具有显著性差异。
1.7 不同频率声音刺激下瘤背石磺OrNXN相对表达量检测潮汐能发出0~200 Hz的声音[17],而一次潮汐高潮到低潮持续6 h,本实验使用SA-SG020型扫描信号发生器(SHIAO, 无锡),SA-PA功率放大器(SHIAO, 无锡)以50、100、150和200 Hz等4组不同频率的低频声音刺激瘤背石磺持续6 h,每个样本组9个样品,3个样品混样,分为3个平行组,样本放在贴有隔声海绵的泡沫培养箱中,培养箱底部铺3 cm东海潮间带泥土,保持室内温度25 ℃,暂养7日以适应环境再进行实验。将每组9只瘤背石磺快速进行解剖,取神经结组织后提取RNA反转cDNA保存,以qPCR检测OrNXN基因在不同频率声音刺激后6 h的表达量,反应体系、引物和反应程序与1.5节相同。得出基因的相对表达量使用SPSS 19.0进行单因素方差分析(One-Way ANOVA),P < 0.05表示具有显著性差异。
1.8 潮汐节律刺激下瘤背石磺OrNXN相对表达量检测为探究瘤背石磺在潮汐刺激下低频听力相关基因OrNXN表达情况,取7月当月最高潮水位即7月25日作为采样时期。在7月25日当日采样第1次高潮点12:13,落潮期14:00、17:00,低潮点18:41,涨潮期20:00、22:00,第2次高潮点24:00等7个时间点,7个潮汐时间点代表了1次完整潮汐。每个时间点取9只瘤背石磺,分成3个样品组,每个样品组3只瘤背石磺混样,取其神经节,使用Trizol法提取RNA,反转为cDNA,以qPCR检测OrNXN基因在潮汐节点刺激时的表达量,反应体系、引物和反应程序与1.5节相同。得出基因的相对表达量使用SPSS 19.0进行单因素方差分析(One-Way ANOVA),P < 0.05表示具有显著性差异。
2 结果与分析 2.1 候选基因筛选在Excel表中运用count if算法对比2个数据表间重复出现的基因,筛得与听觉感知相关并在声音处理后具有显著差异的5个基因:CDIPT、RRBP1、NXN、HERC1、RAB10。其中NXN在ABR实验中受到声音刺激的阈值最低,为6 kHz。
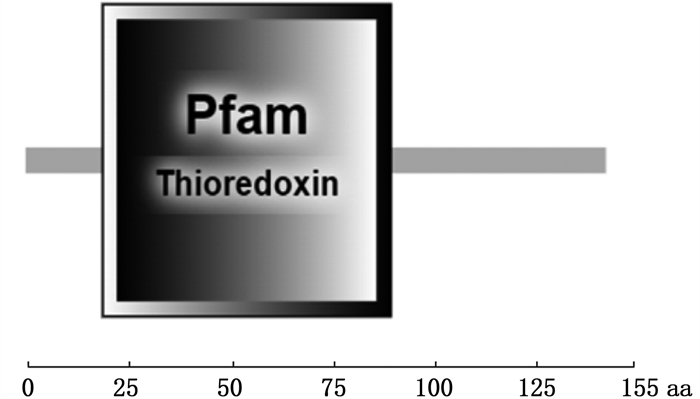
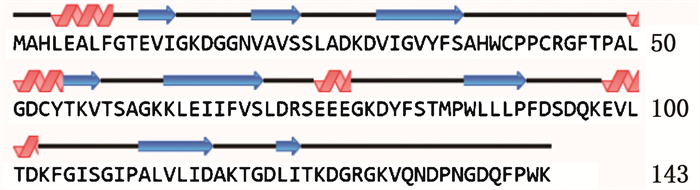
2.2 OrNXN基因cDNA全长及氨基酸序列分析RACE所得OrNXN全长1 593 bp,开放阅读框ORF长度为432 bp,共编码143个氨基酸,5′端非编码区长171 bp,3′非编码区长990 bp(图 2)。使用smart网站在线工具预测蛋白的结构域,结果显示在蛋白序列中含有一个硫氧还蛋白结构(19~90 aa),包括1个催化活性的WCPPC(Trp Cys Pro Cys)结构,该结构参与靶蛋白中二硫键的氧化和还原,符合核氧化还原蛋白的特征(图 3)。GenBank登录号为OK563728。

|
3′-UTR和5′-UTR以小写字母标示,方框标出位置为起始密码子与终止密码子,加尾信号以双下划线标示,波浪线标出poly-A结构,红色字体为催化活性的WCPPC结构。 3′-UTR and 5′-UTR are marked with lowercase letters, box positions for start and stop codons, and end signals is marked by double underscores while the poly-A structure is shown with wavy lines, the red font shows the catalytic activity of WCPPC structure. 图 2 OrNXN cDNA完整序列以及编码氨基酸序列 Fig. 2 Full cDNA length and encoded amino acid sequence of OrNXN gene |
|
图 3 OrNXN的蛋白结构域分析 Fig. 3 Protein domain analysis of OrNXN |
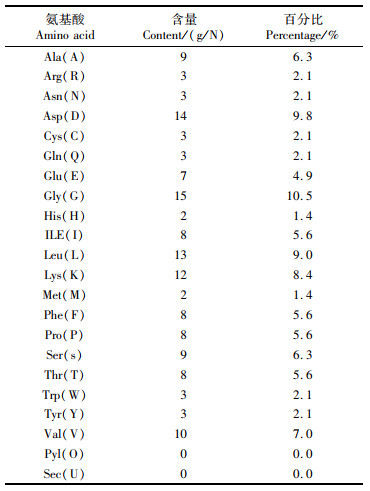
通过ExPASy ProtParam tool在线工具预测OrNXN共编码143个氨基酸,等电点为4.83,相对分子质量为15.570 ku,带负电的残基总数(Asp+Glu)为21个、带正电的残基总数(Arg+Lys)为15个,天冬氨酸(Asp)与甘氨酸(Gly)含量最高,占比为9.8%和10.5%(表 2)。分子式为C703H1087N177O212S5,总原子数为2 184个,脂肪指数83.65,平均亲水指数-0.155,信号肽预测该蛋白质序列无信号肽,蛋白质二级结构中α螺旋和β折叠分别占12.58%和26.57%(图 4),三级机构中同时含有螺旋与折叠(图 5)。
|
表 2 瘤背石磺OrNXN编码蛋白的氨基酸成分 Tab.2 Amino acid composition of Onchidium reevesii OrNXN protein |
|
图中红色部分表示α螺旋,蓝色部分表示β折叠。 Alpha helices are shown in red and beta folds are shown in blue. 图 4 OrNXN的二级结构预测 Fig. 4 Secondary structure prediction of OrNXN |
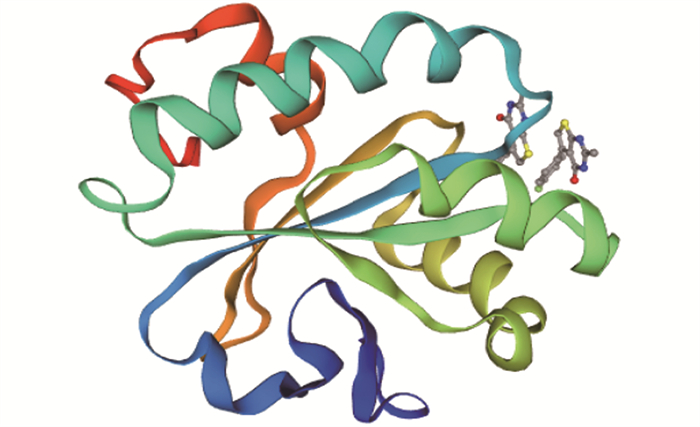
|
图 5 OrNXN的三级结构预测 Fig. 5 Tertiary structure prediction of OrNXN |
NCBI上对比OrNXN氨基酸序列获得相似序列,来自青翼海兔(Elysia marginata)、加州海兔(Aplysia californica)、鸭嘴海豆芽(Lingula anatina)、光滑双脐螺(Biomphalaria glabrata)、虾夷扇贝(Mizuhopecten yessoensis)、美洲牡蛎(Crassostrea virginica)、宙斯盾巨佩托螺(Gigantopelta aegis)、多孔鹿角珊瑚(Acropora millepora)、萼形柱珊瑚(Stylophora pistillata)、星状海葵(Nematostella vectensis)、柄海鞘(Styela clava)、棘冠海星(Acanthaster planci)和长牡蛎(Crassostrea gigas)。通过DNAMAN将序列进行多重比对,发现具有高度同源性(图 6)。利用MEGA软件构建系统进化树,结果表明:瘤背石磺和青翼海兔先合为一支,然后与光滑双脐螺合为一支,接着与加州海兔合为一大支;鸭嘴海豆芽和虾夷扇贝合并为一支;另一大分支包括鱼类、鸟类、两栖类。进化树结果显示瘤背石磺OrNXN蛋白的分子进化地位与其生物学分类一致(图 7)。

|
图 6 瘤背石磺OrNXN与其他物种NXN氨基酸序列比对 Fig. 6 Amino acid sequence comparison between Onchidium reevesii OrNXN and NXN of other species |

|
图 7 OrNXN氨基酸序列进化树 Fig. 7 Amino acid sequence alignment tree of OrNXN |
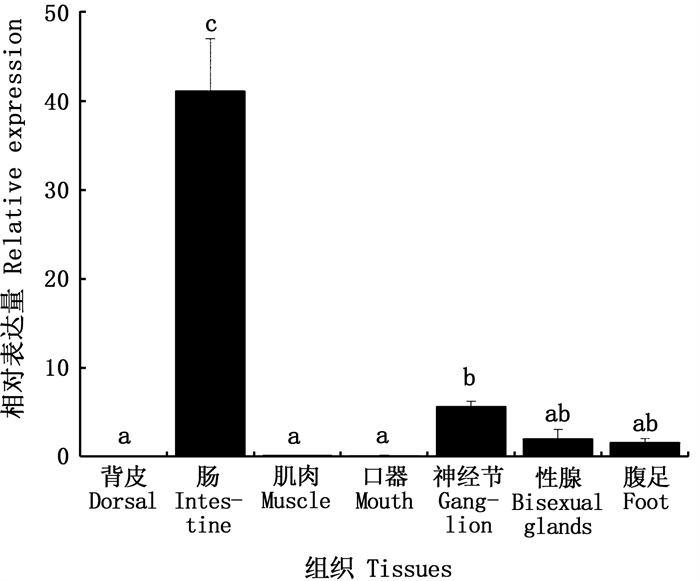
本实验取瘤背石磺背皮、肠、肌肉、口器、神经节、性腺、腹足等7个组织的样本进行荧光定量qPCR检测OrNXN在组织间的分布情况(图 8),结果表明OrNXN基因在瘤背石磺肠内表达最高,神经节组织中表达量其次,性腺和腹足中也有表达,而背皮、肌肉和口器中表达量低(P<0.05)。
|
图中不同小写字母代表处理组之间差异性显著(P<0.05)。 Difference of lowercase letters in the figure indicates that there are significant differences between the treatment groups(P < 0.05). 图 8 OrNXN基因在不同组织中的相对表达量 Fig. 8 Relative expression of OrNXN gene in different tissues |
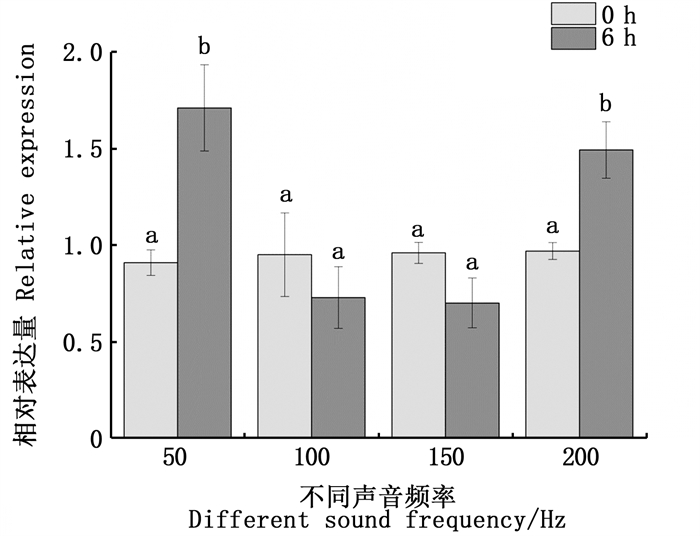
以50、100、150和200 Hz等4种频率低频声音持续刺激瘤背石磺6 h,结果显示:瘤背石磺OrNXN基因在50和200 Hz频率下刺激6 h表达量显著增高(图 9);100与150 Hz频率下OrNXN基因的表达无显著差异(P>0.05)。
|
图中不同小写字母代表处理组之间差异性显著(P<0.05)。 Difference of lowercase letters in the figure indicates that there are significant differences between the treatment groups(P < 0.05). 图 9 OrNXN基因在不同频率低频声音刺激下的相对表达量 Fig. 9 Relative expression of OrNXN gene under different frequencies of low frequency sound stimulation |
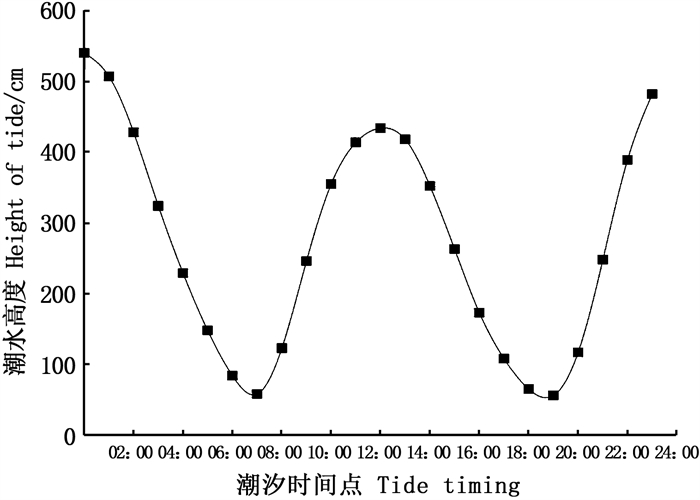
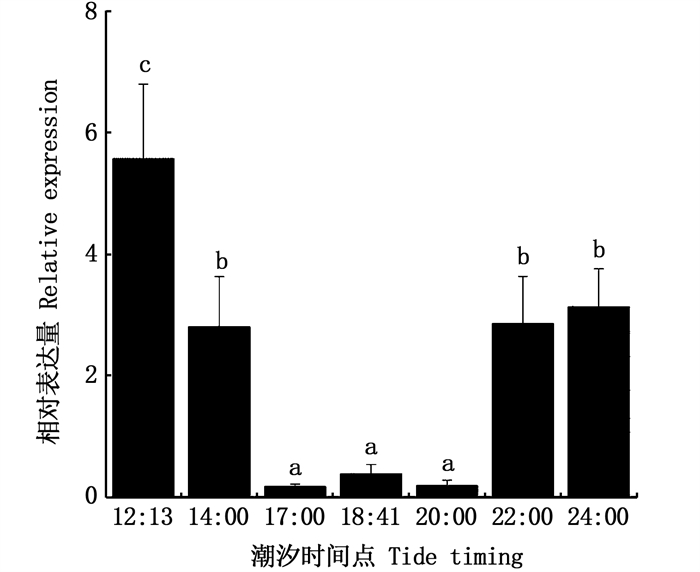
第一次高潮时(12:13)潮水高度为435 cm,低潮点(18:41)时潮水位置为53 cm(图 10),荧光定量结果显示OrNXN表达量随着潮水涨潮落差呈现基本一致的趋势(图 11),在12:13高潮点时表达量最高(P<0.05),14:00落潮点时表达量显著下降(P<0.05),在低潮点18:41左右表达量降低到底部(P<0.05),最高表达量约为最低点的35倍;在17:00~20:00潮水位低于120 cm,基因表达量都显著降低(P<0.05)。随着潮水上涨,OrNXN表达量逐渐升高(P<0.05),至24:00高潮点,表达再次升高(P<0.05)。
|
图 10 芦潮港2021年7月25日潮位变化图 Fig. 10 Tide changes of Luchaogang on July 25, 2021 |
|
图中不同小写字母代表处理组之间差异性显著(P<0.05)。 Difference of lowercase letters in the figure indicates that there are significant differences between the treatment groups(P < 0.05). 图 11 OrNXN基因在不同潮汐时间点刺激下的相对表达量 Fig. 11 Relative expression levels of OrNXN gene at different tidal timing |
此前就有研究者[18]利用小鼠表型数据库对比筛选不同菊头蝠亚种之间听力频率变异相关基因,通过转录组与小鼠表型数据库联合筛选数据,得出与瘤背石磺听力相关的基因,结果来源更加可靠,并且候选数据多,能为后续瘤背石磺低频听力相关研究提供更多思路。
本文克隆了瘤背石磺OrNXN基因全长1 593 bp,ORF框内共有143个氨基酸,蛋白结构预测显示其中包含NXN特有的硫氧还蛋白结构域,中心结构域包括一个具有催化活性的WCPPC结构。同源比较和进化树结果均表明,OrNXN与青翼海兔、加州海兔、光滑双脐螺氨基酸序列相似度高,在进化树位置相近合为一支,说明NXN基因在软体动物体内保守。
组织定量结果显示, OrNXN基因在肠组织内表达量最高,NXN参与调节胃肠上皮细胞更新,同时NXN氧化功能的缺失导致肠胃内疾病的发生与恶化[14],瘤背石磺作为潮间带的偏植食性的杂食动物并且吞食量大,摄食与排泄可同时进行,这需要胃肠道具有强大的氧化还原功能以及稳定的环境做支撑[19]。此前研究[15]显示在成年小鼠大脑皮质、小脑、海马和脑室下区域以及在周围神经系统感觉神经节和神经中NXN皆高表达,与本文中定量结果一致,瘤背石磺长期处于潮间带,感觉神经对潮水产生的低频听力敏感,OrNXN在神经节中的高表达符合其参与低频听力感知之推论。有研究者利用吗啉诺反义寡核苷酸(MO)注射非洲爪蟾以下调NXN的表达,导致非洲爪蟾头部畸形[20],而NXN缺陷的小鼠头部发育也畸形[21],上述研究表明,NXN对大脑发育至关重要,因此OrNXN在神经节内的高表达也印证OrNXN参与瘤背石磺神经节的早期发育与形成。此外,NXN在神经节中的高表达量与NXN参与调控神经细胞生理活动有直接关系,NXN支持其他突触和线粒体蛋白的氧化,低频听力刺激作为外界信号直接影响突触蛋白活动,NXN在神经节中高表达显示OrNXN或参与瘤背石磺低频听力感知。
低频声音刺激结果表明OrNXN基因在50和200 Hz下表达量有显著升高,瘤背石磺在响应低频声音的刺激时,突触及线粒体蛋白氧化呼吸加剧,影响OrNXN的表达。前人研究[22]发现NXN通过维持Camk2的氧化状态,从而保持其活性,而Camk2主要定位于突触后部位和树突棘,参与神经元可塑性的功能和结构形式。长期潮汐低频声音刺激下,瘤背石磺体内神经元可塑性改变,形成与低频听力相联系的长期记忆。低频听力条件触发时,长时程增强效应通过Camk2间接使得OrNXN的表达量发生变化。NXN基因参与生物大脑早期发育过程,瘤背石磺在早期发育过程中形成具有特殊听觉功能的耳石[5],NXN可能参与瘤背石磺耳石的发育与功能的形成。也有研究表明,NXN与PP2A相互作用并影响其活性[23],而PP2A是哺乳动物细胞响应外界信号的主要调节因素[24],NXN通过PP2A参与哺乳动物细胞响应外界信号,而在软体动物瘤背石磺体内,NXN也对50和200 Hz两个特殊频率产生响应,证明OrNXN可能参与瘤背石磺对低频声音信号的响应。
不同潮汐节点下,瘤背石磺OrNXN相对表达量与潮水呈现基本一致的趋势,低潮点时OrNXN显著降低,高潮点OrNXN表达量升至最高,故推测OrNXN在潮汐胁迫下主要参与感知潮汐功能,潮汐发出的声音为0~200 Hz的低频声音,瘤背石磺感知潮汐的功能可能是由于感知到潮汐发出低频声音。此前有研究表明OrNXN在视网膜和松果体内有高表达[25],瘤背石磺体表也分布着背眼,能感受到光信号[3],夜晚24:00高潮水位为526 cm,白天12:35时高潮水位为435 cm,低于夜晚水位,而夜晚OrNXN的表达量却低于白天,可能是由于OrNXN在松果体感光细胞内参与光信号的处理,受光信号刺激产生不同表达,这与之前在小鼠体内NXN的感光性研究结果一致[26]。
本实验从瘤背石磺不同声音频率刺激转录组中利用比较转录组法筛选OrNXN基因并进行全序列克隆、蛋白质结构分析、系统进化树比较以及低频声音与潮汐刺激表达水平的分析。结果显示,瘤背石磺OrNXN基因的结构存在WCPPC结构,并在对应编码的氨基酸序列中第19位至90位之间存在硫氧还蛋白结构。系统进化树显示,瘤背石磺OrNXN基因与青翼海兔、加州海兔、光滑双脐螺合并为一支,符合形态学分类。荧光定量结果显示:OrNXN基因在瘤背石磺肠组织中的表达量最高,推测可能参与胃肠道氧化还原以及肠道上皮更新反应;在神经节中的高表达可能是由于OrNXN参与神经细胞的发育并在神经节中参与响应低频听力信号;不同频率声音刺激与潮汐刺激下的表达揭示了OrNXN基因对外界低频听力信号的响应。本实验为探究海洋软体动物在两栖进化过程中对环境的适应过程提供分子依据。
| [1] |
SHEN H D, LI K, CHEN H C, et al. Experimental ecology and hibernation of Onchidium struma (Gastropoda: Pulmonata: Systellommatophora)[J]. Journal of Experimental Marine Biology and Ecology, 2011, 396(2): 71-76. DOI:10.1016/j.jembe.2010.09.010 |
| [2] |
黄金田, 王爱民. 瘤背石磺营养成分分析及品质评价[J]. 海洋科学, 2008, 32(11): 29-35. HUANG J T, WANG A M. Determination of the nutrients of Onchidium struma and evaluation of its quality[J]. Marine Sciences, 2008, 32(11): 29-35. |
| [3] |
吴旭峰, 沈和定, 吴文健, 等. 我国华东沿海4种石磺形态学比较[J]. 动物学杂志, 2010, 45(6): 92-100. WU X F, SHEN H D, WU W J, et al. Comparison on morphology of Onchidiidae in eastern coast of China[J]. Chinese Journal of Zoology, 2010, 45(6): 92-100. DOI:10.13859/j.cjz.2010.06.021 |
| [4] |
XU G, YANG T Z, SHEN H D. Effect of circadian clock and light-dark cycles in Onchidium reevesii: Possible implications for long-term memory[J]. Genes, 2019, 10(7): 488. DOI:10.3390/genes10070488 |
| [5] |
刘深泉, 范涛. 海若螺平衡囊神经系统的混沌特性[J]. 医用生物力学, 2006, 21(1): 38-42. LIU S Q, FAN T. Chaos property of statocyst systems of Clione[J]. Journal of Medical Biomechanics, 2006, 21(1): 38-42. DOI:10.16156/j.1004-7220.2006.01.008 |
| [6] |
KUROOKA H, KATO K, MINOGUCHI S, et al. Cloning and characterization of the nucleoredoxin gene that encodes a novel nuclear protein related to thioredoxin[J]. Genomics, 1997, 39(3): 331-339. DOI:10.1006/geno.1996.4493 |
| [7] |
FUNATO Y, MIKI H. Nucleoredoxin, a novel thioredoxin family member involved in cell growth and differentiation[J]. Antioxidants & Redox Signaling, 2007, 9(8): 1035-1057. |
| [8] |
URBAINSKY C, NÖLKER R, IMBER M, et al. Nucleoredoxin- dependent targets and processes in neuronal cells[J]. Oxidative Medicine and Cellular Longevity, 2018, 2018: 4829872. |
| [9] |
KORSWAGEN H C. Regulation of the Wnt/β-catenin pathway by redox signaling[J]. Developmental Cell, 2006, 10(6): 687-688. DOI:10.1016/j.devcel.2006.05.007 |
| [10] |
FUNATO Y, MICHIUE T, ASASHIMA M, et al. The thioredoxin-related redox-regulating protein nucleoredoxin inhibits Wnt-β-catenin signalling through dishevelled[J]. Nature Cell Biology, 2006, 8(5): 501-508. DOI:10.1038/ncb1405 |
| [11] |
FUNATO Y, MICHIUE T, TERABAYASHI T, et al. Nucleoredoxin regulates the Wnt/planar cell polarity pathway in Xenopus[J]. Genes to Cells, 2008, 13(9): 965-975. DOI:10.1111/j.1365-2443.2008.01220.x |
| [12] |
VAN DER FLIER L G, CLEVERS H. Stem cells, self-renewal, and differentiation in the intestinal epithelium[J]. Annual Review of Physiology, 2009, 71: 241-260. DOI:10.1146/annurev.physiol.010908.163145 |
| [13] |
BJERKNES M, CHENG H. The stem-cell zone of the small intestinal epithelium. Ⅱ. Evidence from paneth cells in the newborn mouse[J]. American Journal of Anatomy, 1981, 160(1): 65-75. DOI:10.1002/aja.1001600106 |
| [14] |
PÉREZ S, TALÉNS-VISCONTI R, RIUS-PéREZ S, et al. Redox signaling in the gastrointestinal tract[J]. Free Radical Biology and Medicine, 2017, 104: 75-103. DOI:10.1016/j.freeradbiomed.2016.12.048 |
| [15] |
TRAN B N, VALEK L, WILKEN-SCHMITZ A, et al. Reduced exploratory behavior in neuronal nucleoredoxin knockout mice[J]. Redox Biology, 2021, 45: 102054. DOI:10.1016/j.redox.2021.102054 |
| [16] |
黄笑含. 瘤背石磺低频听力基因的克隆验证及其潮汐感知能力的初步探究[D]. 上海: 上海海洋大学, 2020. HUANG X H. Cloning and verification of low-frequency hearing gene and preliminary exploration of tide-sensing ability in Onchidium reevesii[D]. Shanghai: Shanghai Ocean University, 2020. |
| [17] |
THORNE P D. Laboratory and marine measurements on the acoustic detection of sediment transport[J]. The Journal of the Acoustical Society of America, 1986, 80(3): 899-910. DOI:10.1121/1.393913 |
| [18] |
WANG J Y, ZHAO A, SUN H J. The complete mitochondrial genome of the least horseshoe bat (Rhinolophus pusillus)[J]. Mitochondrial DNA Part B, 2020, 5(1): 881-882. DOI:10.1080/23802359.2020.1717389 |
| [19] |
沈和定, 李家乐, 张缓溶. 石磺的生物学特性及其增养殖前景分析[J]. 中国水产, 2004(1): 60-63. SHEN H D, LI J L, ZHANG H R. Biology characteristics and enhancement foreground of Onchidium verruculatum cuvier[J]. China Fisheries, 2004(1): 60-63. |
| [20] |
FUNATO Y, MIKI H. Redox regulation of Wnt signalling via nucleoredoxin[J]. Free Radical Research, 2010, 44(4): 379-388. DOI:10.3109/10715761003610745 |
| [21] |
BRAULT V, MOORE R, KUTSCH S, et al. Inactivation of the (β)-catenin gene by Wnt1-Cre-mediated deletion results in dramatic brain malformation and failure of craniofacial development[J]. Development, 2001, 128(8): 1253-1264. DOI:10.1242/dev.128.8.1253 |
| [22] |
STEPHENSON J R, WANG X H, PERFITT T L, et al. A novel human CAMK2A mutation disrupts dendritic morphology and synaptic transmission, and causes ASD-related behaviors[J]. Journal of Neuroscience, 2017, 37(8): 2216-2233. DOI:10.1523/JNEUROSCI.2068-16.2017 |
| [23] |
LECHWARD K, SUGAJSKA E, DE BAERE I, et al. Interaction of nucleoredoxin with protein phosphatase 2A[J]. FEBS Letters, 2006, 580(15): 3631-3637. |
| [24] |
HUNTER T. Protein kinases and phosphatases: the Yin and Yang of protein phosphorylation and signaling[J]. Cell, 1995, 80(2): 225-236. |
| [25] |
SAHEL J A, LÉVEILLARD T, PICAUD S, et al. Functional rescue of cone photoreceptors in retinitis pigmentosa[J]. Graefe's Archive for Clinical and Experimental Ophthalmology, 2013, 251(7): 1669-1677. |
| [26] |
WOLLOSCHECK T, KUNST S, KELLEHER D K, et al. Transcriptional regulation of nucleoredoxin-like genes takes place on a daily basis in the retina and pineal gland of rats[J]. Visual Neuroscience, 2015, 32: E002. |
2. International Research Center for Marine Biosciences, Ministry of Science and Technology, Shanghai Ocean University, Shanghai 201306, China
 2023,
Vol. 32
2023,
Vol. 32