2. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
3. 国家远洋渔业工程技术研究中心, 上海 201306;
4. 农业农村部大洋渔业开发重点实验室, 上海 201306
能量积累与分配是生物个体生活史转变的重要组成部分, 决定了生长和繁殖之间的权衡[1]。大多数头足类具有典型的生命周期短、生长速度快、产卵结束后即死去等生活史特征[2], 亲代生殖能量的投入情况, 影响着自身繁殖潜能和后代的存活率[3-4]。同时, 头足类的能量积累分配存在属种特殊性, 与其繁殖策略密切相关。比如, 福氏枪乌贼(Loligo forbesi)为间歇性终端产卵者, 繁殖产卵期间逐渐停止摄食, 生殖能量来源于机体组织存储能量的转化利用[5], 而多次产卵者如鸢乌贼(Stenoteuthis oualaniensis)在繁殖产卵期间保持摄食行为, 生殖能量则主要来源于现场摄入食物的吸收转化[6]。此外, 头足类对环境变化的响应速度快, 外界环境变化不仅影响着这些个体的生长发育[7-8], 而且作用于组织能量积累及生殖能量的投入分配过程[9-10]。因此, 在复杂的海洋环境中, 如何获得较大的能量积累和权衡生长与繁殖之间的能量投入分配, 实现生殖价值和后代存活率的最大化, 是这些短生命周期种类繁衍延续的重要保证[1]。
阿根廷滑柔鱼(Illex argentinus)是典型的大洋性头足类, 隶属枪形目(Teuthoidea)柔鱼科(Ommastrephidae)滑柔鱼属(Illex), 主要分布在22°S~54°S的西南大西洋大陆架和大陆坡海域[11]。该种类是世界头足类渔业中的重要经济种, 渔获量占世界头足类总产量的10%左右[12], 也是我国远洋鱿钓渔业的主要捕捞对象之一[13]。同时, 阿根廷滑柔鱼食性贪婪、食物组成多样, 且因资源量大而成为大型鱼类、海洋哺乳类等的主要饵料生物[11], 已经被认为是西南大西洋生态系统中重要的生态指示种和营养传输载体[14]。类似于其他头足类, 阿根廷滑柔鱼的生长发育对栖息海域环境的变化敏感性高, 其中水温、初级生产力等是重要的影响因子[8, 15]。已有研究显示, 在组织能量积累上, 阿根廷滑柔鱼肌肉和性腺等组织能量积累高值发生在海表温较低、叶绿素a质量浓度较高的海域[9]; 在生殖投入策略上, 阿根廷滑柔鱼为收入-资本混合型, 即生殖能量来源以现场食物摄食吸收转化为主, 在生殖能量需求较大时转化利用部分肌肉组织存储能量为辅[16-17]。然而, 阿根廷滑柔鱼性腺发育滞后于个体生长, 性腺开始发育至繁殖产卵结束时长仅占生命周期的10%~20%, 并且性腺成熟之后具有产卵洄游习性[11, 18]。因此, 在短暂的性腺发育过程中, 如何有效地积累生殖能量并应对多变的海域环境将是实现其生殖价值最大化的关键。为此, 本文通过2019年1—3月和2020年5—6月在西南大西洋索饵场采集的阿根廷滑柔鱼样本, 分析性腺发育过程中生殖能量积累过程; 并且以海表面温度和叶绿素a质量浓度作为海域环境参考因子, 利用广义加性混合效应模型(generalized additive mixed-effects models, GAMM)探讨分析性腺组织能量密度和能量积累的环境效应关系, 以期初步掌握阿根廷滑柔鱼在生殖能量积累方面的环境选择适应性, 为可持续开发该种类资源提供科学基础, 也为其他头足类开展类似的研究提供资料参考。
1 材料与方法 1.1 样本采集阿根廷滑柔鱼实验样本来自我国鱿钓渔业作业船。采样时间为2019年1—3月和2020年5—6月。采样海域为西南大西洋公海海域(40°05′S~47°51′S、56°15′W~62°53′W,图 1)。根据作业船相对流动性特点, 采样方案为每个站点随机采集样本约50尾。样本经冷冻保存后运回实验室进行解剖分析。
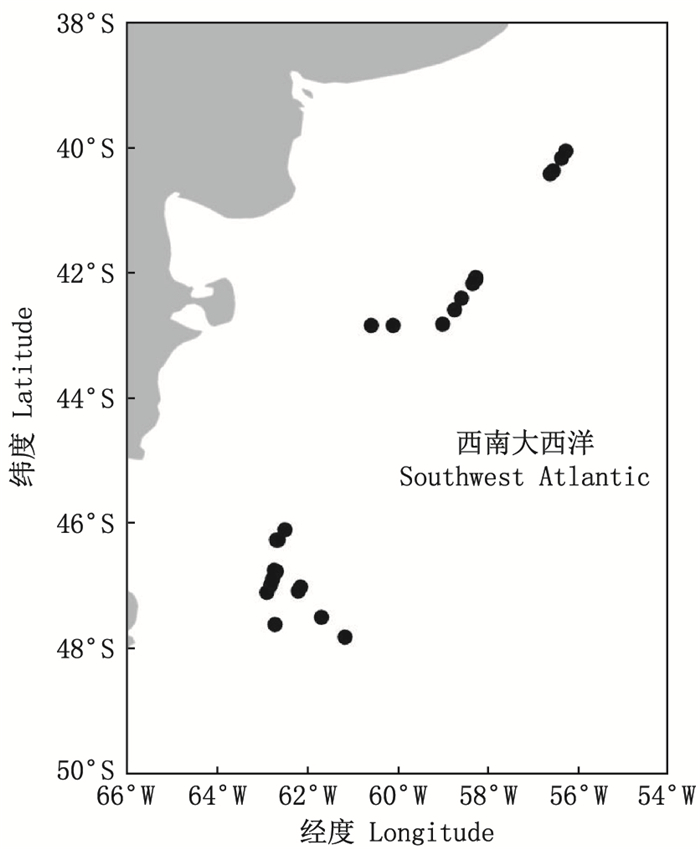
|
图 1 西南大西洋阿根廷滑柔鱼采样海域和采样站点 Fig. 1 Sampling region and sampling stations of Illex argentinus in the southwest Atlantic |
样本在实验室常温解冻后进行生物学测定, 测定内容包括胴背长、体质量、性腺成熟度、卵巢质量、输卵管质量(含成熟卵子但不包括输卵管腺)和缠卵腺质量。胴长测定精确至1mm, 体质量精确至1g, 性腺组织质量精确至0.01g。性腺成熟度划分根据林东明等[19]的划分标准, 进行Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ和Ⅷ等8个时期的鉴别。其中, Ⅰ~Ⅲ期为性腺发育未成熟期(Ⅰ期为未发育, Ⅱ期为开始发育, Ⅲ期为生理性发育), Ⅳ~Ⅵ期为性腺发育成熟期(Ⅳ~Ⅴ期为生理性发育成熟, Ⅵ期为功能性发育成熟), Ⅶ期和Ⅷ期分别为繁殖期和繁殖后期。
阿根廷滑柔鱼的性腺发育滞后于个体生长, 性腺组织自Ⅲ期才开始迅速生长[11]。同时, 该种类产卵后不久便死去[11], 实验样本中未见有Ⅷ期个体。因此, 本实验随机挑选Ⅲ~Ⅶ期雌性样本共104尾, 进行卵巢、输卵管和缠卵腺等性腺组织的能量积累分析, 其中Ⅲ期36尾, Ⅳ期22尾, Ⅴ期18尾, Ⅵ期17尾, Ⅶ期11尾。卵巢、输卵管和缠卵腺切取称量质量后, 及时装入塑料样品瓶中于-40℃保存。
1.3 能量密度测定及能量积累估算卵巢、缠卵腺和输卵管等3处性腺组织冷冻保存后, 置于冷冻干燥机(Scientz-10N))-50℃下冷冻干燥24~36h。冷冻干燥后, 称取各组织的干质量, 精确至0.01g。随后, 各干燥组织分别置于研磨机(Scientz-48)中研磨粉碎。各组织的能量密度值(energy density)使用Parr 6400型氧弹热量仪(Calorimeter Parr6400, USA)进行分析测定, 单位为kJ/g。
卵巢、输卵管、缠卵腺组织能量积累(tissue energy accumulation)计算公式:
 (1)
(1)
式中: Ea为组织能量积累, kJ; Ed为卵巢、输卵管和缠卵腺的组织能量密度, kJ/g; Wt为组织的总湿质量, g; Wd为冷冻干燥组织样品的干质量, g; Ww为冷冻干燥组织样品的湿质量, g; i表示为卵巢、输卵管或者缠卵腺。
1.4 环境数据既有研究[8, 15]发现, 水温和海域初级生产力是影响阿根廷滑柔鱼生长发育较为重要的环境因子。因此, 选取海表面温度(sea-surface temperature, SST)和叶绿素a(chlorophyll-a, Chl.a)质量浓度进行阿根廷滑柔鱼雌性个体生殖能量积累的环境效应关系研究。SST和Chl.a数据来源于美国NOAA全球海洋观测数据库(https://oceanwatch.pifsc.noaa.gov/)。其中, 海表温数据库ID为CRW_sst_v1_0_monthly, 叶绿素a质量浓度数据库ID为esa-cci-chla-monthly-v5-0, 两者的时间分辨率均为月, 空间分辨率为0.05°×0.05°。参考韩飞等[10]的计算方法, 计算阿根廷滑柔鱼样本采样站点的海表面温度、叶绿素a质量浓度。经计算, 采样站点的SST为9.29~14.83℃, 平均值为(13.02±2.04) ℃; Chl.a质量浓度为0.70~1.55 mg/m3, 平均值为(1.08±0.21) mg/m3。
1.5 数据处理按照性腺发育成熟度, 分析阿根廷滑柔鱼卵巢、输卵管和缠卵腺等组织能量密度及其能量积累。对不同发育时期、不同组织的能量密度和能量积累进行单因素方差分析(one-way ANOVA)和Tukey HSD多重比较随后检验, 显著性水平为P < 0.05。
作为终生一次繁殖产卵种类, 阿根廷滑柔鱼各性腺组织的能量密度及其能量积累变化过程可表征其生殖能量积累的变化过程[16-17]。为此, 利用广义加性混合效应模型(generalized additive mixed-effects models, GAMM)分别拟合分析卵巢、输卵管和缠卵腺等组织的能量密度和能量积累与SST、Chl.a浓度等环境因子之间的关系, 模型中以采样月份作为随机效应因子。模型方程如下:
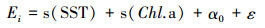 (2)
(2)
式中: Ei为组织能量密度或者组织能量积累, 组织能量密度单位为kJ/g, 组织能量积累单位为kJ; i为卵巢、输卵管、或者缠卵腺; SST为海表面温度, ℃; Chl.a为叶绿素a质量浓度, mg/m3; α0为采样时间对模型截距的随机效应; ε为模型误差。
实验数据以平均值±标准差(Mean±SD)表示。数据分析运用OriginPro 9.1和SPSS等统计分析软件处理, GAMM模型使用R统计平台的mgcv函数包[20]进行拟合分析。
2 结果 2.1 样本个体的胴长和体质量阿根廷滑柔鱼Ⅲ~Ⅶ期雌性样本的胴长为180~338mm, 体质量为103~741g;平均胴长为(229.53±27.78) mm, 平均体质量为(275.14±130.33) g。体质量与胴长的幂函数关系式为W=0.0000072×L3.20(R2=0.82, P < 0.01), 见图 2。
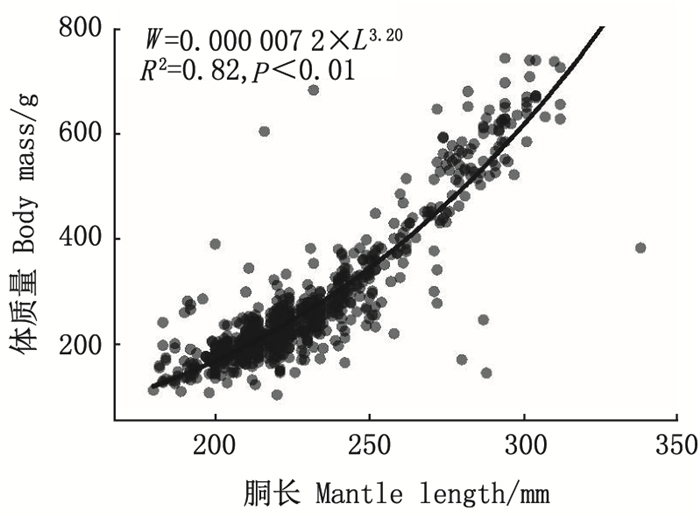
|
图 2 阿根廷滑柔鱼雌性个体的体质量与胴长关系 Fig. 2 Relationship between body mass and mantle length for female Illex argentinus |
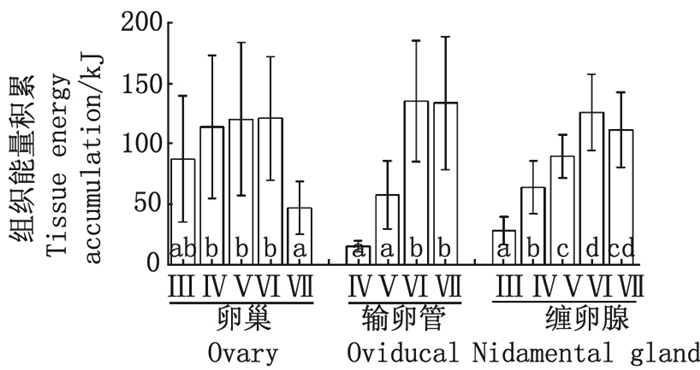
阿根廷滑柔鱼卵巢组织的能量密度为20.45~24.88kJ/g, 平均值为(23.25±0.92)kJ/g; 组织能量积累为10.80~367.00kJ, 平均值为(100.53±65.38) kJ(图 3, 4)。随着性腺发育, 卵巢组织的能量密度和能量积累均呈上升趋势, 且不同性腺成熟度之间的差异性显著(能量密度, F=16.02, P < 0.05;能量积累, F=3.53, P=0.01)。二者均在性腺成熟度Ⅵ期达到最大值, 分别为(23.91±0.48) kJ/g和(121.58±50.98) kJ, 随后均下降显著(Tukey HSD, 能量密度, P=0.01;能量积累, P=0.02)。然而, Tukey多重比较随后检验结果显示, 在性腺成熟度Ⅳ~Ⅵ期, 卵巢组织能量密度和能量积累均处于较稳定的水平(Tukey HSD, 能量密度, P=0.72;能量积累, P=0.50)。
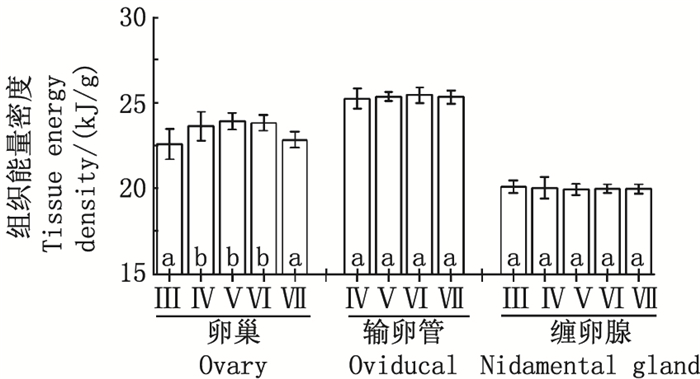
|
各组平均值中标示的不同字母表示Tukey HSD检验差异显著(P < 0.05)。 Mean values with different scripts are significantly different (P < 0.05) as determined using Tukey HSD test. 图 3 不同性腺成熟度阿根廷滑柔鱼雌性个体性腺组织的能量密度 Fig. 3 Energy density of reproductive tissues in female I. argentinus according to different maturities |
|
各组平均值中标示的不同字母表示Tukey HSD检验差异显著(P < 0.05)。 Mean values with different scripts are significantly different (P < 0.05) as determined using Tukey HSD test. 图 4 不同性腺成熟度阿根廷滑柔鱼雌性个体性腺组织能量积累 Fig. 4 Energy accumulation of reproductive tissues in female I. argentinus according to different maturities |
输卵管组织的能量密度为24.28~26.46kJ/g, 平均值为(25.32±0.43) kJ/g; 能量积累为10.77~274.08kJ, 平均值为(86.68±64.80) kJ。缠卵腺组织的能量密度为18.77~21.06kJ/g, 平均值为(20.01±0.42) kJ/g; 能量积累为8.48~204.01 kJ, 平均值为(82.02±41.15) kJ。不同性腺成熟时期, 输卵管和缠卵腺的组织能量密度均无显著性差异(ANOVA, 输卵管, F=0.52, P=0.67;缠卵腺, F=0.32, P=0.87;图 3)。而组织能量积累随性腺成熟显著增加(ANOVA, 输卵管, F=24.40, P < 0.05;缠卵腺, F=41.78, P < 0.05), 在Ⅵ期达最高值, 分别为(135.85±49.87) kJ和(126.41±31.48) kJ, 随后略有下降但不显著(Tukey HSD, 输卵管, P=1.00;缠卵腺, P=0.53;图 4)。
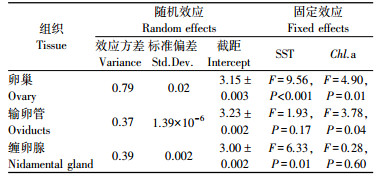
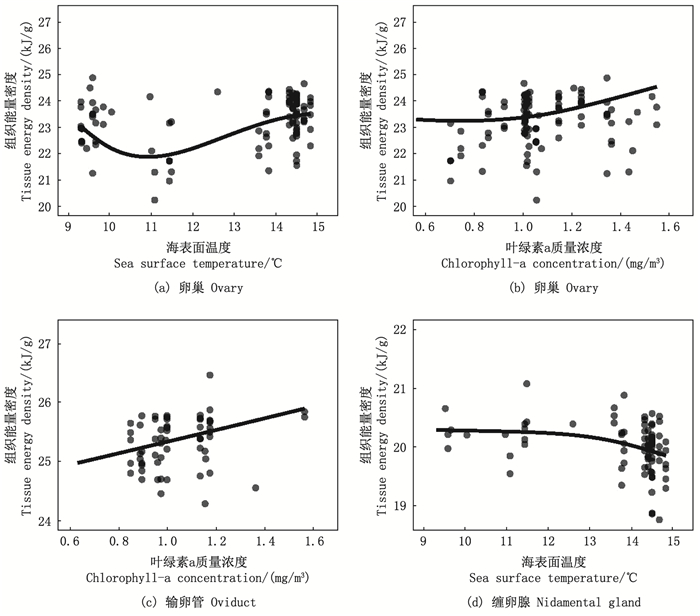
2.3 性腺组织能量密度与环境因子关系GAMM模型显示, 卵巢组织能量密度与环境因子SST和Chl.a质量浓度密切相关(t=931.80, P < 0.001;表 1)。当SST小于11℃时, 卵巢组织能量密度随SST上升呈下降趋势, 随后逐渐升高(F=9.56, P < 0.001;图 5a); 卵巢组织能量密度随Chl.a质量浓度增高而增大(F=4.90, P=0.01;图 5b)。输卵管组织能量密度与Chl.a质量浓度存在显著的相关性(t=1 601.00, P < 0.001), 随着Chl.a质量浓度的升高而逐渐增大(F=3.78, P=0.04;图 5c); 而与SST没有显著的相关性(F=1.93, P=0.17)。缠卵腺组织能量密度则与SST密切相关(t=1400.00, P < 0.001), 随SST的升高缠卵腺组织能量密度呈现缓慢降低趋势, 当高于13℃时下降趋势显著(F=6.33, P=0.01;图 5d)。但是, 缠卵腺组织能量密度与Chl.a质量浓度并不存在显著相关关系(F=0.28, P=0.60)。
|
表 1 阿根廷滑柔鱼雌性个体性腺组织能量密度与海表温和叶绿素a质量浓度的GAMM模型拟合结果 Tab.1 Generalized additive mixed-effects models (GAMM) results of reproductive tissues energy density related to sea surface temperature and chlorophyll-a concentration for female I. argentinus |
|
图 5 海表温和叶绿素a质量浓度对阿根廷滑柔鱼雌性个体性腺组织能量密度的效应影响 Fig. 5 Effects of sea surface temperature and chlorophyll-a concentration on the reproductive tissues energy density of female Illex argentinus |
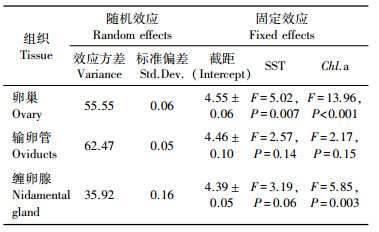
GAMM结果显示, 卵巢组织能量积累与SST和Chl.a质量浓度相关性显著(t=72.76, P < 0.001; 表 2)。卵巢组织能量积累随SST升高而呈递减趋势(F=5.02, P=0.007;图 6a), 随Chl.a质量浓度的升高而呈递增趋势(F=13.96, P < 0.001;图 6b)。缠卵腺组织能量积累仅与Chl.a质量浓度具有显著的相关性(SST, F=3.19, P=0.06;Chl.a, F=5.85, P=0.003), 随Chl.a质量浓度的升高而迅速增加(图 6c)。然而, 输卵管组织能量积累与SST和Chl.a质量浓度均不存在相关性(SST, F=2.57, P=0.14;Chl.a, F=2.17, P=0.15)。
|
表 2 阿根廷滑柔鱼雌性个体性腺组织能量积累与海表温和叶绿素a质量浓度的GAMM模型拟合结果 Tab.2 Generalized additive mixed-effects models (GAMM) results of SST and Chl.a for the total tissue energy accumulation of reproductive tissues in female I. argentinus |
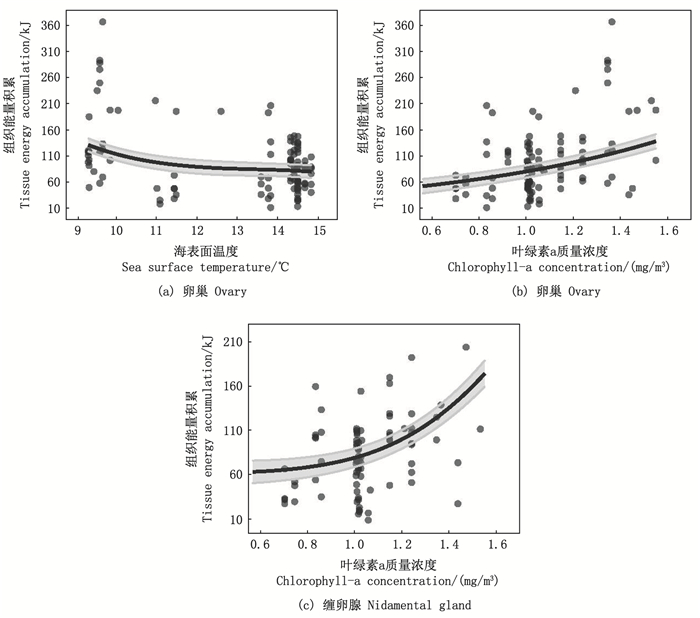
|
黑色散点为数据原始值, 黑色实线和灰色阴影分别表示GAMM拟合曲线及其95%置信区间。 Black scattering points present the raw data, and black lines are from generalized additive mixed-effects models, with 95% confidence intervals in grey shading. 图 6 海表温和叶绿素a质量浓度对阿根廷滑柔鱼雌性性腺组织能量积累的影响 Fig. 6 Effects of sea surface temperature and chlorophyll-a concentration on the reproductive tissues energy accumulation in female Illex argentinus |
头足类的生殖投入存在繁殖策略特殊性, 导致性腺组织能量积累在不同性腺发育期存在差异[21]。阿根廷滑柔鱼为间歇性终端产卵者[22], 随着性腺发育, 卵巢组织内的卵母细胞批次发育成熟, 批次排入并储存于输卵管中, 繁殖期分批排出卵子[23]。在这个过程中, 性腺组织的能量密度及其能量积累也随之发生变化[21]。其中, 卵巢作为卵子发生成熟的重要场所, 在性腺发育阶段较大量地积累并存储蛋白质和脂肪等营养与能量物质[17, 24-26]; 在繁殖产卵期(Ⅶ期), 卵巢组织开始衰败, 未成熟的部分卵巢卵母细胞也会被退化吸收[24]。本研究显示, 阿根廷滑柔鱼卵巢组织能量密度和能量积累随着性腺发育均表现出明显的变化, 在Ⅲ~Ⅵ期增大明显, 随后在繁殖产卵期显著下降, 这一变化与卵巢发育及卵子发生过程是一致的, 也佐证了该种类间歇性终端产卵的繁殖习性。值得注意的是, 阿根廷滑柔鱼卵巢组织在繁殖产卵期的能量密度及能量积累变化与多次产卵的鸢乌贼[6]和茎柔鱼(Dosidicus gigas)[10]不同。通常, 营间歇性终端产卵者自性腺发育成熟之后逐渐降低摄食强度, 在繁殖产卵期基本停止摄食行为, 配子发生能量来源于部分未成熟卵母细胞的退化吸收和肌肉组织存储能量的转化[16-17, 27-28]; 相反, 多次产卵者在繁殖产卵期间保持摄食和体细胞的正常生长, 摄食转化的能量持续投入性腺组织供给配子发生[29-30]。因此, 在繁殖产卵期, 营间歇性终端产卵的阿根廷滑柔鱼性腺组织能量密度及能量积累下降显著, 而营多次产卵的鸢乌贼和茎柔鱼的卵巢组织能量密度及能量积累则基本保持较稳定水平[6]。
不同于卵巢组织, 阿根廷滑柔鱼输卵管和缠卵腺的组织能量密度在性腺发育过程中保持稳定水平, 组织能量积累则不断增加, 说明两组织的能量物质组成在性腺发育过程中稳定, 而能量积累则更多地决定于组织自身的生长。通常, 大洋性柔鱼类的输卵管的主要作用是暂时存储并输送成熟卵子[31], 自生理性成熟开始(Ⅳ期)之后, 营养物质组成相一致的成熟卵子逐渐由卵巢排入并暂存于输卵管中[31]; 缠卵腺则是重要的分泌组织, 生化组成较为单一, 以蛋白质和碳水化合物为主[26]。因此, 输卵管和缠卵腺相对稳定的能量密度值应该与其稳定的生化组成密切相关, 前者组织能量积累随着成熟卵子排入不断增加, 后者组织能量积累则因组织生长而增加。
3.2 性腺组织能量积累与环境因子关系头足类对环境波动变化的敏感性高, 生长发育容易受到海洋学因素影响[32-33]。其中, 栖息海域温度是一个重要的影响因素[34], 对营养物质摄取和生殖能量积累水平产生直接影响[35-36]。在本研究中, 阿根廷滑柔鱼卵巢、缠卵腺的组织能量密度均与海表温呈显著的相关性, 前者在海表温大于11℃时呈现上升趋势, 后者则随着海表温升高而逐渐下降。卵巢组织是卵母细胞发生的重要器官, 在卵母细胞发生过程中积累并合成丰富的蛋白质、脂肪等营养物质[17, 25-26]; 缠卵腺则是一个典型的分泌型腺体, 具有大量的分泌细胞和丰富的细胞器[37-38]。通常, 配子发生过程中营养物质合成与温度呈正相关关系[39], 分泌腺体的分泌细胞和酶的活性则受制于温度的变化[9, 37]。因此, 阿根廷滑柔鱼卵巢和缠卵腺的组织能量密度与海表温之间关系的不同, 应该是两者的生化组成、生理功能及其对外界温度变化的响应存在组织特殊性所致。
已有研究发现, 阿根廷滑柔鱼的最适栖息海表温度为7~15℃[32], 个体代谢率随着温度升高而加快[40]。然而, 在外界温度相对较低时, 机体的酶活性及其代谢速率下降, 有利于营养物质的积累和利用[7, 9]。本研究中, 阿根廷滑柔鱼卵巢组织能量积累与海表温呈负相关关系, 输卵管和缠卵腺组织能量积累则与海表面温度没有显著相关性, 结果与LIN等[9]的研究报道相近。卵巢组织能量积累随海表温升高而下降, 一方面可能说明栖息海域水温升高对该组织能量的实际积累速率产生负效应; 另一方面则可能是海域水温升高加速了卵巢卵母细胞的发生成熟并排入输卵管中[32], 从而导致卵巢组织的能量积累下降。但是, 因为输卵管组织能量积累与海表温没有显著的相关性, 所以卵巢组织能量积累与海表温的负相关关系可能更倾向于能量积累速率下降的解释, 具体原因需要后续卵巢组织的生理化学研究加以佐证。此外, 采样的时空变化可能导致对种群和季节差异的影响[41], 同时阿根廷滑柔鱼存在的年间和月间体征差异性[42], 也可能影响个体的生殖能量投入。
阿根廷滑柔鱼具有索饵洄游和产卵洄游特性, 秋冬季产卵群的产卵场位于巴西-马尔维纳斯汇合处附近, 孵化后幼体沿巴塔哥尼亚大陆架200~300m等深线南下索饵育肥, 性腺发育成熟后返回北方的产卵场产卵[43-45], 这个过程伴随着海域初级生产力、饵料生物种类及其丰度的纬向变化过程[46-47], 并对肌肉、性腺等组织的生化组成、能量密度及其能量积累产生一定影响[9, 26, 48]。在本研究中, 阿根廷滑柔鱼卵巢、输卵管的能量密度及能量积累均与叶绿素a质量浓度呈显著的正相关关系, 说明初级生产力及饵料生物丰度对卵巢和输卵管两者组织的生化组成、组织能量积累具有重要的影响作用。通常, 在西南大西洋巴塔哥尼亚大陆架及大陆坡海域, 叶绿素a质量浓度较高, 饵料生物的可获得率也较大[49], 将有助于捕食者获得较高的能量营养物质积累[25]。本研究的阿根廷滑柔鱼样本来自于巴塔哥尼亚大陆架附近海域, 且处于性腺发育至成熟的索饵育肥期; 因此, 在叶绿素a质量浓度较高、食物可获得率较大时, 将可为阿根廷滑柔鱼获得较高的能量营养物质积累, 随之影响卵巢和输卵管等组织的能量密度及能量积累。这与JACKSON等[50]认为食物可获得率是促进生物个体生长发育的重要因素的结论相近。
综上所述, 随着性腺发育, 阿根廷滑柔鱼卵巢组织能量密度变化明显, 输卵管和缠卵腺组织能量密度则基本保持相对稳定; 然而, 三者的组织能量积累在生理性发育期至繁殖产卵期均持续积累且增加显著。卵巢、缠卵腺的组织能量密度与栖息海域的海表面温度具有显著的相关性和组织特殊性, 前者的组织能量密度随海表温升高而增加、后者的组织能量密度则随海表温升高而下降。同时, 卵巢和输卵管组织能量密度均随着栖息海域的叶绿素a质量浓度增加而增大, 卵巢和缠卵腺的组织能量积累亦随着海域叶绿素a质量浓度增高而增大。此外, 栖息海域温度对卵巢组织能量积累具有显著的影响, 组织能量积累速率随着海表温升高而降低。这些结果表明, 阿根廷滑柔鱼雌性个体的生殖能量随着性腺发育持续积累且增加显著, 与栖息海域的海表温和叶绿素a质量浓度密切相关。然而, 栖息海域环境因子对阿根廷滑柔鱼卵巢、输卵管和缠卵腺3个组织的能量密度及其能量积累的影响作用存在一定的组织特殊性, 可能与各组织的生理结构、生化组成和营养物质需求不同等相关, 后续需要结合性腺组织的组织学和生物化学研究深入分析其生殖能量积累的环境效应关系, 为开展该种类的生殖能量积累策略研究提供资料参考。
| [1] |
VILLEGAS-RÍOS D, ALONSO-FERNÁNDEZ A, DOMÍNGUEZ-PETIT R, et al. Energy allocation and reproductive investment in a temperate protogynous hermaphrodite, the ballan wrasse Labrus bergylta[J]. Journal of Sea Research, 2014(86): 76-85. |
| [2] |
JEREB P, ROPER C F E. Cephalopods of the world: An annotated and illustrated catalogue of cephalopod species known to date. Volume 2. Myopsid and Oegopsid Squids, Rome: FAO, 2010: 1-605.
|
| [3] |
PONTZER H, KAMILAR J M. Great ranging associated with greater reproductive investment in mammals[J]. Proceedings of the National Academy of Sciences, 2009, 106(1): 192-196. DOI:10.1073/pnas.0806105106 |
| [4] |
朱凯, 张立川, 肖楚源, 等. 南海鸢乌贼微型群雌性个体繁殖力研究[J]. 渔业科学进展, 2020, 41(6): 140-148. ZHU K, ZHANG L C, XIAO C Y, et al. Characterizing fecundity of dwarf form of female purple flying squid (Sthenoteuthis oualaniensis) in the South China Sea[J]. Progress in Fishery Sciences, 2020, 41(6): 140-148. |
| [5] |
SMITH J M, PIERCE G J, ZUUR A F, et al. Patterns of investment in reproductive and somatic tissues in the loliginid squid Loligo forbesii and Loligo vulgaris in Iberian and Azorean waters[J]. Hydrobiologia, 2011, 670(1): 201-221. DOI:10.1007/s10750-011-0666-8 |
| [6] |
朱凯, 孙程婕, 陈新军, 等. 南海鸢乌贼中型群雌性个体肌肉和性腺组织能量积累及其分配[J]. 海洋渔业, 2019, 41(6): 641-651. ZHU K, SUN C J, CHEN X J, et al. Energy accumulation of somatic and gonadal tissues and its allocation to reproduction in medium form of female Sthenoteuthis oualaniensis in the South China Sea[J]. Marine Fisheries, 2019, 41(6): 641-651. DOI:10.3969/j.issn.1004-2490.2019.06.001 |
| [7] |
FORSYTHE J W, WALSH L S, TERK P E, et al. Impact of temperature on juvenile growth and age at first egg-laying of the Pacific reef squid Sepioteuthis lessoniana reared in captivity[J]. Marine Biology, 2001, 138(1): 103-112. DOI:10.1007/s002270000450 |
| [8] |
BAZZINO G, QUIÑONES R A, NORBIS W. Environmental associations of shortfin squid Illex argentinus (Cephalopoda: Ommastrephidae) in the Northern Patagonian Shelf[J]. Fisheries Research, 2005, 76(3): 401-416. DOI:10.1016/j.fishres.2005.07.005 |
| [9] |
LIN D M, CHEN X J, WEI Y R, et al. The energy accumulation of somatic tissue and reproductive organs in post-recruit female Illex argentinus and the relationship with sea surface oceanography[J]. Fisheries Research, 2017(185): 102-114. |
| [10] |
韩飞, 陈新军, 林东明. 东太平洋赤道海域茎柔鱼组织能量积累及其与海表面环境因子的关系[J]. 中国水产科学, 2020, 27(4): 427-437. HAN F, CHEN X J, LIN D M. The energy accumulation and the relation to sea surface environments for Dosidicus gigas from the equatorial water of eastern Pacific[J]. Journal of Fishery Sciences of China, 2020, 27(4): 427-437. |
| [11] |
RODHOUSE P G K, ARKHIPKIN A I, LAPTIKHOVSKY V, et al. Illex argentinus, Argentine shortfin squid, in advances in squid biology, ecology and fisheries//ROSA R, PIERCE G, O'DOR R. Part Ⅱ-Oegopsid Squids. New York: Nova Science Publishers, 2013: 109-148.
|
| [12] |
F AO. Review of the state of world marine fishery resources[J]. Rome: Food and Agriculture Organization of the United Nations, 2011, 1-18. |
| [13] |
陈新军. 世界头足类资源开发现状及我国远洋鱿钓渔业发展对策[J]. 上海海洋大学学报, 2019, 28(3): 321-330. CHEN X J. Development status of world cephalopod fisheries and suggestions for squid jigging fishery in China[J]. Journal of Shanghai Ocean University, 2019, 28(3): 321-330. |
| [14] |
ARKHIPKIN I A. Squid as nutrient vectors linking Southwest Atlantic marine ecosystems[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2013, 95(6): 7-20. |
| [15] |
FORSYTHE J W. Accounting for the effect of temperature on squid growth in nature: from hypothesis to practice[J]. Marine Freshwater Research, 2004, 55(4): 331-339. DOI:10.1071/MF03146 |
| [16] |
LIN D M, CHEN X J, CHEN Y, et al. Sex-specific reproductive investment of summer spawners of Illex argentinus in the southwest Atlantic[J]. Invertebrate Biology, 2015, 134(3): 203-213. DOI:10.1111/ivb.12088 |
| [17] |
LIN D M, HAN F, XUAN S P, et al. Fatty acid composition and the evidence for mixed income-capital breeding in female Argentinean short-fin squid Illex argentinus[J]. Marine Biology, 2019, 166(7): 90.91-90.12. |
| [18] |
SCHWARZ R, PEREZ J A A. Age structure and life cycles of the Argentine shortfin squid Illex argentinus (Cephalopoda: Ommastrephidae) in southern Brazil[J]. Journal of the Marine Biological Association of the United Kingdom, 2013, 93(2): 557-565. DOI:10.1017/S0025315412000331 |
| [19] |
林东明, 陈新军, 方舟. 西南大西洋阿根廷滑柔鱼夏季产卵种群繁殖生物学的初步研究[J]. 水产学报, 2014, 38(6): 843-852. LIN D M, CHEN X J, FANG Z. Preliminary study on reproductive biology of summer spawning stock of Illex argentinus in the southwestern Atlantic Ocean[J]. Journal of Fisheries of China, 2014, 38(6): 843-852. |
| [20] |
WOOD S N. Fast stable direct fitting and smoothness selection for generalized additive models[J]. Journal of the Royal Statistical Society: Series B (Statistical Methodology), 2008, 70(3): 495-518. DOI:10.1111/j.1467-9868.2007.00646.x |
| [21] |
林东明, 陈新军, 魏嫣然, 等. 阿根廷滑柔鱼雌性个体肌肉和性腺组织能量积累及其生殖投入[J]. 水产学报, 2017, 41(1): 70-80. LIN D M, CHEN X J, WEI Y R, et al. Energy accumulation of both somatic and reproductive tissues and its allocation to reproduction in Argentinean short-fin squid (Illex argentinus)[J]. Journal of Fisheries of China, 2017, 41(1): 70-80. |
| [22] |
ROCHA F, GUERRA Á, GONZÁLEZ Á F. A review of reproductive strategies in cephalopods[J]. Biological Reviews, 2001, 76(3): 291-304. DOI:10.1017/S1464793101005681 |
| [23] |
林东明. 阿根廷滑柔鱼的产卵策略研究. 上海: 上海海洋大学, 2015: 1-127. LIN D M. Spawning strategy of Argentine shortfin squid, Illex argentinus (Cephalopoda: Ommastrephidae) in the southwest Atlantic. Shanghai: Shanghai Ocean University, 2015: 1-127. |
| [24] |
LIN D M, CHEN X J, CHEN Y, et al. Ovarian development in Argentinean shortfin squid Illex argentinus: group-synchrony for corroboration of intermittent spawning strategy[J]. Hydrobiologia, 2017, 795(1): 327-339. DOI:10.1007/s10750-017-3154-y |
| [25] |
林东明, 孙程婕, 宣思鹏, 等. 雌性阿根廷滑柔鱼性腺发育阶段的脂肪酸组成及变化[J]. 上海海洋大学学报, 2019, 28(3): 409-418. LIN D M, SUN C J, XUAN S P, et al. Fatty acid composition and its changes during sexual maturation in female Illex argentinus[J]. Journal of Shanghai Ocean University, 2019, 28(3): 409-418. |
| [26] |
CLARKE A, RODHOUSE P G, GORE D J. Biochemical composition in relation to the energetics of growth and sexual maturation in the ommastrephid squid Illex argentinus[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 1994, 344(1308): 201-212. DOI:10.1098/rstb.1994.0061 |
| [27] |
ARKHIPKIN A. Age, growth, stock structure and migratory rate of pre-spawning short-finned squid Illex argentinus based on statolith ageing investigations[J]. Fisheries Research, 1993, 16(4): 313-338. DOI:10.1016/0165-7836(93)90144-V |
| [28] |
ROCHA F, GUERRA A. Signs of an extended and intermittent terminal spawning in the squids Loligo vulgaris Lamarck and Loligo forbesi Steenstrup (Cephalopoda: Loliginidae)[J]. Journal of Experimental Marine Biology and Ecology, 1996, 207(1-2): 177-189. DOI:10.1016/S0022-0981(96)02631-7 |
| [29] |
CHEN X J, HAN F, ZHU K, et al. The breeding strategy of female jumbo squid Dosidicus gigas: energy acquisition and allocation[J]. Scientific Reports, 2020, 10(1). DOI:10.1038/s41598-020-66703-5 |
| [30] |
HARMAN R F, YOUNG R E, REID S B, et al. Evidence for multiple spawning in the tropical oceanic squid Stenoteuthis oualaniensis (Teuthoidea: Ommastrephidae)[J]. Marine Biology, 1989, 101(4): 513-519. DOI:10.1007/BF00541653 |
| [31] |
林东明, 陈新军. 头足类生殖系统组织结构研究进展[J]. 上海海洋大学学报, 2013, 22(3): 410-418. LIN D M, CHEN X J. Research progress on histological structure of reproductive system in cephalopod[J]. Journal of Shanghai Ocean University, 2013, 22(3): 410-418. |
| [32] |
SACAU M, PIERCE G J, WANG J, et al. The spatio-temporal pattern of Argentine shortfin squid Illex argentinus abundance in the southwest Atlantic[J]. Aquatic Living Resources, 2005, 18(4): 361-372. DOI:10.1051/alr:2005039 |
| [33] |
FORSYTHE J W, VAN HEUKELEM W F. Cephalopod life cycles// BOYLE P R. Volume Ⅱ: Comparative Reviews. Growth. London: Academic Press, 1987: 135-156.
|
| [34] |
刘赫威, 余为, 陈新军, 等. 南极海冰变动对西南大西洋阿根廷滑柔鱼资源丰度及空间分布的影响[J]. 水产学报, 2021, 45(2): 187-199. LIU H W, YU W, CHEN X J, et al. Influence of Antarctic sea ice variation on abundance and spatial distribution of Argentine shortfin squid Illex argentinus in the southwest Atlantic Ocean[J]. Journal of Fisheries of China, 2021, 45(2): 187-199. |
| [35] |
MOLTSCHANIWSKYJ N A, MARTINEZ P. Effect of temperature and food levels on the growth and condition of juvenile Sepia elliptica (Hoyle 1885): an experimental approach[J]. Journal of Experimental Marine Biology and Ecology, 1998, 229(2): 289-302. DOI:10.1016/S0022-0981(98)00058-6 |
| [36] |
PECL G T, MOLTSCHANIWSKYJ N A. Life history of a short-lived squid (Sepioteuthis australis): resource allocation as a function of size, growth, maturation, and hatching season[J]. ICES Journal of Marine Science, 2006, 63(6): 995-1004. DOI:10.1016/j.icesjms.2006.04.007 |
| [37] |
王峥, 刘长琳, 翟介明, 等. 莱氏拟乌贼缠卵腺的显微与超微结构[J]. 动物学杂志, 2021, 56(1): 80-87. WANG Z, LIU C L, ZHAI J M, et al. Microstructure and ultrastructure of the nidamental gland of Sepioteuthis lessoniana[J]. Chinese Journal of Zoology, 2021, 56(1): 80-87. |
| [38] |
王峥, 刘长琳, 翟介明, 等. 莱氏拟乌贼成体副缠卵腺超显微结构[J]. 上海海洋大学学报, 2021, 30(2): 231-238. WANG Z, LIU C L, ZHAI J M, et al. Ultrastructure of the accessory nidamental gland of adult Sepioteuthis lessoniana[J]. Journal of Shanghai Ocean University, 2021, 30(2): 231-238. |
| [39] |
LACOUE-LABARTHE T, MARTIN S, OBERHANSLI F, et al. Effects of increased pCO(2) and temperature on trace element (Ag, Cd and Zn) bioaccumulation in the eggs of the common cuttlefish, Sepia officinalis[J]. Biogeosciences, 2009, 6(11): 2561-2573. DOI:10.5194/bg-6-2561-2009 |
| [40] |
CHEN C S, HAUNG W B, CHIU T S. Different spatiotemporal distribution of Argentine short-finned squid (Illex argentinus) in the Southwest Atlantic during high-abundance year and its relationship to sea water temperature changes[J]. Zoological Studies, 2007, 46(3): 362-374. |
| [41] |
林东明, 韩飞, 朱凯, 等. 孵化季节对阿根廷滑柔鱼生长发育的影响[J]. 上海海洋大学学报, 2020, 29(3): 374-384. LIN D M, HAN F, ZHU K, et al. The effects of hatching season on the growth and development in Illex argentinus[J]. Journal of Shanghai Ocean University, 2020, 29(3): 374-384. |
| [42] |
臧娜, 连晋欣, 陈新军, 等. 阿根廷滑柔鱼年间生长及体征变化[J]. 水生生物学报, 2021, 45(4): 906-916. ZANG N, LIAN J X, CHEN X J, et al. The yearly growth and body condition of Argentine shortfin squid, Illex argentinus[J]. Acta Hydrobiologica Sinica, 2021, 45(4): 906-916. |
| [43] |
ANDERSON C I H, RODHOUSE P G. Life cycles, oceanography and variability: ommastrephid squid in variable oceanographic environments[J]. Fisheries Research, 2001, 54(1): 133-143. DOI:10.1016/S0165-7836(01)00378-2 |
| [44] |
CHIU T Y, CHIU T S, CHEN C S. Movement patterns determine the availability of Argentine shortfin squid Illex argentinus to fisheries[J]. Fisheries Research, 2017(193): 71-80. |
| [45] |
SANTOS R A D, HAIMOVICI M. Reproductive biology of winter-spring spawners of Illex argentinus (Cephalopoda: Ommastrephidae) off Southern Brazil[J]. Scientia Marina, 1997, 61(1): 53-64. |
| [46] |
MOUAT B, COLLINS M A, POMPERT J. Patterns in the diet of Illex argentinus (Cephalopoda: Ommastrephidae) from the Falkland Islands jigging fishery[J]. Fisheries Research (Amsterdam), 2001, 52(1-2): 41-49. DOI:10.1016/S0165-7836(01)00229-6 |
| [47] |
CRESPI-ABRIL, TRIVELLINI. Diet of spring and summer spawning groups of Illex argentinus inhabiting coastal waters in San Matias Gulf (northern Patagonia, Argentina)[J]. Aquatic Biology, 2011, 14(1): 99-103. DOI:10.3354/ab00386 |
| [48] |
SIEIRO P, OTERO J, AUBOURG S P. Biochemical composition and energy strategy along the reproductive cycle of female Octopus vulgaris in Galician waters (NW Spain)[J]. Frontiers in Physiology, 2020(11): 760-760. |
| [49] |
CRESPI-ABRIL A C, BARÓN P J. Revision of the population structuring of Illex argentinus (Castellanos, 1960) and a new interpretation based on modelling the spatio-temporal environmental suitability for spawning and nursery[J]. Fisheries Oceanography, 2012, 21(2-3): 199-214. DOI:10.1111/j.1365-2419.2012.00615.x |
| [50] |
JACKSON G D, DOMRIER M L. The effects of an extraordinary El Niño / La Niña event on the size and growth of the squid Loligo opalescens off Southern California[J]. Marine Biology, 2003, 142(5): 925-935. DOI:10.1007/s00227-002-1005-4 |
2. Key Laboratory of Sustainable Exploitation of Oceanic Fishery Resources, Ministry of Education, Shanghai 201306, China;
3. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
4. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


