芳香烃受体(Aryl hydrocarbon receptor,AhR)是配体激活的核转录因子,属于螺旋-环-螺旋(Helix-loop-helix,HLH)超家族中bHLH-PAS(Period-Aryl hydrocarbon receptor nuclear translocator Single Minded,Pre-Arnt-Sim)亚家族成员[1],在动物体内具有广泛的生物学和毒理学效应[2-3]。PAS-bHLH蛋白是控制适应性免疫反应中的转录调节因子,还参与应答神经发生、血管化、昼夜节律、新陈代谢和对缺氧的应急反应[4]。研究[5-8]表明,AhR与其他信号通路的蛋白质相互作用,其中包括核因子-κB(NF-κB)、信号传导及转录激活蛋白(STATs)、原癌基因(c-Maf)或β-连环蛋白(β-catenin)等,参与信号通路的调控。一些AhR的配体已得到鉴定,如环境污染物TCDD(2,3,7,8-tetrachlorodibenzo-p-dioxin)和内源性芳香烃受体激动剂(6-Formylindolo[3, 2-b]carbazole,FICZ)被证实是AhR的高亲和力配体。
AhR起源于6亿多年前,无脊椎动物AhR缺乏与卤代和非卤代芳香烃的高亲和力,仅在器官发育中发挥作用,这也是脊椎和无脊椎动物之间AhR的根本区别[9]。在动物进化过程中,ahr基因在早期脊椎动物进化和特定脊椎动物谱系不断复制,导致每个物种存在1~5个ahr基因[10]。哺乳动物只有1个ahr基因,而大多数鱼类有多个ahr基因,这可能是由于软骨鱼类和硬骨鱼类在谱系分化之前串联基因复制导致出现2个ahr分支,即ahr1和ahr2 [11]。此外,由于真骨鱼类特有的全基因组复制事件,真骨鱼类存在更多拷贝,如ahr1a、ahr2a和ahr1b、ahr2b [12]。系统进化分析表明,鱼类ahr1是哺乳动物中ahr的同源基因。目前ahr已在斑马鱼(Danio rerio)[13]、底鳉(Fundulus heteroclitus)[14]、真鲷(Pagrus major)[15]、大西洋鲑(Salmo salar)[16]、青鳉(Oryzias latipes)[17]、红鳍东方鲀(Takifugu rubripes)[18]和大西洋小鳕(Microgadus tomcod)[19]中报道。
T细胞是适应性免疫系统的重要组成部分。初始T细胞在抗原呈递细胞(Antigen presenting cells,APCs)及其共刺激信号激活后进行分化。有研究[20-22]表明,AhR配体能够促进Th17细胞的生成和诱导性Treg细胞、自然Treg细胞和调节性Treg1细胞的增殖。AhR促使Th17细胞分泌IL-22 [21]。在诱导的自身免疫模型中,持续暴露于容易降解的AhR配体(TCDD或FICZ)可以缓解疾病的恶化[23]。AhR参与调控朗格汉斯细胞成熟和功能[24]。ahr在大多数上皮细胞中高量表达[25],对皮肤角质形成细胞的紫外线(UV)B应激反应[26],以及肠道、皮肤、肺和生殖器上皮细胞抵御有害化学物质至关重要。目前有关鱼类AhR的研究都聚焦在AhR2的功能和TCDD毒性的机制上[27],而对AhR1功能的研究尚不深入。最初研究[11]认为AhR1a不具有功能。在斑马鱼中,TCDD诱导的毒性和激活Cyp1a活性似乎不需要AhR1a参与[27]。最近研究[28]发现,敲降ahr1a会降低斑马鱼Cyp1a在胚胎发育过程中的表达。研究[29]表明,斜带石斑鱼(Epinephelus coioides)受到致病性沙门氏气单胞菌(Aeromonas salmonicida)感染后,ahr1在脾脏、肠道和巨噬细胞中被一种未知配体激活,同时,在脾、肠和巨噬细胞中ahr1a和ahr1b表达量显著升高,而ahr2仅在肠中升高,提示ahr1a和ahr1b主要参与免疫应答反应。此外,AhR抑制剂3′,4′-DMF和沉默ahr1a或ahr1b表达会抑制由SRW-OG1感染诱导的il-1β和il-8的升高。这些结果表明: AhR1a在免疫中可能具有重要作用,但具体机制尚不清楚。
草鱼是我国重要的淡水养殖经济鱼类,鉴定其免疫相关基因对草鱼的健康养殖具有重要意义。本研究克隆了草鱼ahr1a并分析其在健康草鱼组织中的表达,以及脂多糖(Lipopolysaccride,LPS)、柱状黄杆菌(Flavobacterium columnare)、草鱼呼肠孤病毒(Reovirus of grass carp,GCRV)、IL-1β重组蛋白对草鱼ahr1a的影响,为进一步研究硬骨鱼类AhR1a免疫相关功能奠定基础。
1 材料与方法 1.1 实验动物本实验所用健康草鱼(120±10)g购自上海海洋大学滨海养殖基地。实验前在(25±3)℃环境下暂养2周。实验操作前用间氨基苯甲酸已脂甲磺酸盐MS-222(100 mg/mL,Sigma-Aldrich)对实验草鱼进行麻醉。所有实验严格遵守上海市有关动物工作管理法规,并获得上海海洋大学实验动物伦理委员会的审核批准(SHOU-DW-2021-027)。
1.2 菌株和毒株大肠杆菌DH5α感受态细胞购自Promega公司。G4株柱状黄杆菌由中国科学院水生生物研究所谢海霞老师提供。Ⅱ型草鱼呼肠孤病毒(GCRV-Ⅱ)由中国科学院武汉病毒研究所方勤研究员提供。
1.3 草鱼总RNA提取以及成鱼组织中的表达分析用MS-222对草鱼进行麻醉,剪断鳃后脊椎骨,乙醇擦拭鱼体表面后,切开鳃弓放血,用无菌剪刀沿着尾鳍解剖鱼体,将肠、鳃、肾脏、肝脏、头肾、胸腺、脾脏、皮肤、脑组织分别放入预先准备的2 mL无RNA酶离心管中。用TRIzolⓇ Reagent(Invitrogen)提取总RNA,具体方法参照JIA等[30]。严格按照HifairⓇ 1st Strand cDNA Synthesis Kit说明书制备qPCR模板,利用实时荧光定量PCR(RT-qPCR)检测草鱼ahr1a基因在各个组织中的表达情况。
1.4 草鱼ahr1a克隆以及序列分析用Hifair Ⅱ 1st Strand cDNA Synthesis Kit(翌圣)合成cDNA,具体方法参照JIA等[30]。从草鱼基因组数据库(http://www.ncgr.ac.cn/grasscarp/)检索到ahr1a基因部分序列,用表 1所列引物以合成的cDNA第一链为模板进行该基因保守片段的扩增。扩增体系为50 μL:PrimeSTARⓇMax 25 μL(TaKaRa),ddH2O 22 μL,上下游引物(F/R)各1 μL,cDNA 1 μL;PCR反应程序:95 ℃预变性3 min;95 ℃变性10 s,58 ℃退火30 s,72 ℃延伸120 s,共35个循环;72 ℃延伸7 min。扩增产物经琼脂糖凝胶电泳后,利用Gel Extraction Kit(OMEGA)对特异性条带进行胶回收。回收产物连接至pMDTM-19-Vector(TaKaRa)并转化至大肠杆菌DH5α感受态细胞,经PCR筛选获得阳性菌落,菌液直接测序(苏州金唯智生物科技有限公司)。根据获得的保守片段设计特异性引物(表 1)快速扩增cDNA(RACE)5′和3′端未知序列。最后,用单对引物扩增全长编码序列,具体方法参照JIA等[30]。通过NCBI数据库中的ORF Finder进行开放阅读框的预测,以及BLAST程序进行序列的同源性搜索和比对。利用ProtParam tool(https://web.expasy.org/protparam/)预测蛋白质相对分子质量和等电点,利用SMART(http://smart.embl-heidelberg.de/)预测结构域;序列比对利用Clustal X软件,ahr1a同源基因数据均来自于NCBI数据库(https://www.ncbi.nlm.nih.gov/);相似性与一致性比较利用网站https://www.ebi.ac.uk/Tools/psa/emboss_needle/进行计算,斑马鱼、斑点雀鳝(Lepisosteus oculatus)、小斑猫鲨(Scyliorhinus canicular)和人(Homo sapiens)的基因组数据均来源于NCBI;进化树构建利用MEGA X软件。

|
表 1 基因引物信息 Tab.1 Information of gene primers |
肾和脾是鱼类的重要中枢免疫组织[31],含有多种类型、大小不一的免疫细胞,因此将草鱼脾和肾组织作为实验对象。
将32条健康的草鱼随机分为两组,每组16条,实验组腹腔注射100 μL柱状黄杆菌(1×108 CFU/mL),对照组腹腔注射等量的PBS,第12、24、48、72小时从每组鱼的脾肾组织中提取总RNA,并反转成cDNA模板备用。
将32条健康草鱼随机分为两组,每组16条,实验组注射200 μL GCRV-Ⅱ病毒(病毒滴度为1×107 TCID50/mL),对照组腹腔注射等量DMEM培养基,第1、3、7、14天从每组鱼的脾肾组织中提取总RNA,并反转成cDNA模板备用。具体方法参照JIA等[30]。
1.6 IL-1β重组蛋白的表达及纯化从美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)获取草鱼IL-1β的序列(登录号:JX014320.1),利用特异性引物(表 1)扩增草鱼IL-1β(从F130-K270)预测成熟肽,用限制性核酸内切酶(Nco Ⅰ和Bam H Ⅰ)分别酶切表达载体质粒和目的片段,将目的片段连接至pET-21d载体。将连接后的产物转化至大肠杆菌DH5α感受态细胞中,挑取含目的片段的单阳性菌落,测序验证后进行质粒提取,将重组表达质粒转化至大肠杆菌Rosseta(DE3)中,挑取单克隆菌落接种至50 mL LB培养基中,37 ℃培养过夜,然后转入5 L LB培养基中,培养约2 h至OD600值达到0.6~0.8时加入1 mmol/L IPTG,并将培养温度调整至16 ℃培养6 h。4 000 r/min离心20 min收集菌体,再加入PBS重悬,用800 bar高压破碎5 min,收集细菌破碎产物,4 ℃条件下8 000 r/min离心10 min,收集上清。用PBS平衡亲和柱(Ni-NTA柱),将收集的破碎菌体上清加入亲和柱,之后再加入不同浓度(30 mmol/L、60 mmol/L和500 mmol/L)咪唑洗脱并收集洗脱液,洗脱后用10 mL ddH2O清洗亲和柱,最后用20%乙醇封柱,具体步骤参考LI等[31]。
1.7 LPS和重组IL-1β刺激草鱼头肾原代细胞实验参照1.3节取头肾组织,置入含1%双抗的PBS中清洗。将头肾组织转移至70 μmol/L的尼龙滤网上,研磨组织并不断滴加Pushing Buffer(L15+2%FBS+0.1%肝素)。将细胞悬液转移至51%Percoll,在4 ℃、加速度为1、减速制动为0条件下400g离心30 min。吸取白色中间层细胞放入含有Pushing Buffer(L15+0.1%FBS+0.1%肝素)的离心管中。4 ℃,400g离心10 min,弃上清,重复1次。将细胞重悬于DMEM/RPMI培养基中,计数后将1×107细胞转于6孔板中,置于28 ℃、5%CO2培养箱中稳定4 h,加入50 μg/mL LPS或500 ng/mL IL-1β重组蛋白,对照组分别加入等体积PBS(LPS对照组)或等体积100 ℃变性5 min的重组蛋白(IL-1β对照组)。12 h后,收集悬浮细胞和贴壁细胞进行总RNA的提取以及cDNA的制备,具体方法参照1.3节。
1.8 统计分析采用SPSS 17.0软件对RT-qPCR生成的数据进行统计分析。用延伸因子1 α (Elongation factor, ef1α)作为内参,计算靶基因的相当表达水平。采用单因素方差分析,进行LSD后检验。P < 0.05和P < 0.01分别表示实验组与对照组差异显著和差异极显著[32],并用GraphPad Prism 5作图。
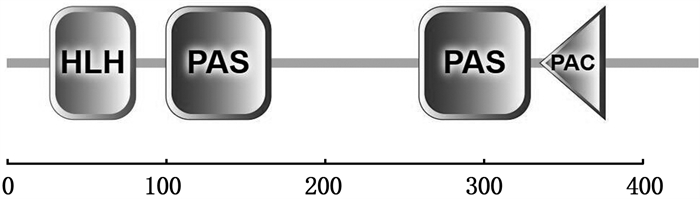
2 结果 2.1 草鱼ahr1a基因克隆及序列分析通过分析草鱼基因组获得草鱼ahr1a基因编码序列,并对此序列测序验证。草鱼ahr1a基因cDNA全长为2 893 bp(图 1),包括5′非编码区(Untranslated region,UTR)292 bp、3′非编码区57 bp和开放阅读框(Open reading frame,ORF)2 544 bp,编码847个氨基酸。3′-UTR有典型的多聚腺苷酸加尾信号“AATAAA”基序和Poly A重复序列。对AhR1a蛋白结构域进行分析(图 2),发现其具有HLH超家族中bHLH-PAS亚家族典型的结构域,即bHLH(N27-N81)、PAS-A(P100-N166)和PAS-B(L259-R329)。草鱼AhR1a的预测分子量为95.0 ku,理论等电点为6.14。

|
下划线为翻译起始和终止密码子,双下划线为多聚腺苷酸信号基序(AATAAA)。 Underlined are the translation initiation and stop codons. Double-underlined is poly(A) adenylation signal site. 图 1 草鱼ahr1a基因的cDNA序列及预测的氨基酸序列 Fig. 1 cDNA sequence and predicted amino acid sequence of ahr1a in grass carp |
|
HLH.螺旋-环-螺旋结构;PAS.周期芳基烃受体核转运子;PAC. 临近PAS基序C端的基序。 HLH.helix-loop-helix; PAS.Period-Aryl hydrocarbon receptor nuclear translocator Single Minded, Pre-Arnt-Sim; PAC. Motif C-terminal to PAS motif. 图 2 草鱼AhR1a结构域预测 Fig. 2 Predicted structural domains of grass carp AhR1a |
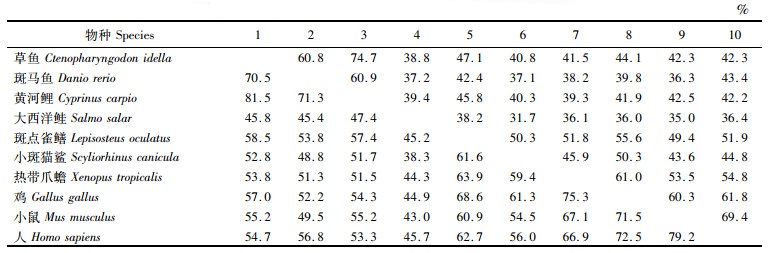
草鱼AhR1a的氨基酸序列与其他物种的相似性和一致性比对结果显示(表 2),草鱼AhR1a与黄河鲤(Cyprinus carpio)相似性与一致性最高,分别为81.5%和74.7%,与其他物种的AhR1a(AhR)相似性和一致性也达到了45.4%和38.8%。
|
表 2 草鱼AhR1a与其他物种AhR1a或AhR基于氨基酸序列比对的相似性(左下)和一致性(右上) Tab.2 Similarity (bottom left) and identity (top right) based on amino acid sequence alignment of grass carp AhR1a and AhR1a or AhR of other animals |
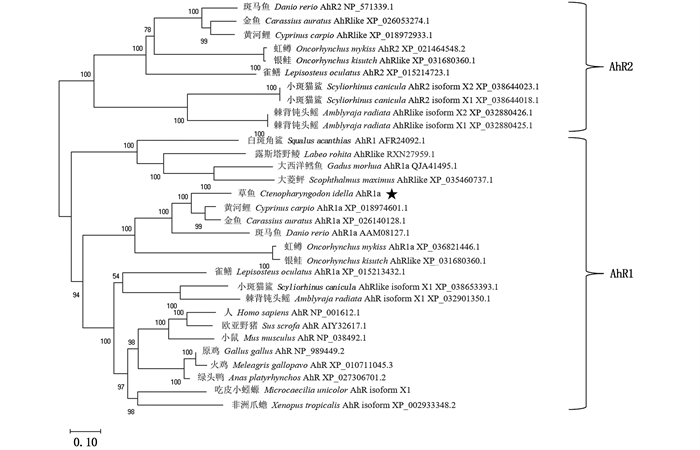
利用Clustal X软件和MEGA X软件构建系统进化树(图 3)。结果表明:AhR1a氨基酸N端区段(即PAS-bHLH功能域)较为保守,而C端序列则同源性较低。系统发育进化分析显示,草鱼AhR1a与黄河鲤、金鱼(Carassius auratus)、斑马鱼、虹鳟(Oncorhynchus mykiss)、大西洋鲑的AhR1a聚在一起,自展值高达100%,与其他物种之间也符合传统分类学的进化关系。
|
图 3 草鱼与其他脊柱动物AhR系统进化树分析 Fig. 3 Phylogenetic tree analysis of grass carp and other vertebrate AhR molecules |
根据草鱼ahr1a基因cDNA与DNA比对后绘制ahr1a基因结构图(图 4)。结果显示,草鱼ahr1a含有11个外显子和10个内含子,与斑点雀鳝、小斑猫鲨和人的ahr1a基因结构一致,而斑马鱼仅含有10个外显子和9个内含子。

|
图中白色方框表示外显子,横线表示内含子,外显子和内含子的大小用bp表示。内含子和外显子大小与图中方框或横线的长度不成比例。 In the figure, the white squares boxes exons, the horizontal lines represent introns, and the size of exons and introns is represented by bp. That the size of intron and exon is not proportional to the length of the box or horizontal line in the figure. 图 4 ahr1a/ahr基因结构 Fig. 4 Structure of ahr1a/ahr genes |
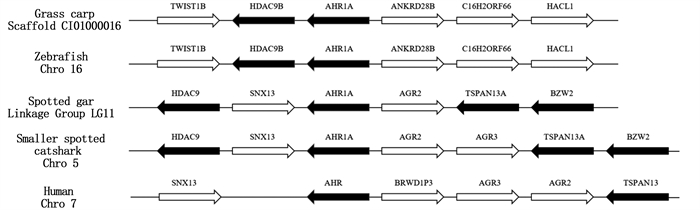
共线性分析发现(图 5),草鱼ahr1a基因和hdac9b和ankrd28b共定位在Scaffold CI01000016上,与斑马鱼Chro 16中的基因座同源,然而,雀鳝和小斑猫鲨中ahr1a基因的上游仅发现hdac9同源基因,下游并未找到同源基因,人和草鱼ahr1a基因的共线性不保守,在其上下游未找到同源基因。
|
图 5 ahr1a/ahr基因共线性分析 Fig. 5 Synteny analysis of ahr1a/ahr genes |
为检测ahr1a基因在草鱼各个组织中的表达情况,本研究对其在肠、鳃、肾脏、肝脏、头肾、胸腺、脾脏、皮肤和脑中的表达进行RT-qPCR分析。结果(图 6)显示,草鱼ahr1a在所检测的组织中均有表达,其中,肠和鳃中表达量最高,其余组织中ahr1a表达量相近。
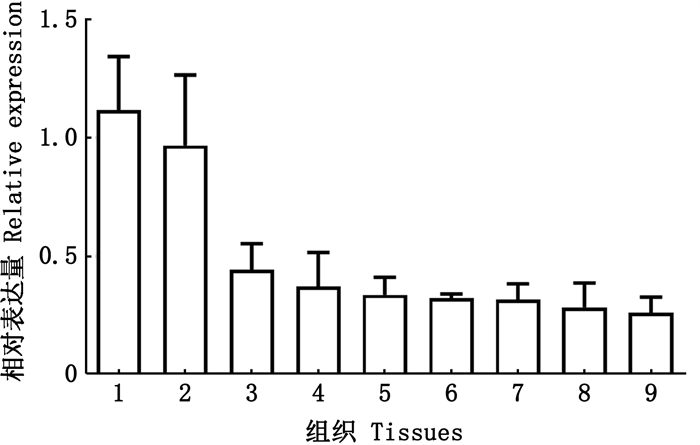
|
1.肠;2.鳃;3.肾脏;4.肝脏;5.头肾;6.胸腺;7.脾脏;8.皮肤;9.脑。 1.Intestine; 2.Gill; 3.Kidney; 4.Liver; 5.Head kidney; 6.Thymus; 7.Spleen; 8.Skin; 9.Brain. 图 6 草鱼ahr1a的组织表达(n=4) Fig. 6 Expression of grass carp ahr1a in tissues (n=4) |
利用腹腔注射柱状黄杆菌感染草鱼,对照组注射PBS,在12、24、48、72 h后检测ahr1a在头肾和脾脏中的表达情况(图 7)。与对照组相比:在头肾中,注射柱状黄杆菌12和24 h后ahr1a表达量呈现下调,在48 h后恢复到本底水平;在脾脏中,ahr1a在24和48 h表达量显著下降,72 h表达量与对照组相比无明显变化。
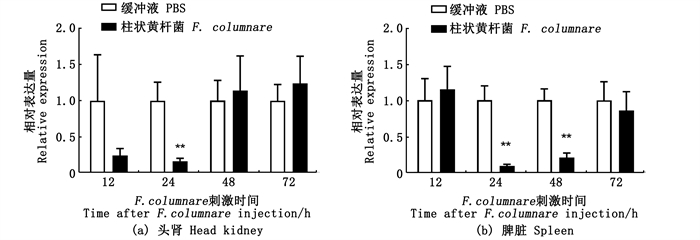
|
**.P < 0.01,n=4。 图 7 草鱼在感染柱状黄杆菌后头肾和脾脏中ahr1a基因mRNA表达 Fig. 7 mRNA expression of ahr1a in grass carp head kidney and spleen after infection with F. columnare |
GCRV-Ⅱ是草鱼出血病的流行致病毒株。为研究ahr1a在病毒感染过程中的表达,本研究利用腹腔注射方式对草鱼进行GCRV-Ⅱ攻毒实验。结果显示(图 8),GCRV-Ⅱ感染后第7天ahr1a基因在头肾中上调表达但与对照组无显著差异,在第14天呈现显著下调;脾脏中ahr1a表达水平除了在第7天略有上调,其余时间点并无明显变化。
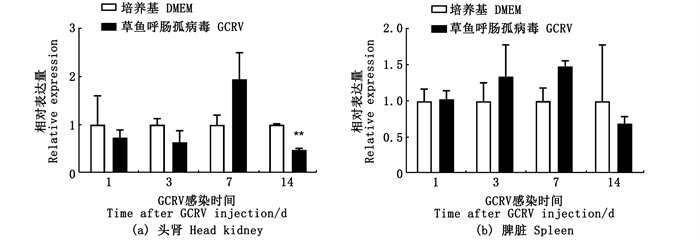
|
**.P < 0.01,n=4。 图 8 草鱼在感染GCRV-Ⅱ后头肾和脾脏中ahr1a mRNA的表达 Fig. 8 mRNA expression of ahr1a in grass carp head kidney and spleen after infection with GCRV-Ⅱ |
为明确细菌病原相关分子模式(Pathogen associated molecular pattern,PAMP)对草鱼ahr1a的表达影响,采用Percoll从草鱼头肾中分离白细胞,用50 μg/mL LPS刺激原代头肾白细胞1、6、12、24 h(图 9)。RT-qPCR结果表明,ahr1a表达水平在LPS刺激6 h后明显下降,12、24 h恢复到对照组水平。
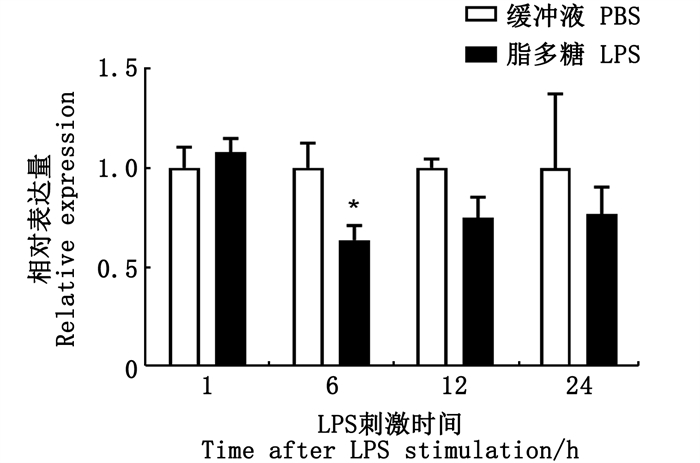
|
*.P < 0.05。 图 9 LPS刺激草鱼头肾原代白细胞后ahr1a mRNA表达(n=4) Fig. 9 mRNA expression of grass carp ahr1a in the primary head kidney leukocytes after LPS stimulation(n=4) |
IL-1β是主要促炎症细胞因子,为了探究IL-1β对ahr1a表达水平的影响,本研究在大肠杆菌中表达并纯化了IL-1β成熟肽(F130-K270)重组蛋白(图 10),SDS-PAGE显示,考马斯亮蓝染色检测到单一条带,表明IL-1β重组蛋白纯度高,其相对分子质量约为15 ku,跟理论值15.49 ku吻合。用IL-1β重组蛋白(500 ng/mL)刺激草鱼原代头肾白细胞6和12 h,用RT-qPCR分析il-1β、il-8、ahr1a表达情况。结果(图 11)表明,il-1β和il-8表达水平显著上调,表明IL-1β重组蛋白具有生物活性,而且下调ahr1a表达。
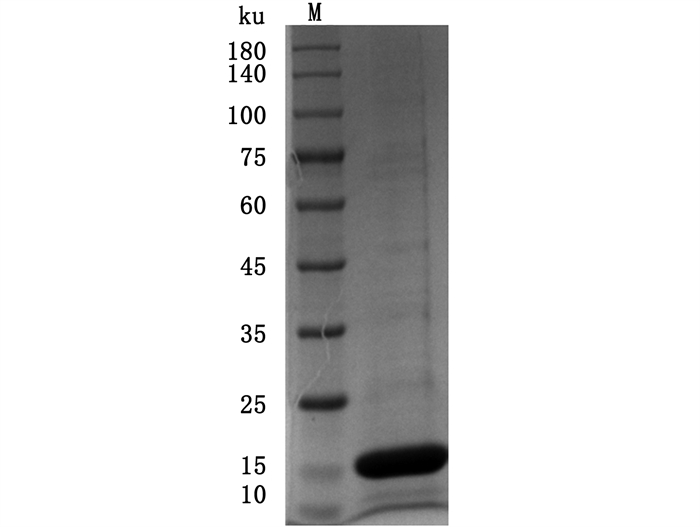
|
图 10 草鱼IL-1β重组蛋白SDS-PAGE图 Fig. 10 SDS-PAGE of grass carp recombinant IL-1β |
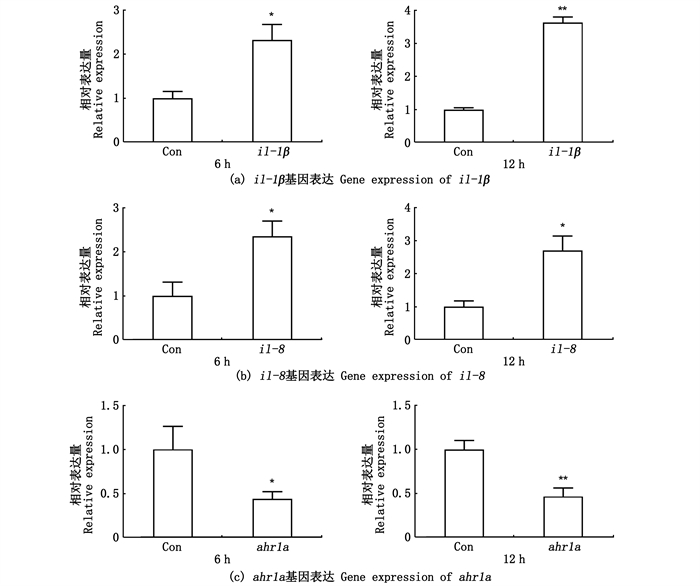
|
Con.高温变性的IL-1β重组蛋白;*.P < 0.05,**.P < 0.01,n=4。 Con. Heat-denatured recombinant IL-1β; *.P < 0.05, **.P < 0.01, n=4. 图 11 草鱼IL-1β重组蛋白刺激草鱼原代头肾白细胞后il-1β、il-8和ahr1a mRNA表达 Fig. 11 mRNA expression of grass carp il-1β, il-8 and ahr1a in the primary head kidney leukocytes after stimulation with recombinant IL-1β |
鱼类对各种芳香烃化合物等有机环境污染物特别敏感,长期暴露于芳香烃化合物中会严重影响机体功能并最终导致死亡[33]。因此,芳香烃受体对鱼类个体生长、发育和免疫系统的稳态维持发挥至关重要的作用。
对玲珑星鲨(Mustelus canis)[34]、底鳉[14]、斑马鱼[35]的研究表明,鱼类存在两种不同的ahr基因谱系(ahr1和ahr2)。哺乳动物含有1个ahr基因,与鱼类ahr1进化关系较近。本研究克隆并分析了草鱼ahr1a基因,发现其蛋白序列包含哺乳动物中AhR同源物的特征基序,包括典型的螺旋-环-螺旋(bHLH)和PER-ARNT-SIM(PAS)结构域,其C端与其他物种的AhR相比具有极低的序列相似性。此外,草鱼AhR1a不具有哺乳动物中特有的1个AhR转录活性所必须的反式激活结构域,这与先前对鱼类AhR的研究[36]结果一致。系统进化树分析表明,草鱼AhR1a与黄河鲤、金鱼AhR1a聚为一支,表明AhR1a在鲤科鱼类中具有较高的保守性。草鱼ahr1a基因含有11个外显子和10个内含子,而斑马鱼仅含有10个外显子和9个内含子,提示ahr基因家族的外显子数量并不固定,可能由两个原因造成:一是AhR之间氨基酸序列C末端保守性极低;二是真骨鱼类经历特有的第3次全基因组复制事件[37-38],因此ahr基因家族的基因结构存在差异也就不足为奇了。共线性分析表明,斑马鱼和草鱼ahr1a基因座十分相似,而全骨鱼类中的典型物种斑点雀鳝基因座更偏向于哺乳类。
鱼类中ahr1和ahr2基因在各种组织中呈差异表达,例如,在斜带石斑鱼[29]中,ahr1在脾脏、肠和巨噬细胞中高量表达,而ahr2表达仅局限于肠道,暗示不同的ahr家族成员在不同的组织中可能发挥不同的作用。本研究对健康草鱼9种组织中ahr1a的表达进行了RT-qPCR分析。结果显示,草鱼ahr1a在肠、鳃、肾脏中表达量最高(图 6)。因此可以推测,ahr1a可能与鱼类免疫系统发生具有潜在关联,参与免疫细胞的增殖和分化。柱状黄杆菌是黄杆菌科中一种常见的鱼类致病菌[39]。草鱼呼肠孤病毒能够引发草鱼病毒性出血病,是危害最大的草鱼传染性病毒病原[40]。本研究用柱状黄杆菌感染草鱼,发现在细菌感染后,头肾(6、12 h)和脾脏(24、48 h)中的ahr1a表达均出现下调(图 7),提示AhR参与宿主应答细菌的早期免疫反应,尤其是细菌介导的炎症反应。有研究[21]表明AhR是Th17细胞分泌IL-22所必需的,AhR通过与许多胞内转录因子(如NF-κB、STATs等)进行互作[5],激活下游信号通路,诱导IL-22的合成和分泌。此外,AhR的激活亦会抑制过度炎症反应[23],减少过度炎症反应诱发的机体损伤。本研究发现,GCRV-Ⅱ感染后头肾中和脾脏中的ahr1a表达没有明显变化(除感染14 d头肾中下调),ahr1a是否参与宿主应答病毒感染的免疫反应仍不明确。
有研究[41]推测,AhR可能是细菌病原体的模式识别受体。LPS为革兰氏阴性菌分泌的内毒素,是典型的细菌病原体相关分子模式,能够激活促炎基因的表达[42]。用LPS刺激草鱼原代头肾白细胞,发现6和12 h后ahr1a呈下调表达(图 9),此外,IL-1β重组蛋白也下调ahr1a表达(图 11),LPS和IL-1β均能激活促炎因子的表达[43],这暗示ahr1a在白细胞中的表达受到细菌PAMP和促炎细胞因子的抑制。然而,在斜带石斑鱼中,沉默ahr1a会显著降低细菌感染诱导的il-1β和il-8表达水平[29],这可能是与炎症反应的强度相关。AhR1a调控鱼类炎症反应的作用机制尚待进一步研究。
综上所述,本研究克隆分析了草鱼ahr1a基因并对其mRNA表达情况进行了研究。结果显示,草鱼AhR1a具有保守的功能结构域。ahr1a在健康草鱼中成常量表达,在细菌感染后表达下调,病毒感染后变化不明显。细胞因子IL-1β抑制草鱼头肾原代细胞中ahr1a的表达,暗示其参与炎症反应的调控,但其具体调控机制尚不明确。研究结果为进一步明晰硬骨鱼类ahr1a的功能提供了一定的参考价值。
| [1] |
殷樱, 贾功伟. 芳香烃受体在细胞免疫调节中的研究进展[J]. 免疫学杂志, 2012, 28(11): 1002-1004, 1008. YIN Y, JIA G W. The aryl hydrocarbon receptor in cellular immunoregulation[J]. Immunological Journal, 2012, 28(11): 1002-1004, 1008. DOI:10.3969/j.issn.1000-484X.2012.11.009 |
| [2] |
ABEL J, HAARMANN-STEMMANN T. An introduction to the molecular basics of aryl hydrocarbon receptor biology[J]. Biological Chemistry, 2010, 391(11): 1235-1248. |
| [3] |
SAFE S, LEE S O, JIN U H. Role of the aryl hydrocarbon receptor in carcinogenesis and potential as a drug target[J]. Toxicological Sciences, 2013, 135(1): 1-16. DOI:10.1093/toxsci/kft128 |
| [4] |
ESSER C, RANNUG A, STOCKINGER B. The aryl hydrocarbon receptor in immunity[J]. Trends in Immunology, 2009, 30(9): 447-454. DOI:10.1016/j.it.2009.06.005 |
| [5] |
KIM D W, GAZOURIAN L, QUADRI S A, et al. The RelA NF-κB subunit and the aryl hydrocarbon receptor (AhR) cooperate to transactivate the c-myc promoter in mammary cells[J]. Oncogene, 2000, 19(48): 5498-5506. DOI:10.1038/sj.onc.1203945 |
| [6] |
KIMURA A, NAKA T, NOHARA K, et al. Aryl hydrocarbon receptor regulates Stat1 activation and participates in the development of Th17 cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(28): 9721-9726. DOI:10.1073/pnas.0804231105 |
| [7] |
VOGEL C F A, SCIULLO E, PARK S, et al. Dioxin increases C/EBPβ transcription by activating cAMP/protein kinase A[J]. Journal of Biological Chemistry, 2004, 279(10): 8886-8894. DOI:10.1074/jbc.M310190200 |
| [8] |
PROCHÁZKOVÁJ, KABáTKOVÁ M, BRYJA V, et al. The interplay of the aryl hydrocarbon receptor and β-catenin alters both AhR-dependent transcription and Wnt/β-catenin signaling in liver progenitors[J]. Toxicological Sciences, 2011, 122(2): 349-360. DOI:10.1093/toxsci/kfr129 |
| [9] |
HAHN M E. Aryl hydrocarbon receptors: diversity and evolution[J]. Chemico-Biological Interactions, 2002, 141(1/2): 131-160. |
| [10] |
HAHN M E, KARCHNER S I, MERSON R R. Diversity as opportunity: insights from 600 million years of AHR evolution[J]. Current Opinion in Toxicology, 2017, 2: 58-71. DOI:10.1016/j.cotox.2017.02.003 |
| [11] |
KARCHNER S I, FRANKS D G, HAHN M E. AHR1B, a new functional aryl hydrocarbon receptor in zebrafish: tandem arrangement of ahr1b and ahr2 genes[J]. Biochemical Journal, 2005, 392: 153-161. DOI:10.1042/BJ20050713 |
| [12] |
GLASAUER S M K, NEUHAUSS S C F. Whole-genome duplication in teleost fishes and its evolutionary consequences[J]. Molecular Genetics & Genomics, 2014, 289(6): 1045-1060. |
| [13] |
HAHN M E, KARCHNER S I. Evolutionary conservation of the vertebrate Ah (dioxin) receptor: amplification and sequencing of the PAS domain of a teleost Ah receptor cDNA[J]. Biochemical Journal, 1995, 310(2): 383-387. DOI:10.1042/bj3100383 |
| [14] |
KARCHNER S I, POWELL W H, HAHN M E. Identification and functional characterization of two highly divergent aryl hydrocarbon receptors (AHR1 and AHR2) in the teleost Fundulus heteroclitus: Evidence for a novel subfamily of ligand-binding basic helix loop helix-Per-ARNT-Sim (bHLH-PAS) factors[J]. Journal of Biological Chemistry, 1999, 274(47): 33814-33824. DOI:10.1074/jbc.274.47.33814 |
| [15] |
YAMAUCHI M, KIM E Y, IWATA H, et al. Molecular characterization of the aryl hydrocarbon receptors (AHR1 and AHR2) from red seabream (Pagrus major)[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2005, 141(2): 177-187. |
| [16] |
HANSSON M C, HAHN M E. Functional properties of the four Atlantic salmon (Salmo salar) aryl hydrocarbon receptor type 2 (AHR2) isoforms[J]. Aquatic Toxicology, 2008, 86(2): 121-130. DOI:10.1016/j.aquatox.2007.10.012 |
| [17] |
HANNO K, ODA S, MITANI H. Effects of dioxin isomers on induction of AhRs and CYP1A1 in early developmental stage embryos of medaka (Oryzias latipes)[J]. Chemosphere, 2010, 78(7): 830-839. DOI:10.1016/j.chemosphere.2009.11.043 |
| [18] |
KARCHNER S, HAHN M. Pufferfish (Fugu rubripes) aryl hydrocarbon receptors: unusually high diversity in a compact genome[J]. Marine Environmental Research, 2004, 58: 139-140. |
| [19] |
ROY N K, WIRGIN I. Characterization of the aromatic hydrocarbon receptor gene and its expression in Atlantic tomcod[J]. Archives of Biochemistry and Biophysics, 1997, 344(2): 373-386. DOI:10.1006/abbi.1997.0238 |
| [20] |
VELDHOEN M, HIROTA K, CHRISTENSEN J, et al. Natural agonists for aryl hydrocarbon receptor in culture medium are essential for optimal differentiation of Th17 T cells[J]. Journal of Experimental Medicine, 2009, 206(1): 43-49. DOI:10.1084/jem.20081438 |
| [21] |
VELDHOEN M, HIROTA K, WESTENDORF A M, et al. The aryl hydrocarbon receptor links TH17-cell-mediated autoimmunity to environmental toxins[J]. Nature, 2008, 453(7191): 106-109. DOI:10.1038/nature06881 |
| [22] |
QUINTANA F J, BASSO A S, IGLESIAS A H, et al. Control of Treg and TH17 cell differentiation by the aryl hydrocarbon receptor[J]. Nature, 2008, 453(7191): 65-71. DOI:10.1038/nature06880 |
| [23] |
DUARTE J H, DI MEGLIO P, HIROTA K, et al. Differential influences of the aryl hydrocarbon receptor on Th17 mediated responses in vitro and in vivo[J]. PLoS One, 2013, 8(11): e79819. |
| [24] |
JUX B, KADOW S, ESSER C. Langerhans cell maturation and contact hypersensitivity are impaired in aryl hydrocarbon receptor-null mice[J]. Journal of Immunology, 2009, 182(11): 6709-6717. |
| [25] |
ESSER C, RANNUG A. The aryl hydrocarbon receptor in barrier organ physiology, immunology, and toxicology[J]. Pharmacological Reviews, 2015, 67(2): 259-279. |
| [26] |
FRAUENSTEIN K, SYDLIK U, TIGGES J, et al. Evidence for a novel anti-apoptotic pathway in human keratinocytes involving the aryl hydrocarbon receptor, E2F1, and checkpoint kinase 1[J]. Cell Death and Differentiation, 2013, 20(10): 1425-1434. |
| [27] |
SOUDER J P, GORELICK D A. Ahr2, but not ahr1a or ahr1b, is required for craniofacial and fin development and TCDD-dependent cardiotoxicity in zebrafish[J]. Toxicological Sciences, 2019, 170(1): 25-44. |
| [28] |
CHLEBOWSKI A C, GARCIA G R, LA DU J K, et al. Mechanistic investigations into the developmental toxicity of nitrated and heterocyclic PAHs[J]. Toxicological Sciences, 2017, 157(1): 246-259. |
| [29] |
HUANG L X, QI W L, ZUO Y F, et al. The immune response of a warm water fish orange-spotted grouper (Epinephelus coioides) infected with a typical cold water bacterial pathogen Aeromonas salmonicida is AhR dependent[J]. Developmental and Comparative Immunology, 2020, 113: 103779. |
| [30] |
JIA Z, WANG J Y, CHEN K Y, et al. Identification and expression analysis of group Ⅱ C-type lectin domain containing receptors in grass carp Ctenopharyngodon idella[J]. Gene, 2021, 789: 145668. |
| [31] |
LI X, YUAN S Y, SUN Z S, et al. Gene identification and functional analysis of peptidoglycan recognition protein from the spotted sea bass (Lateolabrax maculatus)[J]. Fish & Shellfish Immunology, 2020, 106: 1014-1024. |
| [32] |
WANG W, WANG J Y, LEI L N, et al. Characterisation of IL-15 and IL-2Rβ in grass carp: IL-15 upregulates cytokines and transcription factors of type 1 immune response and NK cell activation[J]. Fish & Shellfish Immunology, 2020, 107: 104-117. |
| [33] |
HANSSON M C, WITTZELL H, PERSSON K, et al. Characterization of two distinct aryl hydrocarbon receptor (AhR2) genes in Atlantic salmon (Salmo salar) and evidence for multiple AhR2 gene lineages in salmonid fish[J]. Gene, 2003, 303: 197-206. |
| [34] |
HAHN M E, KARCHNER S I, SHAPIRO M A, et al. Molecular evolution of two vertebrate aryl hydrocarbon (dioxin) receptors (AHR1 and AHR2) and the PAS family[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(25): 13743-13748. |
| [35] |
TANGUAY R L, ABNET C C, HEIDEMAN W, et al. Cloning and characterization of the zebrafish (Danio rerio) aryl hydrocarbon receptor[J]. Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression, 1999, 1444(1): 35-48. |
| [36] |
SHANKAR P, DASGUPTA S, HAHN M E, et al. A review of the functional roles of the zebrafish aryl hydrocarbon receptors[J]. Toxicological Sciences, 2020, 178(2): 215-238. |
| [37] |
HAHN M E, KARCHNER S I, EVANS B R, et al. Unexpected diversity of aryl hydrocarbon receptors in non-mammalian vertebrates: insights from comparative genomics[J]. Journal of Experimental Zoology Part A: Comparative Experimental Biology, 2006, 305(9): 693-706. |
| [38] |
SONG J Y, CASANOVA-NAKAYAMA A, MÖLLER A M, et al. Aryl hydrocarbon receptor signaling is functional in immune cells of rainbow trout (Oncorhynchus mykiss)[J]. International Journal of Molecular Sciences, 2020, 21(17): 6323. |
| [39] |
DONG Y W, FENG L, JIANG W D, et al. Dietary threonine deficiency depressed the disease resistance, immune and physical barriers in the gills of juvenile grass carp (Ctenopharyngodon idella) under infection of Flavobacterium columnare[J]. Fish & Shellfish Immunology, 2018, 72: 161-173. |
| [40] |
盛佳璐, 宗乾坤, 喻飞, 等. 利用原核及真核表达系统体外表达草鱼Ⅱ型呼肠孤病毒外突VP56蛋白的研究[J]. 上海海洋大学学报, 2018, 27(4): 469-476. SHENG J L, ZONG Q K, YU F, et al. Prokaryotic and eukaryotic expression analysis of outer capsid VP56 protein encoded by type Ⅱ reovirus of grass carp[J]. Journal of Shanghai Ocean University, 2018, 27(4): 469-476. |
| [41] |
MOURA-ALVES P, FAÈ K, HOUTHUYS E, et al. AhR sensing of bacterial pigments regulates antibacterial defence[J]. Nature, 2014, 512(7515): 387-392. |
| [42] |
田佳音, 陈康勇, 张畅, 等. 斑马鱼肿瘤坏死因子(tnfα)及其受体(tnfrsf1a)应答细菌和病毒感染的表达[J]. 上海海洋大学学报, 2020, 29(2): 171-179. TIAN J Y, CHEN K Y, ZHANG C, et al. Expression analysis of zebrafish tumor necrosis factor (tnfα) and its receptor (tnfrsf1a) in response to bacterial and viral infections[J]. Journal of Shanghai Ocean University, 2020, 29(2): 171-179. |
| [43] |
姚昀, 刘克海, 胡晓倩. 紫檀茋影响脂多糖诱导巨噬细胞炎症因子的变化[J]. 上海海洋大学学报, 2019, 28(1): 29-36. YAO Y, LIU K H, HU X Q. Effects of pterostilbene on lipopolysaccharide-induced inflammatory cytokine expression in macrophages[J]. Journal of Shanghai Ocean University, 2019, 28(1): 29-36. |
 2023,
Vol. 32
2023,
Vol. 32


