2. 云南省高校高原渔业资源保护与可持续利用重点实验室, 云南 昆明 650201
脯氨酸是精氨酸家族中的一员,它可以在哺乳动物中以组织特异性的方式从精氨酸、鸟氨酸、谷氨酰胺和谷氨酸中合成[1]。特别是动物机体处于应激、受伤、妊娠或产后等状态下,对脯氨酸的需求会急剧增加,导致自身内源性合成脯氨酸不足,往往需要在饮食中提供额外的脯氨酸来满足机体的需要[2-5]。因此,充足的脯氨酸对包括鱼[6-8]在内的许多动物(小鼠[9]、人类[10-11]、猪[12-13]、禽[14-15]、虾[16])最大的生长性能和最佳健康都是至关重要的。有研究[6, 17]指出鱼类缺乏吡咯啉-5-羧酸盐合成酶(P5CS),利用精氨酸合成脯氨酸受阻,导致内源合成的脯氨酸不足,无法满足鱼类最佳生长及饲料利用。许多鱼类对脯氨酸的要求特别高,为了满足最佳生长,必须从饲料中获得足够的脯氨酸,因而常将其归为鱼类的条件性必需氨基酸或功能性氨基酸[17-18]。有研究[19-20]报道,脯氨酸作为一种功能性氨基酸,可以调控动物机体胶原蛋白的合成,促进损伤组织的修复。另有研究[21]表明脯氨酸是细胞内多种生理和生化过程的关键调节因子。除此之外,脯氨酸及其代谢产物吡咯琳-5-羧酸(P5C)可以调控氧化还原反应,清除自由基,增强机体抗压能力[11]。综上所述,脯氨酸在蛋白质合成、代谢、营养、伤口愈合、抗氧化反应、免疫应答等多方面发挥重要作用。
LIN等[22]研究发现饲料中添加脯氨酸可以促进浅色黄姑鱼胶原蛋白沉积。浅色黄姑鱼(Nibea coibor)俗名白奈、金丝,属于鲈形目(Perciformes)石首鱼科(Sciaenidae)黄姑鱼属(Nibea),是石首鱼科中一种主要的产胶鱼类,生产出的“白花胶”被公认为是营养价值很高的补品,也是我国东南沿海地区的一种重要经济鱼类和海水养殖品种[23-24]。然而,目前关于浅色黄姑鱼的饲料开发鲜有研究,制约着养殖业和鱼胶产业的进一步发展。本研究通过饲料中梯度添加脯氨酸,探讨脯氨酸对浅色黄姑鱼生长、体组成及抗氧化性能的影响,分析饲料中脯氨酸最适添加量,以期为浅色黄姑鱼饲料的开发奠定理论基础,促进浅色黄姑鱼养殖业的快速健康发展。
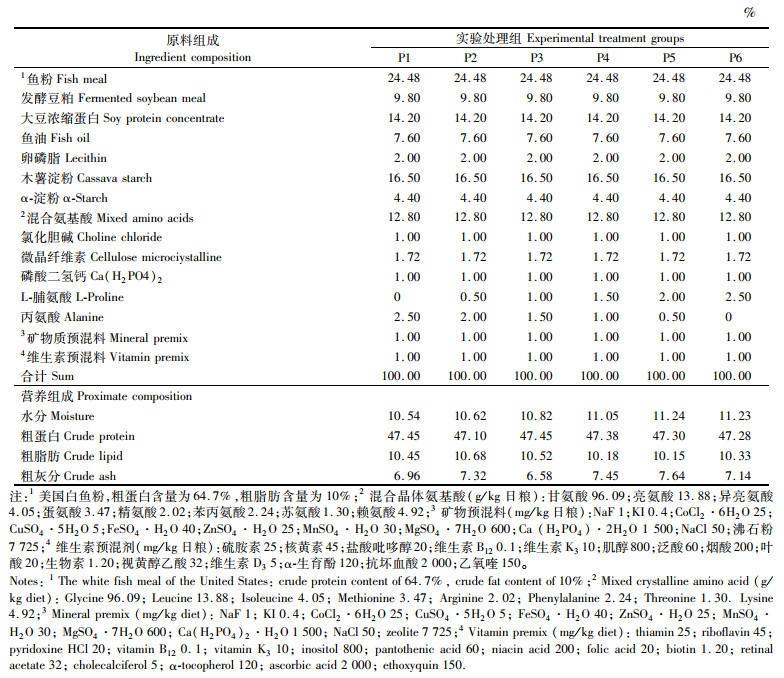
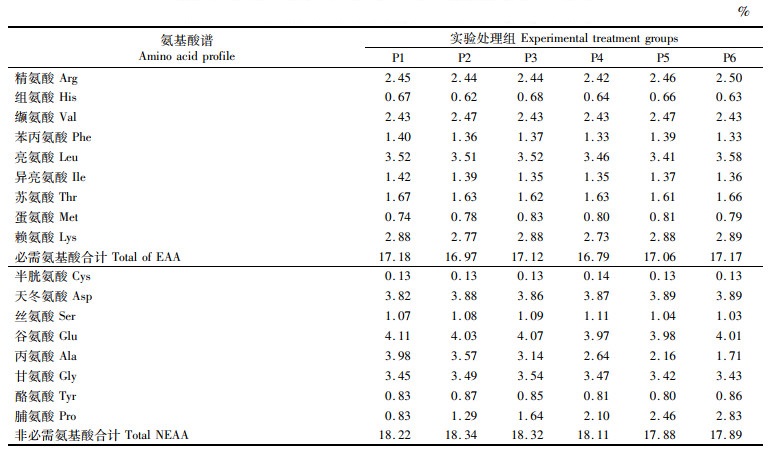
1 材料与方法 1.1 实验饲料本研究仅以饲料中的脯氨酸含量为变量,综合考虑蛋白平衡、脂类平衡、无机盐平衡,以鱼粉、混合氨基酸和结晶氨基酸为主要蛋白源,鱼油为主要脂肪源。试验饲料中脯氨酸的添加水平是参考其他鱼类脯氨酸需求量确定的[6],用P1、P2、P3、P4、P5和P6代表 6个脯氨酸梯度(0、5、10、15、20和25 g/kg干物质)的实验饲料组(表 1)。用丙氨酸来平衡饲料中的氮,并参考文献[25]中大黄鱼的营养需求设计其他营养成分的含量。采用HPLC-Ultimate 3000 (Thermo Scientific Dionex, USA)测定饲料氨基酸谱,见表 2。饲料原料过60目筛,经充分混合,用2.5 mm直径的膨化机制粒,在自然通风环境中风干,干颗粒饲料被密封在塑料袋里于-20 ℃存储,直至使用。
|
表 1 实验饲料的原料组成及近似组分(风干质量) Tab.1 Formulation and proximate composition of the experimental diets(air dry mass) |
|
表 2 实验饲料的氨基酸组成(干物质) Tab.2 Amino acid contents of experimental diets (dry matter) |
养殖实验在广东省汕头市南澳县汕头大学海洋生物临海实验站进行。浅色黄姑鱼购自当地的1个苗种孵化场(广东,饶平)。幼鱼购回后,在1个大的浮动网箱中(长×宽×深=3 m×3 m×2 m)暂养2周使其适应新环境,其间投喂商业饲料(粗蛋白40.0%,粗脂肪10.0%,揭阳通威,中国)。实验前,禁食24 h,麻醉后(30 mg/L丁香酚)称重分鱼,以减少应激。450尾体质量为(8.640±0.138)g的试验鱼被随机分入18个网箱(长×宽×深=1.0 m×1.0 m×1.5 m),每个网箱25尾鱼。3个网箱1组被随机分配到6个饲料处理组中。在8周的饲养期内,每天人工饱食投喂2次(07:00和16:30),记录好饲料投喂量,观察并记录鱼的健康状况及环境变化等,在实验过程中记录环境变化,温度23~30 ℃,pH 7.8~8.1,氨氮低于0.05 mg/L,盐度31~33 g/L,溶解氧5.2~6.0 mg/L。
1.3 样品采集养殖试验结束后,所有试验鱼停食24 h,采用丁香酚(质量体积比为1∶ 10 000;纯度99%,上海试剂,中国)麻醉,称重并计数,计算鱼的生长和饲料利用率。每个网箱随机选取4尾鱼储存在-20 ℃冰箱中用于体成分分析。另外随机选取6尾/网,测量个体体质量、体长,并采集血液样本,用未含抗凝剂的针管利用尾静脉采血法抽取血液后,静置低温离心(3 000 r/min,10 min,4 ℃),分离取上层淡黄色液体即为血清,血清样品存于-80 ℃直至后续检测。将采血后的试验鱼进行屠宰,称量肝脏质量和内脏质量,计算肥满度、肝体指数和脏体指数等,将肝脏保存在-20 ℃冰箱中,用于后续酶活检测。
1.4 常规成分分析根据国际标准方法(AOAC,1995)分析饲料和鱼体常规化学成分,水分含量用烘箱(FUMA DGX-8053B,上海,中国)在105 ℃常压下烘至恒重。灰分含量用马弗炉(Carbolite CWF 11/5,Hope Valley,UK)在550 ℃下烘8 h测定。粗蛋白使用凯氏定氮仪(Kjeldahl auto sampler system 1035 analyzer,Foss,Hoganas,Sweden)根据micro-Kjeldhl法(Ma & Zuazaga 1942)测定。粗脂肪采用Soxtectm 8000(Foss)萃取系统根据乙醚萃取法测定。
1.5 血液及肝脏生化指标测定血清和肝脏所有生化指标[谷草转氨酶(AST)、谷丙转氨酶(GPT)、碱性磷酸酶(AKP)、乳酸脱氢酶(LDH)、总蛋白(TP)、白蛋白(ALB)、还原性谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-PX)、尿素氮(BUN)、血氨(BA)、超氧化物歧化酶(SOD)、丙二醛(MDA)和过氧化氢酶(CAT)]均采用试剂盒(南京建成生物工程研究所,南京,中国)测定,具体方法详见各试剂盒说明书。
1.6 计算与统计分析根据饲养和屠宰实验中测定的鱼体质量、内脏器官质量、体长、饲料消耗等指标,计算鱼体生长性能和饲料利用能力。特定生长率(SGR)、饲料系数(FCR)、蛋白质效率(PER)、蛋白质储积率(PSR)、肝脏器官指数(HSI)、内脏器官指数(VSI)、鱼鳔器官指数(SBSI)、存活率(SR)和肥满度(CF)计算公式:
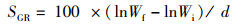 (1)
(1)
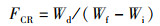 (2)
(2)
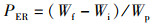 (3)
(3)
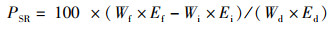 (4)
(4)
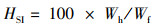 (5)
(5)
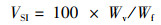 (6)
(6)
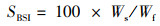 (7)
(7)
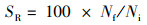 (8)
(8)
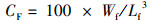 (9)
(9)
式中:SGR为特定生长率,%/d;FCR为饲料系数;PER为蛋白质效率;PSR为蛋白质储积率,%;HSI为肝脏器官指数,%;VSI为内脏器官指数,%; SBSI为鱼鳔器官指数,%;SR为存活率,%;CF为肥满度,g/cm3;Wi和Wf分别为实验鱼初始和终末体质量,g;d为养殖天数,d;Wd和Wp分别为摄食饲料质量和摄食蛋白质质量,g;Ed、Ei和Ef分别为饲料、初始和终末鱼体能量含量;Wh、Wv和Ws分别为肝脏、内脏和鱼鳔质量,g;Ni和Nf分别为养殖开始和结束时实验鱼尾数;Lf为养殖结束时测得的鱼体体长,cm。
所有数据均采用SPSS 20.0(SPSS, Inc., Chicago, IL, USA)进行单因素方差分析(ANOVA),并采用Tukey进行组间显著性检验。数据以“平均值±标准误”(n=3)呈现,P < 0.05为差异有统计学意义。采用分段回归分析方法,以全鱼粗蛋白含量为基础,评价饲料中脯氨酸的最佳添加水平。
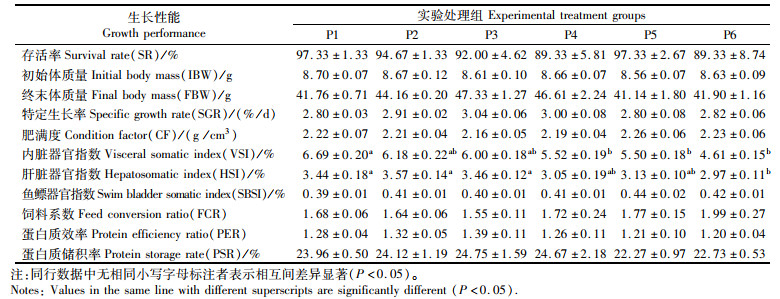
2 结果与分析 2.1 脯氨酸对浅色黄姑鱼生长性能的影响由表 3可知:仅肝体比和脏体比受饲料添加脯氨酸水平的影响显著(P < 0.05),且随着脯氨酸添加水平的增加而降低;其余指标包括特定生长率(SGR)、饲料系数(FCR)、蛋白质效率(RER)、蛋白质储积率(PSR)、肥满度(CF)及鱼鳔器官指数(SBSI)等指标相对稳定,基本不受脯氨酸水平的影响(P>0.05);各组存活率均大于90%,且组间无显著差异(P>0.05)。
|
表 3 饲料中添加不同水平的脯氨酸对浅色黄姑鱼生长性能的影响 Tab.3 Growth performance of Nibea coibor fed diets with different levels of proline |
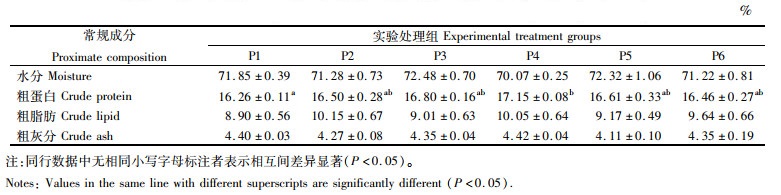
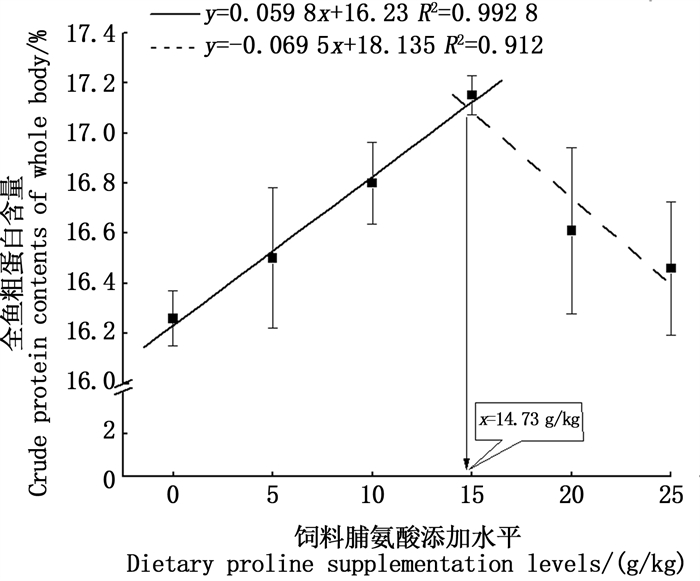
如表 4所示,体常规成分各项指标中,仅粗蛋白水平受饲料中添加脯氨酸影响显著(P < 0.05),随着脯氨酸水平的增加,粗蛋白水平整体呈现先升高后降低的趋势,且P4组与P1组间的差异达到显著水平(P < 0.05),而其他组之间差异均不显著(P>0.05)。通过分段回归分析得到,在基础饲料(P1组)中添加14.73 g/kg(干物质)脯氨酸时,全鱼中蛋白(占湿质量)积累量最高(图 1)。另外,饲料中添加不同水平脯氨酸对浅色黄姑鱼水分、粗脂肪和灰分均无显著影响(P>0.05)。
|
表 4 饲料中添加不同水平的脯氨酸对浅色黄姑鱼鱼体成分的影响(湿质量) Tab.4 Whole-body proximate composition of Nibea coibor fed the experimental diets with different levels of proline(wet mass) |
|
图 1 采用分段回归分析饲料中不同脯氨酸水平对浅色黄姑鱼全鱼中粗蛋白含量的影响 Fig. 1 Piecewise regression analysis of crude protein in whole-body against different dietary proline levels in diets of Nibea coibor |
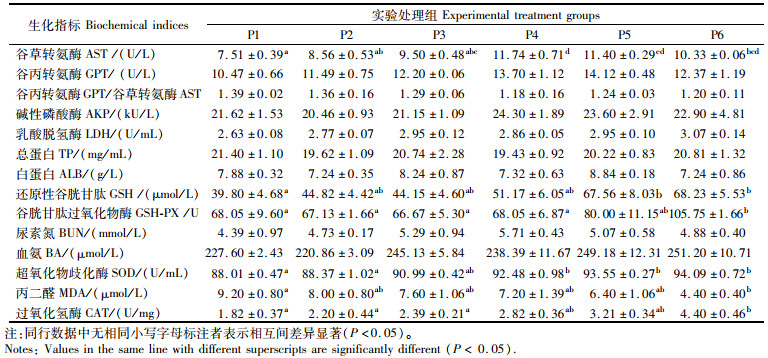
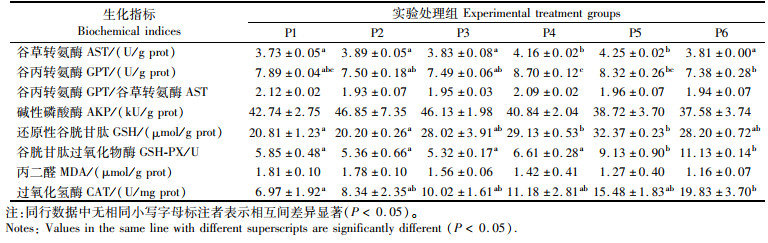
由表 5和表 6可知,摄食不同水平脯氨酸饲料后,浅色黄姑鱼的许多生化指标均发生了显著的变化。抗氧化指标受影响较大,血清GSH、GSH-PX、SOD、MDA、CAT和肝脏GSH、GSH-PX、CAT均受脯氨酸水平的显著影响(P < 0.05)。血清GSH、GSH-PX、SOD、CAT和肝脏GSH、GSH-PX、CAT均随脯氨酸水平的增加而增加(P < 0.05),相反血清MDA水平随脯氨酸水平的增加而降低(P < 0.05)。同时,与生长及蛋白代谢相关的常规生化指标仅肝脏AST、GPT和血清AST受脯氨酸水平的显著影响(P < 0.05),且肝脏AST、GPT和血清AST随脯氨酸添加水平的增加先升高,并在P4组达到最高后,随脯氨酸水平继续增加而略有下降。其他指标(如血清GPT、GPT/AST、AKP、LDH、TP、ALB、BUN、BA和肝脏GPT/AST、AKP、MDA)均相对稳定,不受脯氨酸水平的显著影响(P>0.05)。
|
表 5 饲料中添加不同水平的脯氨酸对浅色黄姑鱼血液生化指标的影响 Tab.5 Biochemical indices in serum of Nibea coibor fed diets with different levels of proline |
|
表 6 饲料中添加不同水平的脯氨酸对浅色黄姑鱼肝脏生化指标的影响 Tab.6 Biochemical indices in liver of Nibea coibor fed diets with different levels of proline |
脯氨酸虽然可以通过精氨酸酶途径及吡咯啉-5-羧酸盐合成酶(P5CS)途径进行生物合成,但不同物种之间的合成效率差异很大(哺乳动物>鸟类>鱼类)[4]。有研究[17]指出鱼类缺乏P5CS途径,内源合成的脯氨酸无法满足鱼类最适生长及饲料利用。也有研究[26]发现脯氨酸合成Arg对许多动物的生长健康至关重要,这都源于脯氨酸参与细胞的氧化还原反应,在鸟氨酸、精氨酸、多胺、谷氨酸代谢和机体抗氧化、抗应激及抗衰老等方面发挥着重要作用[11]。因此,脯氨酸是满足许多动物,特别是鱼类最大生长性能、饲料利用率及组织抗氧化必不可少的营养物质。本研究旨在探讨饲料中添加脯氨酸对浅色黄姑鱼生长及抗氧化性能的影响,发现脯氨酸对浅色黄姑鱼生长性能(包括特定生长率、饲料系数、蛋白质效率和肥满度等)的影响不显著。这些结果与在大菱鲆(Scophthalmus maximus L.)[7]和凡纳滨对虾(Litopenaeus vannamei)[16]上的研究结果相似,一致认为饲料中添加脯氨酸对水生动物生长性能和饲料利用率没有显著影响。另外,也说明了本研究基础饲料中的脯氨酸能够满足浅色黄姑鱼生长的最低需求,此结果对浅色黄姑鱼饲料的开发具有一定指导意义。机体组织中的常规成分分析反映了饲粮的组成,蛋白质作为组织结构的主要成分,常被用来评估组织的质量[27]。本研究发现饲料中添加脯氨酸显著提高了鱼体粗蛋白含量,以粗蛋白含量估算出饲料中脯氨酸的最适添加量为14.73 g/kg(干物质)。可能因为添加脯氨酸在一定程度上影响了蛋白质合成,支持了蛋白质沉积主要与鱼类氨基酸(AA)代谢有关的观点。HO
目前,关于脯氨酸对鱼类血清和肝脏生化指标影响的研究较少,谷氨酸草酰乙酸转氨酶(AST)和谷氨酸丙酮酸转氨酶(GPT)是蛋白质和氨基酸分解代谢以及血浆氨生成中最重要的转氨酶,这两种酶的活性直接反映了蛋白质代谢水平[30]。本研究发现肝脏AST、GPT和血清AST均受饲料中脯氨酸水平的影响,且随脯氨酸水平的增加,呈现出先升高后降低的趋势,其最高水平出现在P4或P5组。之前也有研究[31]报道,AST和GPT的活性受膳食蛋白的数量和质量以及膳食AA谱的影响。这些结果也间接反映了脯氨酸在一定程度上影响机体蛋白质合成。有研究[2, 32]表明,脯氨酸及其代谢产物吡咯啉-5-羧酸(P5C)在清除氧自由基中发挥重要作用,参与人类和动物的氧化还原反应。谷胱甘肽是体内重要的抗氧化剂和自由基清除剂,谷胱甘肽还原酶(GSH)是一种利用还原型NAD(P)将氧化型谷胱甘肽(GS-SG)催化反应生成还原型GSH的酶,缺失谷胱甘肽还原酶会使细胞对氧化剂和抗生素更为敏感。谷胱甘肽过氧化物酶(GSH-PX)和过氧化氢酶(CAT)是机体广泛存在的一种重要的催化过氧化氢分解的酶。本研究发现脯氨酸具有明显的抗氧化作用,其中肝脏和血液中的GSH、GSH-PX和CAT均受脯氨酸水平的显著影响,随脯氨酸水平的增加而增加,表明随饲料中添加脯氨酸,浅色黄姑鱼抗氧化能力也随着增加。另外,超氧化物歧化酶(SOD)是机体内天然存在的超氧自由基清除因子,也是生物体内清除自由基的首要物质。生物体内,自由基作用于脂质发生过氧化反应,终产物为丙二醛(MDA),它是膜脂过氧化最重要的产物之一,它的产生还能加剧膜的损伤。本研究中血清SOD随脯氨酸水平的增加显著增加,而MDA则相反(显著降低),这正好也反映鱼体的抗氧化能力在增强。通过对碱性磷酸酶(AKP)、总蛋白(TP)、白蛋白(ALB)、尿素氮(BUN)、血氨(BA)等指标的研究发现,脯氨酸对免疫和蛋白质代谢等方面的作用要次于脯氨酸的抗氧化作用。这与之前学者的研究报道[2, 5, 10-11]相吻合,脯氨酸促进抗氧化、免疫和胶原合成超过对生长的作用,特别是对一些受伤、应激的动物及压力大的人类。
综上所述,饲料中添加脯氨酸对浅色黄姑鱼的生长无显著的促进作用,但能显著影响鱼体蛋白质沉积和增强抗氧化能力,以鱼体蛋白合成能力估算出饲料中最佳脯氨酸添加水平为14.73 g/kg(干物质)。本试验结果将对浅色黄姑鱼饲料研发提供必要的理论指导。
| [1] |
WU G Y, MORRIS S M JR. Arginine metabolism: nitric oxide and beyond[J]. Biochemical Journal, 1998, 336(1): 1-17. DOI:10.1042/bj3360001 |
| [2] |
PHANG J M, LIU W, ZABIRNYK O. Proline metabolism and microenvironmental stress[J]. Annual Review of Nutrition, 2010, 30: 441-463. DOI:10.1146/annurev.nutr.012809.104638 |
| [3] |
WU G, BAZER F W, BURGHARDT R C, et al. Impacts of amino acid nutrition on pregnancy outcome in pigs: mechanisms and implications for swine production[J]. Journal of Animal Science, 2010, 88(S13): E195-E204. |
| [4] |
HOU Y Q, YAO K, YIN Y L, et al. Endogenous synthesis of amino acids limits growth, lactation, and reproduction in animals[J]. Advances in Nutrition, 2016, 7(2): 331-342. DOI:10.3945/an.115.010850 |
| [5] |
ALBAUGH V L, MUKHERJEE K, BARBUL A. Proline precursors and collagen synthesis: biochemical challenges of nutrient supplementation and wound healing[J]. The Journal of Nutrition, 2017, 147(11): 2011-2017. |
| [6] |
RONG H, LIN F, ZHANG Y L, et al. Effects of dietary proline on growth, physiology, biochemistry and TOR pathway-related gene expression in juvenile spotted drum Nibea diacanthus[J]. Fisheries Science, 2020, 86(3): 495-506. DOI:10.1007/s12562-020-01414-4 |
| [7] |
ZHANG K K, MAI K, XU W, et al. Proline with or without hydroxyproline influences collagen concentration and regulates prolyl 4-hydroxylase α (Ⅰ) gene expression in juvenile turbo (Scophthalmus maximus L.)[J]. Journal of Ocean University of China, 2015, 14(3): 541-548. DOI:10.1007/s11802-015-2436-0 |
| [8] |
RONG H, LIN F, LIMBU S M, et al. Effects of dietary proline on swim bladder collagen synthesis and its possible regulation by the TGF-β/Smad pathway in spotted drum, Nibea diacanthus[J]. Aquaculture Nutrition, 2020, 26(5): 1792-1805. DOI:10.1111/anu.13130 |
| [9] |
SHIMIZU J, ASAMI N, KATAOKA A, et al. Oral collagen-derived dipeptides, prolyl-hydroxyproline and hydroxyprolyl-glycine, ameliorate skin barrier dysfunction and alter gene expression profiles in the skin[J]. Biochemical and Biophysical Research Communications, 2015, 456(2): 626-630. DOI:10.1016/j.bbrc.2014.12.006 |
| [10] |
WU G, BAZER F W, DATTA S, et al. Proline metabolism in the conceptus: implications for fetal growth and development[J]. Amino Acids, 2008, 35(4): 691-702. DOI:10.1007/s00726-008-0052-7 |
| [11] |
WU G Y, BAZER F W, BURGHARDT R C, et al. Proline and hydroxyproline metabolism: implications for animal and human nutrition[J]. Amino Acids, 2011, 40(4): 1053-1063. DOI:10.1007/s00726-010-0715-z |
| [12] |
BARBUL A. Proline precursors to sustain mammalian collagen synthesis[J]. The Journal of Nutrition, 2008, 138(10): 2021S-2024S. DOI:10.1093/jn/138.10.2021S |
| [13] |
KIRCHGESSNER M, FICKLER J, ROTH F X. Effect of dietary proline supply on N-balance of piglets, 3: The importance of non-essential amino acids for protein retention[J]. Journal of Animal Physiology and Animal Nutrition (Germany), 1995, 73(2): 57-65. |
| [14] |
BAKER D H. Advances in protein-amino acid nutrition of poultry[J]. Amino Acids, 2009, 37(1): 29-41. DOI:10.1007/s00726-008-0198-3 |
| [15] |
GRABER G, ALLEN N K, SCOTT H M. Proline essentiality and weight gain[J]. Poultry Science, 1970, 49(3): 692-697. DOI:10.3382/ps.0490692 |
| [16] |
XIE S W, TIAN L X, LI Y M, et al. Effect of proline supplementation on anti-oxidative capacity, immune response and stress tolerance of juvenile Pacific white shrimp, Litopenaeus vannamei[J]. Aquaculture, 2015, 448: 105-111. DOI:10.1016/j.aquaculture.2015.05.040 |
| [17] |
LI P, WU G Y. Roles of dietary glycine, proline, and hydroxyproline in collagen synthesis and animal growth[J]. Amino Acids, 2018, 50(1): 29-38. DOI:10.1007/s00726-017-2490-6 |
| [18] |
LI P, MAI K S, TRUSHENSKI J, et al. New developments in fish amino acid nutrition: towards functional and environmentally oriented aquafeeds[J]. Amino Acids, 2009, 37(1): 43-53. DOI:10.1007/s00726-008-0171-1 |
| [19] |
荣华, 王正阳, 郝亭亭, 等. 甘氨酸、脯氨酸及羟脯氨酸介导胶原蛋白代谢研究进展[J]. 西北农林科技大学学报(自然科学版), 2021, 49(11): 53-61. RONG H, WANG Z Y, HAO T T, et al. Research progress of glycine, proline and hydroxyproline mediated collagen metabolism: A Review[J]. Journal of Northwest A & F University (Natural Science Edition), 2021, 49(11): 53-61. |
| [20] |
KARNA E, SZOKA L, HUYNH T Y L, et al. Proline-dependent regulation of collagen metabolism[J]. Cellular and Molecular Life Sciences, 2020, 77(10): 1911-1918. |
| [21] |
PHANG J M, DONALD S P, PANDHARE J, et al. The metabolism of proline, a stress substrate, modulates carcinogenic pathways[J]. Amino Acids, 2008, 35(4): 681-690. |
| [22] |
LIN F, RONG H, LIN J L, et al. Enhancement of collagen deposition in swim bladder of Chu's croaker (Nibea coibor) by proline: view from in-vitro and in-vivo study[J]. Aquaculture, 2020, 523: 735175. |
| [23] |
古群红, 罗志平, 吴缥飘, 等. 浅色黄姑鱼的池塘养殖试验[J]. 中国水产, 2011(8): 27-29. GU Q H, LUO Z P, WU P P, et al. Pond culture experiment of Nibea coibor[J]. China Fisheries, 2011(8): 27-29. |
| [24] |
WEN J, ZENG L, CHEN Z M, et al. Comparison of nutritional quality in fish maw product of croaker Protonibea diacanthus and perch Lates niloticus[J]. Journal of Ocean University of China, 2016, 15(4): 726-730. |
| [25] |
JOBLING M. National Research Council (NRC): Nutrient requirements of fish and shrimp[J]. Aquaculture International, 2012, 20(3): 601-602. |
| [26] |
WU Z L, HOU Y Q, HU S D, et al. Catabolism and safety of supplemental L-arginine in animals[J]. Amino Acids, 2016, 48(7): 1541-1552. |
| [27] |
DENG J M, WANG K, MAI K, et al. Effects of replacing fish meal with rubber seed meal on growth, nutrient utilization, and cholesterol metabolism of tilapia (Oreochromis niloticus×O. aureus)[J]. Fish Physiology and Biochemistry, 2017, 43(4): 941-954. |
| [28] |
HO  ECEK M. Branched-chain amino acids in health and disease: Metabolism, alterations in blood plasma, and as supplements[J]. Nutrition & Metabolism, 2018, 15: 33. ECEK M. Branched-chain amino acids in health and disease: Metabolism, alterations in blood plasma, and as supplements[J]. Nutrition & Metabolism, 2018, 15: 33.
|
| [29] |
SHEARER K D. Factors affecting the proximate composition of cultured fishes with emphasis on salmonids[J]. Aquaculture, 1994, 119(1): 63-88. |
| [30] |
METÓN I, MEDIAVILLA D, CASERAS A, et al. Effect of diet composition and ration size on key enzyme activities of glycolysis-gluconeogenesis, the pentose phosphate pathway and amino acid metabolism in liver of gilthead sea bream (Sparus aurata)[J]. British Journal of Nutrition, 1999, 82(3): 223-232. |
| [31] |
PERES H, OLIVA-TELES A. Effect of the dietary essential amino acid pattern on growth, feed utilization and nitrogen metabolism of European sea bass (Dicentrarchus labrax)[J]. Aquaculture, 2007, 267(1/4): 119-128. |
| [32] |
SRIVASTAVA D, ZHU W D, JOHNSON W H JR, et al. The structure of the proline utilization a proline dehydrogenase domain inactivated by N-propargylglycine provides insight into conformational changes induced by substrate binding and flavin reduction[J]. Biochemistry, 2009, 49(3): 560-569. |
2. Key Laboratory of Protection and Sustainable Utilization of Plateau Fishery Resources in University of Yunnan Province, Kunming 650201, Yunnan, China
 2023,
Vol. 32
2023,
Vol. 32


