2. 上海水产养殖工程技术研究中心, 上海 201306;
3. 水产科学国家级实验教学示范中心, 上海 201306
许多水产动物雌雄个体存在性别二态性现象,雌雄个体形态差异显著,同样,调控性别决定与分化的基因也存在性别二态性表达,尽管不同物种性别决定基因在进化过程中存在差异[1],具有种的特异性,但Doublesex(Dsx)和mab-3及其相关基因Dmrt1是参与性别决定和分化的最保守的基因[2-4]。Dsx首先在果蝇(Drosophila melanogaster)中发现[5],随后在许多其他昆虫研究中相继报道。Dsx编码的蛋白具有一个独特的且高度保守的结构基序,称之为DM结构域,DM结构域中的锌指结构包含6个半胱氨酸(Cysteine)和2个组氨酸(Histidine),与Zn原子形成2个结合位点(CCHC,HCCC),DM结构域羧基端无序尾部有一个可识别DNA的α-螺旋,通过它与特定的DNA序列结合调控下游基因的表达发挥Dmrt基因功能[6-7]。
昆虫Dsx位于性别决定通路Sex lethal (Sxl)、Transformer (Tra)、Transformer2 (Tra2)和Doublesex(Dsx)的下游,在早期发育中调控性别分化[8-9]。作为下游转录因子,Dsx基因受Tra调控,在雄性和雌性个体中产生了不同的可变剪接体DsxM和DsxF,从而表达不同的Dsx蛋白调控性别分化特异基因的表达,DsxM促进精巢性别分化和雄性特征的发育[4]。DsxF结合到卵黄蛋白基因的5′端,调控卵黄蛋白基因的转录,维持果蝇的雌性特征[10]。在南瓜实蝇(Bactrocera tau)中,使用双链RNA干扰技术敲降雌性Btau-DsxF的表达,卵黄蛋白原基因的表达量降低,同时引起了卵巢的发育缺陷,表明Dsx基因在南瓜实蝇性别特征的维持上发挥着关键作用[11]。不同于果蝇中的性别调控机制,家蚕(Bombyx mori)中的Dsx在BxRBP3和BxRBP1共同作用下调控其外显子的拼接,使其在不同性别的家蚕中产生不同的可变剪接体,以此调控家蚕性别,当BxRBP3和BxRBP1过表达时,抑制Dsx基因第3和第4个外显子的拼接,使雌性家蚕转变为雄性[12]。
虽然在许多昆虫中已经报道了Dsx基因的特征和功能,但是在甲壳类动物中的研究却相对较少,仅在环境决定性别物种大型溞(Daphnia magna)中证明Dsx基因参与雄性特征的发育与维持。与果蝇等昆虫Dsxpre-mRNA可变剪切形式不同,大型溞Dsx1基因呈现性别二态性表达,参与雄性特征的分化与维持,沉默雄溞胚胎Dsx1的表达可导致卵巢及雌性特征的发育,而在雌性胚胎中过表达Dsx1导致了雄性特征的发育,说明Dsx1基因在大型溞的性别分化和性腺发育中起着至关重要的作用[13-14]。另外,在中国对虾(Fenneropenaeus chinensis)中发现了一个Dsx基因[15],该基因在不同组织中表现出广泛的表达模式,通过双链RNA干扰实验,推测Dsx参与中国对虾的性别分化过程。在罗氏沼虾(Macrobrachium rosenbergii)中,已经发现了两个Dsx基因,分别命名为Mro-Dsx和Mr-Dsx [16-17], 但它们都不是性腺特异性表达,推测可能只是参与雄性特征的发育与维持而与性别分化无关。
本研究在罗氏沼虾克隆了一个新的只在性腺特异表达的Dsx基因(MroDsx),并对其在不同发育时期精巢的时空表达进行了分析,以期进一步阐明罗氏沼虾性别分化及性腺发育分子调控机制提供参考。
1 材料与方法 1.1 组织采集本实验所采用的成体罗氏沼虾均购买自上海市浦东新区果园农贸市场,选取活力良好的雌雄罗氏沼虾,运至实验室,在淡水充氧循环系统中饲养7 d,每天投喂3次饵料。然后解剖,选取心脏、肝胰腺、肌肉、鳃、眼、脑和不同发育时期精巢(精巢发育早期:主要是精原细胞;精巢发育中期:主要是精细胞;精巢发育后期:主要是成熟精子)[18],卵巢放至1.5 mL的无酶离心管中,液氮速冻后置于-80 ℃冰箱备用。取不同发育时期精巢组织置于多聚甲醛中,4 ℃冰箱固定过夜,次日使用1×PBS放在摇床上洗涤3次,每次30 min,然后放置于甲醇中,-20 ℃冰箱保存备用。
1.2 总RNA提取与cDNA合成使用Trizol法提取不同组织的总RNA[19],用酶标仪检测总RNA的质量浓度以及OD(OD260/OD280)值并使用1%的琼脂糖凝胶电泳检测RNA的完整性。采用TaKaRa反转录试剂盒合成cDNA第一条链, 保存于-20 ℃冰箱备用。
1.3 克隆MroDsx基因部分序列根据罗氏沼虾性腺(精巢/卵巢)转录组数据分析得到包含DM结构域的部分MroDsx序列(636 bp),使用Primer 5软件设计基因特异性引物(MroDsx-F: 5′- ACCGACCCTAATGAGCCT-3′; MroDsx-R: 5′-GTCAGTTCGTGCCTTTGC-3′), 用于后续的聚合酶链式反应(Polymerase chain reaction, PCR)。PCR反应体系如下(共20 μL):PCR Mix,10 μL;无酶水,8.5 μL;上下游引物各0.25 μL;各组织cDNA 1 μL。反应最佳条件:95 ℃预变性3 min,1个循环;95 ℃ 30 s, 55 ℃ 30 s,72 ℃ 30 s,运行35个循环;72 ℃延伸10 min。将PCR产物,使用1.5%的琼脂糖凝胶电泳,在凝胶成像仪下切割目的条带,根据割胶纯化试剂盒(天根)说明进行纯化,并将纯化产物在T4 DNA连接酶的作用下与pGMT载体相连,过夜连接产物转化至大肠杆菌,挑取阳性克隆送公司测序。
1.4 MroDsx蛋白DM结构域序列分析克隆获得包含DM结构域的部分MroDsx序列后, 使用ORF finder将核苷酸序列翻译成氨基酸序列。将MroDsx基因的氨基酸序列导入NCBI数据库蛋白BLAST, 进行同源性比对。利用在线网址http://smart.embl-heidelberg.de/进行结构域分析。
1.5 MroDsx基因在组织中的表达分布采用实时荧光定量PCR(qRT-PCR)技术,以不同组织(心脏、卵巢、肝胰腺、肌肉、鳃、眼、脑)以及以不同发育时期精巢组织的cDNA为模板,使用基因特异性引物(qPCR-F: 5′- GGCAGAGCAAGGATGTATGA-3′; qPCR-R: 5′-AAACCCTGAGGTAGATGGCT-3′)以及β-actin作为内参基因(β-actin-F:5′-CGACGGTCAGGTCATCACCA-3′;β-actin-R:5′-ACGTCGCACTTCATGATGGA-3′)分析MroDsx组织分布。配制体系:SYBR mixture buffer(2×),10 μL;qPCR-F,0.25 μL;qPCR-R,0.25 μL;模板,1.0 μL;无酶水,8.5 μL。扩增程序包括:95 ℃预变性3 min,1个循环;95 ℃ 30 s, 55 ℃ 30 s,72 ℃ 30 s,运行40个循环;60 ℃检测溶解曲线。使用2-ΔΔCt法计算不同组织中MroDsx基因的相对表达量。利用SPSS 10.0软件对结果进行统计分析,检验显著性(P < 0.05为显著水平)。用GraphPad Prism 5软件进行作图。
1.6 MroDsx基因转录本在不同发育时期精巢中的细胞学定位使用基因特异性引物MroDsx-R和MroDsx-F以早期精巢cDNA为模板,制备重组质粒,根据反转录试剂盒说明,利用T7和SP6 RNA聚合酶,体外转录合成正义链和反义链地高辛标记的RNA探针。取甲醇中保存的性腺组织制备原位杂交装片。按照如下步骤进行原位杂交:(1)60 ℃,烘片1 h;(2)脱蜡:二甲苯(Ⅰ),15 min→二甲苯(Ⅱ),15 min→二甲苯∶乙醇(1∶ 1),15 min →100%乙醇,5 min →100%乙醇,5 min →90%乙醇,5 min →90%乙醇,5 min →80%乙醇,5 min→70%乙醇,5 min→1×PBS,5 min;(3)蛋白酶K消化标本:将样本放入到20 mg/mL的蛋白酶K中,37 ℃水浴锅反应20 min;(4)1×PBS,摇床上漂洗2次,每次5 min;(5)乙醇脱水:70%乙醇,1 min →90%乙醇,1 min →100乙醇,1 min,放在干净的纸上空气干燥15 min;(6)预杂交:仅加杂交液200 μL,小心地用封口膜覆盖,55 ℃杂交仪杂交1 h;(7)杂交:将探针稀释5倍,PCR仪72 ℃,4 min变性,每个样品玻片上滴加探针∶杂交液(3∶ 200)200 μL,小心地用封口膜覆盖,杂交仪杂交1 h;(8)严格洗片;(9)免疫检测:室温湿盒上滴加1 mL封闭液, 封闭15 min;(10)1 μL Anti-DIG-AP fragments和800 μL的马来酸混合均匀,滴加到样品玻片上,放到湿盒,避光4 ℃过夜;(11)室温使用PBST洗片3次,每次5 min;(12)室温滴加400 μL NBT/BCIP显色10 min;(13)PBST洗片,3次,每次5 min;(14)中性树脂封片,显微镜观察。
2 结果与分析 2.1 MroDsx DM结构域序列比对分析根据罗氏沼虾转录组分析得到的部分序列设计引物,利用RT-PCR克隆了包含DM结构域的部分MroDsx cDNA序列(636 bp),将罗氏沼虾MroDsx与其他物种Dsx基因编码的蛋白DM结构域进行序列比对(图 1)发现:罗氏沼虾MroDsx基因蛋白的DM结构域分别与中国对虾(F.chinensis)、东部岩龙虾(Sagmariasus verreauxi)以及红鳌螯虾(Cherax quadricarinatus)Dsx基因蛋白具有73%、52%、52%相似性,此外,各个物种间组氨酸和半胱氨酸残基也具有极高的相似性。

|
黑色和灰色背景分别表示相同和相似的氨基酸。星号表示组氨酸和半胱氨酸位置。DmeDsx.果蝇Dsx(NP_731197.1); BmoDSX.家蚕Dsx(NP_001104815.1); AaeDsx.埃及伊蚊Dsx(ACY78701.1); TcaDsx.赤拟谷盗Dsx(EFA07556.2); PchDsx.中国对虾Dsx(AFU60552.1); SveDsx.东部岩龙虾Dsx(ARK36621.1); CquDsx.红螯螯虾Dsx(QDM55346.1); MrDsx.罗氏沼虾Dsx(QDE10516.1).MrDsx.罗氏沼虾Dsx(QDE10515.1)。 Identical and similar amino acid sites were marked with black and gray background, respectively.The cysteine and histidine conserved residues are denoted by asterisk.DmeDsx: Drosophila melano gaster Dsx(NP_731197.1); BmoDSX: Bombyx mori Dsx(NP_001104815.1); AaeDsx: Aedes aegypti Dsx(ACY78701.1); TcaDsx: Tribolium castaneum Dsx(EFA07556.2); PchDsx: Penaeus chinensis Dsx(AFU60552.1); SveDsx: Sagmariasus verreauxi Dsx(ARK36621.1); CquDsx: Cherax quadricarinatus Dsx(QDM55346.1); MrDsx: M.rosenbergii Dsx(QDE10516.1);MroDsx: M.rosenbergii Dsx(QDE10515.1). 图 1 DM结构域的氨基酸序列比对 Fig. 1 Multiple amino acid sequence alignment of DM domain |
利用实时荧光定量PCR(qPCR)检测MroDsx转录本在成体不同组织中表达模式,结果显示(图 2):MroDsx转录本仅在雌雄罗氏沼虾的性腺中表达,在精巢中的表达量明显高于卵巢中的表达量(P < 0.05),且在卵巢中的表达量极低。又进一步探究了在不同发育时期精巢中的表达量,结果显示(图 3):MroDsx转录本在精子发育早期高表达,随着精子发育, MroDsx转录本的表达量逐渐降低,且MroDsx转录本在精巢发育早期的表达量显著高于精巢发育中期和后期的表达量,约为中期表达量的3倍及后期表达量的10倍。
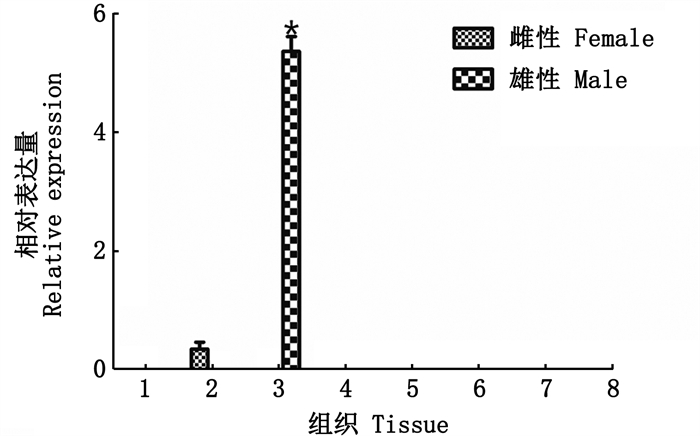
|
1.心脏; 2.卵巢;3.精巢; 4.肝胰腺; 5.肌肉; 6.鳃; 7.眼睛; 8.脑。*表示差异性显著(P < 0.05)。 1. Heart; 2. Ovary; 3. Testis; 4. Hepatopancreas; 5. Muscle; 6. Gill; 7. Eye; 8. Brain.The "*" shows significant difference (P < 0.05). 图 2 MroDsx在雌雄成体罗氏沼虾不同组织中的表达模式 Fig. 2 MroDsx expression in different tissues of female and male adult prawns |
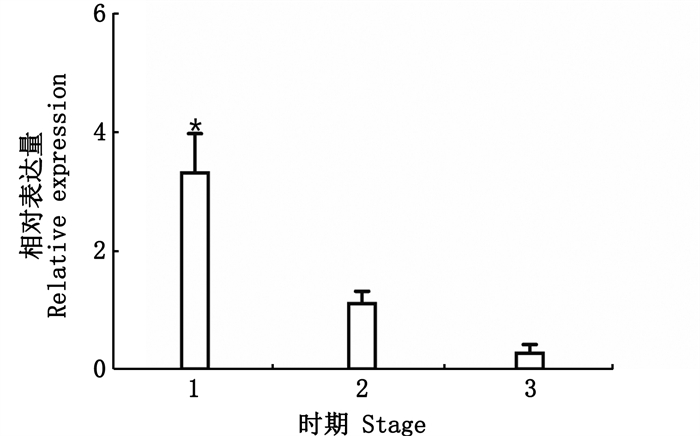
|
1.精巢发生早期(主要是精原细胞); 2.精巢发生中期(主要是精细胞); 3.精巢发生后期(主要是成熟精子)。*表示差异性显著(P < 0.05)。 1. Early-testis (spermatogonium are dominant); 2.Mid-testis (spermatid are dominant); 3.Late-testis (spermatozoa are dominant).The "*" shows significant difference (P < 0.05). 图 3 成体不同发育时期精巢中MroDsx基因的表达量 Fig. 3 Expression level of MroDsx in testis of adults at different development stages |
精子发生过程涉及一系列细胞学事件,最初的精原细胞经过有丝分裂增加细胞数量,然后通过减数分裂发育成精母细胞,再经过精细胞发育为成熟的精子。采用原位杂交技术(ISH)检测MroDsx基因mRNA在成体不同发育时期精巢中的细胞学定位,结果显示(图版):使用反义链RNA探针,MroDsx转录本主要在精原细胞的细胞质中表达,在精母细胞以及精细胞中表达较弱,而在成熟的精子中不表达。使用正义链RNA探针,在精子发生的任何时期都未检测到信号。
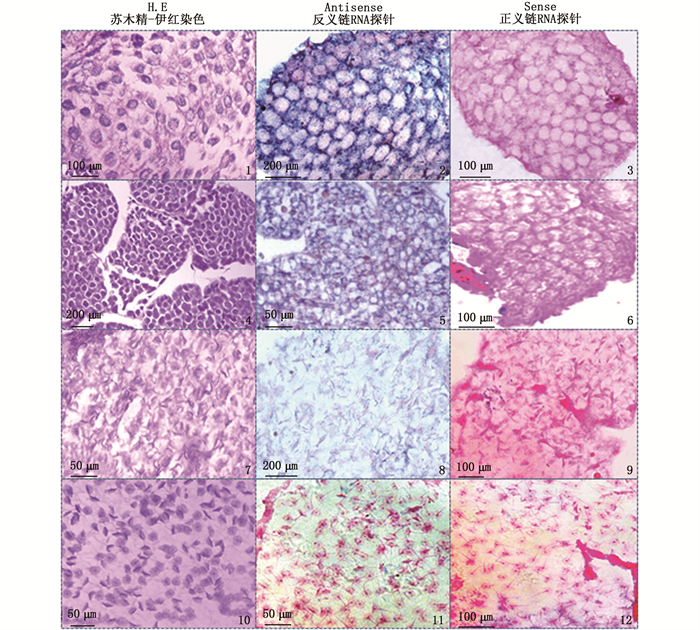
|
1,2,3. 精原细胞; 4,5,6. 精母细胞; 7,8,9. 精细胞; 10,11,12. 成熟精子。 1, 2, 3.spermatogonium; 4, 5, 6. spermatocyte; 7, 8, 9. spermatid; 10, 11, 12.spermatozoa. 图版 MroDsx转录本在不同时期精巢中的细胞学定位 Plate Cellular localization of the MroDsx transcripts in the testis of different developmental stages |
本研究克隆了罗氏沼虾Dsx基因部分序列,并对DM结构域进行比对分析。结果显示:DM结构域在不同物种间存在着极高的相似性,但是DM结构域以外的部分相似性却非常低(图 1)。另外,值得注意的是,迄今为止,所有已报道虾的Dsx基因,其DM结构域仅包含5个半胱氨酸,2个组氨酸,不同于昆虫中的Dsx基因。有研究表明Dmrt基因家族功能的多样性和它的结构密切相关,所以推测罗氏沼虾DM结构域的差异性可能和物种特异性有关,但是在罗氏沼虾中具体起什么作用,需要进一步去探究证明。
继在果蝇Dsx基因鉴定后,在其他动物发现了与Dsx基因同源的Dmrt基因家族,在性别分化和性腺发育中扮演着一个重要的角色。在大型溞(D.magna)中发现了3个Dmrt家族基因分别是Dmrt11E、Dmrt99B和Dmrt93B,其中,Dmrt11E和Dmrt99B在卵巢中的表达水平高于精巢中的表达水平,Dmrt93B在精巢中特异性表达[20]。十足目动物中,本实验室在中华绒螯蟹(Eriocheir sinensis)中克隆了精巢特异性表达的Dmrt基因,命名为EsDmrt-like,该基因在精巢的发育过程中发挥着至关重要的作用[21]。在东部岩龙虾(S.verreauxi)中发现了第一个Y染色体偶联的Dmrt家族基因,命名为Sv-iDmy,该基因参与东部岩龙虾的雄性分化过程:仅仅当Sv-iDmy不表达时,Sv-iDmrt1被预测才能促进雌性特征的发育[22]。迄今为止,虽然已经在罗氏沼虾(M.rosenbergii)中发现了8个Dmrt家族基因,但都不是性腺特异表达基因,其中Dmrt11E、Dmrt99B、iDmrt1b和Dsx基因在精巢中的表达量高于在卵巢中的表达量, 猜测其可能参与精巢的发育以及雄性特征的维持[1, 16-17]。另外,已报道的日本沼虾(Macrobrachium nipponense)Dmrt11E基因以及中国对虾Dsx基因在精巢中的表达量也是高于卵巢中的表达量,推测可能参与精巢的发育过程[15, 23]。本研究荧光定量结果显示(图 2):MroDsx转录本呈现雄性偏向性表达模式,在精巢中高表达,在卵巢中表达量极低,在两性的体组织中不表达。进一步检测MroDsx转录本在精巢周期中的表达量,结果显示(图 3):随着精巢发育,MroDsx基因转录本的表达量越来越低,暗示MroDsx也可能参与雄性罗氏沼虾性腺的发育过程。MroDsx转录本在不同时期精巢组织中的细胞学定位与精巢周期中表达量高度一致,原位杂交结果显示(图版):MroDsx转录本在精原细胞表达量高,在精母细胞以及精细胞中较弱,在成熟的精子中不表达,这一结果与罗氏沼虾MroDmrt11E表达定位相似,MroDmrt11E转录本信号只在精原和精母细胞中检测到,推测该基因也参与罗氏沼虾精巢发育或者是性别分化[1]。
果蝇性别决定通路下游基因是Dsx,在秀丽隐杆线虫(Caenorhabditis elegans)中下游基因是与Dsx同源的Mab-3基因[24],在某些脊椎动物中下游基因是Dsx同源的Dmrt基因[25-26],可见Dsx基因在不同物种的性别决定中具有一定的保守性[26],所以推测在甲壳动物中Dsx也参与其性别决定过程。在中国对虾(F. chinensis)中,使用双链RNA干扰Dsx基因的表达,发现IAG(Insulin-like androgenic gland hormone,甲壳动物的性别分化基因)[27-29]基因的表达产物也同时降低,并且在IAG的启动子区域找到了Dsx基因的结合位点,所以推测Dsx基因位于IAG基因的上游且通过调控IAG的表达控制中国对虾的性别分化[15]。在罗氏沼虾(M. rosenbergii)中, 通过双链RNA干扰Mr-Dsx基因的表达,IAG的表达量也随之降低,暗示该基因也许可以通过调节IAG的表达参与雄性特征的发育[16]。但是, 通过干扰IAG的表达,并未引起Mro-Dsx基因表达的变化[17],进一步暗示:在罗氏沼虾中,Mro-Dsx也可能位于IAG基因的上游,通过调控IAG的表达参与罗氏沼虾的性别分化过程。通过以上事例发现,甲壳动物性别决定通路的研究仍旧处于起步阶段,现在仅仅证明了IAG参与甲壳动物的性别分化过程,那么IAG基因的下游是否也存在调控性别的基因,IAG的上游调控因子尚不清楚,参考其他甲壳动物关于IAG基因的实验思路[27-29]:干扰MroDsx基因的表达是否也影响IAG基因的表达,是否也能成功引起性别反转,需要作进一步地研究,以期为甲壳动物的性别调控通路的研究提供参考。
| [1] |
YU Y Q, MA W M, ZENG Q G, et al. Molecular cloning and sexually dimorphic expression of two dmrtgenes in the giant freshwater prawn, Macrobrachium rosenbergii[J]. Agricultural Research, 2014, 3(2): 181-191. DOI:10.1007/s40003-014-0106-x |
| [2] |
SHIRAK A, SEROUSSI E, CNAANI A, et al. Amh and dmrta2 genes map to tilapia (Oreochromis spp.) linkage group 23 within quantitative trait locus regions for sex determination[J]. Genetics, 2006, 174(3): 1573-1581. DOI:10.1534/genetics.106.059030 |
| [3] |
MURPHY M W, LEE J K, ROJO S, et al. An ancient protein-DNA interaction underlying metazoan sex determination[J]. Nature Structural & Molecular Biology, 2015, 22(6): 442-451. |
| [4] |
RIDEOUT E J, DORNAN A J, NEVILLE M C, et al. Control of sexual differentiation and behavior by the doublesex gene in Drosophila melanogaster[J]. Nature Neuroscience, 2010, 13(4): 458-466. DOI:10.1038/nn.2515 |
| [5] |
BAKER B S, RIDGE K A. Sex and the single cell. Ⅰ. On the action of major loci affecting sex determination in Drosophila melanogaster[J]. Genetics, 1980, 94(2): 383-423. DOI:10.1093/genetics/94.2.383 |
| [6] |
GALINDO-TORRES P, GARCÍA-GASCA A, LLERA-HERRERA R, et al. Sex determination and differentiation genes in a functional hermaphrodite scallop, Nodipecten subnodosus[J]. Marine Genomics, 2018, 37: 161-175. DOI:10.1016/j.margen.2017.11.004 |
| [7] |
ZHANG T, ZARKOWER D. DMRT proteins and coordination of mammalian spermatogenesis[J]. Stem Cell Research, 2017, 24: 195-202. DOI:10.1016/j.scr.2017.07.026 |
| [8] |
CLINE T W. The Drosophila sex determination signal: how do flies count to two?[J]. Trends in Genetics, 1993, 9(11): 385-390. DOI:10.1016/0168-9525(93)90138-8 |
| [9] |
BOPP D, SACCONE G, BEYE M. Sex determination in insects: variations on a common theme[J]. Sexual Development, 2014, 8(1/3): 20-28. |
| [10] |
AN W Q, CHO S Y, ISHⅡ H, et al. Sex-specific and non-sex-specific oligomerization domains in both of the doublesex transcription factors from Drosophila melanogaster[J]. Molecular and Cellular Biology, 1996, 16(6): 3106-3111. DOI:10.1128/MCB.16.6.3106 |
| [11] |
THONGSAIKLAING T, PASSARA H, NIPITWATHANAPHON M, et al. Identification and characterization of doublesex from the pumpkin fruit fly, Bactrocera tau (Diptera: Tephritidae)[J]. European Journal of Entomology, 2018, 115(1): 602-613. |
| [12] |
ZHENG Z Z, SUN X, ZHANG B, et al. Alternative splicing regulation of doublesex gene by RNA-binding proteins in the silkworm Bombyx mori[J]. RNA Biology, 2019, 16(6): 809-820. DOI:10.1080/15476286.2019.1590177 |
| [13] |
KATO Y, KOBAYASHI K, WATANABE H, et al. Environmental sex determination in the Branchiopod Crustacean Daphnia magna: deep conservation of a doublesex gene in the sex-determining pathway[J]. PLoS Genetics, 2011, 7(3): e1001345. DOI:10.1371/journal.pgen.1001345 |
| [14] |
NONG Q D, ISHAK N S M, MATSUURA T, et al. Mapping the expression of the sex determining factor doublesex1 in Daphnia magna using a knock-in reporter[J]. Scientific Reports, 2017, 7: 13521. DOI:10.1038/s41598-017-13730-4 |
| [15] |
LI S H, LI F H, YU K J, et al. Identification and characterization of a doublesex gene which regulates the expression of insulin-like androgenic gland hormone in Fenneropenaeus chinensis[J]. Gene, 2018, 649: 1-7. DOI:10.1016/j.gene.2018.01.043 |
| [16] |
ZHONG P, ZHOU T T, ZHANG Y, et al. Potential involvement of a Dmrt family member (Mr-Dsx) in the regulation of sexual differentiation and moulting in the giant river prawn Macrobrachium rosenbergii[J]. Aquaculture Research, 2019, 50(10): 3037-3049. DOI:10.1111/are.14262 |
| [17] |
ABU ABAYED F A, MANOR R, AFLALO E D, et al. Screening for Dmrt genes from embryo to mature Macrobrachium rosenbergii prawns[J]. General and Comparative Endocrinology, 2019, 282: 113205. DOI:10.1016/j.ygcen.2019.06.009 |
| [18] |
CHEN J, LIU P, LI Z, et al. The cloning of the cdk2 transcript and the localization of its expression during gametogenesis in the freshwater giant prawn, Macrobrachium rosenbergii[J]. Molecular Biology Reports, 2013, 40(8): 4781-4790. DOI:10.1007/s11033-013-2574-7 |
| [19] |
周昊天, 张成硕, 王艳玲, 等. miR-192在尼罗罗非鱼应答碱度胁迫中的表达及靶基因[J]. 上海海洋大学学报, 2021, 30(3): 407-415. ZHOU H T, ZHANG C S, WANG Y L, et al. Expression of miR-192 in Nile tilapia in response toalkalinity stress and verification of target genes[J]. Journal of Shanghai Ocean University, 2021, 30(3): 407-415. |
| [20] |
KATO Y, KOBAYASHI K, ODA S, et al. Molecular cloning and sexually dimorphic expression of DM-domain genes in Daphnia magna[J]. Genomics, 2008, 91(1): 94-101. |
| [21] |
ZHANG E F, QIU G F. A novel Dmrt gene is specifically expressed in the testis of Chinese mitten crab, Eriocheir sinensis[J]. Development Genes and Evolution, 2010, 220(5/6): 151-159. |
| [22] |
CHANDLER J C, FITZGIBBON Q P, SMITH G, et al. Y-linked iDmrt 1 paralogue (iDMY) in the Eastern spiny lobster, Sagmariasus verreauxi: The first invertebrate sex-linked Dmrt[J]. Developmental Biology, 2017, 430(2): 337-345. |
| [23] |
WANG Y B, JIN S B, FU H T, et al. Identification and characterization of the DMRT11E gene in the oriental river prawn Macrobrachium nipponense[J]. International Journal of Molecular Sciences, 2019, 20(7): 1734. |
| [24] |
SHEN M M, HODGKIN J. Mab-3, a gene required for sex-specific yolk protein expression and a male-specific lineage in C.elegans[J]. Cell, 1988, 54(7): 1019-1031. |
| [25] |
HUANG S S, YE L P, CHEN H L. Sex determination and maintenance: the role of DMRT1 and FOXL2[J]. Asian Journal of Andrology, 2017, 19(6): 619-624. |
| [26] |
SAWANTH S K, GOPINATH G, SAMBRANI N, et al. The autoregulatory loop: a common mechanism of regulation of key sex determining genes in insects[J]. Journal of Biosciences, 2016, 41(2): 283-294. |
| [27] |
FOWLER R J, LEONARD B V. The structure and function of the androgenic gland in Cherax destructor (Decapoda: Parastacidae)[J]. Aquaculture, 1999, 171(1/2): 135-148. |
| [28] |
ROSEN O, MANOR R, WEIL S, et al. A sexual shift induced by silencing of a single insulin-like gene in crayfish: ovarian upregulation and testicular degeneration[J]. PLoS One, 2010, 5(12): e15281. |
| [29] |
VENTURA T, MANOR R, AFLALO E D, et al. Timing sexual differentiation: full functional sex reversal achieved through silencing of a single insulin-like gene in the prawn, Macrobrachium rosenbergii[J]. Biology of Reproduction, 2012, 86(3): 1-6. |
2. Shanghai Engineering Research Center of Aquaculture, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Sciences Education, Shanghai 201306, China
 2023,
Vol. 32
2023,
Vol. 32


