2. 广东省水产经济动物病原生物学及流行病学重点实验室, 广东 湛江 524088
20世纪80年代以来,已有多个国家报道了鱼类链球菌病的暴发,包括卵形鲳鲹(Trachinotus ovatus)[1]、尼罗罗非鱼(Tilapia nilotica)[2]和尖吻鲈(Lates calcarifer)[3]等。2016年在西澳大利亚金伯利海岸线观察到大约17 000尾鱼受到链球菌感染死亡,受影响的鱼包括长须狮子鱼(Pterois volitans)、鲈鱼(Psammoperca waigiensis)和黄尾鱼(Carangidae)等,造成巨大的经济损失[4]。
海豚链球菌(Streptococcus iniae)是我国南方鱼类养殖中链球菌的主要病原。该病原为革兰氏阳性细菌,在BHI固体培养基上形态呈圆形或近圆形并呈链状或双排列,无鞭毛,不形成芽孢[5]。研究[6]表明该病原至少能感染27种淡水和海水鱼,已成为水产养殖最严重的致病菌之一。被感染的鱼类经常发生脑膜炎和败血症,死亡率高达50%。同时,该病原还是一种重要的人兽共患的病原菌,人类受到细菌感染后会导致菌血症、蜂窝织炎、脑膜炎和关节炎等,尤其原本患有心脏病、肾病、糖尿病和关节炎的老年人更易感染[7]。
环介导等温扩增(Loop-mediated isothermal amplification,LAMP)主要是利用两对特殊引物和Bst DNA聚合酶,使反应中模板两端引物结合处循环出现环状单链结构,从而保证引物可以在等温条件下顺利与模板结合并进行链置换扩增反应[8]。该技术只需将模板、引物、酶等混合后在水浴锅(60~65 ℃)经过1 h反应就可将数个拷贝的DNA模板完成109个拷贝,与普通PCR方法相比克服了PCR反应需要反复的热变性、复性、延伸过程获得单链模板的缺点,实现了恒温条件下的连续快速扩增,具有更高的灵敏度和扩增效率,从而实现快速、特异、灵敏、简便的检测。该技术反应产物可以通过常规的荧光定量和电泳检测,也可以通过简易直观的荧光目视比色法如SYBR Green Ⅰ、钙黄绿素、羟基萘酚蓝(HNB)、Pico Green和焦磷酸镁浊度检测[9]。目前该技术已广泛应用于病毒及其他病原体的检测,如:袁耀武等[10]利用LAMP法检测单增李斯特菌(Listeria monocytogenes),纯培养的单增李斯特菌的和细菌等病原体的检测灵敏度为7.3×101 cfu/mL;张伟等[11]建立了鸭坦布苏病毒LAMP检测方法,该法测定模板浓度的灵敏度为1×10拷贝数/μL,而PCR的灵敏度为1×103拷贝数/μL;THEKISOE等[12]根据布鲁氏锥虫(Trypanosoma brucei)的18S rRNA基因建立了锥虫的LAMP检测技术,可以检测出锥虫DNA的最低限度是1 fg/μL,为预防和控制锥虫病提供了有效的技术方案。
有研究[13-14]指出细菌逃避噬菌作用最有效的方式是产生荚膜多糖(CPS),有荚膜多糖的菌株比非荚膜菌株的毒力更强。对GenBank中已有的海豚链球菌菌株的全基因组序列进行分析,发现所有测过全基因序列的菌株都有表达荚膜多糖的cpsA基因,且经BLASTN(http://blast.ncbi.nlm.nih.gov/Blast.cgi)分析表明cpsA的预测氨基酸序列高度保守。本研究基于海豚链球菌荚膜多糖cpsA基因设计引物,采取环介导等温扩增技术建立海豚链球菌检测方法,经条件优化后可通过少量的样本检测即可高效、灵敏的检测出海豚链球菌,研究结果为海豚链球菌引发的细菌病的快速诊断和早期检测提供更加可靠、便捷的技术手段。
1 材料与方法 1.1 材料海豚链球菌(Streptococcus iniae ZJ0801)、无乳链球菌(S. agalactiae ZQ0901)、猪链球菌(S. suis GD02)、停乳链球菌(S. dysgalactiae ATCC12394)、化脓链球菌(S. pyogenes ATCC19615)、哈维弧菌(Vibrio harveyi ZJ1603)、霍乱弧菌(V. cholerae nonO1-ZJ0910)、创伤弧菌(V. vulnificus ZJ1007)、副溶血弧菌(V. Parahaemolyticus ZJ1502)、溶藻弧菌(V. alginolyticus HY9901)、金黄色葡萄球菌(Staphylococcus aureus ATCC6538)、地衣芽孢杆菌(Bacillus licheniformis ZJ1906)、枯草芽孢杆菌(B. subtilis ATCC6633)、蜡状芽孢杆菌(B. cereus ATCC14579)、植物乳杆菌(Lactobacillus plantarum ATCC8014)等15株菌株均由广东省水产经济动物病原生物学与流行病学重点实验室保存。
1.2 试剂TSB培养基、BHI培养基购自广东环凯微生物科技有限公司;MgSO4、Betaine购自上海钦诚生物科技有限公司;dNTPs、Bst DNA聚合酶、DEPC处理水购自生工生物工程(上海)股份有限公司;SYBR Green Ⅰ购自北京索莱宝科技有限公司;细菌全基因组DNA提取试剂盒购自天根生化科技(北京)有限公司。
1.3 引物设计与合成选择GenBank中公布的海豚链球菌荚膜多糖(cpsA,GenBank登录号:AAY17293.1)基因,通过序列比对分析后,选择高度保守的基因区段设计特异性引物(表 1),并由生工生物工程(上海)股份有限公司合成。

|
表 1 LAMP扩增引物序列 Tab.1 LAMP amplification primer sequence |
固体培养基划线培养,挑取单菌落扩大培养,用细菌全基因组DNA提取试剂盒提取细菌基因组DNA作为LAMP特异性实验中反应体系模板。
以海豚链球菌基因组DNA作为模板,建立LAMP反应体系。反应体系共25 μL,包括10×Bst Buffer 2.5 μL,MgSO4 (25 mmol/L) 1.2 μL,dNTPs (10 mmol/L) 1.6 μL,内引物各1.6 μL,外引物各0.2 μL,Bst DNA聚合酶(8 U) 1 μL,DNA模板1 μL,DEPC处理水补齐[15]。LAMP反应体系在60 ℃保持60 min后80 ℃灭活2 min,2%的琼脂糖凝胶电泳判断实验结果。
1.4.2 LAMP反应体系优化为优化LAMP方法扩增条件,设计不同的反应温度(50、55、60、65和70 ℃)[16]、不同的反应时间(10、20、30、40、50和60 min)[17]、不同的Mg2+浓度(0、1.2、2.4、3.6、4.8、6.0、8.0 mmol/L)、不同的dNTPs浓度(0、0.32、0.64、1.28、2.56 mmol/L)、不同的内外引物比例(1∶ 1、2∶ 1、4∶ 1、8∶ 1、16∶ 1)进行LAMP反应,反应结束后取5 μL反应产物进行琼脂糖凝胶电泳,观察条带亮度,以确定LAMP最佳反应时间、温度、Mg2+、dNTPs、内外引物比例。为研究本LAMP方法反应体系中是否需要添加甜菜碱,分别在LAMP反应体系中添加0、0.25、1、1.5和2 mmol/L的甜菜碱,反应结束后取5 μL反应产物进行琼脂糖凝胶电泳。
1.4.3 LAMP防污染体系的建立使用UDG-dUTP系统建立防污染LAMP体系可以有效控制假阳性结果。反应前向反应体系中加入1 μL的100 mmol/L dUTP和1 U的UDG,然后在37 ℃预处理5~10 min后进行LAMP反应,对照组不做处理。为进一步确保实验防污染体系可靠性用不开盖检测的钙黄绿素-锰离子方法[15]作对照。反应结果用2%凝胶电泳分析。
1.5 LAMP方法的特异性分析用1.1节中不同菌株基因组DNA为模板,进行LAMP反应,产物经SYBR Green Ⅰ检测;同时利用2%的琼脂糖凝胶电泳判断实验结果,以分析本实验中建立的LAMP方法是否对海豚链球菌具有特异性。
1.6 LAMP方法灵敏度分析将海豚链球菌DNA初始质量浓度确定为21.2 ng/μL,对其进行10倍梯度稀释至2.12×10-9 ng/μL。以各梯度DNA作为模板利用优化后的反应体系进行LAMP检测,取5 μL反应产物进行琼脂糖凝胶电泳和SYBR Green Ⅰ检测。
同时,取上述梯度稀释的DNA为模板并以表 1中引物[18]进行PCR反应,反应程序为94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸30 s,30个循环,72 ℃延伸10 min,取5 μL反应产物进行琼脂糖凝胶电泳。
1.7 LAMP检测方法适用性分析取罗非鱼脑、鳃、肝、脾、头肾等5个组织各0.1 g[19],加入1 mL无菌水,充分匀浆,加入新鲜培养的海豚链球菌(1.8×109 cfu/mL),30 ℃培养然后取1 mL培养液,应用细菌基因组DNA提取试剂盒提取DNA作为模板,并用鱼的β-actin管家基因进行PCR确保鱼的DNA质量,随后进行LAMP检测,以未加海豚链球菌的鱼组织作为对照,判断鱼基因组DNA是否会对LAMP检测方法造成污染。同时,用LAMP方法对实验室收集的14例由海豚链球菌感染的尼罗罗非鱼(Tilapia nilotica)、卵形鲳鲹(Trachinotus ovatus)链球菌病样、5例由无乳链球菌感染的尼罗罗非鱼链球菌病样和2例由哈维弧菌感染的弧菌病病样进行检测,从而验证本方法的临床应用效果。具体方法为取鱼肝脏组织约0.1 g,置于采样管内研磨至浆状,应用细菌基因组DNA提取试剂盒提取DNA作为模板进行LAMP检测,同时用细菌基因组DNA提取试剂盒提取健康罗非鱼和卵形鲳鲹肝脏组织作为对照组,分析应用LAMP方法在临床应用检测中的准确性[20]。
2 结果 2.1 LAMP检测方法的建立和优化应用LAMP技术建立海豚链球菌LAMP检测方法,该检测方法结果可以通过琼脂糖凝胶电泳或SYBR Green Ⅰ显色肉眼判读结果。进一步对LAMP检测方法的反应条件进行优化。结果表明:当反应时间超过20 min时,反应产物即可通过琼脂糖凝胶电泳或SYBR Green Ⅰ显色肉眼判读(图 1a);当反应温度为65 ℃时,琼脂糖凝胶电泳形成的条带最亮(图 1b)。因此,本LAMP检测方法的最佳反应条件为65 ℃反应20 min,并根据条带亮度确定Mg2+(图 2a)和dNTPs(图 2b)最佳反应浓度分别为1.2 mmol/L和0.64 mmol/L,且最佳内外引物比例为16∶ 1(图 2c)。对LAMP反应体系中的甜菜碱浓度在最佳反应条件下进行优化,实验结果表明,是否添加甜菜碱不会影响到LAMP反应产物的电泳结果,说明甜菜碱不是本LAMP检测方法反应必需因子[21](图 2d)。

|
(a)泳道M.2 000 bp marker;1~3.10 min; 4~6.20 min;7~9.30 min;10~12.40 min;13~15.50 min;16~18.60 min;(b)泳道M.2 000 bp marker;1~3.50 ℃;4~6.55 ℃;7~9.60 ℃;10~12.65 ℃;13~15.70 ℃。 (a)Lane M.2 000 bp marker; 1-3.10 min; 4-6.20 min; 7-9.30 min; 10-12.40 min; 13-15.50 min; 16-18.60 min; (b)Lane M.2 000 bp marker; 1-3.50 ℃; 4-6.55 ℃; 7-9.60 ℃; 10-12.65 ℃; 13-15.70 ℃. 图 1 不同反应时间、温度的LAMP扩增结果 Fig. 1 LAMP amplification results at different reaction time and temperatures |

|
(a)Mg2+浓度: 泳道M.2 000 bp marker;1.0 mmol/L;2.1.2 mmol/L;3.2.4 mmol/L;4.3.6 mmol/L;5.4.8 mmol/L;6.8 mmol/L;(b)dNTPs浓度: 泳道M.2 000 bp marker;1.0 mmol/L;2.0.32 mmol/L;3.0.64 mmol/L;4.1.28 mmol/L;5.2.56 mmol/L;(c)内外引物比例: 泳道M.2 000 bp marker;1.0 mmol/L;2.0.32 mmol/L;3.0.64 mmol/L;4.1.28 mmol/L;5.2.56 mmol/L;(d)甜菜碱浓度: 泳道M.2 000 bp marker;1.0 mmol/L;2.0.25 mmol/L;3.1 mmol/L;4.1.5 mmol/L;5.2 mmol/L。 (a) Mg2+concentration: Lane M.2 000 bp marker; 1.0mmol/L; 2.1.2 mmol/L; 3.2.4 mmol/L; 4.3.6 mmol/L; 5.4.8 mmol/L; 6.8 mmol/L; (b) dNTPs concentration: Lane M.2 000 bp marker; 1.0 mmol/L; 2.0.32 mmol/L 3.0.64 mmol/L; 4.1.28 mmol/L; 5.2.56 mmol/L; (c) Ratios of internal and external primers): Lane M.2 000 bp marker; 1.0 mmol/L; 2.0.32 mmol/L; 3.0.64 mmol/L; 4.1.28 mmol/L; 5.2.56 mmol/L; (d)Betaine concentration: Lane M.2 000 bp marker; 1.0 mmol/L; 2.0.25 mmol/L; 3.1 mmol/L; 4.1.5 mmol/L; 5.2 mmol/L. 图 2 不同Mg2+、dNTPs、内外引物比例、甜菜碱浓度的LAMP扩增结果 Fig. 2 LAMP amplification results of different Mg2+, dNTPs, ratios of internal and external primers, and betaine concentrations |
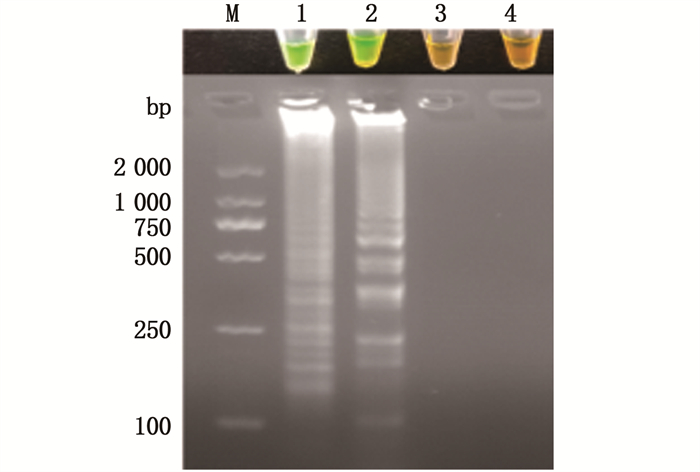
SYBR Green Ⅰ检测开盖容易造成气溶胶污染,所以本实验使用UDG-dUTP系统建立了防污染LAMP体系,并用不开盖检测的钙黄绿素-锰离子法作对照[22],结果一致证明UDG-dUTP污染体系可有效避免气溶胶污染如图 3。
|
泳道M.2 000 bp marker;1.UDG-dUTP污染体系结合SYBR Green I检测(阳性);2.钙黄绿素-锰离子检测(阳性);3.UDG-dUTP污染体系结合SYBR Green I检测(阴性对照);4.钙黄绿素-锰离子检测(阴性对照)。 Lane M.2 000 bp marker; 1.UDG-dUTP pollution system combined with SYBR Green I detection (positive); 2.Calcein-Mn2+ test (positive); 3.UDG-dUTP pollution system combined with SYBR Green I detection (negative control); 4.Calcein-Mn2+ test (negative control). 图 3 UDG-dUTP污染体系检测 Fig. 3 UDG-dUTP pollution system detection |
用上述不同菌株基因组DNA为模板,进行LAMP反应,产物经琼脂糖凝胶电泳和SYBR Green Ⅰ检测。结果表明,LAMP反应对无乳链球菌、化脓链球菌、猪链球菌、停乳链球菌、哈维弧菌、霍乱弧菌、创伤弧菌、副溶血弧菌、溶藻弧菌、金黄色葡萄球菌、地衣芽孢杆菌、枯草芽孢杆菌、蜡状芽孢杆菌和植物乳杆菌均呈现阴性,仅对海豚链球菌呈阳性反应(图 4)。

|
泳道M.2 000 bp marker;1.海豚链球菌;2.无乳链球菌;3.猪链球菌;4.停乳链球菌;5.化脓链球菌;6.哈维弧菌;7.霍乱弧菌;8.创伤弧菌;9.副溶血弧菌;10.溶藻弧菌;11.金黄色葡萄球菌;12.地衣芽孢杆菌;13.枯草芽孢杆菌;14.蜡状芽孢杆菌;15.植物乳杆菌;16.阴性对照。 Lane M.2 000 bp marker; 1.S. iniae; 2.S. agalactiae; 3.S. pyogenes; 4.S. suis; 5.S. pyogenes; 6.V. harveyi; 7.V. cholerae; 8.V. vulnificus; 9.V. parahaemolyticus; 10.V. alginolyticus; 11.S. aureus; 12.B. licheniformis; 13.B. subtilis; 14.B. cereus; 15.L. plantarum; 16.Negative control. 图 4 不同菌种的LAMP扩增结果 Fig. 4 LAMP amplification results of different strains |
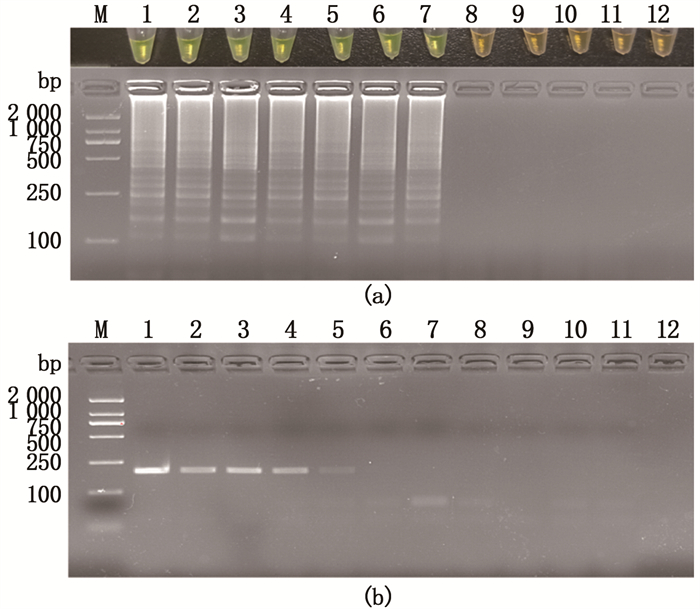
用不同稀释倍数的海豚链球菌基因组DNA为模板进行LAMP扩增和PCR反应,结果表明:当模板质量浓度高于2.12×10-5 ng/μL时,琼脂糖凝胶电泳或SYBR Green Ⅰ显色能检测出LAMP反应产物,即本LAMP检测方法的灵敏度为2.12×10-5 ng/μL(图 5a);而在PCR反应中,模板质量浓度需达到2.12×10-3 ng/μL才能利用琼脂糖凝胶电泳在反应产物中检测到条带(图 5b)。
|
泳道M.2 000 bp marker;1.模板质量浓度为21.2 ng/μL;2.模板质量浓度为2.12 ng/μL;3.模板质量浓度为2.12×10-1 ng/μL;4.模板质量浓度为2.12×10-2 ng/μL;5.模板质量浓度为2.12×10-3 ng/μL;6.模板质量浓度为2.12×10-4 ng/μL;7.模板质量浓度为2.12×10-5 ng/μL;8.模板质量浓度为2.12×10-6 ng/μL;9.模板质量浓度为2.12×10-7 ng/μL;10.模板质量浓度为2.12×10-8 ng/μL;11.模板质量浓度为2.12×10-9 ng/μL;12.阴性对照。 Lane M.2 000 bp marker; 1.Template mass concentration is 21.2 ng/μL; 2.Template mass concentration is 2.12 ng/μL; 3.Template mass concentration is 2.12×10-1 ng/μL; 4.Template mass concentration is 2.12×10-2 ng/μL; 5.Template mass concentration is 2.12×10-3 ng/μL; 6.Template mass concentration is 2.12×10-4 ng/μL; 7.Template mass concentration is 2.12×10-5 ng/μL; 8.Template mass concentration is 2.12×10-6 ng/μL; 9.Template mass concentration is 2.12×10-7 ng/μL; 10.Template mass concentration is 2.12×10-8 ng/μL; 11.Template mass concentration is 2.12×10-9 ng/μL; 12.Negative control. 图 5 不同质量浓度DNA LAMP和PCR扩增结果 Fig. 5 Different mass concentrations of DNA LAMP and PCR amplification results |
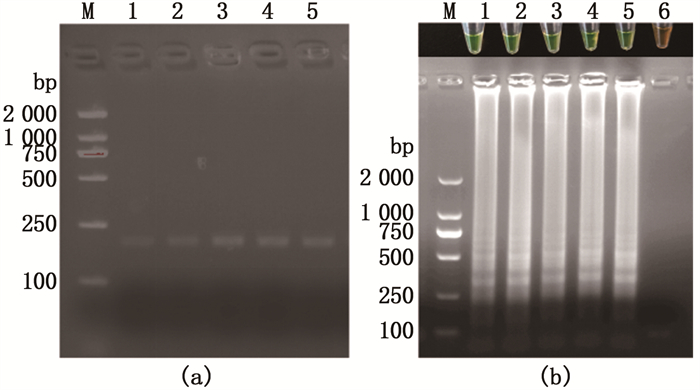
取新鲜的海豚链球菌(1.8×109 cfu/mL)人工污染罗非鱼脑、鳃、肝、脾和头肾组织,提取基因组DNA对β-actin管家基因检测和进行LAMP检测。结果表明即使模板DNA样品中有鱼组织的基因组干扰,本实验建立的LAMP检测方法仍能显示正确的实验结果,不会呈现出假阳性或假阴性(图 6)。
|
泳道M.2 000 bp marker;1.头肾;2.脑;3.脾;4.肝;5.鳃;6.阴性对照。 Lane M.2 000 bp marker; 1.Head kidney; 2.Brain; 3.Spleen; 4. Liver; 5.Gill; 6.Negative Control. 图 6 鱼不同组织与海豚链球菌共培养后提取DNA作为模板的LAMP和PCR检测结果 Fig. 6 LAMP and PCR detection results of DNA extracted from different fish tissues and Streptococcus iniae co-cultured as a template |
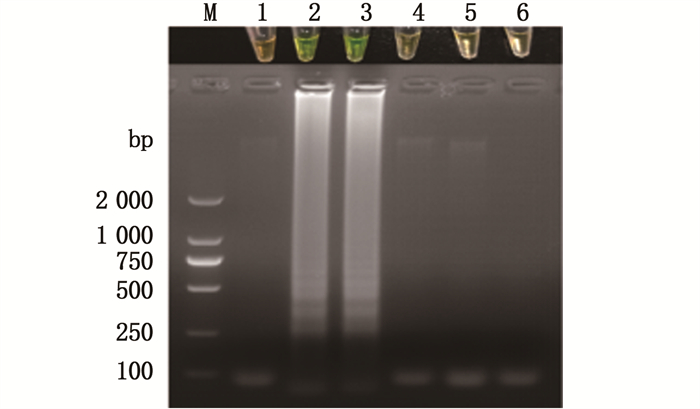
用本研究中建立的LAMP检测方法对临床病例进行检测,结果表明,本LAMP检测方法检测结果与取样进行的细菌分离鉴定结果完全一致(图 7)。
|
泳道M.2 000 bp marker;1.ddH2O;2.海豚链球菌感染的罗非鱼链球菌病病例;3.海豚链球菌感染的卵形鲳鲹链球菌病病例;4.哈维弧菌感染的卵形鲳鲹弧菌病病例;5.健康的卵形鲳鲹;6.健康的罗非鱼。 Lane M.2 000 bp marker; 1.ddH2O; 2.Tilapia Infected by Streptococcus iniae; 3.Trachinotus ovatus infected by Streptococcus iniae; 4.Trachinotus ovatus infected by Vibrio harveyi; 5.Healthy Trachinotus ovatus; 6. Healthy Tilapia. 图 7 LAMP法检测临床病例结果 Fig. 7 LAMP method to detect the results of clinical cases |
由海豚链球菌引起的链球菌病是近几年严重危害养殖鱼类健康的一种细菌性疾病,在我国南方水产养殖中主要危害罗非鱼和卵形鲳鲹。目前针对海豚链球菌的检测方法主要包括传统的细菌学方法、免疫学检测和分子生物学检测方法[5]。传统的方法包含选择培养基筛选和生理生化指标的测定,如:NGUYEN等[23]设计了醋酸铊-草酸和黏菌素硫酸盐-草酸两种选择性培养基应用于牙鲆(Paralichthys olivaceus)海豚链球菌的分离;AMRI等[24]对海豚链球菌的接触酶阴、阳性等生理生化指标进行分析。免疫学检测方法如KLESIUS等[25]建立了一种基于针对海豚链球菌的高度特异性单克隆抗体的间接荧光抗体技术(IFA-T)。分子生物学检测技术方法如PCR法和多重PCR法,如:ZLOTKIN等[26]对海豚链球菌16S rRNA设计引物产生约300 bp的特异条带,而无乳链球菌无扩增条带;PARK等[27]针对gyrB和16S rRNA基因设计引物,使用多重PCR法检测出使牙鲆患病的迟缓爱德华氏菌(Edwardsiella tarda)和海豚链球菌,最低检出限分别为0.01 ng/μL和0.1 ng/μL。
本研究建立的LAMP检测方法与其他方法相比,有以下优势:操作简单,LAMP法在普通水浴锅或金属浴就可以完成[28],而PCR技术在操作性、使用成本等方面都有一定的局限性[29];特异性良好:LAMP技术应用4条引物对靶序列的6个特异序列区进行识别,保证了扩增特异性[30],本研究的结果也表明本LAMP检测方法15种菌中仅在海豚链球菌作为模板时呈阳性结果;灵敏度高:HAN等[31]建立的LAMP技术检测的灵敏度为100 fg/μL,KLESIUS等[25]建立的间接免疫荧光抗体方法灵敏度可达10 cells/反应,本LAMP体系检测的灵敏度为2.12×10-5 ng/μL,比PCR反应高出100倍;检测时间短:HAN等[31]建立的LAMP技术在90 min之内完成,KLESIUS等[25]建立的间接免疫荧光抗体方法需要4 h才能完成,甘西等[32]建立的PCR检测方法中需要3 h才能完成,本LAMP检测方法反应时间仅需要20 min,从取样、DNA提取到最终获得检测结果的时间可控制在1 h内完成;结果易于判定:只需向LAMP产物中添加SYBR Green Ⅰ等核酸染料即可肉眼观察检测结果[33],缩短了电泳检测所需时间,简化了LAMP检测程序,建立的UDG-dUTP防污染体系能有效避免气溶胶污染,结果可信更能满足现场检测的需要。综上,本研究方法与前人实验相比有检测灵敏度高,时间短的优势。
本实验针对海豚链球菌的cpsA基因进行LAMP反应,该体系显示包括无乳链球菌等在内的14株对照菌检测结果均为阴性,显示出良好的特异性;然后对反应体系的温度、时间Mg2+、dNTPs、内外引物比例进行了优化,2%凝胶电泳和SYBR Green Ⅰ结果都显示65 ℃ 20 min,Mg2+浓度为1.2 mmol/L、dNTPs浓度为0.64 mmol/L、内外引物比例为16∶ 1时条带清晰,效率较高。随后对该方法的敏感度进行了评估,在敏感度检测中当海豚链球菌模板质量浓度降低到2.12×10-6 ng/μL时未出现阳性条带,说明该LAMP体系检测的灵敏度为2.12×10-5 ng/μL,比PCR法灵敏度高出两个数量级,因此该方法更适合于链球菌感染初期的检测。有学者指出甜菜碱可以使靶基因序列上富含GC的区域作用力改变,键能减弱,影响了DNA分子结构,增强DNA聚合酶的稳定性,本研究对甜菜碱浓度优化发现是否添加不会影响到LAMP反应产物的电泳结果,说明甜菜碱不是本LAMP检测方法反应必需因子[34-35]。最后对弧菌感染样本和海豚链球菌感染样本进行检测,可稳定的检测出海豚链球菌充分证明引物的特异性和可行性,加之该方法操作简单、检测成本低,不需要特殊的仪器设备和实验条件等优势,通过少量的样本检测即可高效、灵敏的检测出海豚链球菌,为其引发的细菌病的快速诊断和早期检测提供更加可靠、便捷的技术手段。
| [1] |
熊向英, 蔡小辉, 彭银辉, 等. 卵形鲳鲹主要致病链球菌多重PCR诊断技术的建立[J]. 广西科学, 2016, 23(1): 35-40. XIONG X Y, CAI X H, PENG Y H, et al. Development of multiplex PCR assay for detection of main streptococcosis pathogens in Trachinoms ovatus[J]. Guangxi Sciences, 2016, 23(1): 34-40. DOI:10.13656/j.cnki.gxkx.20160315.014 |
| [2] |
AL-HARBI A H. First isolation of Streptococcus sp. from hybrid tilapia (Oreochromis niloticus ×O. aureus) in Saudi Arabia[J]. Aquaculture, 1994, 128(3/4): 195-201. |
| [3] |
BROMAGE E S, THOMAS A, OWENS L. Streptococcus iniae, a bacterial infection in barramundi Lates calcarifer[J]. Diseases of Aquatic Organisms, 1999, 36(3): 177-181. |
| [4] |
YOUNG E J, BANNISTER J, BULLER N B, et al. Streptococcus iniae associated mass marine fish kill off Western Australia[J]. Diseases of Aquatic Organisms, 2020, 142: 197-201. DOI:10.3354/dao03545 |
| [5] |
罗晓雯, 李莉, 朱永肖, 等. 鱼类海豚链球菌病研究进展[J]. 水产科学, 2018, 37(6): 847-854. LUO X W, LI L, ZHU Y X, et al. Research progress on diseases caused by pathogen Streptococcus iniae in fishes: a review[J]. Fisheries Science, 2018, 37(6): 847-854. DOI:10.16378/j.cnki.1003-1111.2018.06.021 |
| [6] |
张永德, 冯世文, 李军, 等. 海豚链球菌LAMP方法的建立及初步应用[J]. 湖北农业科学, 2018, 57(15): 99-104. ZHANG Y D, FENG S W, LI J, et al. Development and preliminary application of Loop-mediated isothermal amplification (LAMP) method for rapid detection of Streptococcus iniae[J]. Hubei Agricultural Sciences, 2018, 57(15): 99-104. |
| [7] |
AGNEW W, BARNES A C. Streptococcus iniae: An aquatic pathogen of global veterinary significance and a challenging candidate for reliable vaccination[J]. Veterinary Microbiology, 2007, 122(1/2): 1-15. |
| [8] |
谢佳芮, 寇美玲, 苗海生. 环介导等温扩增技术的最新研究进展[J]. 畜牧与兽医, 2021, 53(2): 119-125. XIE J R, KOU M L, MIAO H S. Latest progress in research on loop-mediated isothermal amplification[J]. Animal Husbandy & Veterinary Medicine, 2021, 53(2): 119-125. |
| [9] |
徐敬潇. 印第安纳沙门菌快速检测方法的建立[D]. 北京: 中国农业科学院, 2020. XU J X. Establishment of a rapid detection method for salmonella Indiana[D]. Beijing: Chinese Academy of Agricultural Sciences, 2020. |
| [10] |
袁耀武, 张亚爽, 马晓燕, 等. LAMP检测单核细胞增生性李斯特氏菌的研究[J]. 中国食品学报, 2009, 9(3): 168-173. YUAN Y W, ZHANG Y S, MA X Y, et al. The study on the detection of Listeria monocytogenes by LAMP[J]. Journal of Chinese Institute of Food Science and Technology, 2009, 9(3): 168-173. DOI:10.3969/j.issn.1009-7848.2009.03.028 |
| [11] |
张伟, 逯茂洋, 黄庆华, 等. 荧光显色技术在鸭坦布苏病毒LAMP检测方法中的应用及比较[J]. 中国兽医科学, 2014, 44(4): 406-411. ZHANG W, LU M Y, HUANG Q H, et al. Application and comparison of fluorescent reagents in detection of duck Tembusu virus by loop-mediated isothermal amplification[J]. Chinese Veterinary Science, 2014, 44(4): 406-411. |
| [12] |
THEKISOE O M M, KUBOKI N, NAMBOTA A, et al. Species-specific loop-mediated isothermal amplification (LAMP) for diagnosis of trypanosomosis[J]. Acta Tropica, 2007, 102(3): 182-189. DOI:10.1016/j.actatropica.2007.05.004 |
| [13] |
MILLER J D, NEELY M N. Large-scale screen highlights the importance of capsule for virulence in the zoonotic pathogen Streptococcus iniae[J]. Infection and Immunity, 2005, 73(2): 921-934. DOI:10.1128/IAI.73.2.921-934.2005 |
| [14] |
GRIFFIN A M, MORRIS V J, GASSON M J. The cpsABCDE genes involved in polysaccharide production in Streptococcus salivarius ssp. thermophilus strain NCBF 2393[J]. Gene, 1996, 183(1/2): 23-27. |
| [15] |
陈昌国, 陈秋圆, 侯兵兵, 等. 基于LAMP技术针对溶藻弧菌gyrB基因快速检测方法的建立[J]. 现代检验医学杂志, 2019, 34(6): 6-9. CHEN C G, CHEN Q Y, HOU B B, et al. Establishment of the rapid detection method targeting to gyrB gene of Vibrio parahaemolyticus based on LAMP technology[J]. Journal of Modern Laboratory Medicine, 2019, 34(6): 6-9. |
| [16] |
蒋金蓁, 张白玉, 杨锐, 等. 大熊猫轮状病毒可视化LAMP检测技术的建立及应用[J]. 湖南农业大学学报(自然科学版), 2021, 47(1): 49-54. JIANG J Z, ZHANG B Y, YANG R, et al. Establishment and application of visual LAMP detection technology for giant panda rotavirus[J]. Journal of Hunan Agricultural University (Natural Sciences), 2021, 47(1): 49-54. |
| [17] |
张琳, 马利, 丁雅苓, 等. 基于荧光显色的IBV LAMP检测方法研究[J]. 西北农林科技大学学报(自然科学版), 2012, 40(10): 38-44. ZHANG L, MA L, DING Y L, et al. Research of fluorescent reagent in detection of IBV by loop-mediated isothermal amplification (LAMP)[J]. Journal of Northwest A & F University (Natural Science Edition), 2012, 40(10): 38-44. |
| [18] |
孙秀娟. 环介导等温扩增(LAMP)技术快速检测灿烂弧菌的研究[D]: 青岛: 青岛科技大学, 2013. SUN X J. Study on loop-mediated isothermal amplification (LAMP) for the fast detection of Vibrio splendidus[D]. Qingdao: Qingdao University of Science & Technology, 2013. |
| [19] |
王瑞娜, 周前进, 陈炯. 环介导等温扩增联合横向流动试纸条可视化检测海豚链球菌方法的建立[J]. 农业生物技术学报, 2014, 22(12): 1584-1594. WANG R N, ZHOU Q J, CHEN J. Visual detection of Streptococcus iniae based on loop-mediated isothermal amplification combined with a lateral flow dipstick[J]. Journal of Agricultural Biotechnology, 2014, 22(12): 1584-1594. |
| [20] |
相兴伟, 郑斌, 顾丽霞, 等. 双重LAMP技术快速检测水产品中副溶血性弧菌和霍乱弧菌的方法学研究[J]. 现代食品科技, 2017, 33(1): 253-260. XIANG X W, ZHENG B, GU L X, et al. Study on simultaneous detection of Vibrio parahaemolyticus and Vibrio cholerae in aquatic products by loop-mediated isothermal amplification method[J]. Modern Food Science and Technology, 2017, 33(1): 253-260. |
| [21] |
王一凡. 双链DNA恒温检测新技术及其在海洋弧菌中检测的研究[D]: 青岛: 青岛科技大学, 2017. WANG Y F. Study on new technology of the isothermal detection for double-stranded DNA and its application in marine vibrio detection research[D]. Qingdao: Qingdao University of Science & Technology, 2017. |
| [22] |
HSIEH K, MAGE P L, CSORDAS A T, et al. Simultaneous elimination of carryover contamination and detection of DNA with uracil-DNA-glycosylase-supplemented loop-mediated isothermal amplification (UDG-LAMP)[J]. Chemical Communications, 2014, 50(28): 3747-3749. |
| [23] |
NGUYEN H T, KANAI K. Selective agars for the isolation of Streptococcus iniae from Japanese flounder, Paralichthys olivaceus, and its cultural environment[J]. Journal of Applied Microbiology, 1999, 86(5): 769-776. |
| [24] |
AMRI F E, PADILLA D, ACOSTA F, et al. First report of Streptococcus iniae in red porgy (Pagrus pagrus, L.)[J]. Journal of Fish Diseases, 2010, 33(11): 901-905. |
| [25] |
KLESIUS P, EVANS J, SHOEMAKER C, et al. Rapid detection and identification of Streptococcus iniae using a monoclonal antibody-based indirect fluorescent antibody technique[J]. Aquaculture, 2006, 258(1/4): 180-186. |
| [26] |
ZLOTKIN A, HERSHKO H, ELDAR A. Possible transmission of Streptococcus iniae from wild fish to cultured marine fish[J]. Applied and Environmental Microbiology, 1998, 64(10): 4065-4067. |
| [27] |
PARK S B, KWON K, CHA I S, et al. Development of a multiplex PCR assay to detect Edwardsiella tarda, Streptococcus parauberis, and Streptococcus iniae in olive flounder (Paralichthys olivaceus)[J]. Journal of Veterinary Science, 2014, 15(1): 163-166. |
| [28] |
唐毕锋, 马立业, 曹广文. 环介导等温扩增技术的应用和发展[J]. 实用医学杂志, 2008, 24(22): 3972-3974. TANG B F, MA L Y, CAO G W. Application and development of loop-mediated isothermal amplification technology[J]. The Journal of Practical Medicine, 2008, 24(22): 3972-3974. |
| [29] |
刘晓菲, 陈睿元, 郑宇. 基于环介导等温扩增技术的玫烟色棒束孢可视化检测[J]. 中国生物防治学报, 2020, 36(5): 795-801. LIU X F, CHEN R Y, ZHENG Y. Visual detection of entomogenous fungi Isaria fumosorosea by loop-mediated isothermal amplification technology[J]. Chinese Journal of Biological Control, 2020, 36(5): 795-801. |
| [30] |
匡燕云, 李思光, 罗玉萍. 环介导等温扩增核酸技术及其应用[J]. 微生物学通报, 2007, 34(3): 557-560. KUANG Y Y, LI S G, LUO Y P. Loop-mediated isothermal amplification method for detection of nucleic acids and its application[J]. Microbiology China, 2007, 34(3): 557-560. |
| [31] |
HAN H J, JUNG S J, OH M J, et al. Rapid and sensitive detection of Streptococcus iniae by loop‐mediated isothermal amplification (LAMP)[J]. Journal of Fish Diseases, 2011, 34(5): 395-398. |
| [32] |
甘西, 陈明, 余晓丽, 等. 罗非鱼海豚链球菌PCR检测方法的建立[J]. 上海水产大学学报, 2008, 17(1): 40-46. GAN X, CHEN M, YU X L, et al. Development of a PCR assay for Streptococcus iniae in Tilapia[J]. Journal of Shanghai Fisheries University, 2008, 17(1): 40-46. |
| [33] |
申培立, 王羽, 李志辉, 等. 变形杆菌环介导等温扩增检测法的可视化方法的比较[J]. 河北农业大学学报, 2016, 39(3): 73-77, 82. SHEN P L, WANG Y, LI Z H, et al. Comparison of the visualization methods of loop-mediated isothermal amplification for detecting Proteus[J]. Journal of Agricultural University of Hebei, 2016, 39(3): 73-77, 82. |
| [34] |
HENKE W, HERDEL K, JUNG K, et al. Betaine improves the PCR amplification of GC-rich DNA sequences[J]. Nucleic Acids Research, 1997, 25(19): 3957-3958. |
| [35] |
WEISSENSTEINER T, LANCHBURY J S. Strategy for controlling preferential amplification and avoiding false negatives in PCR typing[J]. Biotechniques, 1996, 21(6): 1102-1108. |
2. Guangdong Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals, Zhanjiang 524088, Guangdong, China
 2023,
Vol. 32
2023,
Vol. 32


