2. 上海海洋大学 上海市水产养殖工程技术研究中心, 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
虾青素(3, 3′-二羟基-4, 4′-二酮基-β, β′-胡萝卜素)是一种类胡萝卜素酮化物,是自然界抗氧化能力最强的物质之一[1]。虾青素可广泛应用于生物医药、化妆品、食品和饲料添加剂等领域[2-4]。目前天然虾青素的生产来源主要从甲壳动物[5]、红法夫酵母(Phaffia rhodozyma)[6]和微藻[7]中提取。雨生红球藻(Haematococcus pluvialis)是自然界中已知虾青素含量最高的生物,可占干物质质量的1.5%~4.0%[8-9]。雨生红球藻是一种淡水单细胞绿藻,生活史复杂。藻细胞处于游动细胞或动孢子时期细胞为绿色,具有较强的分裂增殖能力;而在静细胞和静孢子阶段,细胞内积蓄大量虾青素导致细胞呈红色或深红色[10]。因此,实际生产中利用雨生红球藻生产虾青素通常采用两步法,即先优化培养条件获得尽可能大的藻细胞生物量,然后优化胁迫条件诱导藻细胞大量合成虾青素。
雨生红球藻的自然生境主要为小水沟、小水坑或沼泽化的富含有机物的小水体[10],容易形成不同生态适应和生长特性的品系[11]。本文就实验室新分离的一株雨生红球藻,利用单因素实验,对藻细胞适宜的增殖条件进行探究,然后利用响应曲面法优化培养条件(光照强度、培养温度和接种密度),以期为该藻株后续开发利用提供基础数据。
1 材料与方法 1.1 藻种及培养基试验用藻株SHOU-F1901于2019年6月采自江苏省丹阳市一微型淡水水体,经分离纯化后得到。纯化藻株经形态学检测并结合18S rRNA测序比对,确认为雨生红球藻(Haematococcus pluvialis)。选择雨生红球藻常用的SE培养基[12]作为藻种逐级扩培及后续试验的基础培养基。藻种扩培及后续生长实验均在光照培养箱中进行。藻种扩培条件:光周期12L∶ 12D,温度25 ℃,光照强度80 μmol/(m2·s), 每日定时摇瓶4次。批次培养周期12 d。
1.2 光照强度、温度及接种密度的单因子试验设计光照强度试验:将处于指数生长期的雨生红球藻以5×104 cells/mL的初始密度接种到1 000 mL锥形瓶中,设置35、70、105、140和175 μmol/(m2·s)5个光照强度,每个光照强度设3个平行。培养期间光周期12L∶ 12D,温度25 ℃, 每日定时摇瓶4次。批次培养至静止期。
温度试验:将处于指数生长期的雨生红球藻以5×104 cells/mL的初始密度接种到1 000 mL锥形瓶中,设置17、21、25、29和33 ℃ 5个温度梯度,每个温度设3个平行。培养期间光照强度80 μmol/(m2·s),光周期12L∶ 12D,每日摇瓶4次。批次培养至静止期。
初始接种密度试验:将处于指数生长期的雨生红球藻以2.5×104、5.0×104、7.5×104、10.0×104、12.5×104和15.0×104 cells/mL的初始密度接种到1 000 mL锥形瓶中,每个接种密度设3个平行。培养期间光照强度80 μmol/(m2·s),光周期12L∶ 12D,温度25 ℃, 每日摇瓶4次。批次培养至静止期。
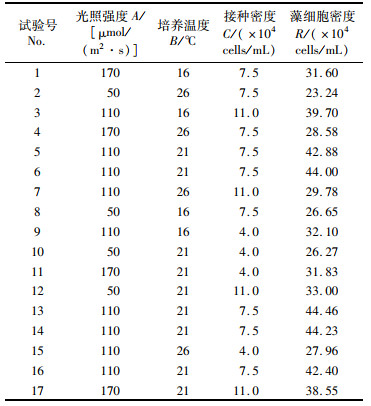
1.3 光照强度、温度及接种密度的响应曲面试验设计采用Box-Behnken的3因素3水平试验设计,根据1.2节单因素试验结果,以光照强度(A)、培养温度(B)和接种密度(C)为自变量,藻细胞密度作为响应值R。各因素和水平如表 1所示。
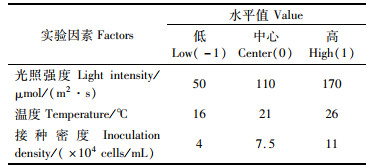
|
表 1 响应曲面分析的因素与水平 Tab.1 Design factors and levels of response surface methodology for extraction |
培养过程中,每天定时摇匀藻液并定量取样,固定后采用浮游植物计数板测定并计算藻液藻细胞密度,每个样品计数9次,取平均值。
在培养第12天,摇匀后自锥形瓶中取样20 mL,经0.45 μm事先恒重的醋酸纤维滤膜(W0)抽滤,并用蒸馏水漂洗抽滤后将滤膜烘干至恒重(W1),计算藻细胞的生物量(W)。
1.5 藻细胞色素含量的测定叶绿素含量的测定:参照赵陆敏[13]的方法。将藻液摇匀,取V0 mL藻液,5 000 r/min离心5 min弃上清,藻泥用蒸馏水重悬浮,洗涤离心。在藻泥内加入0.1 g直径为50 μm的石英砂放置于研钵中冰水浴,充分研磨,加入V1 mL无水甲醇,45 ℃黑暗水浴35 min,其间振摇1次,待藻泥呈灰白色时,5 000 r/min离心5 min,取上清提取液。甲醇做空白对照,用分光光度计测量提取液在480、662、665 nm的吸光度,750 nm作为浊光矫正。计算叶绿素a、叶绿素b、类胡萝卜素和总叶绿素的质量浓度。
虾青素含量的测定:参照尚敏敏等[14]的方法。取V0 mL藻液,5 000 r/min离心5 min弃上清,藻泥用蒸馏水重悬浮,洗涤离心。在藻泥中加入5 mL 5%氢氧化钾(溶剂为30%的甲醇水溶液),65 ℃水浴5 min,离心去除上清,沉淀利用蒸馏水洗涤离心两次后,沉淀中加V1 mL的二甲基亚砜(DMSO),冰水浴超声破壁提取,离心收集上清,重复提取直至藻泥变白。随后5 000 r/min离心10 min取上清,DMSO做空白对照,用分光光度计测量提取液在490 nm的吸光度值,计算虾青素的质量浓度Pax:
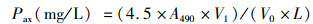 (1)
(1)
式中:A490为吸光度值;V0为取得的藻液体积, mL;V1为浸提液体积, mL;L为比色皿光径。
将计算所得的各色素质量浓度除以各组藻干质量,可以得到各组单位质量藻细胞的叶绿素a、叶绿素b、类胡萝卜素及虾青素的含量。
1.6 数据处理数据以平均值±标准差表示。用统计软件IBM SPSS Statistics 25对所得的数据进行单因子方差分析(ANOVA, P < 0.05表示差异显著),结果差异显著则进行Duncan氏法多重比较。用绘图软件Origin 2018作图, 响应曲面实验利用Design-Expert 12进行设计分析。
2 结果与分析 2.1 光照强度、温度和初始接种密度对雨生红球藻培养生物量的影响光照强度、温度和初始接种密度对批次培养的雨生红球藻的生长及生物量均有显著影响(P < 0.05)。经过12 d培养,雨生红球藻的生物量随光照强度的升高呈先升后降的变化,在105 μmol/(m2·s)组有着最大生物量,藻细胞密度达39.86×104 cells/mL,是35 μmol/(m2·s)组的1.98倍;干物质达到0.48 g/L,高出35 μmol/(m2·s)组1.51倍(图 1a)。雨生红球藻不耐高温,29 ℃组及33 ℃组藻细胞失去游动能力且下沉后互相粘连,无法准确计数。在17~25 ℃范围内,21 ℃组有最大的藻细胞密度(34.37×104 cells/mL),显著高于25 ℃组(P < 0.05)。各组干物质量随着培养温度的升高先升高后降低,在21 ℃组最大(0.30 g/L),与25 ℃组无显著差异,两者均显著高于其他温度组(图 1b)。在低接种密度时,雨生红球藻批次培养的细胞密度和生物量均随接种密度的升高而增大,当接种密度达到7.5×104cells/mL后,雨生红球藻的生物量和细胞密度均不随接种密度的提高而有显著变化(图 1c)。
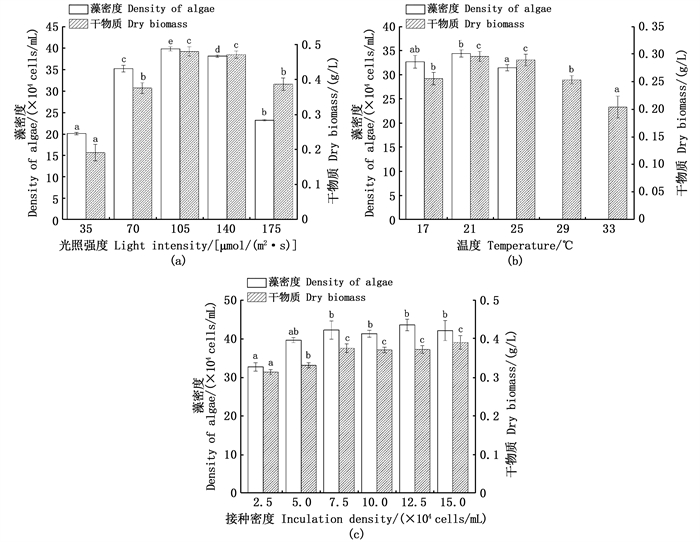
|
不同小写字母表示组间存在显著性差异(P < 0.05)。 Different small letters mean significant differences among the treatments(P < 0.05). 图 1 光照强度(a)、温度(b)和初始接种密度(c)对雨生红球藻细胞密度和干物质的影响 Fig. 1 Effects of light intensity(a), temperature(b) and inoculation density(c) on the biomass of microalgae H. plivialis under batch culture |
光照强度显著影响雨生红球藻细胞色素组成及含量,35 μmol/(m2·s)组的叶绿素a、类胡萝卜素、总叶绿素含量显著的高于其他光照强度组;35 μmol/(m2·s)组、70 μmol/(m2·s)组和105 μmol/(m2·s)组叶绿素b含量显著高于140 μmol/(m2·s)组和175 μmol/(m2·s)组(图 2a)。藻细胞虾青素的含量总体随着光照强度的上升先下降后上升,70 μmol/(m2·s)组虾青素含量最低,为(5.97±0.28) mg/g,175 μmol/(m2·s)组最高(图 2b)。
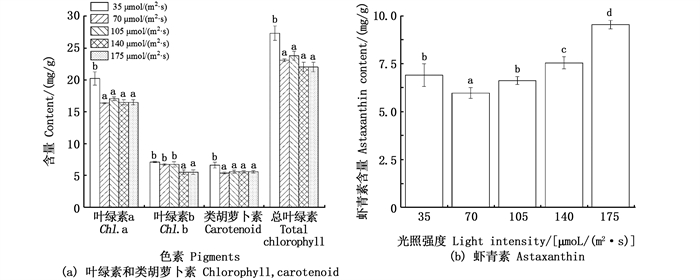
|
不同小写字母表示组间存在显著性差异(P < 0.05)。 Different small letters mean significant differences among the treatments(P < 0.05). 图 2 光照强度对雨生红球藻细胞叶绿素、类胡萝卜素(a)和虾青素(b)的影响 Fig. 2 Effects of light intensity on the contents of chlorophyll, carotenoid (a) and astaxanthin(b) in microalga H. plivialis |
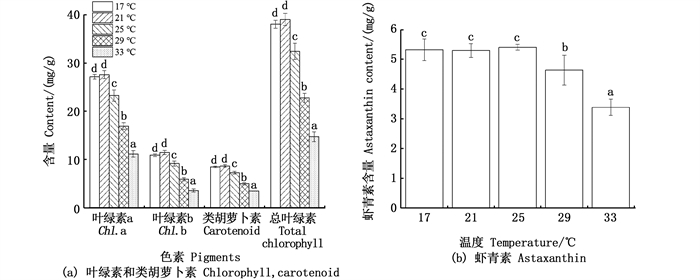
当温度大于21 ℃时,雨生红球藻的叶绿素a、叶绿素b、类胡萝卜素和总叶绿素含量随培养温度的升高而显著减少(图 2a);虾青素含量在17、21和25 ℃组之间没有显著的差异,29 ℃组和33 ℃组细胞虾青素含量显著减少(图 2b)。
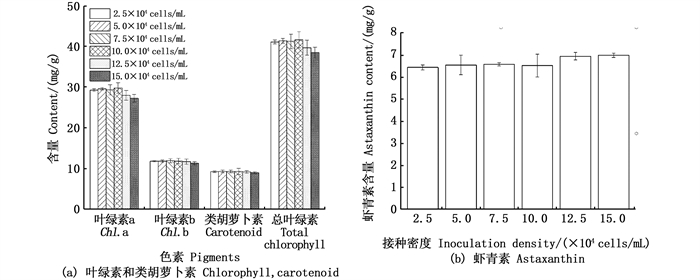
初始接种密度对雨生红球藻细胞叶绿素a、叶绿素b、类胡萝卜素、总叶绿素和虾青素含量均无显著性的影响(图 4)。
|
不同小写字母表示组间存在显著性差异(P < 0.05)。 Different small letters mean significant differences among the treatments(P < 0.05). 图 3 培养温度对雨生红球藻细胞叶绿素、类胡萝卜素(a)和虾青素(b)的影响 Fig. 3 Effects of culture temperature on the contents of chlorophyll, carotenoid(a) and astaxanthin(b) in microalga H. plivialis |
|
图 4 初始接种密度对雨生红球藻叶绿素、类胡萝卜素(a)和虾青素(b)的影响 Fig. 4 Effects of inoculation density on the contents of chlorophyll, carotenoid(a) and astaxanthin(b) in microalga H. plivialis |
基于2.1节的结果,采用Box-Benhnken响应面优化设计实验开展雨生红球藻培养光照强度-温度-接种密度组合条件的优化。优化实验设计方案及结果见表 2。
|
表 2 雨生红球藻培养条件优化试验设计方案及结果 Tab.2 Extraction conditions and results of response surface methodology for optimizationon growth of microalga H. plivialis |
应用Design-expert 12统计软件对响应面试验数据进行二次多元回归拟合,得到3因素的优化方程模型:
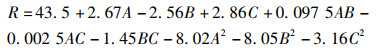
式中:R为藻细胞密度,104 cells/mL;A为光照强度,μmol/(m2·s);B为培养温度,℃;C为接种密度,104 cells/mL。
对该回归方程进行方差分析,回归数学模型极显著(P < 0.000 1),相关系数R2=0.984 9,失拟项(P=0.113 0>0.05),表明失拟项相对于绝对误差不显著,综上得出该模型与该实验结果有着良好的拟合程度(表 3)。
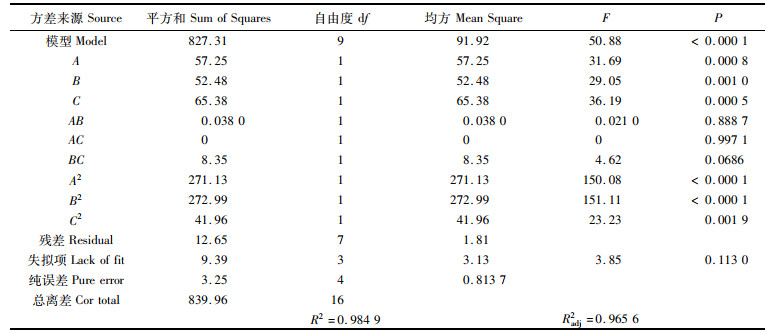
|
表 3 方差分析结果表 Tab.3 ANOVA of regression analysis |
根据模型各项的P,A、B、C及二项式A2、B2、C2的P < 0.05,表明上述因子显著影响雨生红球藻培养生物量,接种密度(C)对综合得分影响最大,光照强度(A)次之,培养温度(B)影响最弱。以P的大小为响应影响排序,各因素影响力: 接种密度(C)>光照强度(A)>培养温度(B),AB、AC、BC未有显著的影响(表 3)。
模型的预测值和实际值的对比曲线如图 5,该模型可以适用于实际生产的预测。
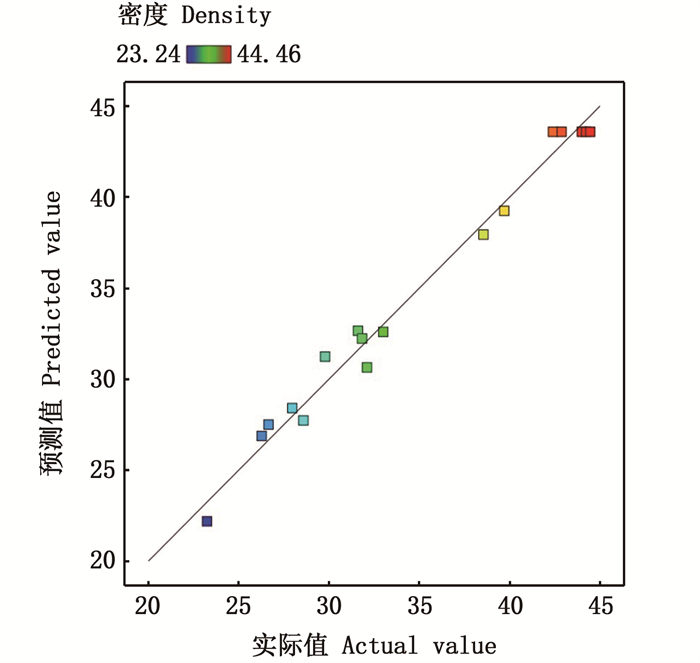
|
图 5 模型预测值与实际值的对比曲线 Fig. 5 Comparison curve between model predicted value and actual value |
利用Design-Expert 12软件画出该模型的三维响应面图和等高线图以反映光照强度、培养温度和接种密度3个因素两两之间的关系。在三维响应面图图中,最高点代表着两因素之间存在极值[15],坡度可以反映出两因素之间的交互作用,倾斜度越高,两者之间的交互作用越显著。等高线图是3D图在二维平面的投影,可以更加直观地看出两因素之间的交互作用,当中心形状为椭圆时可以表明两者之间有交互作用,等高线反应出三维图的坡度,等高线越密集代表着两者之间的交互作用越显著[16]。
A、B、C 3个因子的交互作用的3D图和等高线图见图 6,光照强度(A)和培养温度(B)的等高线图呈圆形,且等高线之间较为稀疏表明二者交互作用不显著(图 6a,6d)。光照强度(A)和接种密度(C)的等最中间高线图虽然为椭圆,但等高线之间并不密集及3D图坡度较缓,表明二者的交互作用不显著(图 6b,6e)。同理,温度(B)和接种密度(C)的交互作用不显著(图 6c,6f)。与方差分析表的结果相符。
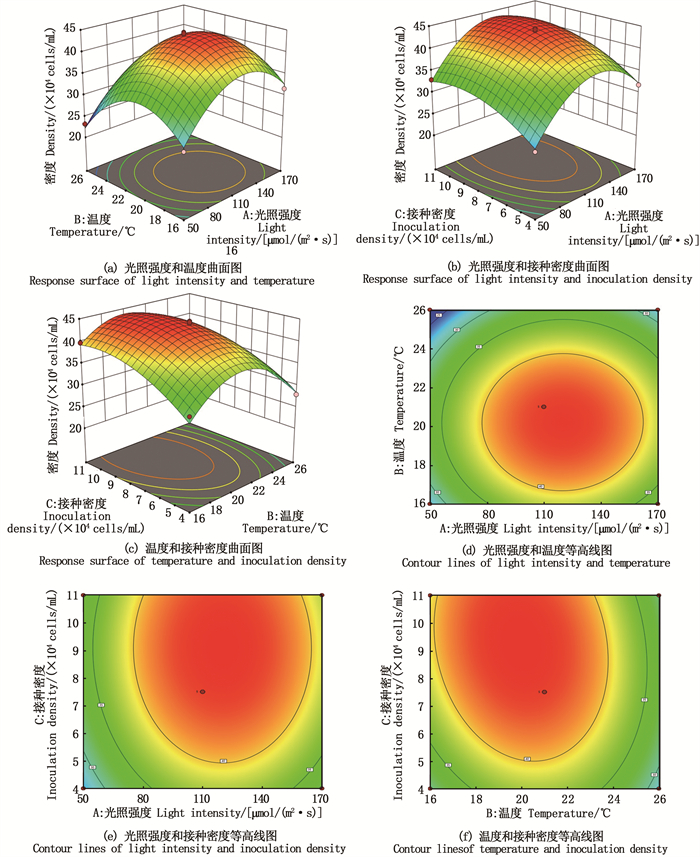
|
图 6 光照强度,温度和接种密度对雨生红球藻密度的3D图和等高线 Fig. 6 Response surface and contour lines of light intensity, temperature and inoculation density for cultured biomass of microalga H. plivialis |
通过Design-Expert 12软件Box-Behnken设计优化雨生红球藻培养条件,当藻细胞密度综合得分最大时,雨生红球藻的最优培养条件:光照强度119.89 μmol/(m2·s),温度19.99 ℃,接种密度9.25×104 cells/mL,在此培养条件下预测雨生红球藻培养细胞密度可达44.79×104 cells/mL。验证实验中,出于可操作性考虑将优化条件调整为光照强度120 μmol/(m2·s),温度20 ℃,接种密度9.25×104 cells/mL。根据上述条件进行3次平行试验,经过12 d的培养,雨生红球藻的细胞密度为(45.08±0.26)× 104 cells/mL,与模型预测值相近,表明该模型可以在雨生红球藻培养时用于预测培养效果。
3 讨论生物量是利用雨生红球藻生产虾青素的基础,也是提高雨生红球藻虾青素生产率的重要条件[17]。由于雨生红球藻细胞只有处于静细胞和静孢子阶段才能在细胞内积蓄大量虾青素,而静细胞和静孢子阶段细胞的增殖效率很低。促进游动细胞和游孢子增殖的条件与促进静细胞和静孢子合成虾青素的条件相差甚大[18]。因此,先优化生长条件获得最大藻细胞生物量再对获得的藻细胞进行诱导合成虾青素,成为雨生红球藻生产虾青素的基本策略。
植物对光照强度的利用从小到大可以分为4个区域:光限制区、光过渡区、光饱和区和光抑制区[19]。光限制区中藻的生长受到限制。在光过渡区到光饱和区中藻的细胞密度随着光强的提高而增加,光抑制区内的藻生长受到了抑制。光照强度对雨生红球藻绿色游动细胞的生长有着显著的影响。雨生红球藻生长适宜的光照强度已有报道,陈书秀等[20]报道的雨生红球藻生长最佳光照强度为50 μmol/(m2·s)。HARKER等[21]则认为最佳生长光照强度为50~60 μmol/(m2·s),才金玲等[22]与董庆霖等[23]认为雨生红球藻生长的最适光强在80 μmol/(m2·s)。XUE等[19]报道雨生红球藻游动细胞增殖的适宜光照强度在80~120 μmol/(m2·s)。陶云莹等[24]得出的雨生红球藻最佳光照强度为200 μmol/(m2· s)。本研究中光照强度在105 μmol/(m2·s)组,雨生红球藻细胞密度和干物质量均显著(P < 0.05)高于其他光照条件组,表明该光照强度适合本研究藻株游动细胞的大量增殖(图 1a)。造成不同学者获得的雨生红球藻生长的最适光照强度的差异: 一方面源于藻株的差异, 由于雨生红球藻的自然生境为小型水体,因此在进化上容易形成适应特定生境条件的地理藻株; 另一方面,微藻的生长是多种环境因子共同作用的综合表现,其他环境因子与光照强度之间存在一定的协同和拮抗作用。叶绿素和类胡萝卜素是藻类捕获不同能量光子的主要色素,在光限制区时,增加叶绿素的含量能增强藻类光合作用的能力[25]。本研究中,光照强度为35 μmol/(m2·s)组雨生红球藻叶绿素a、类胡萝卜素和总叶绿素的含量均显著的高于其他组别,推测这是雨生红球藻为了应对低光照强度的一种生理响应,藻细胞通过增加色素,捕获更多光子以保证细胞的生长。才金玲等[22]认为高光照强度会导致雨生红球藻游动细胞进入不动期,从而降低细胞增殖和藻细胞生物量。HARKER等[26]和陶云莹等[24]认为提高光照强度有利于雨生红球藻内虾青素的积累。本研究中也观察到了类似的结果,175 μmol/(m2·s)组细胞生物量降低,总叶绿素含量也降低,同时虾青素含量显著升高。由于高光照强度具有光漂白作用,导致藻细胞内氧自由基增多,因此藻细胞需要合成更多具有抗氧化效能的虾青素。
温度是生物生长发育的重要因素,过高或过低的温度都会影响到细胞内各种生物酶的活性,并影响营养物质的代谢、细胞增殖等,从而显著影响藻的生长[27]。就光合作用而言,高温会影响到卡尔文循环的运作,藻体细胞内部同化产物的代谢产生变化,最后影响藻的增殖[28]。有报道高温不利于雨生红球藻游动孢子的增殖[24],温度高于28 ℃则雨生红球藻的生长受到抑制[29]。本研究中,29 ℃组和33 ℃组藻细胞沉底明显,显微观察发现此两组雨生红球藻细胞鞭毛脱落,细胞壁增厚形成不动孢子且互相黏连结块。然而,学者对雨生红球藻的适宜培养温度有不同的报道。张宝玉等[30]筛选出的两株雨生红球藻的最适生长温度分别为15和20 ℃,苗凤萍等[31]报道雨生红球藻的最适生长温度为22~25 ℃。在异养或兼养条件下,较高的温度(30 ℃)有利于雨生红球藻的生长[32]。本研究的雨生红球藻藻株培养最适温度为21 ℃。同时发现该藻株的叶绿素、类胡萝卜素和总叶绿素均在21 ℃组有最大值,随着温度的升高细胞叶绿素和类胡萝卜素含量均显著降低(图 3),与细胞生长表现相一致。当温度超过25 ℃时本研究的雨生红球藻藻株细胞虾青素含量也显著降低(图 3),江红霞等[33]也有类似的发现。然而,也有学者[22]认为高温能促使细胞生成更多的活性氧从而诱导细胞加快虾青素的合成和积累。温度对雨生红球藻细胞内虾青素含量的影响可能与细胞所处的阶段及温度的胁迫强度有关。
初始接种密度会影响到最终雨生红球藻的生物量。接种密度为10×104 cells/mL,最终藻细胞密度可达49×104 cells/mL[24],李艳国等[34]报道2×104 cells/mL的接种密度最适合雨生红球藻游动细胞的增殖,最终的藻细胞密度可以达到26.52×104 cells/mL。本研究中,接种密度低于7.5×104 cells/mL时,藻细胞最终密度会随接种密度的增加而增加,接种密度大于7.5×104 cells/mL时藻细胞密度不随初始接种密度的变化而变化。接种密度为7.5 ×104 cells/mL,最终的藻密度可以达到42.17×104 cells/mL。
藻细胞的生长受外界多环境因素的耦合影响。单因子试验虽然能找出某个自变量的最优值,但难以直观地判别优化区域。响应曲面设计方法是将体系的响应作为一个或多个因素的函数,利用合理的试验设计方法并通过实验得到一定数据,采用多元二次回归方程来拟合因素与响应值之间的函数关系,运用图形技术将这种函数关系显示出来,可以直观获得试验设计中的最优化条件。本研究中,运用响应曲面设计方法对雨生红球藻生长的光照强度、温度、接种密度进行优化,获得雨生红球藻的最佳实际培养条件组合为光照强度120 μmol/(m2·s)、温度20 ℃、接种密度9×104 cells/mL,并获得了45.08× 104 cells/mL的细胞培养密度,该密度比单因素试验获得结果高出6.9%。
综上所述,通过响应曲面设计方法雨生红球藻生长的光照强度、温度和接种密度进行优化,得到该株雨生红球藻的最佳培养条件:光照强度为120 μmol/(m2·s),温度20 ℃,接种密度9.25×104 cells/mL。
| [1] |
LORENZ R T, CYSEWSKI G R. Commercial potential for Haematococcus microalgae as a natural source of astaxanthin[J]. Trends in Biotechnology, 2000, 18(4): 160-167. DOI:10.1016/S0167-7799(00)01433-5 |
| [2] |
CHEW B P, PARK J S. Carotenoid action on the immune response[J]. Journal of Nutrition, 2004, 134(1): 257-261. DOI:10.1093/jn/134.1.257S |
| [3] |
GUERIN M, HUNTLEY M E, OLAIZOLA M. Haematococcus astaxanthin: applications for human health and nutrition[J]. Trends in Biotechnology, 2003, 21(5): 210-216. DOI:10.1016/S0167-7799(03)00078-7 |
| [4] |
NAGENDRAPRABHU P, SUDHANDIRAN G. Astaxanthin inhibits tumor invasion by decreasing extracellular matrix production and induces apoptosis in experimental rat colon carcinogenesis by modulating the expressions of ERK-2, NFkB and COX-2[J]. Investigational New Drugs, 2011, 29(2): 207-224. DOI:10.1007/s10637-009-9342-5 |
| [5] |
HIGUERA-CIAPARA I, FÉLIX-VALENZUELA L, GOYCOOLEA F M. Astaxanthin: a review of its chemistry and applications[J]. Critical Reviews in Food Science and Nutrition, 2006, 46(2): 185-196. DOI:10.1080/10408690590957188 |
| [6] |
LIU Z Q, ZHANG J F, ZHENG Y G, et al. Improvement of astaxanthin production by a newly isolated Phaffia rhodozyma mutant with low-energy ion beam implantation[J]. Journal of Applied Microbiology, 2008, 104(3): 861-872. DOI:10.1111/j.1365-2672.2007.03603.x |
| [7] |
李艳, 高静. 雨生红球藻天然虾青素提取研究进展[J]. 食品与机械, 2020, 36(12): 211-217. LI Y, GAO J. Research progress on the extraction of natural astaxanthin from Haematococcus pluvialis[J]. Food and Machinery, 2020, 36(12): 211-217. DOI:10.13652/j.issn.1003-5788.2020.12.042 |
| [8] |
SUN W H, XING L H, LIN H, et al. Assessment and comparison of in vitro immunoregulatory activity of three astaxanthin stereoisomers[J]. Journal of Ocean University of China, 2016, 15(2): 283-287. DOI:10.1007/s11802-016-2716-3 |
| [9] |
魏东, 臧晓南. 大规模培养雨生红球藻生产天然虾青素的研究进展和产业化现状[J]. 中国海洋药物, 2001, 20(5): 4-8. WEI D, ZANG X N. Production of natural astaxanthin by mass cultivation of Haematococcus pluvialis: research advances and current situation of industrialization[J]. Chinese Journal of Marine Drugs, 2001, 20(5): 4-8. DOI:10.3969/j.issn.1002-3461.2001.05.002 |
| [10] |
成永旭, 蒋霞敏, 陈学豪, 等. 生物饵料培养学[M]. 2版. 北京: 中国农业出版社, 2005: 47-48. CHENG Y X, JIANG X M, CHEN X H, et al. Biological feed cultivation[M]. 2nd ed. Beijing: China Agriculture Press, 2005: 47-48. |
| [11] |
龙元薷. 乙酸钠兼养下雨生红球藻生长特性分析[D]. 青岛: 中国科学院海洋研究所, 2014: 5-9. LONG Y R. Growth characteristics analysis of Haematococcus pluvialis undermixotrophic culture with sodium acetate[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2014: 5-9. |
| [12] |
尚敏敏. 不同诱导条件对Haematococcus pluvialis LUGU虾青素积累的影响及其机制的初步研究[D]. 昆明: 昆明理工大学, 2016: 22. SHANG M M. Investigation on the effect and their mechanism of different induction condition on astaxanthin production in Haematococcus pluvialis LUGU[D]. Kunming: Kunming University of Science and Technology, 2016: 22. |
| [13] |
赵陆敏. 基于绿球藻、大型溞的猪场沼液净化及资源化利用的研究[D]. 上海: 上海海洋大学, 2018: 11-12. ZHAO L M. Study on purification and resource utilization of piggery biogas slurry based on Chlorococcum sp. and Daphnia magna Straus[D]. Shanghai: Shanghai Ocean University, 2018: 11-12. |
| [14] |
尚敏敏, 赵永腾, 赵鹏, 等. 黄腐酸对Haematococcus pluvialis LUGU虾青素积累和lcy基因表达量的影响[J]. 食品与生物技术学报, 2017, 36(7): 702-706. SHANG M M, ZHAO Y T, ZHAO P, et al. Effects of Fulvicacid on Astaxanthin accumulation and the transcript levels expression kinetics of lcy Gene of Haematococcus pluvialis LUGU[J]. Journal of Food Science and Biotechnology, 2017, 36(7): 702-706. DOI:10.3969/j.issn.1673-1689.2017.07.006 |
| [15] |
段绍君, 孙玉柱, 宋兴福, 等. 响应曲面法优化碳酸锂反应结晶工艺[J]. 化工学报, 2017, 68(11): 4169-4177. DUAN S J, SUN Y Z, SONG X F, et al. Optimization of reactive-crystallization process of lithium carbonate based on response surface methodology[J]. CIESC Jorunal, 2017, 68(11): 4169-4177. |
| [16] |
KARACAN F, OZDEN U, KARACAN S. Optimization of manufacturing conditions for activated carbon from Turkish lignite by chemical activation using response surface methodology[J]. Applied Thermal Engineering, 2007, 27(7): 1212-1218. DOI:10.1016/j.applthermaleng.2006.02.046 |
| [17] |
FÁBREGAS J, OTERO A, MASEDA A, et al. Two-stage cultures for the production of Astaxanthin from Haematococcus pluvialis[J]. Journal of Biotechnology, 2001, 89(1): 65-71. DOI:10.1016/S0168-1656(01)00289-9 |
| [18] |
PEREIRA S, OTERO A. Haematococcus pluvialis bioprocess optimization: effect of light quality, temperature and irradiance on growth, pigment content and photosynthetic response[J]. Algal Research, 2020, 51: 102027. DOI:10.1016/j.algal.2020.102027 |
| [19] |
XUE S Z, SU Z F, CONG W. Growth of Spirulina platensis enhanced under intermittent illumination[J]. Journal of biotechnology, 2011, 151(3): 271-277. DOI:10.1016/j.jbiotec.2010.12.012 |
| [20] |
陈书秀, 梁英. 光照强度对雨生红球藻叶绿素荧光特性及虾青素含量的影响[J]. 南方水产, 2009, 5(1): 1-8. CHEN S X, LIANG Y. Effects of illumination on the chlorophyll fluorescence parameters and astaxanthin content of Haematococcus pluvialis[J]. South China Fisheries Science, 2009, 5(1): 1-8. DOI:10.3969/j.issn.1673-2227.2009.01.001 |
| [21] |
HARKER M, TSAVALOS A J, YOUNG A J. Use of response surface methodology to optimise carotenogenesis in the microalga, Haematococcus pluvialis[J]. Journal of Applied Phycology, 1995, 7(4): 399-406. DOI:10.1007/BF00003797 |
| [22] |
才金玲, 欧阳泽瑞, 陈国兴, 等. 光照强度对雨生红球藻细胞生长和虾青素积累的影响[J]. 食品科技, 2013, 38(1): 17-20, 25. CHAI J L, OUYANG Z R, CHEN G X, et al. Influence of light intensity on cell growth and astaxanthin production by Haematococcus pluvialis[J]. Food Science and Technology, 2013, 38(1): 17-20, 25. |
| [23] |
董庆霖, 邢向英, 赵学明. 光照强度对雨生红球藻合成虾青素的影响[J]. 水生生物学报, 2007, 31(3): 445-447. DONG Q L, XING X Y, ZHAO X M. Effect of light intensity on astaxanthin synthesis in Haematococcus pluvialis[J]. Acta Hydrobiologica Sinica, 2007, 31(3): 445-447. DOI:10.3321/j.issn:1000-3207.2007.03.022 |
| [24] |
陶云莹, 王巧晗, 赫勇, 等. 光照强度和温度对雨生红球藻生长、虾青素及内源脱落酸积累的影响[J]. 中国海洋大学学报, 2016, 46(8): 28-36. TAO Y Y, WANG Q H, HE Y, et al. Effects of light intensity and temperature on the growth and accumulation of Astaxanthin and Endogenous Abscisic Acid (ABA) of Haematococcus plivialis[J]. Periodical of Ocean University of China, 2016, 46(8): 28-36. |
| [25] |
GREENE R M, GEIDER R J, KOLBER Z, et al. Iron-induced changes in light harvesting and photochemical energy conversion processes in eukaryotic marine algae[J]. Plant Physiology, 1992, 100(2): 565-575. DOI:10.1104/pp.100.2.565 |
| [26] |
HARKER M, TSAVALOS A J, YOUNG A J. Factors responsible for astaxanthin formation in the chlorophyte Haematococcus pluvialis[J]. Bioresource Technology, 1996, 55(3): 207-214. DOI:10.1016/0960-8524(95)00002-X |
| [27] |
BOYD P W, RYNEARSON T A, ARMSTRONG E A, et al. Marine phytoplankton temperature versus growth responses from polar to tropical waters-outcome of a scientific community-wide study[J]. PLoS One, 2013, 8(5): e63091. |
| [28] |
JIAO J, GRODZINSKI B. The effect of leaf temperature and photorespiratory conditions on export of sugars during steady-state photosynthesis in Salvia splendens[J]. Plant Physiology, 1996, 111(1): 169-178. DOI:10.1104/pp.111.1.169 |
| [29] |
WAN M X, ZHANG J K, HOU D M, et al. The effect of temperature on cell growth and astaxanthin accumulation of Haematococcus pluvialis during a light-dark cyclic cultivation[J]. Bioresource Technology, 2014, 167: 276-283. |
| [30] |
张宝玉, 李夜光, 耿亚红, 等. 适合大量培养的红球藻藻种的筛选[J]. 水生生物学报, 2004, 28(3): 289-293. ZHANG B Y, LI Y G, GENG Y H, et al. Selection of Haematococcus strains suitable for mass culture[J]. Acta Hydrobiologica Sinica, 2004, 28(3): 289-293. |
| [31] |
苗凤萍, 李夜光, 耿亚红, 等. 温度对雨生红球藻(Haematococcus pluvialis)生物量和虾青素产量的影响[J]. 武汉植物学研究, 2005, 23(1): 73-76. MIAO F P, LI Y G, GENG Y H, et al. The effects of temperature on the biomass and the Astaxanthin Output of Haematococcus pluvialis[J]. Journal of Wuhan Botanical Research, 2005, 23(1): 73-76. |
| [32] |
ZHANG X W, GONG X D, CHEN F. Kinetic models for astaxanthin production by high cell density mixotrophic culture of the microalga Haematococcus pluvialis[J]. Journal of Industrial Microbiology and Biotechnology, 1999, 23(1): 691-696. |
| [33] |
江红霞, 林雄平, 雷梦云, 等. 温度对雨生红球藻生长、虾青素累积和抗氧化能力的影响[J]. 水生态学杂志, 2015, 36(4): 63-68. JIANG H X, LIN X P, LEI M Y, et al. Effects of temperature on growth, astaxanthin accumulation and Antioxidative capacity in Haematococcus pluvialis[J]. Journal of Hydroecology, 2015, 36(4): 63-68. |
| [34] |
李艳国, 杨柳, 徐年军, 等. 雨生红球藻ZL-1生长和虾青素积累条件优化[J]. 生态科学, 2018, 37(1): 20-26. LI Y G, YANG L, XU N J, et al. Optimization of growth and astaxanthin accumulation of Haematococcus pluvialis ZL-1[J]. Ecological Science, 2018, 37(1): 20-26. |
2. Shanghai Aquaculture Engineering Technology Research Center, Shanghai Ocean University, Shanghai 201306, China;
3. National Experimental Teaching Demonstration Center of Fishery Science, Shanghai Ocean University, Shanghai 201306, China
 2023,
Vol. 32
2023,
Vol. 32


