2. 上海海洋大学 农业农村部淡水水产种质资源重点实验室, 上海 201306
三角帆蚌(Hyriopsis cumingii)是我国特有的淡水珍珠蚌[1],所产珍珠占世界淡水珍珠95%以上,占据重要的国际战略及经济地位。珍珠形成过程除了涉及生物矿化外,育珠工艺带来的伤口愈合、珍珠囊的形成及免疫调节,对珍珠的形成和生长至关重要[2-5],珍珠的形成实质上是一种病理性过程[6],但目前对其研究尚未深入开展。
免疫应答对育珠过程至关重要,温度等环境因素以及插核小片形状等都会对其免疫机制产生影响,对贝类各项生理指标产生影响,进而影响插核成功率及育珠质量[7-8],如插核手术引起三角帆蚌超氧化物歧化酶、酸性磷酸酶活性的升高[9],而常规小片移植后三角帆蚌血细胞中的白介素17以及半乳糖凝集素、同种移植炎症因子AIF等均出现表达上调[10-12]。无脊椎动物与脊椎动物免疫系统存在较大差别,主要依赖血淋巴细胞和多种体液因子实现细胞免疫和体液免疫[13]。研究已经证实珍珠囊由移植小片与受体贝外套膜融合而来,是外套膜组织在珍珠形成过程中的特化组织[14],一方面外套膜可以通过调节有机质的分泌形成生物矿化的成核位点,一方面又可以通过血细胞发挥细胞免疫和体液免疫[15-16]。过去一般认为贝类不产生免疫球蛋白,但是近年来陆续有研究[17-18]发现软体动物同样具有类抗体和免疫球蛋白,可见关于贝类免疫机制领域还有待进一步深入。
人工育珠主要通过小片或者珠核插核手术刺激珍珠囊的形成进而分泌珍珠质形成珍珠[8],5天是手术后贝类伤口愈合时期,而珍珠贝珍珠囊通常在插核后20~30 d已经初步形成,50 d前后珍珠囊逐渐开始分泌珍珠质,而90 d左右珍珠囊已基本形成,因此可以认为插核后5、20、50、90 d是珍珠囊形成过程中几个重要节点[19-21],然而上述结论主要通过组织观察等方法获得,尚缺乏分子证据证明,有待进一步检验。
本研究基于iTRAQ技术对三角帆蚌珍珠囊和外套膜外膜差异蛋白进行对比分析,从蛋白组学角度对参与珍珠囊形成的免疫相关蛋白进行筛选和讨论,而后结合数字表达谱分析其mRNA表达水平,为进一步阐明珍珠囊形成中的免疫调节机制以及育珠技术改良提供理论基础,并为后续贝类免疫系统调节网络提供基础。
1 材料与方法 1.1 材料 1.1.1 实验动物实验中所用的三角帆蚌采自浙江省诸暨市珍珠养殖基地,挑选同批繁育且个体生长情况均一、健康的未插核三角帆蚌200只。对三角帆蚌个体大小进行测量统计[长:(13.3±0.4) cm;宽:(7.6±0.4) cm;高:(3.4±0.2) cm],养殖于实验室条件完全相同的水族箱内,水温控制在25 ℃上下,溶氧保持在(5.0±0.3)mg/L,并以小球藻(Chlorella vulgaris)投喂,每天2次,并24 h不断充氧,每5 d换1次水,换水量不超过水箱水量1/3。
1.2 外套膜插核手术及测序样品采集 1.2.1 插核手术实验三角帆蚌随机分为2组,每组100只,参考文献[1]和[21]的常规小片移植方法对其中一组(珍珠囊组)进行插核手术,另一组(外套膜组)不进行手术处理,手术后将两组蚌分别放入5个水箱中以相同条件养殖,用于后续组织样品采集。
1.2.2 样品采集在插核后第90天时,从插核组及未插核组各水箱内选取4只蚌(20只/组, 共40只蚌),用手术刀小心割断蚌两侧闭壳肌,采集插核同位点组织的外套膜及珍珠囊组织。每个样品50 mg,迅速放置于液氮中用于后续蛋白组学测序分析。
在插核组插核后第5天和第20天分别采集三角帆蚌插核组织部位及第50天和第90天的珍珠囊组织,插核部位及珍珠囊取样部位均位于育珠蚌外套膜外膜与内膜之间靠近外膜的部位。每组每箱内选取4只蚌(20只/组, 共80只蚌),并以未进行手术的三角帆蚌外套膜样品作为空白对照,用于开展数字基因表达谱(digital gene expression profiling,DGE)实验。
1.3 iTRAQ蛋白组学分析 1.3.1 总蛋白提取及iTRAQ测序采用超声裂解法对样品总蛋白进行提取并检测蛋白提取质量,基于色氨酸质量浓度和荧光分光光度对蛋白质质量浓度进行检测,同时采用SDS-PAGE方法对蛋白质完整性进行检测,具体步骤均参照文献[22]说明。
采用胰蛋白酶(Trypsin)将蛋白质水解为肽段,每组样品分别取肽段样品20 μg并用iTRAQ试剂进行标记,然后采用Easy nLC 1000和Orbitrap Elite液质联用技术进行一级质谱,质谱分析使用Orbitrap Elite,数据采集鲫鱼Xcalibur平台完成。
1.3.2 信息分析流程蛋白质定量信息分析首先对原始文件进行峰值识别并得到对应峰列表;基于Maxquant网站中的Uniprot release 2016_07(https://www.uniprot.org/)对质谱检测原始数据进行检索,然后将数据进行归一化处理,并参考GO(http://www.geneontology.org/)、KEGG(http://www.genome.jp/kegg/)、UniProt(www.uniprot.org)、Swiss-Prot(http://www.ebi.ac.uk/uniprot)、STRING(https://www.string-db.org/)、Reactome(https://reactome.org/)、NCBI(https://www.ncbi.nlm.nih.gov/)、EBI(https://www.ebi.ac.uk/)、UCSC(http://genome.ucsc.edu/)、TCGA(https://www.tcga.org/)等数据库进行注释、鉴定及生物信息分析。
1.4 基因数字表达谱(DGE)构建 1.4.1 总RNA提取及DGE测序采用TRIzol(Invitrogen, USA)一步法提取RNA,样品送至北京诺禾致源生物信息科技有限公司进行RT-PCR及进一步处理,并通过Illumina HiSeqTM2000测序,构建基因数字表达谱,测序数据通过实验室构建的转录组数据进行注释和分析,所用生物信息库如上所示,并通过两两比较进行差异分析。
1.4.2 数据分析与统计蛋白组差异分析中,珍珠囊对比外套膜组织,上调差异蛋白比值设置为≥ 1.5,下调差异蛋白比值设置为≤ 0.67,采用t检验,两组间显著水平为P < 0.05,极显著水平为P < 0.01。DGE差异表达分析采用基于负二项分布模型的DESeq进行分析,阈值设定为|log2(Fold change)| > 1且q值< 0.005。
采用Excel 2016软件对mRNA表达水平显著性进行单因素方差分析和Duncan氏法多重比较,描述性统计值使用平均值±标准误(Mean±SE)表示,P < 0.05为差异显著。
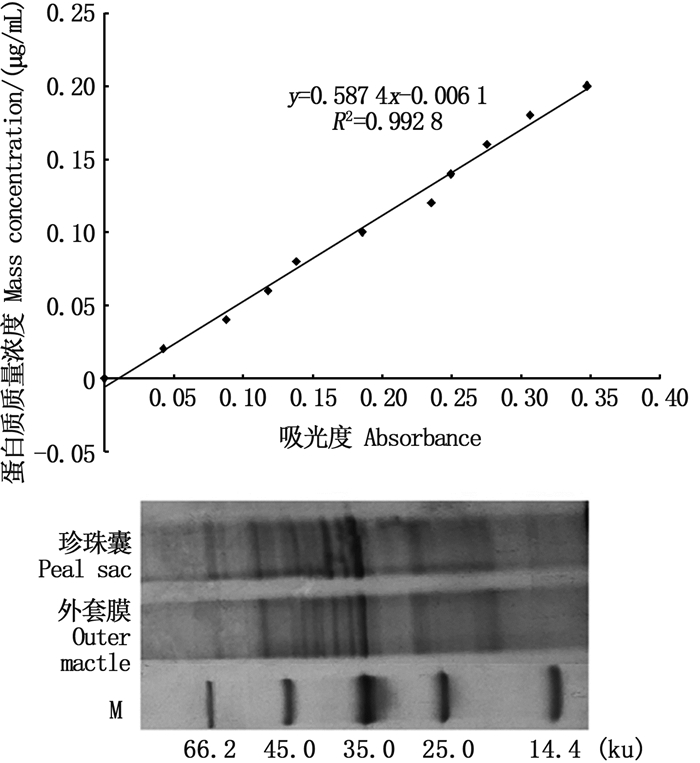
2 结果与分析 2.1 蛋白质定量和质量分析蛋白质含量与色氨酸的含量成正线性相关关系,通过测定蛋白质样品中的色氨酸含量,计算蛋白质的浓度。根据色氨酸定量标准曲线(图 1)参考样品测得的吸光度计算出珍珠囊、外套膜蛋白质含量分别为17.82和18.95 μg/μL。采用SDS-PAGE凝胶电泳法对抽提蛋白质进行质量分析,电泳结果中蛋白降解较少,条带清晰且排布较为整齐。
|
图 1 色氨酸定量标准曲线及蛋白质完整性检验 Fig. 1 Standard curve for tryptophan quantification and detection results of protein integrity |
通过测序分析总共鉴定到1 871个蛋白,根据不同数据库的注释信息,通过GO功能数据库总共注释到1 586个蛋白质,KEGG数据库总共注释到1 331个蛋白质,COG注释到的蛋白质数1 039个。
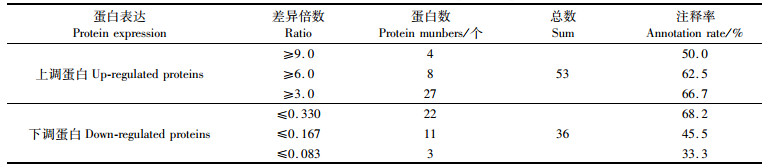
从三角帆蚌的珍珠囊与外套膜对比筛选到显著差异蛋白总计119个,上调蛋白74个,下调蛋白45个,其中GO或者KEGG均被注释到的蛋白共89个,包括上调蛋白53个、下调蛋白36个;在这些差异蛋白中,差异倍数大于3.0的上调蛋白有27个,差异倍数大于6.0的有8个而大于9.0的有4个,下调蛋白中差异倍数小于0.33的有22个,而差异倍数小于0.167和0.083的分别为11个和3个。见表 1。
|
表 1 差异蛋白注释情况 Tab.1 Annotation of differentially expressed proteins |
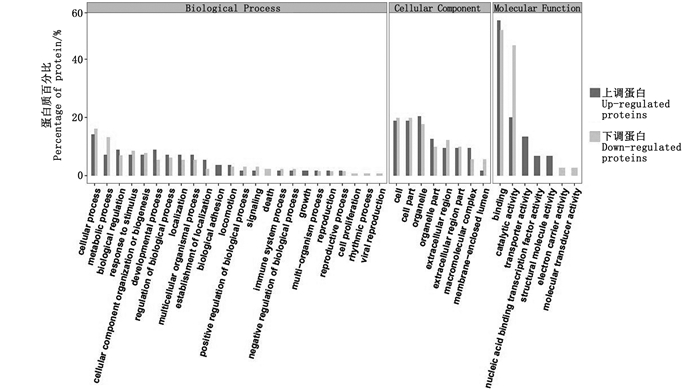
研究通过GO功能注释(图 2),生物学过程中注释到的差异蛋白主要富集在细胞进程、代谢、生物调节、应激反应、生物合成和发育等类别中;分子功能注释中蛋白多富集在结合、催化活性和结构分子活性、运载体活性、调节酶活性等;对于细胞组分,蛋白主要富集在细胞、细胞器、生物膜等中。
|
图 2 样品组间差异表达蛋白GO功能注释 Fig. 2 Gene ontology annotation of differentially expressed proteins between two groups |
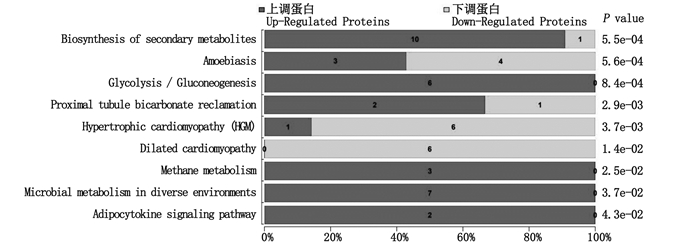
在KEGG富集分析中,与正常外套膜组织相比,总计筛选出74个被注释的差异蛋白,主要被标记为82条不同的KEGG,其中9个通路呈显著差异(P≤ 0.05,图 3),差异蛋白主要富集在次生代谢产物的生物合成、变形虫病、糖酵解与糖异生、近端小管碳酸氢盐回收、肥厚性心肌病、扩张型心肌病、甲烷代谢、微生物在不同环境中的代谢以及脂肪细胞因子信号通路中。其中肥厚性心脏病与扩张型心肌病有关通路蛋白主要表现为下调,而次生代谢生物合成、甲烷代谢、微生物不同环境中的代谢以及脂肪因子信号通路中的差异蛋白主要表现为上调(珍珠囊&外套膜)。
|
图 3 差异表达蛋白KEGG通路富集分析 Fig. 3 KEGG pathway enrichment of differentially expressed proteins |
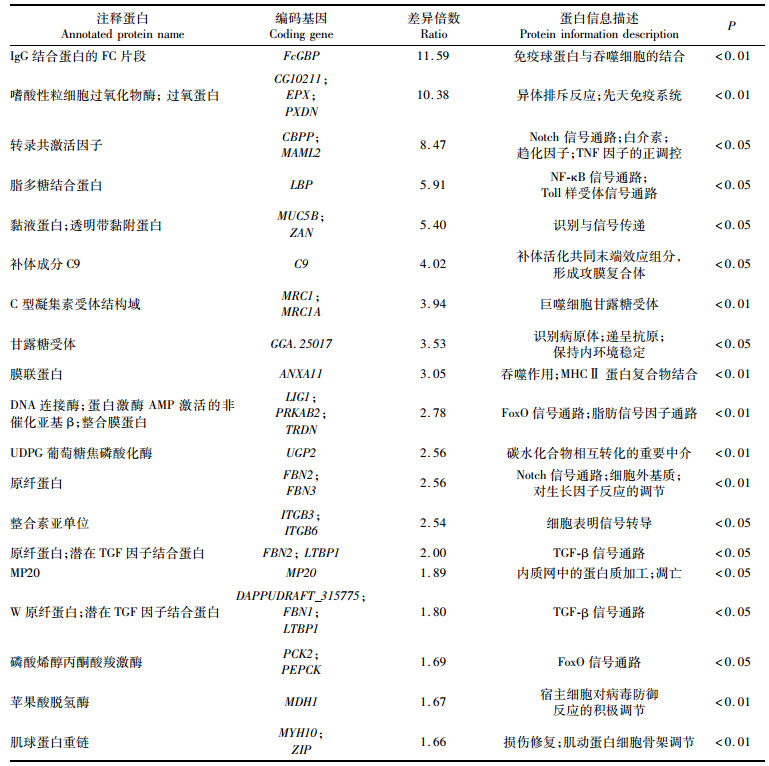
进一步生物信息分析从三角帆蚌珍珠囊与外套膜蛋白组中筛选到珍珠囊相对于外套膜外膜的19个上调蛋白。上调蛋白中FcGBP、EPX、MAML2等差异倍数大且差异极显著(P < 0.01),这些蛋白分别与免疫球蛋白的结合作用、异体排斥反应以及免疫应答和趋化过程有关,参与免疫识别与应答、炎症与凋亡等信号通路, 见表 2。
|
表 2 三角帆蚌珍珠囊&外套膜上调蛋白筛选 Tab.2 Screening of up-regulated protein in pearl sac and outer mantle of Hyriopsis cumingii |
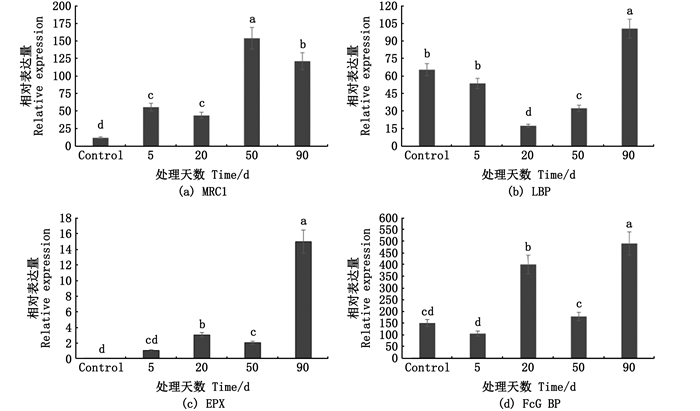
从筛选所得上调蛋白中对MRC1、LBP、EPX、FcGBP进行不同时期mRNA表达水平分析(图 4)。结果发现MRC1、LBP、EPX、FcGBP等上调蛋白对应基因在插核后90 d的珍珠囊组织中同样显示表达量上调,且明显高于插核后其他采样时间组。其中,MRC1和EPX在插核后的90 d中对应mRNA表达量大致呈上升趋势,而LBP在插核后20 d的珍珠囊中表达量最低,FcGBP的表达量在插核后5 d和50 d表达量处于较低水平,其他采样时间呈较高表达水平(P < 0.05)。
|
Control为对照组,即外套膜外膜中相应蛋白mRNA表达量;5、20为小片植入后第5、20天的组织表达情况;50、90为小片植入后第50、90天的珍珠囊表达情况。 Control means the expression of the outer mantle; 5, 20 means the tissues of the 5th, 20th days after small piece insertion; 50, 90 means the pearl sac of the 50th, 90th days after small piece insertion. 图 4 免疫上调蛋白mRNA表达分析 Fig. 4 mRNA expression analysis of related up-regulated immune protein |
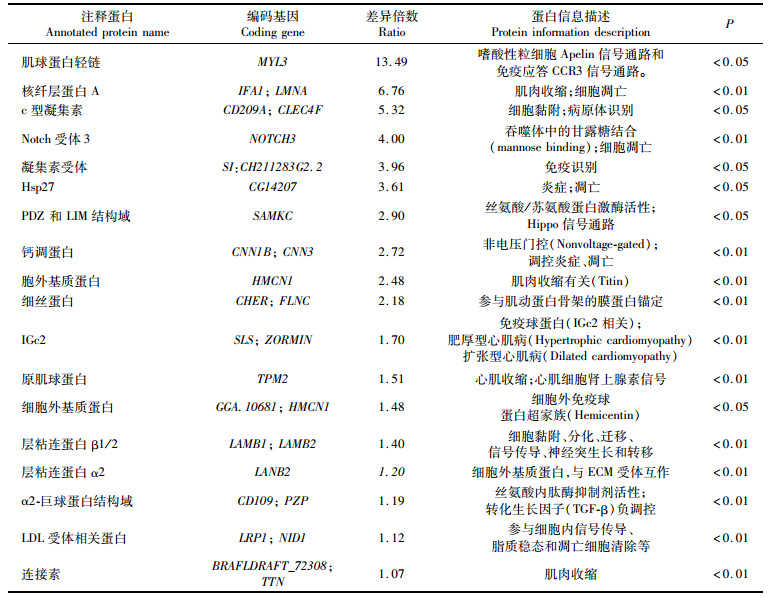
对筛选到的18个下调蛋白进行分析。其中,LAMB1、LAMB2、LANB2、CD109、LRP1、CNN3等下调极显著(P < 0.01),与细胞间及细胞内的信号传递过程相关,从而参与调节免疫进程。同时筛选中发现,这些免疫相关蛋白参与凋亡、免疫识别、信号转导等通路。见表 3。
|
表 3 三角帆蚌珍珠囊&外套膜下调蛋白筛选 Tab.3 Screening of down-regulated protein in pearl sac and outer mantle of Hyriopsis cumingii |
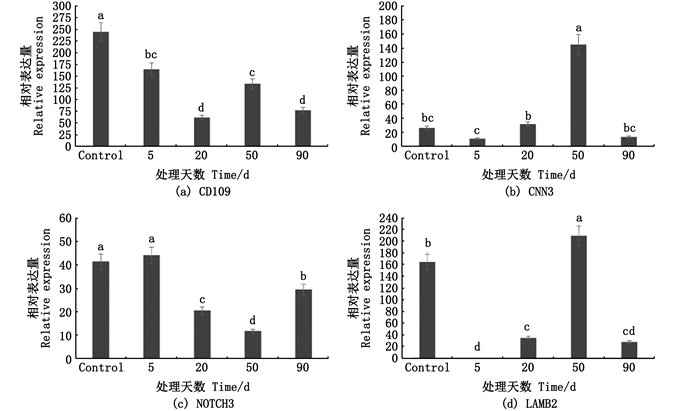
对珍珠囊相对于外套膜下调的免疫相关蛋白CD109、CNN3、NOTCH3、LAMB2基因mRNA表达水平进行分析(图 5),上述蛋白mRNA在插核后90 d均呈现相应表达下调,且CD109和NOTCH3在珍珠囊形成过程中表达量总体呈现下调趋势,而LAMB2和CNN3的mRNA表达量尽管在插核后5、20、90 d较低,却在插核后50 d显著高于其他检测时间。
|
Control为对照组,即外套膜外膜中相应蛋白mRNA表达量;5、20为小片植入后第5、20天的组织表达情况;50、90为小片植入后第50、90天的珍珠囊表达情况。 Control means the expression of the outer mantle; 5, 20 means the tissues of the 5th, 20th days after small piece insertion; 50, 90 means the pearl sac of the 50th, 90th days after small piece insertion. 图 5 免疫下调蛋白mRNA表达分析 Fig. 5 mRNA expression analysis of related down-regulated immune protein |
研究中发现,差异蛋白大多与能量代谢、疾病发生等通路相关。人工育珠工艺会带来伤口愈合以及增强自身免疫抵御病原物入侵等问题,因此生物合成、能量代谢等活性的增强可能是为了满足伤口愈合需要,而变形虫病、肥厚型心肌病及扩张型心肌病等通路相关蛋白的改变则是为了适应伤口愈合及珍珠囊形成需要。此外,在对各差异蛋白功能进行具体分析时,还注意到许多受Ca2+调控或调节转运Ca2+的蛋白以及与细胞黏附、紧密连接等功能有关的蛋白差异表达,推测主要是由珍珠形成过程中外套膜细胞的迁移及生物矿化等过程引起[3, 15-16]。
贝类免疫功能主要是通过贝类血细胞以及其血淋巴中的各种体液因子发挥作用,随着近年来贝类免疫学领域研究的深入,传统贝类免疫学观点似乎已经不足以概括现有研究成果,亟待对于贝类免疫体系进行重新描述。本研究基于iTRAQ技术并结合统计学和开源数据库对三角帆蚌外套膜外膜与珍珠囊进行分析,筛选免疫相关差异表达蛋白并对其中13个蛋白进行讨论,这些蛋白主要与免疫球蛋白、吞噬作用、炎症反应、细胞外基质等通路相关。
3.1 免疫识别与应答相关蛋白本研究首次发现lgG的Fc片段(FcGBP)、CD109的差异表达。在珍珠囊&外套膜中发现FcGBP的显著上调(P < 0.05),FcGBP被证实可能在TGF-β1诱导的间充质转移中发挥重要作用,也可能在珍珠囊形成中发挥着细胞保护以及一定的抗炎作用[23]。然而CD109蛋白显示为表达下调,作为一种以GPI为基础的糖蛋白,CD109可能在破骨前细胞中调节骨质代谢并承担某些未知的重要功能[24],还可能作为一种TGF-β拮抗剂通过Ca2+以及TGF-β通路对珍珠囊形成产生影响[25]。同时,实验还发现了与细胞外基质ECM有关蛋白的表达下调,包括LAMB1、LAMB、LANB2等蛋白,主要介导雷帕霉素(mTOR)通路。mTOR对TGF-β具有正调控作用[26],因此这些蛋白可能也通过介导外套膜细胞间质转化调节珍珠囊的形成。
此外,研究中还筛选到终末补体成分C9蛋白表达上调,目前C3在海水和淡水贝类中均已被发现且组成型表达,能介导炎症以及吞噬作用并负责免疫监视和非自身抗原消除[27-28]。因此尽管C9在贝类中缺乏研究,但C9可能与C3共同作用,在同种异体移植以及同种免疫反应和复杂的补体激活机制中发挥作用[29]。
值得注意的是,FcGBP与CD109均与免疫识别应答相关,而在对FcGBP和CD109的mRNA表达量分析中,二者表达情况大体上相反。FcGBP在插核后第20天的插核组织以及插核后第90天的珍珠囊组织中均显著高于外套膜以及其他检测天数的表达量(P < 0.05),而CD109在组织中的mRNA表达量则总体呈现下调趋势,且在第20天表达量最低,可见插核后20 d是较为关键的时期。CD109主要对TGF-β产生负调控,而TGF-β能够抑制免疫活性细胞增殖、TNF-β等细胞因子产生促进ECM表达以及伤口愈合等功能[25],不利于TGF-β发挥功能;而FcGBP是免疫球蛋白识别的关键区域,对TGF-β具有正调控作用。因此FcGBP的上调和CD109的下调都有利于TGF-β调节受体蚌外套膜对移植小片的免疫识别及插核手术后的伤口愈合,进而促进外套膜与珍珠囊的融合以及珍珠囊的形成[14]。
3.2 吞噬作用及其相关蛋白研究发现C型凝集素受体(MRC1)和嗜酸性粒细胞过氧化酶(EPX)出现上调。其中,凝集素主要参与贝类细胞免疫中的趋化过程[30],而溶酶体酶,如嗜酸性粒细胞阳离子蛋白等对于多种微生物以及哺乳动物组织、细胞等具有较高的细胞毒性[31],而贝类同种小片的移植会引起免疫识别应答并被血细胞吞噬消化[2],可见上述两种蛋白对于贝类免疫系统发挥作用具有重要意义。
结合MRC1与EPX在插核后不同阶段的mRNA的表达情况,两者的表达量大体上随天数呈上升趋势且均在检测后期高表达,MRC1在第50、90天表达量显著高于外套膜组织及其他检测时期(P < 0.05),而EPX仅在第90天高表达。因此推测,上述两种蛋白的上调增强血细胞对异己的识别作用一方面是为了强化吞噬及趋化过程,促进珍珠囊形成[14],另一方面也可能是该时期珍珠囊已经基本形成,因此机体提高自身免疫能力以保护机体免于病原体入侵造成进一步的损伤甚至死亡[30]。
3.3 炎症、凋亡相关蛋白对炎症介质释放以及细胞凋亡的调控可能有利于移植手术后的上皮细胞愈合及珍珠囊形成,实验中LBP的上调以及CNN3、NOTCH3、FBN1、FBN2、LTBP1、Hsp27等的下调可以印证这一观点。Hsp27可通过调节NF-κB和Hippo通路保护上皮细胞在炎症反应中免受损伤并促进细胞增殖[32],然而值得注意的是Hsp27既能诱导受损器官或免疫细胞释放促炎介质引发细胞凋亡[32],也能在缺血、炎症以及在应激条件下发挥抗炎作用保护细胞[33],这主要取决于Hsp27相对于细胞发挥功能的具体位置,因此有待于进一步的实验检验。结合CNN3、NOTCH3、FBN1、FBN2、LTBP1与Notch和TGF-β等通路高度相关,对上皮细胞具有重要的调节作用[34-35],同时这些蛋白的下调还能通过Jun通路、p38的MAPK通路以及某些细胞外信号对细胞凋亡和细胞周期等进行调控,并发挥一定的免疫功能[36]。推测这些功能蛋白的差异表达通过调节外套膜细胞的增殖以及保护其免于在炎症中受损等方式促进上皮细胞的创伤修复,进而利于珍珠囊的形成。
有趣的是,LBP、CNN3、NOTCH3的mRNA表达量均在检测中后期出现不同程度上调,而CNN3尽管在第90天表达水平与蛋白组学检测结果相符,却在50天反常上调。分析推测NOTCH3可能是在贝类珍珠囊形成过程中减少炎症反应,减弱细胞应激,而LBP作为LPS的结合蛋白,上调后可增强贝类对病原体的抵抗能力,由此推测CNN3在50天的高表达也与此有关。因此认为,在插核后珍珠囊形成的过程中,贝类首先会减弱凋亡和炎症等免疫排斥反应,同时也会根据机体需要上调某些免疫过程抵御病原体入侵。
3.4 其他免疫相关差异蛋白除上述蛋白外,研究还发现许多功能未知或者尚且缺乏文献参考的差异表达蛋白,如膜联蛋白ANXA11。膜联蛋白在贝类缺乏研究,但ANXA5与抗炎反应、凋亡调节等有关[37],且ANXA11在人IgG4相关疾病中是IgG的自身抗体靶标[38],提示其可能也与免疫球蛋白发挥功能有关,这也与研究中观察到FcGBP的表达上调相符,因此也可能参与免疫识别及珍珠囊形成。此外还有大量与心肌收缩相关的差异蛋白,根据KEGG富集分析及GO注释结果,这些蛋白大多受到Ca2+调控,继而对肌动蛋白、肌球蛋白以及肌肉收缩等产生负调控作用。在珍珠囊形成过程中,表皮细胞仅在游离端形成中间连接而在其余部分彼此分离形成较大空间[21],因此推测下调心肌收缩有关蛋白可能提升了珍珠囊的延展性以更好包裹珍珠。然而由于上述这些蛋白的功能缺乏足够的文献支持,本文未展开讨论。
4 结论本研究利用iTRAQ技术对三角帆蚌外套膜外膜以及珍珠囊进行蛋白组学分析,总共鉴定到蛋白质1 871个,其中差异蛋白119个,对差异表达蛋白进行GO注释和KEGG通路分析,筛选分析了13个免疫相关蛋白,主要参与NF-κB、Notch、凋亡以及炎症反应等通路。FcGBP、CD109、C3等免疫球蛋白或补体成分的表达上调提示:贝类可能存在与脊椎动物类似的免疫系统,并具有抗体类似物发挥特异性免疫;ECM有关蛋白、吞噬作用相关蛋白的表达差异主要与异己识别、免疫排斥等功能相关,这可能是贝类珍珠囊形成过程中促进伤口愈合以及减少应激伤害的调节手段;而炎症相关通路中的差异蛋白以及膜联蛋白A11的表达上调可能介导了细胞凋亡和炎症反应,这可能与珍珠形成过程中移植小片与受体蚌外套膜的免疫排斥反应以及融合过程有关;iTRAQ分析中筛选到的免疫相关蛋白与其对应的mRNA在珍珠囊中的表达情况基本相符,并进一步证实插核后5 d左右免疫相关因子主要参与伤口愈合过程,可能与小片和外套膜的融合过程相关[14],而插核50~90 d是珍珠囊形成过程中免疫调节的关键时期。
此外, 分析还发现免疫相关蛋白在通路中发挥功能的过程并非彼此孤立的,提示这些蛋白可能通过信号通路之间的串话实现互作。后续研究将关注不同免疫相关蛋白间的相互作用及其潜在关联阐述贝类免疫系统调节网络,以期为后续贝类免疫学相关研究提供新视角。
| [1] |
刘孝华. 河蚌的生物学特性及人工育珠技术[J]. 安徽农业科学, 2008, 36(35): 15524-15525, 15624. LIU X H. The biological characteristics of freshwater clam and the artificial technology of cultivating pearls[J]. Journal of Anhui Agricultural Sciences, 2008, 36(35): 15524-15525, 15624. DOI:10.3969/j.issn.0517-6611.2008.35.099 |
| [2] |
魏晋奋. 合浦珠母贝组织移植免疫排斥的分子机制研究[D]. 上海: 上海海洋大学, 2017. WEI J F. The molecular mechanism of immune rejection in the pearl oyster Pinctada fucata to tissue transplantation[D]. Shanghai: Shanghai Ocean University, 2017. |
| [3] |
李文娟, 黄凯, 李倩, 等. 三角帆蚌内脏团不同部位插核育珠对珍珠囊形成的影响[J]. 中国水产科学, 2014, 21(6): 1098-1107. LI W J, HUANG K, LI Q, et al. Effects of different tissue sites insert-nucleus on pearl-sac formation in visceral mass of Hyriopsis cumingii[J]. Journal of Fishery Sciences of China, 2014, 21(6): 1098-1107. |
| [4] |
黄凯, 施志仪, 李文娟, 等. 三角帆蚌内脏团不同插核部位对机体生理代谢的影响[J]. 水生生物学报, 2013, 37(6): 1085-1093. HUANG K, SHI Z Y, LI W J, et al. The effect of different insetting-nucleus locations on body physiological metabolism in visceral mass of Hyriopsis cumingii[J]. Acta Hydrobiologica Sinica, 2013, 37(6): 1085-1093. |
| [5] |
谢绍河, 林伟财, 梁飞龙, 等. 三角帆蚌内脏团植核育珠技术的初步研究[J]. 海洋湖沼通报, 2015(4): 27-32. XIE S H, LIN W C, LIANG F L, et al. A preliminary methodological study on pearl production by nucleating the visceral mass of Hyriopsis cumingii[J]. Transactions of Oceanology and Limnology, 2015(4): 27-32. |
| [6] |
黄丹丹. 三角帆蚌珍珠囊不同发育时期基因表达差异分析及IRAK4和TRAF6基因功能研究[D]. 上海: 上海海洋大学, 2019. HUANG D D. Differential expression analysis of gene in the development of pearl sac in Hyriopsis cumingii post mantle implantation and function analysis of IRAK4 and TRAF6[D]. Shanghai: Shanghai Ocean University, 2019. |
| [7] |
魏雯璐, 刘琪, 张丞澍, 等. 不同温度下马氏珠母贝干露耐受能力及其免疫相关基因表达的变化[J]. 广东海洋大学学报, 2021, 41(2): 69-75. WEI W L, LIU Q, ZHANG C S, et al. Changes of tolerance of air exposure and immune-related gene expression of Pinctada fucata martensii at different temperatures[J]. Journal of Guangdong Ocean University, 2021, 41(2): 69-75. |
| [8] |
翁雄, 李有宁, 樊虎, 等. 细胞小片形状对合浦珠母贝插核休养期死亡率和脱核率的影响[J]. 广东农业科学, 2012, 39(23): 119-122. WENG X, LI Y N, FAN H, et al. Effect of different shapes of mantle piece on death rate and nucleus spitting rate during the recuperation period of pearl oyster Pinctada fucata nucleus insertion[J]. Guangdong Agricultural Sciences, 2012, 39(23): 119-122. |
| [9] |
何秀娟, 施志仪, 李文娟. 插核手术对三角帆蚌血淋巴中3种免疫防御因子的影响[J]. 中国水产科学, 2009, 16(6): 859-867. HE X J, SHI Z Y, LI W J. Effects of pearl-nucleus-inserting operation on three immune factors in Hyriopsis cumingii Lea[J]. Journal of Fishery Sciences of China, 2009, 16(6): 859-867. DOI:10.3321/j.issn:1005-8737.2009.06.007 |
| [10] |
ZHANG R, WANG M, XIA N, et al. Cloning and analysis of gene expression of interleukin-17 homolog in triangle-shell pearl mussel, Hyriopsis cumingii, during pearl sac formation[J]. Fish & Shellfish Immunology, 2016, 52: 151-156. |
| [11] |
BAI Z Y, ZHAO L T, CHEN X J, et al. A galectin from Hyriopsis cumingii involved in the innate immune response against to pathogenic microorganism and its expression profiling during pearl sac formation[J]. Fish & Shellfish Immunology, 2016, 56: 127-135. |
| [12] |
LI Q Q, BAI Z Y, ZHAO L T, et al. Characterization of allograft inflammatory factor-1 in Hyriopsis cumingii and its expression in response to immune challenge and pearl sac formation[J]. Fish & Shellfish Immunology, 2016, 59: 241-249. |
| [13] |
柯佳颖, 陈寅山, 戴聪杰. 贝类免疫机制研究概况[J]. 宁德师专学报(自然科学版), 2009, 21(2): 113-117, 127. KE J Y, CHEN Y S, DAI C J. Review of researches done on the malacozoan immune mechanism[J]. Journal of Ningde Teachers College (Natural Science), 2009, 21(2): 113-117, 127. |
| [14] |
胡宏辉, 白志毅, 郭思鹏, 等. 体外培养条件下三角帆蚌胚胎早期发育观察及胚胎发育生物学零度和有效积温分析[J]. 水产学报, 2021, 45(11): 1835-1842. HU H H, BAI Z Y, GUO S P, et al. Continuous observation of early embryonic development of Hyriopsis cumingii under in vitro culture condition and analysis of biological zero point and effective accumulated temperature[J]. Journal of Fisheries of China, 2021, 45(11): 1835-1842. |
| [15] |
孙朝虎, 白志毅, 张朝晖, 等. 不同月龄三角帆蚌幼蚌内外壳色相关性分析[J]. 上海海洋大学学报, 2021, 30(1): 58-64. SUN C H, BAI Z Y, ZHANG C H, et al. Correlation analysis between inner shell color and outer shell color of juvenile mussels at different month ages in Hyriopsis cumingii[J]. Journal of Shanghai Ocean University, 2021, 30(1): 58-64. |
| [16] |
黄敬亮. 合浦珠母贝外套膜组织和血细胞在贝壳生长中的作用研究[D]. 北京: 清华大学, 2019. HUANG J L. The functions of the mantle tissue and hemocytes in the shell growth of Pinctada fucata[D]. Beijing: Tsinghua University, 2019. |
| [17] |
施志仪, 杨显祥, 陈晓武, 等. 三角帆蚌alpha-2巨球蛋白cDNA全长的克隆及表达特征[J]. 水产学报, 2008, 32(4): 526-532. SHI Z Y, YANG X X, CHEN X W, et al. Full-length cdna cloning and expression characterization of alpha-2 macroglobulin from Hyriopsis cumingii[J]. Journal of Fisheries of China, 2008, 32(4): 526-532. |
| [18] |
刘斐斐, 崔晓羽, 董赛赛, 等. 三角帆蚌中WNT4基因克隆及表达分析[J]. 上海海洋大学学报, 2020, 29(6): 801-810. LIU F F, CUI X Y, DONG S S, et al. Cloning and expression analysis of WNT4 gene in the Hyriopsis cumingii[J]. Journal of Shanghai Ocean University, 2020, 29(6): 801-810. |
| [19] |
NORTON J H, LUCAS J S, TURNER I, et al. Approaches to improve cultured pearl formation in Pinctada margaritifera through use of relaxation, antiseptic application and incision closure during bead insertion[J]. Aquaculture, 2000, 184(1/2): 1-17. |
| [20] |
李家乐, 刘越. 影响养殖珍珠质量的主要因子[J]. 水产学报, 2011, 35(11): 1753-1760. LI J L, LIU Y. The main influencing factors on the quality of cultured pearls[J]. Journal of Fisheries of China, 2011, 35(11): 1753-1760. |
| [21] |
杜晓东, 焦钰, 邓岳文, 等. 马氏珠母贝Pinctada martensii珍珠囊发育的超微结构观察[J]. 海洋学报, 2010, 32(5): 160-164. DU X D, JIAO Y, DENG Y W, et al. Ultrastructure of the pearl sac cells of pearl oyster Pinctada martensii[J]. Haiyang Xuebao, 2010, 32(5): 160-164. |
| [22] |
刘凡, 郭磊, 陈秀红, 等. G1与G95代次鸡滑液囊支原体的差异蛋白质组学分析[J]. 畜牧与兽医, 2021, 53(6): 52-60. LIU F, GUO L, CHEN X H, et al. Differential proteomic analysis of Mycoplasma synoviae strains of passge 1 and 95[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(6): 52-60. |
| [23] |
XIONG L, WEN Y, MIAO X Y, et al. NT5E and FcGBP as key regulators of TGF-1-induced epithelial-mesenchymal transition (EMT) are associated with tumor progression and survival of patients with gallbladder cancer[J]. Cell and Tissue Research, 2014, 355(2): 365-374. |
| [24] |
MⅡ S, HOSHINO A, ENOMOTO A, et al. CD109 deficiency induces osteopenia with an osteoporosis‐like phenotype in vivo[J]. Genes to Cells, 2018, 23(7): 590-598. |
| [25] |
BIZET A A, TRAN-KHANH N, SAKSENA A, et al. CD109-mediated degradation of TGF-β receptors and inhibition of TGF-β responses involve regulation of SMAD7 and Smurf2 localization and function[J]. Journal of Cellular Biochemistry, 2012, 113(1): 238-246. |
| [26] |
KUNIHIRO A G, BRICKEY J A, FRYE J B, et al. Curcumin, but not curcumin-glucuronide, inhibits Smad signaling in TGFβ-dependent bone metastatic breast cancer cells and is enriched in bone compared to other tissues[J]. The Journal of Nutritional Biochemistry, 2019, 63: 150-156. |
| [27] |
NONAKA M. The complement C3 protein family in invertebrates[J]. Invertebrate Survival Journal, 2011, 8(1): 21-32. |
| [28] |
WANG N, QIN M T, CHEN X H, et al. Molecular cloning of complement component C3 gene from pearl mussel, Hyriopsis cumingii and analysis of the gene expression in response to tissue transplantation[J]. Fish & Shellfish Immunology, 2019, 94: 288-293. |
| [29] |
SHANAHAN J, ROSENBERG W, CHAPMAN R W, et al. Deposition of complement C9 in primary sclerosing cholangitis (PSC)[J]. Gastroenterology, 1998, 114: A1340. |
| [30] |
马洪明, 麦康森. 贝类血细胞的吞噬作用和非我识别[J]. 海洋科学, 2003, 27(2): 16-18. MA H M, MAI K S. Phagocytosis and non-self recognition of molluscan blood cells: a review[J]. Marine Sciences, 2003, 27(2): 16-18. |
| [31] |
吴宁, 陈梦玫, 王素芳. 贝类免疫机制的研究进展[J]. 药物生物技术, 2017, 24(1): 68-71. WU N, CHEN M M, WANG S F. Research progress of shellfish immune mechanism[J]. Chinese Journal of Pharmaceutical Biotechnology, 2017, 24(1): 68-71. |
| [32] |
SUR R, LYTE P A, SOUTHALL M D. Hsp27 regulates pro-inflammatory mediator release in keratinocytes by modulating NF-κB signaling[J]. Journal of Investigative Dermatology, 2008, 128(5): 1116-1122. |
| [33] |
MILLER-GRAZIANOC L, DE A, Laudanski K, et al. HSP27: an anti-inflammatory and immunomodulatory stress protein acting to dampen immune function[J]. The Biology of Extracellular Molecular Chaperones: Novartis Foundation Symposium, 2008, 291: 196-211. |
| [34] |
葛迪, 苗俊英, 赵静. 内皮细胞向间充质细胞的转分化[J]. 生命的化学, 2011, 31(4): 532-535. GE D, MIAO J Y, ZHAO J. Research progress of endothelial-to-mesenchymal transition[J]. Chemistry of Life, 2011, 31(4): 532-535. |
| [35] |
CORDONNIER T, BISHOP J L, SHIOTA M, et al. Hsp27 regulates EGF/β-catenin mediated epithelial to mesenchymal transition in prostate cancer[J]. International Journal of Cancer, 2015, 136(6): E496-E507. |
| [36] |
VANDER HEIDE R S. Increased expression of HSP27 protects canine myocytes from simulated ischemia-reperfusion injury[J]. American Journal of Physiology: Heart and Circulatory Physiology, 2002, 282(3): H935-H941. |
| [37] |
LUO C, JI X M, FAN J J, et al. Annexin A5 promotes macrophage activation and contributes to pulmonary fibrosis induced by silica particles[J]. Toxicology andIndustrial Health, 2016, 32(9): 1628-1638. |
| [38] |
HUBERS L M, VOS H, SCHUURMAN A R, et al. Annexin A11 is targeted by IgG4 and IgG1 autoantibodies in IgG4-related disease[J]. Gut, 2018, 67(4): 728-735. |
2. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


