2. 福建省水产研究所 福建省海洋生物增养殖与高值化利用重点实验室, 福建 厦门 361021;
3. 集美大学 水产学院, 福建 厦门 361023
仿刺参(Apostichopus japonicus)隶属于海参纲(Holothuroidea)辛那参目(Synallactida)刺参科(Stichopodidae)仿刺参属(Apostichopus),温带种,主要分布在北太平洋浅海,包括日本、朝鲜、俄罗斯远东沿海和中国北部沿海,主要栖息地为岩礁或细沙泥底质的潮间带,主要摄食沉积于海底表层的藻类碎屑、浮游动植物尸体、微生物以及夹杂其中的泥沙等颗粒[1-2]。仿刺参是食用海参中品质最好、分布最广、产量最大的品种,仿刺参养殖是我国水产养殖的重要产业之一。
温度是影响仿刺参生存、生长、繁殖的重要因子之一,一般适宜的温度为10~25 ℃ [3]。温度过高或过低都会抑制仿刺参生长,增加发病率。另外,在夏季水温升高时,仿刺参为适应高温环境会进入夏眠,停止摄食、体质量减轻。在温度升高过程中,仿刺参在生理生化水平上随之发生改变来适应高温带来的影响。目前关于仿刺参受温度影响的研究比较广泛。徐冬雪[4]研究了仿刺参热胁迫响应机制;赵欢[5]研究了仿刺参温度胁迫下热休克蛋白的表达变化;臧元奇[6]探究了仿刺参在不同环境胁迫下的生理生态学响应机制。WANG等[7]和王方雨[8]研究了夏眠期间仿刺参体腔液内免疫酶活性变化;JI等[9]研究了升温与夏眠过程中仿刺参的免疫生理反应;DONG等[10]研究了在不同温度变化下仿刺参体内过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性变化,探讨了高温驯化下仿刺参的热耐受性。本研究以南移养殖仿刺参和北方养殖仿刺参为实验材料,在室内不同温度环境条件,比较研究南移养殖仿刺参群体和北方养殖仿刺参群体热休克蛋白基因hsp10、hsp60、hsp70和hsp90 在不同温度下的变化情况,以及两个仿刺参群体抗氧化酶、磷酸酶和溶菌酶活力的变化情况,以期为南移仿刺参的良种选育和幼苗培育提供参考。
1 材料与方法 1.1 材料试验所用南移仿刺参来自福建省水产研究所东山基地(福建漳州)培育的1龄仿刺参,北方群体来自山东烟台地区培育的1龄仿刺参。每组各随机选取100只健康仿刺参,其中,南移仿刺参平均体质量为(30.8±3.6) g,北方仿刺参平均体质量为(27.8±1.9) g。
1.2 方法 1.2.1 试验设计仿刺参暂养在实验室的水槽中,水温控制在16 ℃。2021年1月8日开始试验,根据南方仿刺参养殖环境的温度变化设置5个温度梯度:16(对照组)、20、24、28和32 ℃。将南移仿刺参标记为S组,北方仿刺参标记为N组。S组和N组两组各设置5个平行,每个平行20只仿刺参,对应5个温度梯度。试验采用急性温度胁迫的方法,提前将海水用控温设备严格控制在相应温度,温度差控制在±0.5 ℃。试验持续48 h,分别在0、3、6、12、24和48 h时,每组随机取3只仿刺参解剖采样,采集仿刺参的体壁和肠道,每组3个重复。在12 h时取体壁组织测定酶活。将样本组织存放在2 mL的RNase free离心管中,放入液氮冷冻后转移到-80 ℃冰箱中保存。
1.2.2 总RNA的提取取混合的组织样品10~20 mg用FastPure® Cell/Tissue Total RNA Isolation Kit V2试剂盒(南京诺唯赞生物科技股份有限公司)提取RNA,用超微分光光度计(NanoDrop 2000)检测RNA的纯度和含量。
1.2.3 cDNA的制备用TransScript® All-in-One First-Strand cDNA Synthesis SuperMix for qPCR (One-Step gDNA Removal,北京全式金生物技术有限公司)试剂盒进行逆转录,反应体系(共20 μL):5×TransScript® All-in-One SuperMix for qPCR 4 μL,gDNA去除剂1 μL,总RNA 200 ng,RNase-free Water补足20 μL。样品混合均匀后在PCR仪上进行逆转录反应,反应条件为42 ℃孵育15 min,85 ℃反应5 s。
1.2.4 引物的选择与合成查找文献选择相应基因的引物序列(表 1),引物由铂尚生物技术有限公司(上海)合成。
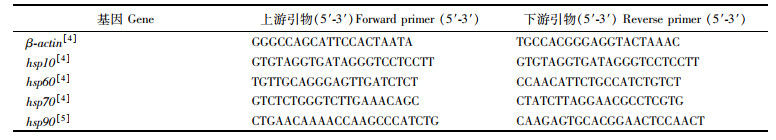
|
表 1 仿刺参实时荧光定量PCR引物 Tab.1 Quantitative real-time PCR primer for A. japonicus |
用ChamQ Universal SYBR qPCR Master Mix试剂盒(南京诺唯赞生物科技股份有限公司),在LightCycler 96上进行荧光定量PCR。反应体系(共20 μL):2× ChamQ Universal SYBR qPCR Master Mix 10 μL,上、下游引物各0.5 μL,cDNA模板4 μL,用ddH2O补足20 μL的反应体系。反应程序:95 ℃预变性30 s;95 ℃下变性10 s,56 ℃下30 s,72 ℃下退火30 s,共进行45个循环;溶解曲线阶段95 ℃下变性10 s,65 ℃下退火1 min,95 ℃下延伸15 s。每个样品3个平行试验以减小误差。
1.2.6 免疫指标测定利用南京建成生物工程研究所试剂盒测定超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、总抗氧化能力(T-AOC)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)和溶菌酶(LSZ)。
1.2.7 数据处理以β-actin为内参基因,采用2-ΔΔCt的方法计算出各候选基因的相对表达量,用Excel软件统计仿刺参南移群体(S组)和北方群体(N组)在不同温度下的SOD、CAT、T-AOC、ACP、AKP和LSZ酶活力的平均值和标准差(Mean±SD),所得结果用SPSS 20.0软件进行统计分析,在单因素ANOVA方差分析达到显著水平(P < 0.05)时,采用Duncan氏法进行多重比较。
2 结果 2.1 高温胁迫下仿刺参的状态变化在试验过程中发现温度在28 ℃以下时,N组和S组仿刺参无明显差异,而在32 ℃的高温组中,N组从实验开始时仿刺参表现出无附着力的状态,S组在胁迫开始3 h前无异常现象;温度胁迫12 h后,N组出现化皮死亡;胁迫24 h后,N组仿刺参全部死亡;而S组仿刺参仅出现吐脏现象;胁迫48 h后,S组仍有3只存活:见图 1。结果表明,南移仿刺参养殖群体较北方养殖群体具有更强的温度耐受特性。

|
图 1 32℃胁迫条件下南移养殖仿刺参和北方养殖仿刺参的行为变化 Fig. 1 Behavior changes at 32 ℃ of A. japonicus cultured in south and north of China |
利用qRT-PCR技术检测仿刺参hsp10 的mRNA在肠道组织中的表达量。结果显示(图 2),随着温度的升高,hsp10 的mRNA表达量在肠道中有不同程度的提高,和对照组相比,32 ℃组的热休克蛋白基因表达量有极显著性上调(P < 0.05),而在其他温度组中热休克蛋白基因的表达量都有不同程度的上调。在32 ℃条件下,随着胁迫时间的增长,仿刺参肠道组织中的hsp10 mRNA表达量呈上升趋势,其中6 h前无显著差异(P>0.05),而在12 h后呈显著升高(P < 0.05)。

|
标有不同字母表示差异显著(P < 0.05),标有相同字母表示差异不显著(P>0.05)。 Different lowercase letters indicate significant difference (P < 0.05), while the same lowercase letter means no significant difference (P>0.05). 图 2 不同温度(a)和同一温度(32 ℃)不同时间(b)胁迫条件下仿刺参肠道hsp10 基因的相对表达量 Fig. 2 Relative expression of hsp10 gene in intestinal tract of sea cucumber A. japonicus at different temperature (a) and the same temperature (32 ℃) and under different time (b) stress conditions |
仿刺参肠道组织中hsp60 基因的表达情况与hsp10 基本类似。如图 3所示,hsp60 的mRNA在高温下的表达量有大幅度的上调。其中,32 ℃温度组hsp60 基因的mRNA在肠道中的表达量随时间的延长都呈逐步上升趋势,对照组中hsp60 基因的mRNA表达量最低。其中,3 h和6 h组,12 h和24 h组之间,hsp60 的表达量无显著差异(P>0.05),而在24 h和48 h组之间,hsp60 的表达量差异显著(P < 0.05)。

|
标有不同字母表示差异显著(P < 0.05),标有相同字母表示差异不显著(P>0.05)。 Different lowercase letters indicate significant difference (P < 0.05), while the same lowercase letter means no significant difference (P>0.05). 图 3 不同温度(a)和同一温度(32 ℃)不同时间(b)胁迫条件下仿刺参肠道hsp60 基因的相对表达量 Fig. 3 Relative expression of hsp60 gene in intestinal tract of sea cucumber A. japonicus at different temperature (a) and the same temperature (32 ℃) and under different time (b) stress conditions |
如图 4所示,仿刺参hsp70 基因对温度刺激更加敏感,在32 ℃刺激下,仿刺参肠道组织中的hsp70 的mRNA表达量显著高于对照组(P < 0.05),其中在3 h时hsp70 mRNA的表达量是对照组的6 908.82倍,在24 h内,随着时间的延长,其表达量呈现先升高再降低的趋势,但在48 h时,hsp70 mRNA的表达量急剧上升,显著高于其他时间组(P < 0.05),是对照组的8 969.81倍。

|
标有不同字母表示差异显著(P < 0.05),标有相同字母表示差异不显著(P>0.05)。 Different lowercase letters indicate significant difference (P < 0.05), while the same lowercase letter means no significant difference (P>0.05). 图 4 不同温度(a)和同一温度(32 ℃)不同时间(b)胁迫条件下仿刺参肠道hsp70 基因的相对表达量 Fig. 4 Relative expression of hsp70 gene in intestinal tract of sea cucumber A. japonicus at different temperature (a) and the same temperature (32 ℃) and under different time (b)stress conditions |
由图 5可以看出,随着温度的升高,热休克蛋白基因hsp90 mRNA的表达量呈逐渐升高趋势,在温度达到32 ℃后,表达量相比于16、20、24和28 ℃温度组显著上升。在32 ℃胁迫下,在48 h时的表达量达到峰值,而在胁迫6、12和24 h时,hsp90 mRNA的表达量无显著性差异(P>0.05)。

|
标有不同字母表示差异显著(P < 0.05),标有相同字母表示差异不显著(P>0.05)。 Different lowercase letters indicate significant difference (P < 0.05), while the same lowercase letter means no significant difference (P>0.05). 图 5 不同温度(a)和同一温度(32 ℃)不同时间(b)胁迫条件下仿刺参肠道hsp90 基因的相对表达量 Fig. 5 Relative expression of hsp90 gene in intestinal tract of sea cucumber A. japonicus at different temperature (a) and the same temperature (32 ℃) and under different time (b) stress conditions |
由图 6所示,在28 ℃的急性胁迫下,N组群体的热休克蛋白基因表达都呈现逐渐降低的趋势,S组则呈现先升高后降低的趋势。热休克蛋白基因hsp10、hsp60和hsp90 的mRNA表达量在肠道中呈现出相似的变化情况,N组热休克蛋白基因的mRNA表达量在各个时间点都高于S组。在胁迫3 h后N组热休克蛋白基因的表达量达到峰值,并随着时间延长而逐步降低,而S组基因峰值出现的时间晚于N组。

|
不同小写字母表示同一群体内不同处理时间热休克蛋白基因的相对表达量差异显著(P < 0.05),不同大写字母表示相同处理时间下N组和S组热休克蛋白基因的相对表达量差异显著(P < 0.05)。 Different lowercase letters indicated that the relative expression level of heat shock protein gene in the same population was significantly different at different treatment times (P < 0.05), and different capital letters indicated that the relative expression level of heat shock protein gene in the same group was significantly different between the N group and the S group at the same treatment time (P < 0.05). 图 6 28 ℃下仿刺参肠道中hsp10 (a)、hsp60 (b)、hsp70 (c)和hsp90 (d)基因相对表达量 Fig. 6 Relative expression of hsp10 (a), hsp60 (b), hsp70 (c) and hsp90 (d)genes in intestinal tract of A. japonicus at 28 ℃ |
由图 7可知,仿刺参体壁SOD酶活力受温度的影响显著(P < 0.05),在N组和S组均呈现先升高后降低的趋势,在16、20、28和32 ℃刺激下,S组的SOD酶活力均显著高于N组,而在24 ℃时两组差异不显著(P>0.05)。N组:20 ℃时SOD酶活力最高,显著高于16、28和32 ℃时的SOD酶活力。S组:20 ℃时SOD酶活力最高,且显著高于其他温度组(P < 0.05)。

|
不同小写字母表示同一群体内不同处理温度间免疫酶活力差异显著(P < 0.05),不同大写字母表示同一温度下N组和S组免疫酶活力差异显著(P < 0.05)。 Different lowercase letters indicate significant difference at different temperatures in the same group (P < 0.05), and different capital letters indicate significant difference between group N and S at the same temperature (P < 0.05). 图 7 不同温度胁迫下仿刺参体壁SOD酶活力变化 Fig. 7 SOD activity of A. japonicus at different temperature |
仿刺参体壁CAT酶活力变化见图 8,随着温度的升高,N组和S组的CAT酶活力逐渐降低。除在28 ℃外,其余温度组中S组仿刺参体壁的CAT酶活力显著高于N组(P < 0.05)。N组:随着温度升高,仿刺参体壁的CAT酶活力呈下降趋势,各个温度组之间差异显著(P < 0.05)。S组:在28和32 ℃胁迫条件下的仿刺参CAT酶活力差异不显著(P>0.05)。

|
不同小写字母表示同一群体内不同处理温度间免疫酶活力差异显著(P < 0.05),不同大写字母表示同一温度下N组和S组免疫酶活力差异显著(P < 0.05)。 Different lowercase letters indicate significant difference at different temperatures in the same group (P < 0.05), and different capital letters indicate significant difference between group N and S at the same temperature (P < 0.05). 图 8 不同温度胁迫下仿刺参体壁CAT酶活力变化 Fig. 8 CAT activity of A. japonicus at different temperature |
由图 9所示,随着温度的升高,N组和S组仿刺参体壁组织的T-AOC酶活力呈下降趋势。N组:在16 ℃时T-AOC酶活力最高,且显著高于20、24、28和32 ℃温度组(P < 0.05),而在24、28和32 ℃温度组之间没有显著性差异(P>0.05)。S组:16 ℃下T-AOC酶活力显著高于其他温度组(P < 0.05),28和32 ℃之间无显著性差异(P>0.05)。N组和S组在16、24和28 ℃下的T-AOC酶活力具有显著性差异(P < 0.05),且除24 ℃外,S组的T-AOC酶活力都高于N组。

|
不同小写字母表示同一群体内不同处理温度间免疫酶活力差异显著(P < 0.05),不同大写字母表示同一温度下N组和S组免疫酶活力差异显著(P < 0.05)。 Different lowercase letters indicate significant difference at different temperatures in the same group (P < 0.05), and different capital letters indicate significant difference between group N and S at the same temperature (P < 0.05). 图 9 不同温度胁迫下仿刺参体壁T-AOC酶活力变化 Fig. 9 T-AOC activity of A. japonicus at different temperature |
由图 10可以看出,随着温度的升高,N组和S组的ACP酶活力均呈下降趋势,且温度对两组仿刺参体壁ACP酶活力影响显著(P < 0.05)。S组在各个温度下ACP酶活力均高于N组,S组和N组在16 ℃下的ACP酶活力差异不显著(P>0.05),在其他温度下两组具有显著性差异(P < 0.05)。N组:在16~32 ℃各温度下的ACP酶活力有显著性差异(P < 0.05),16 ℃时的ACP酶活力最高。S组:在16 ℃和20 ℃之间ACP酶活力无显著性差异(P>0.05),均显著高于24、28和32 ℃下的ACP酶活力(P < 0.05)。

|
不同小写字母表示同一群体内不同处理温度间免疫酶活力差异显著(P < 0.05),不同大写字母表示同一温度下N组和S组免疫酶活力差异显著(P < 0.05)。 Different lowercase letters indicate significant difference at different temperatures in the same group (P<0.05), and different capital letters indicate significant difference between group N and S at the same temperature (P < 0.05). 图 10 不同温度胁迫下仿刺参体壁ACP酶活力变化 Fig. 10 ACP activity of A. japonicus at different temperature |
由图 11所示,随着温度升高,N组和S组的AKP酶活力均呈下降趋势,且两组在16 ℃和20 ℃的ACP酶活力与其他组之间存在显著差异(P < 0.05),而在24、28和32 ℃组之间差异不显著(P>0.05),N组和S组在16和20 ℃温度下的ACP酶活力有显著性差异(P < 0.05),在其他温度下差异不显著(P>0.05)。

|
不同小写字母表示同一群体内不同处理温度间免疫酶活力差异显著(P < 0.05),不同大写字母表示同一温度下N组和S组免疫酶活力差异显著(P < 0.05)。 Different lowercase letters indicate significant difference at different temperatures in the same group (P < 0.05), and different capital letters indicate significant difference between group N and S at the same temperature (P < 0.05). 图 11 不同温度胁迫下仿刺参体壁AKP酶活力变化 Fig. 11 AKP activity of A. japonicus at different temperature |
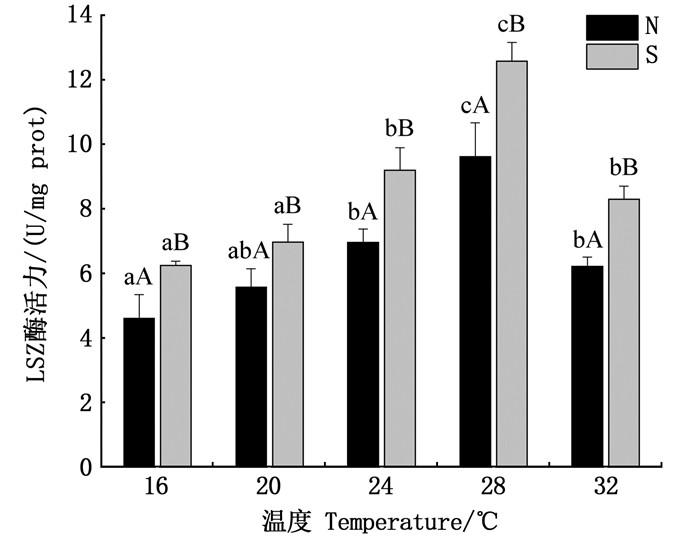
由图 12可以看出,随着温度的升高,N组和S组的LSZ酶活力呈现先升高后降低的趋势,温度对LSZ酶活力变化影响显著。N组:28 ℃时LSZ酶活力最高,显著高于其他温度下的LSZ酶活力(P < 0.05),除24和32 ℃之间差异不显著(P>0.05)外,其他各组间均具有显著差异(P < 0.05)。S组:28 ℃下的LSZ酶活力最高,显著高于其他温度下的LSZ酶活力,且每个温度下S组的LSZ酶活力均显著高于N组(P < 0.05)。
|
不同小写字母表示同一群体内不同处理温度间免疫酶活力差异显著(P < 0.05),不同大写字母表示同一温度下N组和S组免疫酶活力差异显著(P < 0.05)。 Different lowercase letters indicate significant difference at different temperatures in the same group (P < 0.05), and different capital letters indicate significant difference between group N and S at the same temperature (P < 0.05). 图 12 不同温度胁迫下仿刺参体壁LSZ酶活力变化 Fig. 12 LSZ activity of A. japonicus at different temperature |
热休克蛋白基因是一种在受到热刺激后被激活表达,产生一组特殊蛋白并抑制合成其他蛋白,所产生的蛋白质称为热休克蛋白。热休克蛋白是一类结构和功能非常保守的蛋白家族。热休克蛋白可以加速热胁迫下非正常折叠的蛋白降解,或者使这些错误构象的蛋白进行重新折叠,为细胞提供有效保护[11]。本研究中,高温诱导仿刺参的hsp10、hsp60、hsp70、hsp90 基因表达量显著上调。随着温度的升高,4种热休克蛋白基因的表达均呈上升趋势,尤其在32 ℃下,hsps 基因的表达量相比于16 ℃时有极显著的升高。在对其他物种的研究中,HUANG等[12]发现凡纳滨对虾(Litopenaeus vannamei)的hsp60基因表达上升。在斑节对虾(Penaeus monodon)和中国明对虾(Fenneropenaeus chinensis)的研究中发现,hsp70和hsp90 的表达被显著诱导上升[13-15]。在罗氏沼虾(Macrobrachium rosenbergii )[16]及三疣梭子蟹(Portunus trituberculatus)[17]的研究中也有相似的结果。其次,在32 ℃刺激下,随着胁迫时间的延长,热休克蛋白基因的表达量呈上升趋势。在徐冬雪[4]的研究中,26 ℃胁迫下,HSPs的表达呈现先升高再下降的变化,在4~8 h内达到峰值。这一点与本研究中结果有所区别,热休克反应的衰减说明之前hsps的累积已减轻了细胞内的蛋白损伤,细胞将更多能量用于其他细胞活动。而在本研究中,胁迫温度相对较高,对于仿刺参造成了更为严重的损伤,仿刺参体内的HSPs不足以修复或减缓细胞内的蛋白损伤,导致随着胁迫时间的延长,hsps 基因的表达进一步升高。在32 ℃刺激的24 h内,hsp70 的表达呈先升高再降低的趋势,然后在48 h时其表达量又急剧上升,并且hsp70的表达量比hsp10、hsp60和hsp90更高。推测其主要原因是不同hsps 在高温刺激下发挥的作用不同。例如:hsp10 在细胞受到高温等刺激下大量表达,是调节细胞凋亡的关键信号通路,通过抑制细胞凋亡的发生,发挥保护细胞作用;hsp60 可参与蛋白折叠、蛋白转运和复杂蛋白的组装等;hsp90 主要参与某些转录因子和蛋白激酶的构象调节;hsp70 在热胁迫下的功能更为广泛,可以帮助细胞质、线粒体、内质网内的蛋白正确折叠等[11, 18-19]。本研究结果发现,南移养殖仿刺参在高温胁迫下受损伤程度更低,且其热休克蛋白基因的表达量显著低于北方养殖仿刺参群体,这种变化表明,南移仿刺参具有更好的耐高温能力。
3.2 高温胁迫对南移仿刺参抗氧化能力的影响环境温度的变化会引起仿刺参机体的生理免疫等反应发生变化;随着温度升高,会引起仿刺参代谢水平的变化,增加活性氧的形成,导致仿刺参体内氧化过程和抗氧化防御系统之间的失衡,从而引起氧化胁迫,造成机体组织损伤[20]。SOD是第一个对抗活性氧自由基的抗氧化酶,参与清除体内超氧阴离子自由基,可以防止机体损伤和衰老;CAT是生物体内过氧化物酶体的标志酶,能够催化过氧化氢分解;T-AOC是生物体对外来刺激的应激能力,是衡量机体抗氧化系统功能状态的综合性指标[21-22]。在本研究中,随着温度的升高,S组与N组体壁中的SOD活性均呈先升高后降低的趋势,且在28 ℃和32 ℃的高温胁迫组中,S组体壁的SOD酶活力均显著高于N组。南、北方两个群体的仿刺参体壁CAT和T-AOC酶活力均随温度的升高而降低,这一变化趋势与刘石林等[23]研究的高温胁迫下仿刺参耐高温群体与普通群体抗氧酶活性变化趋势相似,这表明在急性高温胁迫下,随着温度的提高,仿刺参体内的活性氧急剧上升抑制了抗氧化酶的活性,进而导致仿刺参组织受损而死亡,但S组由于长时间生活在较高温度的自然环境中,相对于N组,S组的抗氧化酶活性显著高于N组。因此,南移仿刺参在高温胁迫时仍具有较强的保护机体免受氧化损伤的能力。
3.3 高温胁迫对南移仿刺参磷酸酶活力的影响酸性磷酸酶,广泛分布于生物界,一般认为其位于溶酶体内,是溶酶体的标志酶。与碱性磷酸酶相对应,酸性磷酸酶可以在酸性环境下催化各种醇和酚的磷酸酯进行水解反应。碱性磷酸酶在碱性环境下,既可催化各种醇和酚的磷酸酯进行水解反应,又有磷酸的转移作用,因此在细胞膜上较为活跃[6, 24]。本研究中,随着温度的升高,S组和N组的ACP和AKP呈下降趋势,这与仿刺参在干露[25]、饥饿和夏眠[26]等胁迫条件下酶活力随时间的变化趋势基本一致;杨东敏等[27]研究发现菲律宾蛤仔在高温胁迫条件下AKP同样出现了降低的趋势。S组在不同温度下的ACP和AKP活力高于N组,尤其在20~32 ℃,S组的ACP活力显著高于N组。这表明,相对于N组,S组常年处于较高的温度下,对高温具有较强的适应力,在高温胁迫下具有较强的免疫防御能力。
3.4 高温胁迫对南移仿刺参溶菌酶活力的影响溶菌酶(LSZ)是一种碱性蛋白酶,广泛存在于生物体许多组织和体液中,是专门作用于微生物细胞壁的水解酶,在抵抗外来病原生物入侵中起重要的作用[28-29]。本研究发现,随着温度升高,S组和N组体壁的LSZ酶活力呈先升高后降低的趋势。相关研究表明,温度对溶菌酶活力变化影响显著。曹学顺等[20]对仿刺参的研究发现,升温过程中仿刺参体腔液LSZ酶活性先升高后降低又升高;刘石林等[23]对仿刺参研究发现,随着海水温度的上升,LSZ酶活力也呈先升高后降低的变化趋势;秦艺铭等[21]研究发现在急剧升温方式下,23、27 ℃处理组毛蚶肝胰腺中LSZ酶活性随时间的变化趋势为先升后降。这与本研究中LSZ酶活力变化趋势相一致。以上结果表明,一定程度范围内的温度胁迫可以增强LSZ酶活力,但超过机体的耐受范围就会破坏机体的免疫系统,导致LSZ酶活力降低,最后危及生物的生命。
| [1] |
崔龙波, 董志宁, 陆瑶华. 仿刺参消化系统的组织学和组织化学研究[J]. 动物学杂志, 2000, 35(6): 2-4. CUI L B, DONG Z N, LU Y H. Histological and histochemical studies on the digestive system of Apostichopus japonicus[J]. Chinese Journal of Zoology, 2000, 35(6): 2-4. |
| [2] |
廖玉麟. 中国动物志-棘皮动物门. 海参纲[M]. 北京: 科学出版社, 1997. LIAO Y L. Zoology of China-Echinodermata. Holothuroidea[M]. Beijing: Science Press, 1997. |
| [3] |
董云伟, 董双林, 田相利, 等. 不同水温对刺参幼参生长、呼吸及体组成的影响[J]. 中国水产科学, 2005, 12(1): 33-37. DONG Y W, DONG S L, TIAN X L, et al. Effects of water temperature on growth, respiration and body composition of young sea cucumber Apostichopus japonicus[J]. Journal of Fishery Sciences of China, 2005, 12(1): 33-37. DOI:10.3321/j.issn:1005-8737.2005.01.007 |
| [4] |
徐冬雪. 仿刺参热胁迫响应的分子调控特征研究与SNP标记筛选[D]. 青岛: 中国科学院研究生院(海洋研究所), 2016. XU D X. Research of molecular mechanisms of heat shock response and heat-resistance SNP in sea cucumbers Apostichopus japonicus[D]. Qingdao: The Institute of Oceanology, Chinese Academy of Sciences, 2016. |
| [5] |
赵欢. 刺参Apostichopus japonicus (Selenka)对温度胁迫响应分子机理的基础研究[D]. 青岛: 中国科学院研究生院(海洋研究所), 2011. ZHAO H. Fundamental research on the molecular mechanism in response to heat stress in Apostichopus japonicus (Selenka)[D]. Qingdao: The Institute of Oceanology, Chinese Academy of Sciences, 2011. |
| [6] |
臧元奇. 刺参(Apostichopus japonicus Selenka)对典型环境胁迫的生理生态学响应及其机制研究[D]. 青岛: 中国海洋大学, 2012. ZANG Y Q. Ecological and physiological mechanisms on typical environmental factors in sea cucumber, Apostichopus japonicus Selenka[D]. Qingdao: Ocean University of China, 2012. |
| [7] |
WANG F Y, YANG H S, GABR H R, et al. Immune condition of Apostichopus japonicus during aestivation[J]. Aquaculture, 2008, 285(1/4): 238-243. |
| [8] |
王方雨. 刺参Apostichopus japonicus生态免疫与夏眠的基础研究[D]. 青岛: 中国科学院研究生院(海洋研究所), 2008. WANG F Y. Mechanism of ecoogical immunity and aestivation of Apostichopus japonicus[D]. Qingdao: The Institute of Oceanology, Chinese Academy of Sciences, 2008. |
| [9] |
JI T T, DONG Y W, DONG S L. Growth and physiological responses in the sea cucumber, Apostichopus japonicus Selenka: aestivation and temperature[J]. Aquaculture, 2008, 283(1/4): 180-187. |
| [10] |
DONG Y W, DONG S L, MENG X L. Effects of thermal and osmotic stress on growth, osmoregulation and hsp70 in sea cucumber (Apostichopus japonicus Selenka)[J]. Aquaculture, 2008, 276(1/4): 179-186. |
| [11] |
PARSELL D A, LINDQUIST S. The function of heat-shock proteins in stress tolerance: degradation and reactivation of damaged proteins[J]. Annual Review of Genetics, 1993, 27: 437-496. DOI:10.1146/annurev.ge.27.120193.002253 |
| [12] |
HUANG W J, LEU J H, TSAU M T, et al. Differential expression of Lvhsp60 in shrimp in response to environmental stress[J]. Fish & Shellfish Immunology, 2011, 30(2): 576-582. |
| [13] |
RUNGRASSAMEE W, LEELATANAWIT R, JIRAVANICHPAISAL P, et al. Expression and distribution of three heat shock protein genes under heat shock stress and under exposure to Vibrio harveyi in Penaeus monodon[J]. Developmental & Comparative Immunology, 2010, 34(10): 1082-1089. |
| [14] |
LI F H, LUAN W, ZHANG C S, et al. Cloning of cytoplasmic heat shock protein 90 (Fchsp90) from Fenneropenaeus chinensis and its expression response to heat shock and hypoxia[J]. Cell Stress and Chaperones, 2009, 14(2): 161-172. DOI:10.1007/s12192-008-0069-6 |
| [15] |
LUAN W, LI F H, ZHANG J Q, et al. Identification of a novel inducible cytosolic hsp70 gene in Chinese shrimp Fenneropenaeus chinensis and comparison of its expression with the cognate Hsc70 under different stresses[J]. Cell Stress and Chaperones, 2010, 15(1): 83. DOI:10.1007/s12192-009-0124-y |
| [16] |
LIU J, YANG W J, ZHU X J, et al. Molecular cloning and expression of two hsp70 genes in the prawn, Macrobrachium rosenbergii[J]. Cell Stress & Chaperones, 2004, 9(3): 313-323. |
| [17] |
ZHANG X Y, ZHANG M Z, ZHENG C J, et al. Identification of two hsp90 genes from the marine crab, Portunus trituberculatus and their specific expression profiles under different environmental conditions[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2009, 150(4): 465-473. |
| [18] |
FEDER M E, HOFMANN G E. Heat-shock proteins, molecular chaperones, and the stress response: evolutionary and ecological physiology[J]. Annual Review of Physiology, 1999, 61(1): 243-282. DOI:10.1146/annurev.physiol.61.1.243 |
| [19] |
GEORGOPOULOS C, WELCH W J. Role of the major heat shock proteins as molecular chaperones[J]. Annual Review of Cell Biology, 1993, 9(1): 601-634. DOI:10.1146/annurev.cb.09.110193.003125 |
| [20] |
曹学顺, 丁君, 白雪秋, 等. 升温对"水院1号"和大连养殖刺参非特异性免疫影响的研究[J]. 农学学报, 2015, 5(1): 80-85. CAO X S, DING J, BAI X Q, et al. The study of rising temperature on serum non-specific immune in Shuiyuan No.1 sea cucumber populations and the cultured sea cucumber populations[[J]. Journal of Agriculture, 2015, 5(1): 80-85. |
| [21] |
秦艺铭, 陈丽梅, 李莉, 等. 2种升温方式对毛蚶呼吸代谢及免疫相关酶活性的影响[J]. 水产科学, 2021, 40(1): 29-36. QIN Y M, CHEN L M, LI L, et al. Effects of two warming patterns on respiratory metabolism and immune-related enzyme activities of ark shell Scapharca subcrenata[J]. Fisheries Science, 2021, 40(1): 29-36. |
| [22] |
贲月, 郝振林, 丁君, 等. 高温对虾夷扇贝体腔液免疫酶活力的影响[J]. 水产学报, 2013, 37(6): 858-863. BEN Y, HAO Z L, DING J, et al. Effects of high temperature on the immuno-enzymetic activity in coelomic fluid of Mizuhopecten yessoensis[J]. Journal of Fisheries of China, 2013, 37(6): 858-863. |
| [23] |
刘石林, 茹小尚, 徐勤增, 等. 高温胁迫对刺参耐高温群体和普通群体主要免疫酶活力的影响[J]. 中国水产科学, 2016, 23(2): 344-351. LIU S L, RU X S, XU Q Z, et al. Effects of high-temperature stress on several immune enzyme activities of Apostichopus japonicus thermotolerant and normal species[J]. Journal of Fishery Sciences of China, 2016, 23(2): 344-351. |
| [24] |
王天神, 周鑫, 赵朝阳, 等. 不同温度条件下克氏原螯虾免疫酶活性变化[J]. 江苏农业科学, 2012, 40(12): 239-241. WANG T S, ZHOU X, ZHAO C Y, et al. Immunoenzymatic activity changes of Procambarus clarkii different temperature conditions[J]. Jiangsu Agricultural Sciences, 2012, 40(12): 239-241. |
| [25] |
田相利, 何瑞鹏, 钱圆, 等. 干露胁迫对刺参体壁非特异性免疫的影响[J]. 河北渔业, 2014(7): 21-26, 35. TIAN X L, HE R P, QIAN Y, et al. Effects of desiccation on non-specific immune indices in sea cucumber Apostichopus japonicus under different temperatures[J]. Hebei Fisheries, 2014(7): 21-26, 35. |
| [26] |
DU R B, ZANG Y Q, TIAN X L, et al. Growth, metabolism and physiological response of the sea cucumber, Apostichopus japonicus Selenka during periods of inactivity[J]. Journal of Ocean University of China, 2013, 12(1): 146-154. |
| [27] |
杨东敏, 张艳丽, 丁鉴锋, 等. 高温、低盐对菲律宾蛤仔免疫能力的影响[J]. 大连海洋大学学报, 2017, 32(3): 302-309. YANG D M, ZHANG Y L, DING J F, et al. Synergistic effects of high temperature and low salinity on immunity of Manila clam Ruditapes philippinarum[J]. Journal of Dalian Ocean University, 2017, 32(3): 302-309. |
| [28] |
李文龙, 梁兴明, 梁萌青, 等. 温度对大菱鲆幼鱼生长及免疫相关酶活性的影响[J]. 水产科学, 2017, 36(3): 311-316. LI W L, LIANG X M, LIANG M Q, et al. Effects of temperature on growth and enzyme activity related to immunity in juvenile turbot Scophthalmus maximus[J]. Fisheries Science, 2017, 36(3): 311-316. |
| [29] |
程操. 不同品系虾夷扇贝应对高温变化的比较研究[D]. 大连: 大连海洋大学, 2019. CHENG C. Comparative study on the different strains of Mizuhopecten yessoensis response to high temperature[D]. Dalian: Dalian Ocean University, 2019. |
2. Key Laboratory of Cultivation and High-value Utilization of Marine Organisms in Fujian Province, Fisheries Research Institute of Fujian, Xiamen 361021, Fujian, China;
3. Fisheries College of Jimei University, Xiamen 361023, Fujian, China
 2022,
Vol. 31
2022,
Vol. 31


