2. 中国水产科学研究院淡水渔业研究中心 农业农村部淡水渔业和种质资源利用重点实验室, 江苏 无锡 214081
长江江豚(Neophoc aena asiaeorient alis asiaeorientalis) 是一种小型齿鲸,隶属于鼠海豚科(Phocaenidae)江豚属(Neophocaena),仅生活于长江中下游干流及与之相通的洞庭湖、鄱阳湖[1]。自2007年白鳍豚(Lipotes vexillifer)被宣告功能性灭绝以后,长江江豚已成为长江中栖息的唯一鲸类动物,也是长江水生态系统是否健康的重要指示物种[2]。多年来,由于长江流域的过度捕捞、水质污染、栖息地丧失、以及人为活动等综合作用,长江江豚数量急剧下降,种群极度濒危[3]。2017年长江江豚科学考察结果表明,长江江豚数量约为1 012头,其中干流约445头。2018年,长江江豚全基因组序列公布,长江江豚被认定为新的独立物种,也是江豚由海入江进化历程的唯一见证物种[4]。2021年2月5日,调整后的《国家重点保护野生动物名录》发布,长江江豚升级为国家一级重点保护野生动物,这更加凸显了长江江豚的重要地位和对其进行抢救性保护工作的紧迫性。
持久性有机污染物(Persistent organic pollutants,POPs)是普遍存在的不易降解的环境污染物,环境中常见的POPs包括:六氯环己烷(Hexachlorocyclohexanes,HCH)、滴滴涕(Dichlorodiphenyltrichloroe-thanes,DDT)和多氯联苯(Polychlorinated biphenyls,PCBs)[5],具有持久性、生物蓄积性、毒性和长期运输等特性,其主要来源包括农药、工业生产和船舶防污漆[6]。高浓度的POPs可引发急性和慢性效应,包括过敏、神经系统受损、生殖障碍、免疫系统紊乱和内分泌系统受干扰,以及致癌作用[7]。鲸类动物位于水生态系统食物链顶端,营养水平高、脂肪储量大、寿命较长、代谢和排泄铑及降解能力较低,因此其体内容易积累大量POPs[7]。在我国沿海海域搁浅死亡的东亚江豚(Neophocaena sunameri)[8]、印太江豚(Neophocaena phocaenoides)[9]和糙齿海豚(Steno bredanensis)[10]样本中均检测到PCBs和DDT残留物;在洞庭湖长江江豚死亡样本中也发现残留的DDT和HCH[11],同时对洞庭湖长江江豚栖息地的调查中也发现存在PCBs残留[12],表明环境中的POPs可在鲸豚类动物体内累积。
目前,对长江江豚野外死亡个体持久性有机污染物的研究报道很少。本研究采集了长江下游及鄱阳湖5头长江江豚野外死亡样本,并首次对9种器官组织中的有机污染水平进行了检测,以期掌握其主要组织器官POPs的累积特征,为长江江豚保护及长江水域生态环境修复提供基础数据。
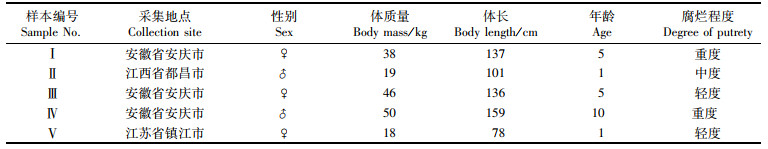
1 材料与方法 1.1 实验材料本实验分析的5头长江江豚样本是2017—2018年在长江下游及鄱阳湖沿岸发现的死亡个体(表 1)。遗骸带回实验室置于-20 ℃冰柜中保存。按照张先锋[13]指出的年龄鉴定方法确定年龄。样本解剖后,取心、肾、肺、肝、肌肉、皮肤、脂肪、胃和肠9种器官组织用于POPs分析。具体取样方法参照张淮城等[14]进行,肌肉、脂肪和皮肤取背中部,肝取中部,心取左心室部分,肺和肾取左侧的中部,胃壁取主胃,肠道取中段。样品用锡箔纸包裹后分别放在多聚乙烯袋中,置于-80 ℃冰箱中保存。
|
表 1 长江江豚基本信息表 Tab.1 Information of Yangtze finless porpoise samples |
本研究分析的目标化合物为HCH、DDT和PCBs。包括,4种HCH异构体(α-HCH、β-HCH、γ-HCH、δ-HCH);6种DDT异构体(o, p′-DDE、p, p′-DDE、o, p′-DDD、p, p′-DDD、o, p′-DDT、p, p′-DDT);6种环境中较广泛存在的PCBs(PCB28、PCB52、PCB101、PCB138、PCB153、PCB180)。
1.3 样品的提取与净化将样品匀浆置于不锈钢盘中,先于-20 ℃冰箱冷冻,后放至真空冷冻干燥机干燥48 h以上至恒重。精确称取5 g样品和4 g硅藻土于研钵中,充分研磨均匀。混匀样品转移至20 mL ASE萃取池。以V(正己烷)∶ V(丙酮)=1∶ 1混合液为提取剂,在设定条件下(温度:100 ℃,压力:100 bar,加热1 min,保持8 min,洗脱4 min)进行3个循环提取。以V(正己烷)∶ V(丙酮)=1∶ 1快速冲洗样品,氮气吹扫90 s,收集全部萃取液。将萃取液通过装有无水硫酸钠的漏斗(80%滤纸体积),用2 mL正己烷/丙酮(体积比为1∶ 1)混合液清洗收集瓶并过滤,再用5 mL正己烷/丙酮(1∶ 1)混合液淋洗无水硫酸钠。所得萃取液转移至鸡心瓶,在35 ℃条件下减压旋蒸至近干,以3×10 mL正己烷溶解残渣,转移至50 mL离心管。在上述样液中加入5 mL浓硫酸,在2 000 r/min条件下涡旋5 min。将离心管放入冷冻离心机中,在6 000 r/min的条件下离心10 min。取离心后的上层澄清有机溶剂(若仍有颜色存在,可重复上述步骤),转移至鸡心瓶中,在40 ℃条件下减压旋蒸干。用1 mL异辛烷溶解残渣,经0.22 μm的有机相滤膜过滤,待上机测定。
1.4 样品的仪器分析采用气相色谱仪(Agilent-7890A)测定POPs种类及含量。色谱柱:DB-5毛细管色谱柱(30 m×0.25 mm×0.25 μm);检测条件:载气,99.999%高纯氮气;流速为0.8 mL/min;进样方式为不分流进样;进样口温度为260 ℃;进样量为1 μL;检测器为ECD检测器;检测器温度为325 ℃;尾气为氮气;尾吹为30 mL/min;升温程序为80 ℃,保持1 min,以30 ℃/min升至170 ℃,再以5 ℃/min升至240 ℃,以20 ℃/min升至280 ℃保持3 min。确保所有的样品已经流出。
1.5 数据分析数据结果均以平均数±标准差(Mean±SD)表示。利用SPSS 19.0统计软件中的One-Way ANOVA方差分析对长江江豚各组织器官中的POPs含量进行统计检验分析。将长江江豚样本按照性别分为雌性组、雄性组,按照年龄分为S组(年龄≤3)、M组(3<年龄≤8)和L组(年龄>8),按照发现水域将其分为长江下游组和鄱阳湖组。
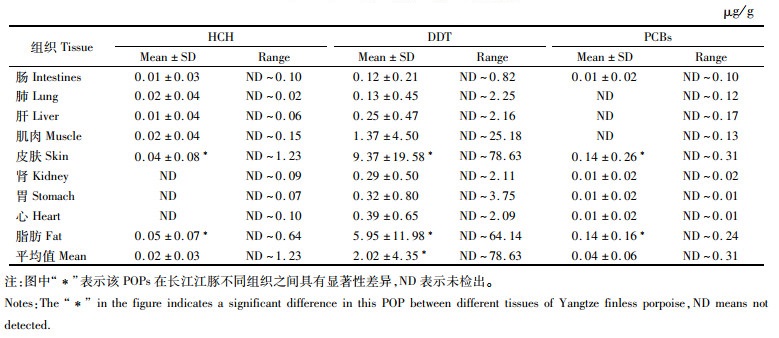
2 结果与分析 2.1 不同组织中POPs的累积特征长江江豚9种器官和组织中HCH、DDT和PCBs含量变幅分别为0~1.23 μg/g、0~78.63 μg/g和0~0.31 μg/g,平均含量顺序为DDT > PCBs> HCH(表 2)。DDT总体含量显著高于PCBs和HCH(P < 0.05),3种POPs在皮肤和脂肪中含量均显著大于其他组织(P < 0.05)。
|
表 2 长江江豚不同组织中POPs平均含量和单因素方差分析结果 Tab.2 Average concentration of POPs in different tissues of Yangtze finless porpoise and results of One-Way ANOVA |
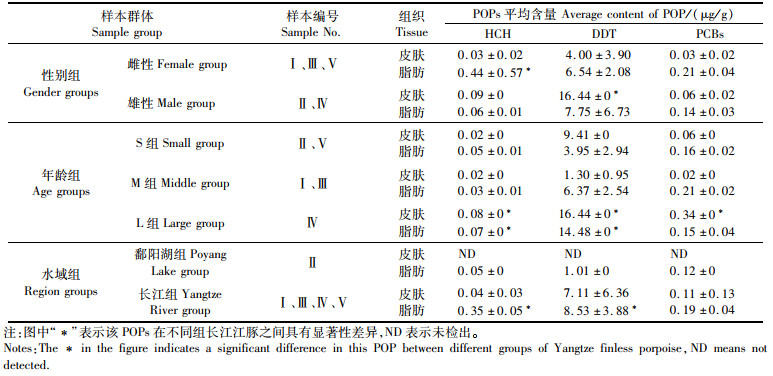
在性别组样本中,HCH、DDT和PCBs 3种POPs在雌性样本皮肤中含量分别为0.03、4.00、0.03 μg/g,在雌性样本脂肪中含量分别为0.44、6.54、0.21 μg/g,在雄性样本皮肤含量分别为0.09、16.44、0.06 μg/g,在脂肪中含量分别为0.06、7.75、0.14 μg/g。HCH在雌性江豚脂肪中含量显著大于雄性(P < 0.05),DDT在雄性江豚皮肤和脂肪中含量均显著大于雌性江豚(P < 0.05),PCBs则无显著差异(P>0.05), 见表 3。
|
表 3 长江江豚不同群体皮肤脂肪POPs平均含量 Tab.3 Average concentration of POPs in different groups of skin and fat of Yangtze finless porpoise |
在年龄组样本中,HCH和DDT在L组样本皮肤和脂肪中含量均最高,分别为0.08、0.07、16.44、14.48 μg/g,显著高于S组和M组样本。L组样本皮肤PCBs含量为0.34 μg/g,显著高于S组和M组(P < 0.05),而脂肪中PCBs含量则最低,为0.15 μg/g, 见表 3。
在水域组样本中,HCH、DDT和PCBs 3种POPs在鄱阳湖组样本皮肤中未检出,脂肪中含量分别为0.05、1.01、0.12 μg/g,在长江组样本皮肤中含量分别为0.04、7.11、0.11 μg/g,脂肪中含量分别为0.35、8.53、0.09 μg/g。长江组样本脂肪中HCH和DDT含量显著高于鄱阳湖组样本(P < 0.05), PCBs无显著差异,但检测值高于鄱阳湖组样本(P>0.05),见表 3。
3 讨论 3.1 长江江豚体内POPs累积特征鲸类动物组织器官中有机污染物的含量通常用来指示其健康状况及其生存水域的污染水平[15]。据报道,灰海豚[15]、白鲸[16]等均不同程度受到POPs的威胁,其内分泌系统和免疫系统受到影响。在我国,由于杀虫剂的使用和电子垃圾的排放,大量有机污染物在土壤和水体沉积,处于水体食物链顶端的长江江豚也受到DDT、HCH和PCBs的直接或间接影响[17],因此POPs累积特征及潜在威胁一直受到关注。
POPs常在鲸类含油脂量较高的组织,如皮肤和脂肪中大量积累,这与其脂溶性和持久性及不同组织的代谢能力有关[12],而鲸类动物的心脏是脂肪含量最高的器官,糙齿海豚[18]心和肺中脂肪含量分别为22.3%和9.7%,心脏PCBs含量约为肺的4.6倍,本研究中长江下游长江江豚心脏DDT含量为肺3倍。有毒物质需要经肝肾等解毒器官的参与才能排出体外,但是当鲸类动物体内累积的PCBs浓度达到50~200 μg/g时,会造成肝损伤,从而对其免疫系统造成危害,因此由POPs引起的肿瘤主要常常发生在肝脏[19],尽管本研究中长江江豚体内HCH和PCBs含量较低,但部分样本(编号Ⅳ)皮肤和脂肪中DDT含量高达78.63和64.14 μg/g,其主要栖息水域的DDT污染情况及水生生物健康状况值得关注。
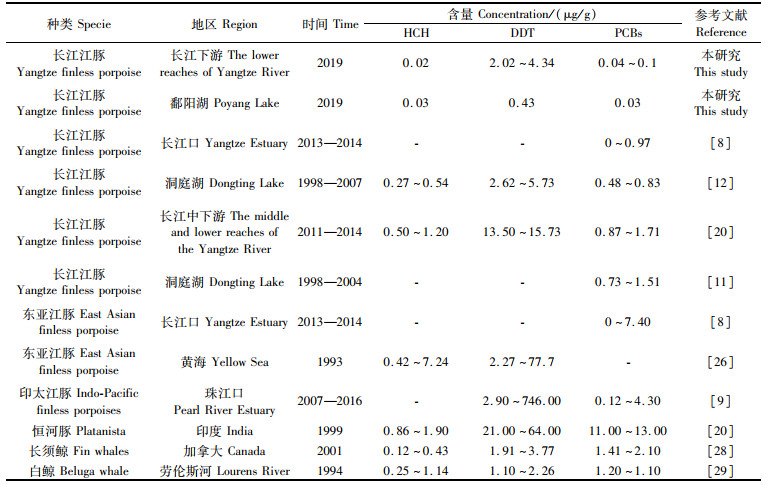
为了更直观地表达POPs的累积特征,将长江江豚脂肪HCH、DDT和PCBs含量与其他鲸豚类进行了比较(表 4)。本研究中长江江豚与长江口[8]、洞庭湖[12]和长江中下游长江江豚[20]脂肪POPs浓度水平比较接近;但栖息于黄海的东亚江豚[8]和珠江口的印太江豚[9]体内DDT含量约为长江江豚的20倍和200倍。与其他淡水豚相比,印度的恒河豚[21]体内DDT和PCBs含量约为长江江豚的16倍和100倍,这可能与恒河水体中上述污染物背景值及恒河豚的降解能力差异有关[22]。总的来说,与其他水体鲸类动物相比,本研究长江江豚所处环境中有机污染物水平较低,对长江江豚潜在威胁较小。
|
表 4 不同水域鲸豚类体脂中POPs的含量比较 Tab.4 Comparison of POPs in body fat of cetaceans in different waters |
POPs在长江江豚体内的累积可能与性别有一定联系,在洞庭湖长江江豚[12]和印太江豚[9]中均发现雄性个体中上述3类POPs含量高于雌性个体,这可能与雌雄个体本身的脂肪蓄积量不同,及有机氯促进雌性个体脂肪生成和雄性个体脂肪分解的作用机制差异相关[11],此外,有报告指出处于妊娠期或哺乳期的雌性个体可能会通过母婴传递来减轻自身POPs含量[12]。本研究也发现雄性个体HCH、DDT和PCBs含量均更高,但是个体对环境污染物的富集差异还可能与其降解能力、营养以及健康和繁殖状况等相关[9],因此POPs的累积与长江江豚性别的关系需要在收集更多样本后更进一步探究。
很多研究报道鲸类体内POPs的累积量会随着鲸类年龄的增长而上升,与动物年龄成正相关关系[23],应是通过食物链富集的结果。然而在宽吻海豚[24]和白鲸[25]研究中均未发现此关系,周荣等[26]则指出雄性黄海江豚脂肪组织中DDT和HCH的含量随着年龄的增长而增加,而雌性个体则表现出随着年龄的增长先增加后下降的趋势。本研究中长江江豚POPs含量水平与其年龄无显著正相关关系,但L组样本体内DDT和PCBs含量大于M组和S组江豚,表明POPs在长江江豚体内的累积量有随年龄增加的趋势,符合其持久、难降解的特性和通过食物链累积的规律。
3.3 长江江豚栖息地环境背景与POPs累积的关系长江口和珠江口是内陆水体和海洋的连接处,污染较为严重,沉积物和水体有机污染物含量较高,因此长江口东亚江豚[8]和珠江口印太江豚[9]体内POPs含量均高于长江下游长江江豚。
在长江中下游流域,鄱阳湖沉积物中HCH含量是长江下游干流的6倍左右,长江下游干流沉积物中DDT和PCBs含量分别为鄱阳湖的10倍和5倍左右,本研究中鄱阳湖和长江下游样本HCH、DDT和PCBs含量表现出一致的趋势[27](表 5)。此外,DDT/PCBs的值表示农业和工业生产对鲸类动物POPs累积水平的影响程度[20],长江下游样本的DDT/PCBs值为54.81,而鄱阳湖样本为9.82,这表明长江下游地区长江江豚受到农业污染的影响可能更严重。但由于缺乏长江下游干流系统的水体POPs污染特征资料,加之野外死亡样本的发现地点与死亡地点可能存在较大的偏差,尚难以准确判断其实际栖息水域,上述结果可能暂时无法从环境背景数据中得到验证。因此,关注长江江豚主要栖息地水环境质量及污染物分布特征,还可以为野外死亡长江江豚死因诊断及栖息地溯源提供参考。

|
表 5 长江下游各江段沉积物和长江江豚脂肪中POPs平均含量比较 Tab.5 Comparison of POPs contents in the sediment of lower Yangtze River and fat of Yangtze finless porpoise |
| [1] |
王克雄. 鄱阳湖——长江江豚最后的避难所?[J]. 大自然, 2007(3): 21-23. WANG K X. Poyang Lake-the last refuge of the Yangtze finless porpoise?[J]. China Nature, 2007(3): 21-23. |
| [2] |
周荣, 吴文军, 周开亚. 渤海江豚组织中钠、钙、锶、镁、磷、钾的研究[J]. 海洋环境科学, 1996, 15(1): 28-34. ZHOU R, WU W J, ZHOU K Y. Study on Na, Ca, Sr, Mg, P and K in the finless porpoise tissues in Bohai Sea[J]. Marine Environmental Science, 1996, 15(1): 28-34. |
| [3] |
杨健, 尹君, 许海伦, 等. 长江江豚锌、铜、铅、镉和砷的摄入与累积[J]. 水生生物学报, 2005, 29(5): 557-563. YANG J, YIN J, XU H L, et al. The ingestion and accumulation of zinc, copper, lead, cadmium and arsenic in the Yangtze finless Porpoise, Neophoc aena phocaenoides asiaeorientalis[J]. Acta Hydrobiologica Sinica, 2005, 29(5): 557-563. DOI:10.3321/j.issn:1000-3207.2005.05.014 |
| [4] |
肖文. 鄱阳湖江豚种群现状与保护的研究[J]. 水生生物学报, 1999. XIAO W. Study on the population status and protection of finless porpoise in Poyang Lake[J]. Acta Hydrobiologica Sinica, 1999. |
| [5] |
ERICKSON M D, KALEYⅡ R G. Applications of polychlorinated biphenyls[J]. Environmental Science and Pollution Research, 2011, 18(2): 135-151. DOI:10.1007/s11356-010-0392-1 |
| [6] |
段晓勇. 黄、东海沉积物中多氯联苯的分布及来源[D]. 青岛: 中国海洋大学, 2014. DUAN X Y. Distributions and sources of polychlorinated biphenyls in the Yellow Sea and the East China Sea inner shelf sediments[D]. Qingdao: Ocean University of China, 2014. |
| [7] |
WEISBROD A V, SHEA D, MOORE M J, et al. Species, tissue and gender-related organochlorine bioaccumulation in white-sided dolphins, pilot whales and their common prey in the northwest Atlantic[J]. Marine Environmental Research, 2001, 51(1): 29-50. DOI:10.1016/S0141-1136(00)00032-5 |
| [8] |
徐添翼, 唐文乔. 长江口两种江豚亚种体脂内多氯联苯同分异构体含量的比较分析[J]. 动物学杂志, 2016, 51(3): 337-346. XU T Y, TANG W Q. Comparative analysis on isomer-specific of polychlorinated biphenyls in the dead bodies of two Finless Porpoise subspecies in Yangtze Estuary[J]. Chinese Journal of Zoology, 2016, 51(3): 337-346. |
| [9] |
GUI D, HE J W, ZHANG X Y, et al. Potential association between exposure to legacy persistent organic pollutants and parasitic body burdens in Indo-Pacific finless porpoises from the Pearl River Estuary, China[J]. Science of the Total Environment, 2018, 643: 785-792. DOI:10.1016/j.scitotenv.2018.06.249 |
| [10] |
黄健生, 贾晓平, 甘居利. 广东大鹏湾海域糙齿海豚体内多氯联苯的分布特征与毒性评价[J]. 中国水产科学, 2007, 14(6): 974-980. HUANG J S, JIA X P, GAN J L. Distribution and toxicity assessment of polychlorinated biphenyls (PCBs) in tissues of rough-toothed dolphin(Steno bredanensis) from Dapeng Bay, Guangdong, China[J]. Journal of Fishery Sciences of China, 2007, 14(6): 974-980. DOI:10.3321/j.issn:1005-8737.2007.06.013 |
| [11] |
YANG F X, ZHANG Q H, XU Y, et al. Preliminary hazard assessment of polychlorinated biphenyls, polybrominated diphenyl ethers, and polychlorinated dibenzo-p-dioxins and dibenzofurans to Yangtze finless porpoise in Dongting Lake, China[J]. Environmental Toxicology and Chemistry, 2008, 27(4): 991-996. DOI:10.1897/07-381.1 |
| [12] |
董玮玮. 持久性有机污染物在长江江豚体内及其栖息地中的积累规律研究[D]. 武汉: 中国科学院水生生物研究所, 2009. DONG W W. Studies on persistent organic pollutants accumulation in Yangtze finless porpoise and its habitats[D]. Wuhan: Institute of Hydrobiology, the Chinese Academy of Sciences, 2009. |
| [13] |
张先锋. 江豚的年龄鉴定、生长和生殖的研究[J]. 水生生物学报, 1992, 16(4): 289-298. ZAHNG X F. Studies on the age determination, growth and reproduction of finless porpoise Neophocaena phocaenoides[J]. Acta Hydrobiologica Sinica, 1992, 16(4): 289-298. |
| [14] |
张淮城, 周开亚, 周荣, 等. 渤海江豚体内汞的初步研究[J]. 海洋环境科学, 1995, 14(2): 33-38. ZHANG H C, ZHOU K Y, ZHOU R, et al. The preliminary study on the concentration of Hg in finless porpoise (Neophocaena phocaenoides) from BohaiSea[J]. Marine Environmental Science, 1995, 14(2): 33-38. |
| [15] |
STORELLI M M, MARCOTRIGIANO G O. Persistent organochlorine residues in risso's dolphins (Grampus griseus) from the Mediterranean sea (Italy)[J]. Marine Pollution Bulletin, 2000, 40(6): 555-558. |
| [16] |
WADE T L, CHAMBERS L, GARDINALI P R, et al. Toxaphene, PCB, DDT, and chlordane analyses of Beluga Whale Blubber[J]. Chemosphere, 1997, 34(5/7): 1351-1357. |
| [17] |
陈满荣, 俞立中, 许世远, 等. 长江口PCBs污染及水环境PCBs研究趋势[J]. 环境科学与技术, 2004, 27(5): 24-25, 34. CHEN M R, YU L Z, XU S Y, et al. Research of PCBs pollution in tidal flat sediments of Yangtze River estuary[J]. Environmental Science & Technology, 2004, 27(5): 24-25, 34. |
| [18] |
刘会, 甘居利, 贾晓平. 广东红海湾银杏齿喙鲸鲸脂中多氯联苯的分布特征及其毒性评价[J]. 中国水产科学, 2009, 16(3): 381-387. LIU H, GAN J L, JIA X P. Distribution characteristic and risk assessment of PCBs in blubber of Mesoplodon ginkgodens from HonghaiBay, Guangdong China[J]. Journal of Fishery Sciences of China, 2009, 16(3): 381-387. |
| [19] |
KEMPER C, GIBBS P, OBENDORF D, et al. A review of heavy metal and organochlorine levels in marine mammals in Australia[J]. Science of the Total Environment, 1994, 154(2/3): 129-139. |
| [20] |
ZHANG K, QIAN Z Y, RUAN Y F, et al. First evaluation of legacy persistent organic pollutant contamination status of stranded Yangtze finless porpoises along the Yangtze River Basin, China[J]. Science of the Total Environment, 2020, 710: 136446. |
| [21] |
SENTHILKUMAR K, KANNAN K, SINHA R K, et al. Bioaccumulation profiles of polychlorinated biphenyl congeners and organochlorine pesticides in Ganges river dolphins[J]. Environmental Toxicology and Chemistry, 1999, 18(7): 1511-1520. |
| [22] |
KANNAN K, RAMU K, KAJIWARA N, et al. Organochlorine pesticides, polychlorinated biphenyls, and polybrominated diphenyl ethers in Irrawaddy dolphins from India[J]. Archives of Environmental Contamination and Toxicology, 2005, 49(3): 415-420. |
| [23] |
BORRELL A, AGUILAR A. Mother-calf transfer of organochlorine compounds in the common dolphin (Delphinus delphis)[J]. Bulletin of Environmental Contamination and Toxicology, 2005, 75(1): 149-156. |
| [24] |
WELLS R S, TORNERO V, BORRELL A, et al. Integrating life-history and reproductive success data to examine potential relationships with organochlorine compounds for bottlenose dolphins (Tursiops truncatus) in Sarasota Bay, Florida[J]. Science of the Total Environment, 2005, 349(1/3): 106-119. |
| [25] |
STERN G A, MACDONALD C R, ARMSTRONG D, et al. Spatial trends and factors affecting variation of organochlorine contaminants levels in Canadian Arctic beluga (Delphinapterus leucas)[J]. Science of the Total Environment, 2005, 351-352: 344-368. |
| [26] |
周荣, 周开亚. 黄海江豚体脂中有机氯的含量及与其年龄等相关性的研究[J]. 环境科学学报, 1993, 13(3): 360-366. ZHOU R, ZHOU K Y. Chlorinated organic compounds in Neopocaena phocaenoides from Yellow Sea[J]. Acta Scientiae Circumstantiae, 1993, 13(3): 360-366. |
| [27] |
郦倩玉, 赵中华, 蒋豫, 等. 鄱阳湖周溪湾沉积物中有机氯农药和多环芳烃的垂直分布特征[J]. 湖泊科学, 2016, 28(4): 765-774. LI Q Y, ZHAO Z H, JIANG Y, et al. Vertical distribution characteristics of organochlorine pesticides and polycyclic aromatic hydrocarbons in a sedimentary core from Zhouxi Bay, Lake Poyang[J]. Journal of Lake Sciences, 2016, 28(4): 765-774. |
| [28] |
HOBBS K E, MUIR D C G, MITCHELL E. Temporal and biogeographic comparisons of PCBs and persistent organochlorine pollutants in the blubber of fin whales from eastern Canada in 1971-1991[J]. Environmental Pollution, 2001, 114(2): 243-254. |
| [29] |
HOBBS K E, MUIR D C G, MICHAUD R, et al. PCBs and organochlorine pesticides in blubber biopsies from free-ranging St. Lawrence River Estuary beluga whales (Delphinapterus leucas), 1994-1998[J]. Environmental Pollution, 2003, 122(2): 291-302. |
| [30] |
刘明丽. 长江流域水相、沉积相中多溴联苯醚及有机氯农药的污染特征和风险评价[D]. 北京: 北京交通大学, 2018. LIU M L. Characteristics and risk assessment of polybrominated diphenyl ethers and organochlorine pesticides in water and sediment of the Yangtze River Basin[D]. Beijing: Beijing Jiaotong University, 2018. |
2. Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization, Ministry of Agriculture and Rural Affairs, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, Jiangsu, China
 2023,
Vol. 32
2023,
Vol. 32


