2. 上海海洋大学 国家海洋生物科学国际联合研究中心, 上海 201306;
3. 上海海洋大学 国家渔业科学教育实验示范中心, 上海 201306
微藻是一类分布广泛的单细胞微生物群体。一方面,微藻含有叶绿体,能够进行光自养,即利用光作为能源,利用无机碳作为碳源[1]。在光自养中,处于生长后期的微藻往往会因为相互遮挡而降低光的利用效率,使细胞无法达到较高的密度[2]。另一方面,少部分微藻具有异养的能力,即在黑暗条件下利用有机碳作为生长的唯一能量和碳源[3]。与光自养相比,微藻的异养不受限于光照,因此可以在密闭的生物反应器中进行,条件可控,污染风险低,细胞密度也高得多[4]。但值得注意的是,并非所有的微藻都能够异养。目前所报道的异养藻种主要限定于小球藻、菱形藻、裂殖壶菌等,品种十分有限[5-6]。因此,发掘具备异养能力的微藻种质资源,具有重要的现实意义。本研究选取等鞭金藻(Isochrysis sp.)与缺刻缘绿藻(Myrmecia incisa),对其异养特性展开研究。等鞭金藻是海水藻,无细胞壁,易消化,且胞内富含二十二碳六烯酸(docosahexaenoic acid, DHA);缺刻缘绿藻是一种球形淡水绿藻,是迄今为止已知的花生四烯酸(arachidonic acid, ArA)含量最高的微藻[7-8]。在现有的文献中,等鞭金藻能否异养,观点尚不统一;缺刻缘绿藻则只有1篇异养的报道,所观察到的生长速率也很低[9-11]。因此,本研究首先探索等鞭金藻和缺刻缘绿藻异养的可行性;在此基础上继而展开兼养的研究,即提供有机碳源的同时也补充光照,以期获得更高的生物量产量。除了生物量之外,重点考察2种微藻中各自的特色脂肪酸,即DHA与ArA在异养/兼养模式下的产量变化。最后,对于所获得的富含DHA的等鞭金藻与富含ArA的缺刻缘绿藻,尝试用于投喂卤虫,观察这些多不饱和脂肪酸是否能够传递给卤虫并在其体内富集,以形成营养强化型的水产饵料。
1 材料与方法 1.1 实验材料本研究所采用的缺刻缘绿藻(Myrmecia incisa)由暨南大学张成武教授馈赠;等鞭金藻(Isochrysis sp.)购于上海光语生物科技公司。本研究所采用的渤海湾卤虫(Artemia sp.)休眠卵购于无棣海吉水产有限公司。
1.2 实验方法 1.2.1 微藻的异养培养等鞭金藻的培养采用的是f/2培养基,培养温度为25 ℃,盐度为28,pH调节至8.0,在3、5、10 g/L的葡萄糖浓度及75 mg/L的硝酸钠浓度下等鞭金藻进行异养;缺刻缘绿藻的培养采用的是BG-11培养基,培养温度为25 ℃,pH调节至6.8,在0.5、1.0、1.5、2.0 g/L的葡萄糖质量浓度及1 500 mg/L的硝酸钠质量浓度下缺刻缘绿藻进行异养。两株微藻均采用内径为3.5 cm的圆柱体玻璃管(容量约500 mL)作为光生物反应器,并加入0.22 μm过滤空气充气培养,置于黑暗的培养室。
在筛选出微藻生长的最佳葡萄糖质量浓度后,进一步明确了适合两株微藻异养生长的最佳硝酸钠质量浓度。等鞭金藻在含有5 g/L葡萄糖,75、150、300、600 mg/L的硝酸钠的f/2培养基中进行异养。缺刻缘绿藻在含有1 g/L葡萄糖,150、300、750、1 500 mg/L的硝酸钠的BG-11培养基中进行异养。
1.2.2 微藻的兼养培养在明确上述异养条件后,其他条件不变,另外施加120 μmol/(m2·s)的光照,光照和黑暗时间比为12 h∶ 12 h,在此条件下对等鞭金藻和缺刻缘绿藻进行兼养培养。为减少杂菌干扰,异养和兼养培养基中均添加39 mg/L氨苄青霉素。2种微藻的培养时间均为12 d。
1.2.3 微藻生物量的测定采用差量法测定生物量。每两天取10 mL藻液以转速5 000 r/min离心并用蒸馏水冲洗3次,在已烘干称重的滤纸(Whatman GF/C,孔径1.6 μm)上过滤后,置于80 ℃的干燥箱烘至恒重。根据不同时间点的藻类生物量绘制微藻生长曲线。用下列公式计算生物量(N):
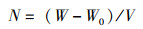 (1)
(1)
式中:N为生物量,g/L;W为含有藻液的滤纸的质量,g;W0为滤纸的质量,g;V为藻液的体积,L。
1.2.4 微藻的DHA与ArA的测定根据改良的COHEN的方法测定脂肪酸[12]。取20 mg冻干的藻粉加入1 mL 4%的硫酸甲醇溶液,氮气充满后迅速封口,置于80 ℃水浴1 h,冷却后加入1 mL正己烷和1 mL 0.9%的氯化钠溶液,涡旋振荡,充分混匀,5 500 r/min,离心10 min,吸取上清液,用氮气吹干并用正己烷复溶。脂肪酸组成分析采用Angilent 6890 plus型气相色谱仪,色谱柱为HP-5型毛细管柱;分流比为50∶ 1;空气、氮气、氢气的流速分别为450、30、40 mL/min,进样量为1 μL。根据脂肪酸标准品的分析图谱和保留时间对样品脂肪酸定性分析,利用峰面积归一化法计算DHA和ArA的相对百分含量。
1.2.5 卤虫的孵化与微藻投喂参照BARUAH等[13]的方法进行消毒和孵化。卤虫孵化条件为:温度为30 ℃,盐度为27,pH调节至8.5,光照强度为36 μmol/(m2·s)。所用的卤虫为孵化24 h后的卤虫无节幼体。卤虫孵化好后,利用兼养模式下获得最高DHA和ArA含量的等鞭金藻和缺刻缘绿藻作为饵料投喂卤虫,对其进行营养强化。以不投喂饵料组为对照,各设3个平行组。强化时,卤虫的密度为50个/mL,微藻的密度为3×106个/mL。
1.2.6 卤虫的DHA与ArA的测定分别在强化6、12和24 h后用300目筛绢过滤收集强化好的卤虫。用蒸馏水冲洗干净,置于烘箱中60 ℃过夜后磨碎,获取卤虫样品,用于DHA与ArA的测定,各设3个平行组。测定方法同1.2.4节。
1.3 数据处理与分析所有实验均进行3次,实验结果数据均用平均值±标准差来表示。不同组间差异采用Kruskal-Wallis单因素方差分析,在P < 0.05的置信度水平上采用Duncan氏多重范围检验。不同小写字母表示差异有统计学意义。采用SPSS 22.0分析数据,GraphPad Prism 5.0进行作图。
2 结果与分析 2.1 等鞭金藻和缺刻缘绿藻异养探究首先检测了2种微藻能否在异养条件下存活。在黑暗条件下,2种微藻均补充葡萄糖作为唯一碳源。对于等鞭金藻,设置的葡萄糖质量浓度为3~10 g/L,这一质量浓度范围适用于大多数已报道的异养微藻。结果如图 1a所示,补充葡萄糖后,等鞭金藻能够正常生长,最佳质量浓度为5 g/L。在葡萄糖质量浓度提升至10 g/L后,微藻生物量反而出现下降。对于缺刻缘绿藻,迄今只有1篇文献报道了其异养性能,且适用于该藻的葡萄糖质量浓度很低。参考该文献,本研究设置的葡萄糖质量浓度为0.5~2.0 g/L。结果发现,在所使用的质量浓度范围内,缺刻缘绿藻均能够生长,其中效果最佳的质量浓度是1 g/L(图 1b)。在进一步增加葡萄糖质量浓度至5~10 g/L时,观察到微藻絮凝成团,不能存活。这说明缺刻缘绿藻可能仅可以在较低的葡萄糖质量浓度下异养存活。
|
图 1 异养条件下等鞭金藻(a)和缺刻缘绿藻(b)的生长情况 Fig. 1 Growth of Isochrysis sp. (a) and Myrmecia incisa (b) under heterotrophic condition |
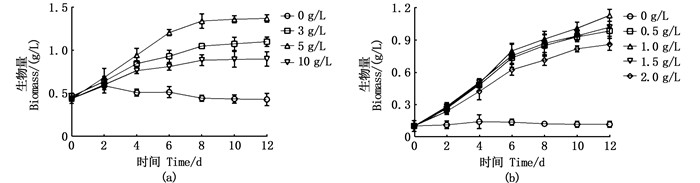
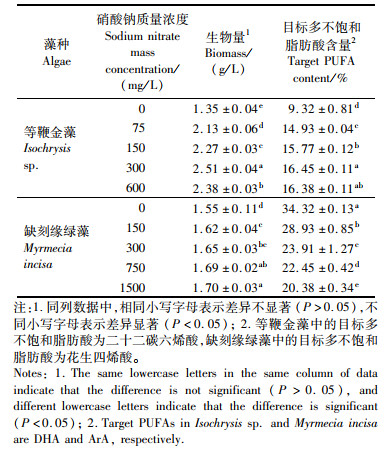
除了碳之外,氮是微藻生长最重要的营养限制因子,因此,在明确了适用于2种微藻异养培养的有机碳含量后,本研究进一步探索了适用于2种微藻的氮含量。对于等鞭金藻,在5 g/L葡萄糖质量浓度的基础上,加入75~600 mg/L硝酸钠进行异养培养(其中75 mg/L为正常f/2培养基所含的硝酸钠质量浓度)。结果如表 1所示,硝酸钠质量浓度对等鞭金藻的生长促进效果从高到底依次为:300 mg/L>600 mg/L>150 mg/L>75 mg/L>0 mg/L,最高生物量可达1.52 g/L。除了生物量之外,微藻的脂肪酸含量也与培养基中的氮含量密切相关。本研究继而检测了等鞭金藻中的目标多不饱和脂肪酸,即DHA的含量。发现硝酸钠的质量浓度在300 mg/L时DHA含量最高,达到总脂肪酸含量的11.16%。对于缺刻缘绿藻,在1 g/L葡萄糖质量浓度的基础上,加入了150~1 500 mg/L硝酸钠进行异养培养(其中1 500 mg/L为正常BG-11培养基所含的硝酸钠质量浓度)。结果表明,不同质量浓度的硝酸钠对缺刻缘绿藻的生长影响较小,但对于其目标多不饱和脂肪酸,即ArA含量的影响显著(P < 0.05)。值得注意的是,ArA的最高含量出现在完全缺氮的条件下,达到了总脂肪酸含量的30.36%。这与等鞭金藻中的情况恰好相反(DHA在缺氮条件下的含量最低)。
|
表 1 异养条件下氮含量对2种微藻的生长及目标多不饱和脂肪酸含量的影响 Tab.1 Effects of nitrogen content on growth and target polyunsaturated fatty acid (PUFA) contents of two microalgae under heterotrophic condition |
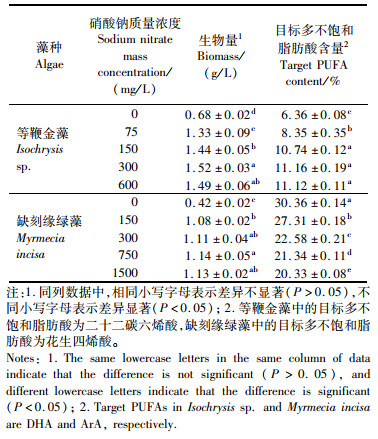
在明确了等鞭金藻和缺刻缘绿藻能够异养后,进一步对其兼养特性进行探究,即在异养的基础上增加了120 μmol/(m2·s)的光照。结果显示,2种微藻的生长均得到了显著的提升:在12 d的培养周期结束后,等鞭金藻的生物量达到2.13 g/L,是异养条件下的1.57倍(P < 0.05)[图 2(a)];而缺刻缘绿藻的生物量达到1.70 g/L,比异养条件提高了50.44%(P < 0.05)[图 2(b)]。
|
图 2 兼养条件下等鞭金藻(a)和缺刻缘绿藻(b)的生物量 Fig. 2 Biomass of Isochrysis sp. (a) and Myrmecia incisa (b) under mixotrophic condition |
在此基础上,进一步探究兼养条件下氮含量对2种微藻生长及脂肪酸积累的影响。如表 2所示,对于等鞭金藻,300 mg/L的硝酸钠质量浓度对于其生长表现出最佳的促进作用,最高生物量可达2.51 g/L。与同样碳、氮含量的异养相比,显著提高了65.13%(P < 0.05)。等鞭金藻中的DHA,在300 mg/L的硝酸钠质量浓度下达到了16.45%(TFA),比异养时显著增加了47.40%(P < 0.05)。对于缺刻缘绿藻,在添加1 500 mg/L的硝酸钠时,兼养的生物量最高为1.70 g/L。与同样碳、氮含量的异养相比,显著提高了50.44%(P < 0.05)。至于ArA的含量,在完全缺氮条件下高达34.32%(TFA),比异养时增加了13.04%(P < 0.05)。随着硝酸钠质量浓度的升高,缺刻缘绿藻的ArA含量逐渐降低。
|
表 2 兼养条件下氮含量对2种微藻的生长及目标多不饱和脂肪酸含量的影响 Tab.2 Effects of nitrogen content on growth and target polyunsaturated fatty acid (PUFA) contents of two microalgae under mixotrophic condition |
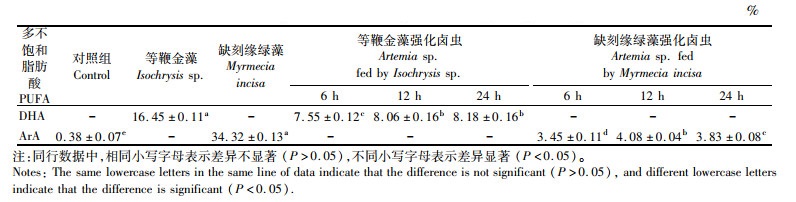
结果表明,兼养条件下,2种微藻能够生产高含量的目标多不饱和脂肪酸(即DHA和ArA)。对于等鞭金藻,最适宜的营养条件为5 g/L葡萄糖、300 mg/L硝酸钠;对于缺刻缘绿藻,最适宜的营养条件为1 g/L葡萄糖,缺氮培养。对于所获得的富含目标多不饱和脂肪酸的2种微藻,进一步探究了其用做水产动物饵料的可行性。对于很多水产动物,脂肪酸的摄入会显著影响其存活率、生长速度、抗应激能力等生理指标[14]。对于本研究中的2种目标多不饱和脂肪酸而言,DHA的摄入不足,可能会损害海洋幼鱼的神经和视觉发育,而ArA则在水产动物幼体的磷酸肌醇转导信号机制中发挥着至关重要的作用[15]。将2种微藻尝试用于对卤虫无节幼体进行营养强化。卤虫是培育海水苗种食物链的重要一环,常被用作水产动物幼苗的开口饵料;但是在其无节幼体内,从较短的碳链前体合成长链多不饱和脂肪酸所需的去饱和酶和延长酶活性非常低,因此难以自身合成DHA与ArA[16]。本研究分别将等鞭金藻和缺刻缘绿藻投喂卤虫,对照组是未投喂任何食物的卤虫。在投喂微藻6、12、24 h后,卤虫体内DHA与ArA含量变化如表 3所示。
|
表 3 经2种兼养型微藻分别饲养后的卤虫体内的目标多不饱和脂肪酸含量变化 Tab.3 Content changes of the target PUFA in the body of Artemia sp. after feeding with two mixotrophic microalgae respectively |
由表 3可知,未进行营养强化时,卤虫体内不含有DHA,只检测到少量的ArA。在投喂等鞭金藻6 h后卤虫体内的DHA就富集了7.55%,且卤虫体内的DHA含量随着强化时间的延长而增加,最终卤虫体内的DHA含量由0增长至8.18%,等鞭金藻中DHA含量的49.73%富集到卤虫体内,大大提高了卤虫的DHA含量(P < 0.05)。利用缺刻缘绿藻强化卤虫时,显著改善了卤虫体内的ArA含量(P < 0.05),在经过6 h强化后,ArA含量由0.38%增加至3.45%,12 h强化后,ArA含量进一步增加至4.08%,比未强化时增加了9.74倍,但强化12~24 h时,ArA含量略有下降。这一结果表明,2种微藻的目标多不饱和脂肪酸均能够通过投喂的形式,有效传递并富集在卤虫体内,达到营养强化的效果。
3 讨论 3.1 等鞭金藻与缺刻缘绿藻异养的可行性分析微藻能够利用有机物的前提是该藻能够异养。异养时,微藻依赖有机碳作为生长的能量和碳源,而不受光照的限制。本研究以葡萄糖作为有机碳源,对等鞭金藻与缺刻缘绿藻尝试进行了异养。文献中关于这2种微藻的异养报道十分有限:对于等鞭金藻,BASRI等[9]研究表明I. maritima能够利用葡萄糖异养,最大细胞密度是光自养时的4.6倍, 在异养中的不同细胞生长阶段,碳水化合物含量均高于光自养;而ALKHAMIS等[10]研究则表明,I. galbana在异养条件下生长速率受到显著的抑制。因此,等鞭金藻的异养能力可能存在物种特异性。本研究的结果表明,I. galbana UTEXLB2307能够进行异养培养,最适葡萄糖质量浓度为5 g/L。对于缺刻缘绿藻,迄今只有1篇异养的报道,且获得的生物量也很低:在15天的培养后,净增长只有0.6 g/L[11]。在本研究中,12 d的异养培养后生物量净增长了1.03 g/L,比原先TABABA等报道的数据增加了71.67%,这可能是由于以下两方面的原因:(1)TABABA等研究使用的是转速较低(65 r/min转速)的摇床来摇动微藻,低转速会导致微藻絮凝,溶氧量低,不利用生长。而本研究采用的是加入过滤空气的生物反应器来培养微藻,大大提高了微藻的溶氧量,不易絮凝;(2)本研究调节了异养培养基中的pH,因为异养型微藻利用有机碳代谢生成CO2,导致培养基中的pH降低,所以调节pH更有利于异养微藻的生长[17]。另外,对于2种微藻,当葡萄糖质量浓度过高时(等鞭金藻的葡萄糖质量浓度大于5 g/L,缺刻缘绿藻的葡萄糖质量浓度大于1 g/L),微藻的生长均会受到限制。这可能是由于葡萄糖质量浓度过高,使得同化这些葡萄糖所需要大量ATP超过了其本身所含的能量,从而无法继续促进微藻的生长[18]。
除了碳之外,氮也是微藻生长的关键营养因子,而氮含量对微藻生长的影响各有不同[10]。一般而言,微藻倾向于在氮充足环境下生长,如NIGAM等[19]研究发现,蛋白核小球藻的生物量随着氮浓度的升高而增加,富氮条件下更有利于其生长。但是,也有部分微藻更倾向于低氮条件下生长,如ARUMUGAM等[20]研究表明低氮环境下促进栅藻生长,高氮则抑制其生长。同时,还有部分微藻的生长对培养基中的氮浓度响应不敏感,如:石岩骏[21]研究表明不同氮含量对塔玛亚历山大藻的比生长速率几乎没有影响;BREUER等[22]研究发现微拟球藻在缺氮培养条件下的生物量产率与氮充足时相似。对于等鞭金藻,正常f/2培养基中的硝酸钠质量浓度是75 mg/L,在培养的中后段往往会耗尽。因此,本研究中适当提高等鞭金藻的培养基中的氮含量,使藻细胞的光合效率保持在一个更高的水平,增加同化力形成(NADPH和ATP),促进碳同化,加快了藻细胞的生长[23]。对于缺刻缘绿藻,氮含量的改变则对其生物量的影响并不明显,这一结果与之前缺刻缘绿藻的报道一致,可能与缺刻缘绿藻中蛋白质与脂质之间的转化有关[8, 22, 24]。
相较于生物量,微藻胞内脂肪酸的含量更容易受到氮含量的影响。培养基中C/N的变化能够调节微藻内碳流的代谢,造成碳水化合物与能量的代谢及物质再分配,从而显著影响微藻内产物的积累,尤其是脂肪酸[8]。目前,部分异养型微藻被应用于生产多不饱和脂肪酸,如:WEN等[25]利用菱形藻异养生产EPA;LING等[6]异养培养裂殖弧菌来高效生产DHA,还有部分微藻已经开始应用于大规模商业化生产多不饱和脂肪酸,如美国的DSM营养产品公司通过异养发酵培养隐甲藻而获得富含40-50%DHA的藻油,用作婴儿配方奶粉添加剂[26]。因此除了2种微藻的生物量外,本研究还检测了其目标多不饱和脂肪酸在不同氮含量下的积累情况。对于等鞭金藻来说,观察到培养基中氮含量显著影响DHA的积累,相较于缺氮和低氮培养,富氮条件下更有利于DHA的积累。据报道,对于大多数等鞭金藻,其DHA含量与初始氮含量呈正相关[27]。ZARRINMEHR等[28]研究发现在充足的氮浓度条件下,等鞭金藻中多不饱和脂肪酸含量比氮匮乏时增加了5倍。低氮条件下DHA含量较低,可能是因为培养基中的氮被很快消耗,而缺氮时从糖脂中释放出来的DHA由于不能被纳入中性脂中,因而受到β-氧化降解导致含量降低[27]。相对于等鞭金藻,缺刻缘绿藻的研究表明在缺氮条件下更有利于ArA的积累。大量的研究[29-30]也证明,在缺刻缘绿藻中,缺氮或低氮情况下会加速积累ArA。与等鞭金藻不同,缺刻缘绿藻中ArA主要集中在中性脂而非极性脂上。因此,随着培养基中氮的消耗,碳流会从碳水化合物和蛋白质流向储能效果更好的中性脂(尤其是甘油三酯)中,这使得ArA的含量迅速上升[31]。
3.2 等鞭金藻与缺刻缘绿藻兼养特性的分析对于能够异养的藻种而言,兼养可能是一种更高效的培养策略。大多数研究[32]表明,与异养相比,兼养具有更高的生长速率和生物质含量。本研究的结果也表明,2种微藻均在兼养条件下获得最高的生物量。这可能是由于在兼养中同时提供了光照和有机碳,一方面光合作用产生的ATP能够加速葡萄糖的氧化代谢,另一方面葡萄糖氧化释放的CO2可以被重新用于光合作用[33]。因此,在兼养环境中,光合作用和葡萄糖氧化共同发挥作用,往往能够有效地提高微藻的生长速率。其次,相对于光自养和异养,兼养型微藻同时利用无机碳和有机碳代谢生成羟基和CO2,使得培养基中的pH维持在一个较为稳定的水平,对藻类的生长更有利,从而提高生物质含量[17]。
除了生物量外,兼养条件下微藻的DHA及ArA含量也显著高于异养组,可能是在兼养过程中,微藻的质体和线粒体之间的二氧化碳穿梭作用增强,代谢物的细胞内含量增加,参与糖酵解和三羧酸循环活性的增强,这些增强的TCA活性对应于脂肪酸和脂质等存储物质合成的增加,且在光照的作用下,光合作用产生氧气,使得脂肪酸去饱和酶能够更好地发挥作用,从而提高多不饱和脂肪酸的含量[34-35]。
3.3 DHA和ArA由微藻向卤虫传递的分析对于兼养后富含DHA和ArA的2种微藻,本研究进一步尝试用来投喂卤虫,以期获得营养强化型的生物饵料。目前,已有多种微藻应用于卤虫的营养强化,比如海洋微藻盐生杜氏藻、亚心形扁藻、微拟球藻、等鞭金藻等[16]。对于缺刻缘绿藻而言,虽然它是淡水藻,但同样可以被滤食性的卤虫有效摄食。有研究[36]表明,投喂淡水小球藻能够有效获得营养强化的卤虫。
在投喂了等鞭金藻与缺刻缘绿藻后,在卤虫体内成功检测到了丰富的DHA与ArA。利用等鞭金藻强化卤虫时,随着强化时间的延长,DHA含量持续上升,未出现下降,这可能是由于等鞭金藻胞内富含类胡萝卜素等具有强抗氧化活性的物质,有助于保护长链的多不饱和脂肪酸不被氧化分解[14]。对于缺刻缘绿藻而言,尽管其自身含有很高含量的ArA,有效传递给卤虫的比例并不高。这可能是由于缺刻缘绿藻含有细胞壁,而卤虫缺乏咀嚼器,因而导致其对于缺刻缘绿藻的消化速度较慢,ArA的吸收率相对较低[37]。缺刻缘绿藻投喂的卤虫在12~24 h时,ArA含量略有下降,可能是由于消化不良导致的存活率降低有关。但值得注意的是,对于海洋幼鱼来说,虽然ArA是必需的脂肪酸,但其需求量并不高。已有研究[38]表明,低含量的ArA可以显著提高幼鱼的生长率,而提高ArA含量反而会抑制其生长。这提示,利用缺刻缘绿藻进行营养强化所获得的卤虫可能是适用于海洋幼鱼的优质生物饵料。
综上所述,本研究首先明确了等鞭金藻和缺刻缘绿藻具有异养的能力,能够有效利用外源葡萄糖作为有机碳源进行生长。在此基础上,兼养培养能够进一步提升微藻的生物量以及目标多不饱和脂肪酸的含量。对于所获得的富含DHA与ArA的2种微藻,证实了能够通过投喂的方式,有效将多不饱和脂肪酸传递给卤虫,从而有望作为营养强化型的水产饵料。本研究的成果为等鞭金藻和缺刻缘绿藻的资源化利用提供了理论依据与可行的技术思路。
| [1] |
GOUVEIA L, OLIVEIRA A C. Microalgae as a raw material for biofuels production[J]. Journal of Industrial Microbiology and Biotechnology, 2009, 36(2): 269-274. DOI:10.1007/s10295-008-0495-6 |
| [2] |
WEN Z Y, CHEN F. Optimization of nitrogen sources for heterotrophic production of eicosapentaenoic acid by the diatom Nitzschia laevis[J]. Enzyme and Microbial Technology, 2001, 29(6/7): 341-347. |
| [3] |
MOHAN S V, ROHIT M V, CHIRANJEEVI P, et al. Heterotrophic microalgae cultivation to synergize biodiesel production with waste remediation: progress and perspectives[J]. Bioresource Technology, 2015, 184: 169-178. DOI:10.1016/j.biortech.2014.10.056 |
| [4] |
DANESH A, ZILOUEI H, FARHADIAN O. The effect of glycerol and carbonate on the growth and lipid production of Isochrysis galbana under different cultivation modes[J]. Journal of Applied Phycology, 2019, 31(6): 3411-3420. DOI:10.1007/s10811-019-01888-5 |
| [5] |
LU X, LIU B, HE Y J, et al. Novel insights into mixotrophic cultivation of Nitzschia laevis for co-production of fucoxanthin and eicosapentaenoic acid[J]. Bioresource Technology, 2019, 294: 122145. DOI:10.1016/j.biortech.2019.122145 |
| [6] |
LING X P, GUO J, LIU X T, et al. Impact of carbon and nitrogen feeding strategy on high production of biomass and docosahexaenoic acid (DHA) by Schizochytrium sp. LU310[J]. Bioresource Technology, 2015, 184: 139-147. DOI:10.1016/j.biortech.2014.09.130 |
| [7] |
LI Y L, SUN H, WU T, et al. Storage carbon metabolism of Isochrysis zhangjiangensis under different light intensities and its application for co-production of fucoxanthin and stearidonic acid[J]. Bioresource Technology, 2019, 282: 94-102. DOI:10.1016/j.biortech.2019.02.127 |
| [8] |
童牧, 于水燕, 欧阳珑玲, 等. 氮饥饿与磷饥饿促使缺刻缘绿藻花生四烯酸含量增加的比较[J]. 水产学报, 2011, 35(5): 763-773. TONG M, YU S Y, OUYANG L L, et al. Comparison of increased arachidonic acid content in Myrmecia incisa cultured during the course of nitrogen or phosphorus starvation[J]. Journal of Fisheries of China, 2011, 35(5): 763-773. |
| [9] |
BASRI E M, MAZNAH W O W. Differential growth and biochemical composition of photoautotrophic and heterotrophic Isochrysis maritima: evaluation for use as aquaculture feed[J]. Journal of Applied Phycology, 2017, 29(3): 1159-1170. DOI:10.1007/s10811-017-1054-1 |
| [10] |
ALKHAMIS Y, QIN J G. Cultivation of Isochrysis galbana in phototrophic, heterotrophic, and mixotrophic conditions[J]. BioMed Research International, 2013, 2013: 983465. |
| [11] |
TABABA H G, HIRABAYASHI S, INUBUSHI K. Growth of Parietochloris incisa in various organic carbon substrates[J]. HortResearch, 2012, 66: 25-35. |
| [12] |
COHEN Z, REUNGJITCHACHAWALI M, SIANGDUNG W, et al. Production and partial purification of γ-linolenic acid and some pigments from Spirulina platensis[J]. Journal of Applied Phycology, 1993, 5(1): 109-115. DOI:10.1007/BF02182428 |
| [13] |
BARUAH K, RANJAN J, SORGELOOS P, et al. Priming the prophenoloxidase system of Artemia franciscana by heat shock proteins protects against Vibrio campbellii challenge[J]. Fish & Shellfish Immunology, 2011, 31(1): 134-141. |
| [14] |
CHAKRABORTY R D, CHAKRABORTY K, RADHAKRISHNAN E V. Variation in fatty acid composition of Artemia salina nauplii enriched with microalgae and baker's yeast for use in larviculture[J]. Journal of Agricultural and food Chemistry, 2007, 55(10): 4043-4051. DOI:10.1021/jf063654l |
| [15] |
从娇娇, 庾庭驰, 于立志, 等. 饲料中植物油替代鱼油对中华绒螯蟹脂肪酸组成的影响[J]. 上海海洋大学学报, 2020, 29(4): 559-567. CONG J J, YU T C, YU L Z, et al. Effects of dietary replacement of fish oil by vegetable oil on fatty acid composition of Chinese mitten crab (Eriocheir sinensis)[J]. Journal of Shanghai Ocean University, 2020, 29(4): 559-567. |
| [16] |
张跃群, 陈爱华, 张雨, 等. 微藻营养强化对卤虫生长和营养成分的影响[J]. 中国农业大学学报, 2018, 23(8): 77-84. ZHANG Y Q, CHEN A H, ZHANG Y, et al. Effects of microalgae on the growth and nutrient enrichment of cultured Artemia[J]. Journal of China Agricultural University, 2018, 23(8): 77-84. |
| [17] |
KIM S, PARK J E, CHO Y B, et al. Growth rate, organic carbon and nutrient removal rates of Chlorella sorokiniana in autotrophic, heterotrophic and mixotrophic conditions[J]. Bioresource Technology, 2013, 144: 8-13. DOI:10.1016/j.biortech.2013.06.068 |
| [18] |
OGAWA T, AIBA S. Bioenergetic analysis of mixotrophic growth in Chlorella vulgaris and Scenedesmus acutus[J]. Biotechnology and Bioengineering, 1981, 23(5): 1121-1132. DOI:10.1002/bit.260230519 |
| [19] |
NIGAM S, RAI M P, SHARMA R. Effect of nitrogen on growth and lipid content of Chlorella pyrenoidosa[J]. American Journal of Biochemistry and Biotechnology, 2011, 7(3): 124-129. DOI:10.3844/ajbbsp.2011.124.129 |
| [20] |
ARUMUGAM M, AGARWAL A, ARYA M C, et al. Influence of nitrogen sources on biomass productivity of microalgae Scenedesmus bijugatus[J]. Bioresource Technology, 2013, 131: 246-249. |
| [21] |
石岩峻. 赤潮藻对营养盐的吸收及生长和相关特性研究[D]. 北京: 北京化工大学, 2004. SHI Y J. The nutrient availability, growth and related characteristics of red tide algae[D]. Beijing: Beijing University of Chemical Technology, 2004. |
| [22] |
BREUER G, LAMERS P P, MARTENS D E, et al. The impact of nitrogen starvation on the dynamics of triacylglycerol accumulation in nine microalgae strains[J]. Bioresource Technology, 2012, 124: 217-226. |
| [23] |
BAILLEUL B, BERNE N, MURIK O, et al. Energetic coupling between plastids and mitochondria drives CO2 assimilation in diatoms[J]. Nature, 2015, 524(7565): 366-369. |
| [24] |
罗梦柳. 缺刻缘绿藻(Parietchloris incisa)和缺刻蚁形藻(Myrmecia incisa)生长和花生四烯酸积累特性研究[D]. 广州: 暨南大学, 2010. LUO M L. The characteristics of growth and arachidonic acid production in the microalgae Parietchloris incisa and Myrmecia incisa[D]. Guangzhou: Jinan University, 2010. |
| [25] |
WEN Z Y, CHEN F. A perfusion-cell bleeding culture strategy for enhancing the productivity of eicosapentaenoic acid by Nitzschia laevis[J]. Applied Microbiology and Biotechnology, 2001, 57(3): 316-322. |
| [26] |
RADIANINGTYAS H, BURJA A M, BARROW J C. Oil producing microbes and method of modification thereof: US, 9023616[P]. 2015-05-05.
|
| [27] |
SUN Z, CHEN Y, MAO X M, et al. Physiological and biochemical changes reveal differential patterns of docosahexaenoic acid partitioning in two marine algal strains of Isochrysis[J]. Marine Drugs, 2017, 15(11): 357. |
| [28] |
ZARRINMEHR M J, FARHADIAN O, HEYRATI F P, et al. Effect of nitrogen concentration on the growth rate and biochemical composition of the microalga, Isochrysis galbana[J]. The Egyptian Journal of Aquatic Research, 2020, 46(2): 153-158. |
| [29] |
ZHANG C W, COHEN Z, KHOZIN-GOLDBERG I, et al. Characterization of growth and arachidonic acid production of Parietochloris incisa comb. nov (Trebouxiophyceae, Chlorophyta)[J]. Journal of Applied Phycology, 2002, 14(6): 453-460. |
| [30] |
翟映雪, 冷云, 衣尧, 等. 氮源、光照对缺刻缘绿藻总脂、花生四烯酸和色素积累的影响[J]. 食品与发酵工业, 2013, 39(8): 53-58. ZHAI Y X, LENG Y, YI Y, et al. Effects of nitrogen starvation and light intensity on total fatty acids, arachidonic acid and pigment in the green microalga Parietochloris incise[J]. Food and Fermentation Industries, 2013, 39(8): 53-58. |
| [31] |
欧阳珑玲, 李晓蕾, 周志刚. 缺刻缘绿藻的光合膜脂与中性脂及其脂肪酸组成在氮饥饿/氮恢复培养过程中的变化[J]. 海洋渔业, 2016, 38(6): 653-662. OUYANG L L, LI X L, ZHOU Z G. Alternations of photosynthetic membrane lipids and triacylglycerol and their fatty acids in Myrmecia incisa grown in a shift from nitrogen starvation to replenishment[J]. Marine Fisheries, 2016, 38(6): 653-662. |
| [32] |
MOHAMMAD MIRZAIE M A, KALBASI M, MOUSAVI S M, et al. Investigation of mixotrophic, heterotrophic, and autotrophic growth of Chlorella vulgaris under agricultural waste medium[J]. Preparative Biochemistry & Biotechnology, 2016, 46(2): 150-156. |
| [33] |
纪鹏, 王伟隆, 黄旭雄. 不同C/N对绿球藻生长和细胞组分的影响[J]. 上海海洋大学学报, 2020, 29(4): 542-551. JI P, WANG W L, HUANG X X. Effects of different C/N ratios on growth and cell biochemical components of Chlorococcum sp.[J]. Journal of Shanghai Ocean University, 2020, 29(4): 542-551. |
| [34] |
ZUNIGA C, LI C T, HUELSMAN T, et al. Genome-scale metabolic model for the green alga Chlorella vulgaris UTEX 395 accurately predicts phenotypes under autotrophic, heterotrophic, and mixotrophic growth conditions[J]. Plant Physiology, 2016, 172(1): 589-602. |
| [35] |
陈锵, 蒋霞敏, 彭瑞冰, 等, 薛瑞萍. 四种微藻投喂对三角帆蚌生长、产珠性能、内壳层颜色和微量元素的影响[J]. 水产学报, 2021, 45(6): 899-909. CHEN Q, JIANG X M, PENG R P, et al. Effects of four microalgae diets on growth, nutritional composition, pearl producing function, shell nacre color and trace element content of Hyriopsis cumingii[J]. Journal of Fisheries of China, 2021, 45(6): 899-909. |
| [36] |
CHEBAN L, KHUDYI O, PRUSINSKA M, et al. Survival, proximate composition, and proteolytic activity of Artemia salina bioencapsulated with different algal monocultures[J]. Fisheries & Aquatic Life, 2020, 28(4): 205-215. |
| [37] |
田宝军, 李英文, 丁茜, 等. 轮虫与卤虫在营养价值等方面的比较[J]. 河北渔业, 2007(12): 45-47. TIAN B J, LIN Y W, DING X, et al. A comparison of rotifer and brine shrimp in nutrient value[J]. Hebei Fisheries, 2007(12): 45-47. |
| [38] |
HAREL M, LUND E, GAVASSO S, et al. Modulation of arachidonate and docosahexaenoate in Morone chrysops larval tissues and the effect on growth and survival[J]. Lipids, 2000, 35(11): 1269-1280. |
2. International Research Center for Marine Biosciences, Ministry of Science and Technology, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


