光是一种非常重要的外部环境因子, 光的主要特征包括光谱成分、光照强度和光周期[1-2]。斑马鱼(Danio rerio)是一种视觉领域研究中的模式生物, 具有广泛的视觉引导行为, 如视动反应、趋光行为和摄食行为等[3-4]。光谱成分和光照强度是影响鱼类趋光反应的关键因素, 鱼类对不同光照条件表现出不同的趋光反应[5-7]。在斑马鱼视觉功能相关的研究中, 趋光反应是一种常用的研究手段[8-9]。NAVA等[10]研究了斑马鱼在紫外光(ultra violet, UV)照射下的趋光反应, 发现UV照射下斑马鱼的负趋光行为明显增加。AVDESH等[11]通过趋光反应研究了斑马鱼对红色、黄色、绿色和蓝色的颜色偏好, 发现相对于红色, 黄色和绿色, 斑马鱼对蓝色表现强烈的反感, 而相对于红色和绿色, 斑马鱼对黄色的偏好程度较低; OLIVEIRA等[12]通过将斑马鱼放置在具有多个不同环境颜色的多室水箱中进行观察, 发现斑马鱼偏爱蓝色和绿色, 逃避黄色和红色。AVDESH等[11]和OLIVEIRA等[12]都对斑马鱼在红色、黄色、绿色和蓝色环境中的颜色偏好进行了研究, 却得到了相互矛盾的试验结果, 这可能是由于他们在试验中未对刺激光强度进行控制所导致的。为此, 本文在严格控制试验参数的条件下研究了斑马鱼对UV和可见光的趋避性, 以及斑马鱼对不同颜色可见光的偏好选择。研究结果对于集约化水产养殖中饲养方式的优化有着重要的现实意义[13-14], 也可为斑马鱼视觉生态的研究提供参考。
1 材料与方法 1.1 试验材料 1.1.1 试验鱼试验鱼为未经过特定选育的6月龄成年斑马鱼(体长3.5~4.0cm), 试验鱼选购自上海乙诺水族科技有限公司。试验前, 试验鱼在上海海洋大学海洋科学学院鱼类行为实验室的循环水槽中暂养2周, 暂养水槽尺寸为500cm×80cm×60cm。暂养水为曝气后的自来水, 水温为(28±0.5) ℃[1], pH为7.0~7.5。每周更换循环水槽的过滤棉和30%水体。暂养期间由4个100W的全光谱LED灯(上海寸景水族有限公司, 上海)提供照明, 光照周期为14h光照(L)∶10h黑暗(D)(光照时段为8:00~22:00)。暂养期间每天投喂1次人工配合饲料。
1.1.2 试验装置设计了1种圆形试验水槽用于测试不同光照条件对斑马鱼趋避行为的影响。试验水槽设计为上下两层结构, 上层为试验区, 下层为背景光区。试验区的半径为60cm, 高度为20cm。试验区中心位置设置了1个活动的圆柱形隔板(半径为10cm, 高度为20cm), 作为试验鱼的释放区。利用2块不透光的矩形隔板(50cm×20cm)将试验区分隔成2个等面积的试验区A和试验区B, 构成双分区试验装置(图 1a); 利用6块不透光的矩形隔板(50cm×20cm)将试验区分隔成6个等面积的试验区, 构成六分区试验装置(图 1b)。在各个试验区水槽壁外侧中心位置安装了刺激光源, 照射向水槽圆心方向。试验区的底部为黑色的亚克力板(半径为60cm), 将圆形试验水槽上层试验区与下层背景光区分隔。背景光区的面积与上层试验区一致, 高度为10cm。在背景光区的底部安装了向正上方照射的红外LED灯(峰值波长为940nm, 半峰全宽为35.7nm), 提供红外背景照明。试验中, 用一套水冷装置对刺激光源和背景光源作冷却处理, 水冷装置由40mm×40mm的铝制水冷板, 8mm管径的PVC软管和直流循环泵(泰尔电子, 中国)组成。水槽正上方安装一台摄像机(DS-2CD3T45D, 海康威视, 中国), 用于记录试验鱼的游动。摄像机镜头前方安装红外滤光片, 避免刺激光对摄相机的记录产生干扰。
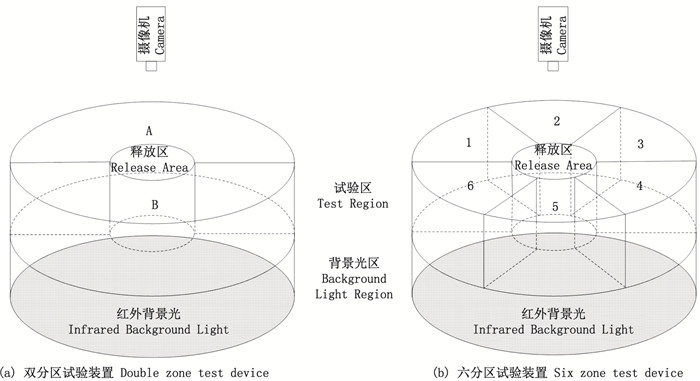
|
图 1 试验装置示意图 Fig. 1 Schematic diagram of test device |
试验中选用6组相同功率(10W)的集成LED灯珠(深圳市优晶光电有限公司, 中国)作为刺激光源, 集成LED灯珠的尺寸为20mm×20mm×3mm。6组刺激光源的颜色分别为UV、紫色、蓝色、绿色、黄色和红色, 峰值波长分别为365、420、460、500、585和620nm(表 1)。
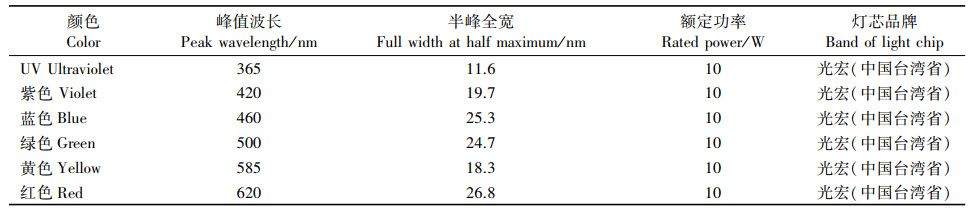
|
表 1 刺激光源参数 Tab.1 Parameters of integrated LED light source |
根据斑马鱼视锥细胞视色素的吸收光谱[15-16], 可知365nm波长的刺激光源能够激活斑马鱼视网膜中U-视锥细胞的功能, 而460和620nm波长的刺激光源能够同时不同程度地激活S-视锥细胞、M-视锥细胞和L-视锥细胞的功能。因此, 试验中选用蓝光(480nm)和红光(620nm)的组合代表可见光。试验前, 预先使用紫外光功率计(U-20, 杭州远方光电, 中国)和可见光功率计(TES132, 泰仕, 中国台湾省)测量刺激光源在试验区中心位置产生5、10、15、20和25μW/cm2光强所需的电流大小, 并在试验期间通过控制恒流电源(DH1716-5D, 大华, 中国)的输出电流实现对刺激光强度(5~25μW/cm2)的改变。
1.2 试验方法试验在避光的暗室中进行, 为了避免昼夜节律对试验结果产生影响, 试验在9:00~17:00时段进行。每次试验随机从暂养水槽中选取50尾健康有活力的斑马鱼置于圆形试验水槽中央的释放区暗适应90min。试验时, 开启刺激光源并取走试验区中央的圆柱形挡板。试验鱼受刺激光的照射, 游向各个试验区。试验鱼的游动行为由试验装置正上方的摄像机所记录, 记录时间为30min。单组试验重复3次, 且已进行过试验的斑马鱼在试验结束后单独暂养, 避免在此试验中重复使用。
1.2.1 斑马鱼对UV和可见光的趋避性选用蓝光(480nm)和红光(620nm)代表可见光。如图 1a所示, 试验区A设置为黑暗环境, 试验区B设置为3组刺激光, 分别是黑暗-UV组、黑暗-蓝光组和黑暗-红光组。UV、红光和蓝光的强度设置5个等级, 分别为5、10、15、20和25μW/cm2。
1.2.2 斑马鱼的避UV性和趋可见光性之间的相互作用利用图 1a试验装置, 刺激光选取UV(365nm)、蓝光(480nm)和红光(620nm)。为了测试斑马鱼的趋光性和避紫外性之间是否具有协同作用, 在图 1a所示装置的试验区A设置强度不断增加的UV(刺激强度为0~25μW/cm2, 并以5μW/cm2的单位递增), 试验区B设置3组持续高强度(25μW/cm2)的可见光, 分别为红光、蓝光和红蓝光。为了测试斑马鱼的趋光性和避紫外性之间是否具有抑制作用, 试验区A设置为黑暗环境, 试验区B设置为强度不断增加的紫外光(刺激强度为0~25μW/cm2, 刺激强度以5μW/cm2的单位递增)和3组持续高强度(25μW/cm2)的可见光的组合, 即UV&红光、UV&蓝光和UV&红蓝光。
1.2.3 斑马鱼对不同波长单色可见光的喜好试验中, 选取颜色分别为紫色(420nm)、蓝色(460nm)、绿色(500nm)、黄色(585nm)和红色(620nm)的5组单色可见光作为刺激光源, 分别设置在图 1b所示试验区1~试验区5, 刺激光源强度设置为20μW/cm2。试验区6设置为黑暗环境, 作为空白对照。
1.3 数据处理与分析 1.3.1 数据处理测试斑马鱼对UV和可见光的偏好试验中, 试验鱼在30min时的分布趋于稳定, 根据视频记录统计30min时斑马鱼在试验区A和试验区B的分布情况。记分布在试验区A的试验鱼数量为NA, 出现在试验区B的数量为NB, 试验鱼对UV和可见光的偏好指数记为γ:
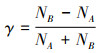 (1)
(1)
式中: γ为试验鱼对刺激光的偏好指数; NA为试验区A的试验鱼分布数量; NB为试验区B的试验鱼分布数量。
测试斑马鱼对不同波长单色可见光的偏好试验中, 根据视频记录统计5、10、15、20、25和30min时间节点斑马鱼在试验区1~6的分布情况。分布于试验区1~试验区6的试验鱼数量分别记为N1、N2、N3、N4、N5和N6, 试验鱼在各个试验区的分布率记为F(公式2)。分布率是指斑马鱼在某一试验区的分布数量与试验鱼总数之比, 表示试验鱼对该试验区对应刺激光的喜好程度。
 (2)
(2)
式中: Fi为某一试验区的分布率; Ni为某一光刺激对应试验区的试验鱼分布数量; N为试验鱼总数。
为了避免随机分布对试验结果的影响, 参照巩建华等[17]的方法, 斑马鱼对不同颜色刺激光的选择指数为η:
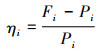 (3)
(3)
式中: ηi为试验鱼对某一单色光的选择指数; Fi为某一单色光区域内试验鱼的分布率; Pi为试验鱼在该区域随机出现的概率。
1.3.2 数据分析所有数据采用平均值±标准差(Mean±SD)表示, 采用Graphpad Prism 8软件对试验数据进行统计分析。数据分析前先用Levene方法检验数据的方差齐性, 并以K-S检验(Kolmogorov-Smirnov test)判断数据是否符合正态分布, 当数据方差齐且符合正态分布时, 对各试验区斑马鱼分布率进行单因素方差分析(one-way ANOVA, P=0.05)。
2 结果 2.1 斑马鱼对UV和可见光的趋避性图 2显示, UV刺激下, 当UV强度较低时(5μW/cm2), 斑马鱼少量分布在UV光一侧, 斑马鱼对UV的偏好指数为(0.04±0)。随着UV强度的增加, 斑马鱼游向黑暗一侧, 斑马鱼对UV的偏好指数逐渐降低, 在UV强度达到25μW/cm2时, 偏好指数降至最低, 为(-0.23±0.01)。蓝光刺激下, 当蓝光强度较低时(5μW/cm2), 斑马鱼少量分布在黑暗环境一侧, 此时斑马鱼对蓝光的偏好指数为(-0.03±0)。随着蓝光强度的增加, 斑马鱼游向蓝光一侧, 斑马鱼对蓝光的偏好指数逐渐升高, 在蓝光强度达到20μW/cm2时, 偏好指数升至最高, 为(0.73±0.04)。红光刺激下, 斑马鱼优先游向红光一侧, 试验鱼在5~25μW/cm2强度的刺激光下对红光的偏好指数均显示为正值。随着红光强度的增加, 斑马鱼对红光的偏好指数逐渐升高, 在红光强度达到25μW/cm2时, 偏好指数升至最高, 为0.58±0.03。结果显示, 试验鱼对低强度(5μW/cm2)的UV和蓝光的偏好性较低, 而对低强度的红光表现出明显的偏好性。随着刺激光强度的增加, 刺激光为UV时, 试验鱼优先游向黑暗环境一侧; 刺激光为蓝光和红光时, 试验鱼优先游向有刺激光一侧, 试验鱼表现出明显的避UV和趋可见光的特征。
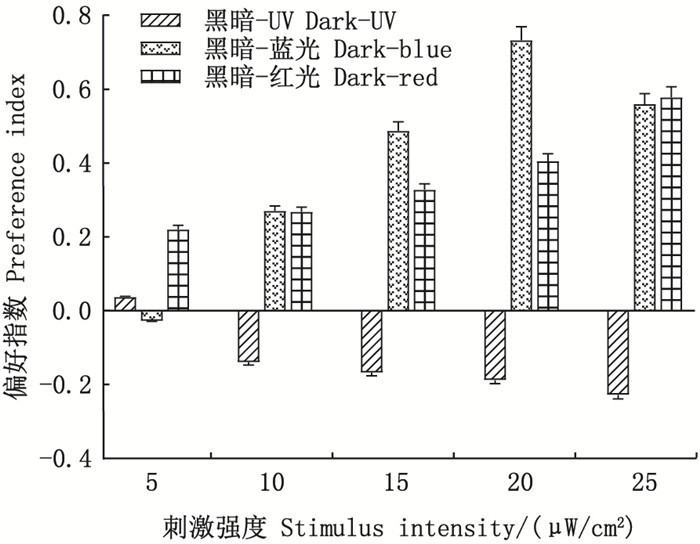
|
图 2 斑马鱼对UV、红光和蓝光的偏好指数 Fig. 2 Preference index of zebrafish to UV, red and blue light |
统计了30min时试验鱼在UV-红光组、UV-蓝光组和UV-红&蓝光组以及在黑暗-UV&红光组、黑暗-UV&蓝光组和黑暗-UV&红&蓝光组试验条件下分布于试验区A和试验区B的数量, 并绘制了偏好指数随UV强度变化的关系图(图 3和4)。
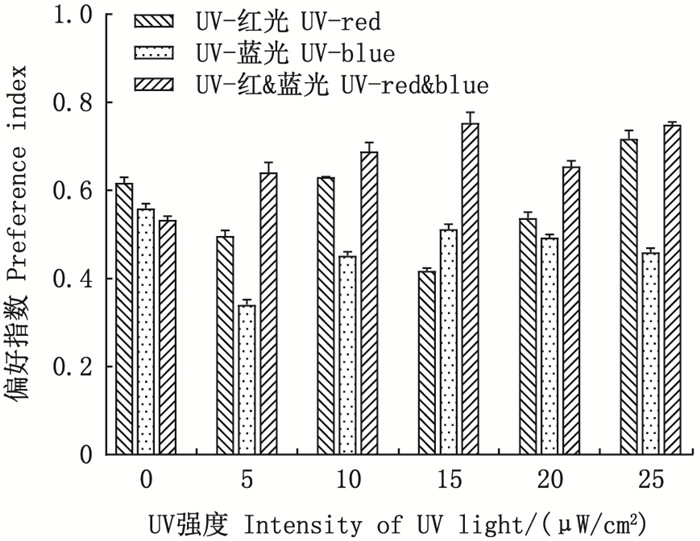
|
图 3 避UV性和趋光性的协同作用 Fig. 3 Synergistic effect of UV avoidance and phototaxis |
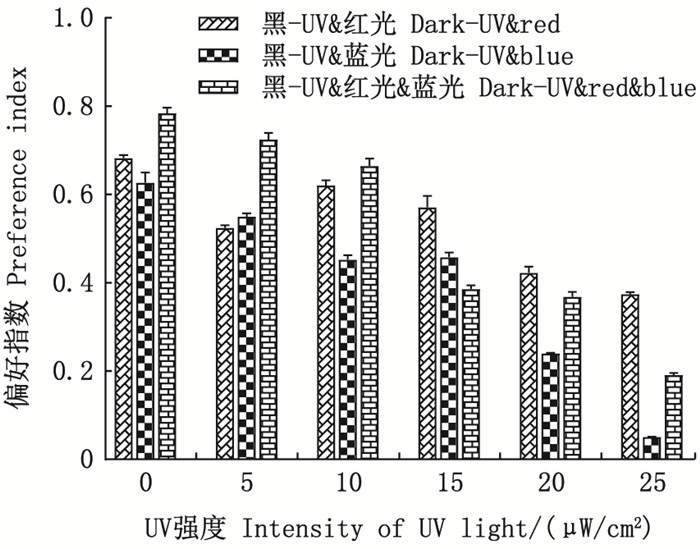
|
图 4 避UV性和趋光性的抑制作用 Fig. 4 Inhibiting effect of UV avoidance and phototaxis |
UV和可见光分别设置在试验区A和试验区B时(UV-红光组、UV-蓝光组和UV-红&蓝光组), 3组试验条件下的偏好指数均为正值(图 3)。随着试验区A中UV强度的增加, 3组试验条件下的偏好指数存在一定的波动, 但并未发现明显的增加趋势。
UV和可见光同时设置在试验区B时(黑暗-UV&红光组、黑暗-UV&蓝光组和黑暗-UV&红&蓝光组), 3组试验条件下的偏好指数均为正值(图 4)。随着试验区B中UV强度的增加, 3组试验条件下的偏好指数均呈现明显的下降趋势, UV&红光组的偏好指数由0.68±0.01降低至0.37±0;UV&蓝光组的偏好指数由0.63±0.02下降至0.05±0;UV&红蓝光组的偏好指数由0.78±0.01下降至0.19±0.01。
2.3 斑马鱼对不同波长光的偏好选择统计了5、10、15、20、25和30min 6个时间节点试验鱼分布于试验区1~6的数量, 并绘制了试验鱼在不同波长单色可见光刺激下的分布率随时间的变化(图 5)和选择指数随时间的变化(图 6)。
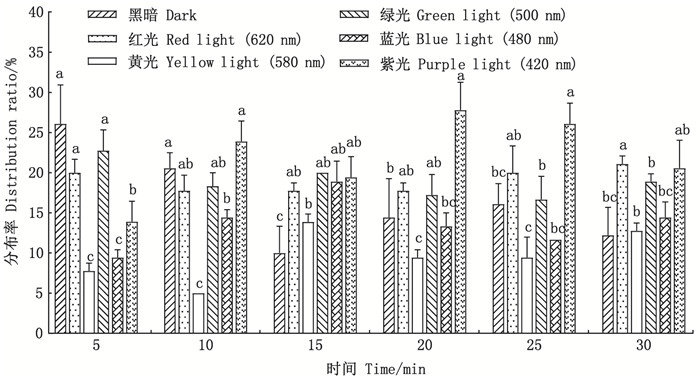
|
标有不同字母者表示组间有显著性差异(P < 0.05), 标有相同字母者表示组间无显著性差异(P>0.05)。 The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column have no significant difference. 图 5 斑马鱼在不同波长光区的分布率 Fig. 5 Distribution ratio of zebrafish in different wavelengths of light |
|
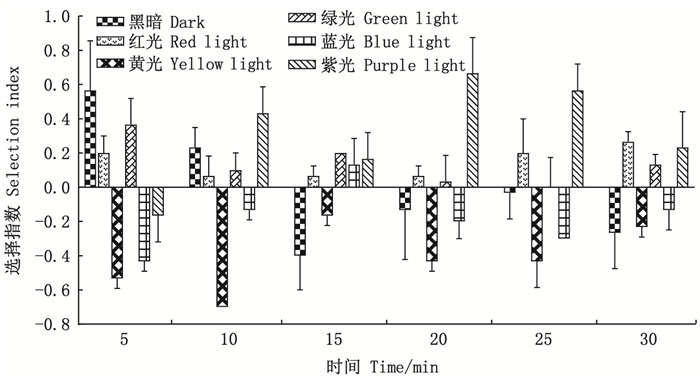
图 6 斑马鱼对不同波长光的选择指数 Fig. 6 Selection index of zebrafish to different wavelengths of light |
图 5显示了光刺激开始后30min内斑马鱼在各试验区的分布率变化。5min时, 平均分布率由大到小分别为黑暗区(26.11%)、绿光区(22.78%)、红光区(20.00%)、紫光区(13.89%)、蓝光区(9.44%)和黄光区(7.78%); 而30min时, 平均分布率由大到小分别为红光区(21.11%)、紫光区(20.56%)、绿光区(18.89%)、蓝光区(14.44%)、黄光区(12.78%)和黑暗区(12.22%)。随着试验时间的推移(5~30min), 斑马鱼由暗适应状态向明适应状态转变, 在此过程中红光试验区的分布率变化不显著(P>0.05);黑暗和绿光区30min的分布率相对于5min时的分布率出现了显著的降低(P < 0.05);蓝光区和紫光区分布率总体呈上升趋势, 但在5min和30min时的分布率差异不显著(P>0.05);黄光区的分布率始终处于较低水平, 其在5min和30min时的分布率相对于红光区的分布率均存在显著性差异(P < 0.05)。
根据30min内的分布率计算得到试验鱼对不同波长刺激光的选择指数(图 6)。黑暗试验区, 5min时斑马鱼的选择指数为0.57±0.29, 10min时下降为0.23±0.12, 10min之后则为负值。表明随着视觉系统逐渐明适应, 斑马鱼对黑暗环境的喜好程度逐渐降低。红光和绿光试验区, 试验鱼在30min内的选择指数始终为正值, 且在15min前对绿光的喜好程度大于红光, 15min后对红光的喜好程度则大于绿光。黄光试验区, 斑马鱼的选择指数始终为负值, 表现出对黄光的明显不喜好, 在10min时选择指数最小为-0.37±0。蓝光试验区, 斑马鱼的选择指数仅在15min时为正值(0.13±0.15), 其余时间节点均表现为不喜好。紫光试验区, 斑马鱼的选择指数随着时间的变化由负转正, 在20min时达到最大, 为0.67±0.21。
3 讨论 3.1 斑马鱼的避UV性和紫外视觉紫外线对动物而言是一种非常显著的刺激。本试验中斑马鱼对UV和可见光的偏好结果显示斑马鱼趋向可见光而远离紫外光, 表现出明显的避UV性(图 2)。避UV性的前提是能感受紫外光, 而U-视锥细胞是斑马鱼视网膜中唯一的UV感受器, U-视锥细胞中的紫外线视蛋白已经被证实能够介导行为[18]。由此可判断斑马鱼的避紫外性是一种视觉引导行为, 由视觉系统中的U-视锥细胞介导。自然界中, 许多动物都能感受到紫外线, 如蚂蚁[19]、蜜蜂[19-20]、鱼类[21]、鸟类[22]以及其他一些哺乳动物[23]。鱼类的紫外视觉与其配偶选择[24]和觅食行为[25]相关, 鱼类可以利用紫外视觉实现增强摄食、识别同类和展现保护色等功能[26-29]。此外, 鱼类还可以利用紫外视觉调节体表的黑素体, 从而避免被强光灼伤[30]。另外, 斑马鱼大脑内、外的部分区域能够表达丰富的非视觉系统视蛋白[31-32], 其中一些非视觉系统视蛋白(如黑色素[33])也已经被证明与行为相关, 如改变眼睛的进光量和调节昼夜节律等[34]。
3.2 避UV性与趋可见光性的相互作用UV和可见光分别设置在试验区A和试验区B时, 随着UV刺激强度增加, 斑马鱼的偏好指数出现了一定的波动, 但并没有呈现明显的增加趋势(图 3)。结果表明, 斑马鱼的趋可见光性随着紫外光强度的增加未出现明显的增加, 即斑马鱼的避UV性与趋可见光性之间无协同作用。UV和可见光同时设置在试验区B时, 随着UV刺激强度增加, 斑马鱼的偏好指数呈现出明显的下降趋势, UV&红光组的偏好指数由0.68±0.01降低至0.37±0, UV&蓝光组的偏好指数由0.63±0.02降低至0.05±0;UV&红蓝光组的偏好指数由0.78±0.01降低至0.19±0.01。结果表明, 斑马鱼的趋可见光性随着紫外光强度的增加出现了明显的下降(P>0.05), 即斑马鱼的避UV性与趋可见光性之间存在显著的抑制作用。斑马鱼生活在浑浊度不一的浅水环境[35], 这种环境存在使斑马鱼暴露于紫外线照射的风险[36]。而斑马鱼又依赖视觉来寻找食物和躲避捕食者, 这迫使斑马鱼在躲避紫外线照射和为视觉系统提供充足光照的之间取得平衡。这种平衡机制可能是斑马鱼在黑暗和低UV含量的光照之间选择低UV含量的光照, 光照中紫外线含量升高时偏好性呈现明显下降的原因。也很好地解释了在黑暗-UV试验组, 避UV反应不强烈的原因(图 2)。当然这种不强烈的避UV反应也可能归因于刺激光激活了S-视锥细胞和M-视锥细胞的部分功能, 使得斑马鱼表现出微弱的趋光行为。
3.3 斑马鱼对不同波长可见光的偏好性斑马鱼对特定波长的光产生不同的趋光行为是一种视觉介导的行为[37]。本试验中, 0~30min时间内, 斑马鱼由暗视视觉逐渐向明视视觉转变, 因此5min时的分布率和选择指数代表了暗适应条件下斑马鱼对不同波长可见光的选择, 30min时的分布率和选择指数代表了明适应条件下斑马鱼对不同波长可见光的选择。暗适应条件下, 斑马鱼的平均分布率为黑暗区>绿光区>红光区>紫光区>蓝光区>黄光区(图 5)。尽管暗适应条件下的斑马鱼在不同颜色区域的分布率不同, 但并不代表暗适应的斑马鱼存在颜色分辨的能力, 可能是视杆细胞对不同颜色试验区内对比度差异的一种选择。明适应条件下, 斑马鱼的平均分布率为红光区>紫光区>绿光区>蓝光区>黄光区>黑暗区(图 5), 对应的平均选择指数分别为红光区>紫光区>绿光区>蓝光区>黄光区>黑暗区(图 6), 与平均分布律的变化一致。明适应条件下, 有光区的平均分布率和平均选择指数均大于黑暗区, 说明明适应的斑马鱼表现出明显的趋光性。斑马鱼视网膜中S-视锥细胞的光谱敏感峰值波长为415nm(紫),M-视锥细胞的光谱敏感峰值波长为480nm(蓝),L-视锥细胞的光谱敏感峰值波长为570nm(绿)[38]。对应了斑马鱼对紫、蓝、绿3种颜色的高选择指数。本试验发现斑马鱼对红光的喜好程度最高, 对黄光的喜好程度始终较低, 这一结果与AVDESH等[11]的试验结果相符。但OLIVEIRA等[12]对斑马鱼对红、黄、绿、蓝4种颜色的物体的认知研究中发现斑马鱼不喜好红色。这可能是试验中刺激光强度不同导致的, OLIVEIRA等[12]的试验中带颜色的物体本身不发光, 而本试验中同样刺激光强度下, 红光波段的光子数相对于短波长要多, 可能加强了红光对斑马鱼的吸引力。本文中设计的试验仅考虑了斑马鱼在同一水平面的移动, 未考虑不同光照刺激下斑马鱼在水体的垂直移动行为, 这可能需要进一步探究。
| [1] |
刘晓, 黄六一, 刘长东, 等. 光照颜色对虹鳟行为反应、血浆皮质醇和生化指标的影响[J]. 水产学报, 2021, 45(5): 740-747. LIU X, HUANG L Y, LIU C D, et al. Effects of light colors on behavior response, plasma cortisol and biochemical indexes of rainbow trout Oncorhynchus mykiss[J]. Journal of Fisheries of China, 2021, 45(5): 740-747. |
| [2] |
王奎, 李慷, 刘利平. 循环水养殖模式下光照强度和光周期对日本鳗鲡生长及动物福利的影响[J]. 上海海洋大学学报, 2018, 27(5): 683-692. WANG K, LI K, LIU L P. Effect of light intensity and photoperiod on Japanese eel growth and animal welfare in recirculating aquaculture system[J]. Journal of Shanghai Ocean University, 2018, 27(5): 683-692. |
| [3] |
PORTUGUES R, SEVERI K E, WYART C, et al. Optogenetics in a transparent animal: circuit function in the larval zebrafish[J]. Current Opinion in Neurobiology, 2013, 23(1): 119-126. DOI:10.1016/j.conb.2012.11.001 |
| [4] |
郑金存, 赵峰, 林勇, 等. 基于近红外深度图的游泳型鱼类摄食强度实时测量[J]. 上海海洋大学学报, 2021, 30(6): 1067-1078. ZHENG J C, ZHAO F, LIN Y, et al. Evaluation of fish feeding intensity in aquaculture based on near-infrared depth image[J]. Journal of Shanghai Ocean University, 2021, 30(6): 1067-1078. |
| [5] |
ANONGPONYOSKUN M, AWAIWANONT K, ANANPONGSUK S, et al. Comparison of different light spectra in fishing lamps[J]. Agriculture and Natural Resources, 2011, 45(5): 856-862. |
| [6] |
CHEN X Y, ENGERT F. Navigational strategies underlying phototaxis in larval zebrafish[J]. Frontiers in Systems Neuroscience, 2014, 8: 39. |
| [7] |
ESCOBAR-CAMACHO D, CARLETON K L. Sensory modalities in cichlid fish behavior[J]. Current Opinion in Behavioral Sciences, 2015, 6: 115-124. DOI:10.1016/j.cobeha.2015.11.002 |
| [8] |
LI L. Zebrafish mutants: behavioral genetic studies of visual system defects[J]. Developmental Dynamics, 2001, 221(4): 365-372. DOI:10.1002/dvdy.1159 |
| [9] |
BILOTTA J, SASZIK S. The zebrafish as a model visual system[J]. International Journal of Developmental Neuroscience, 2001, 19(7): 621-629. DOI:10.1016/S0736-5748(01)00050-8 |
| [10] |
NAVA S S, AN S, HAMIL T. Visual detection of UV cues by adult zebrafish (Danio rerio)[J]. Journal of Vision, 2011, 11(6): 2. DOI:10.1167/11.6.2 |
| [11] |
AVDESH A, MARTIN-IVERSON M T, MONDAL A, et al. Evaluation of color preference in zebrafish for learning and memory[J]. Journal of Alzheimer's Disease, 2012, 28(2): 459-469. DOI:10.3233/JAD-2011-110704 |
| [12] |
OLIVEIRA J, SILVEIRA M, CHACON D, et al. The zebrafish world of colors and shapes: preference and discrimination[J]. Zebrafish, 2015, 12(2): 166-173. DOI:10.1089/zeb.2014.1019 |
| [13] |
GROZEA A, DRAŞOVEAN A, LALESCU D, et al. The pikeperch (Sander lucioperca) background color first choice in the recirculating aquaculture systems[J]. Turkish Journal of Fisheries and Aquatic Sciences, 2016, 16(4): 891-897. |
| [14] |
VILLAMIZAR N, BLANCO-VIVES B, MIGAUD H, et al. Effects of light during early larval development of some aquacultured teleosts: A review[J]. Aquaculture, 2011, 315(1/2): 86-94. |
| [15] |
GOVARDOVSKⅡ V I, FYHRQUIST N, REUTER T, et al. In search of the visual pigment template[J]. Visual Neuroscience, 2000, 17(1): 509-528. |
| [16] |
CAMERON D A. Mapping absorbance spectra, cone fractions, and neuronal mechanisms to photopic spectral sensitivity in the zebrafish[J]. Visual Neuroscience, 2002, 19(3): 365-372. DOI:10.1017/S0952523802192121 |
| [17] |
巩建华, 郭春阳, 田喆, 等. 红鲫鱼对环境颜色及光强的趋向性研究[J]. 生物学杂志, 2016, 33(5): 13-18. GONG J H, GUO C Y, TIAN Z, et al. Study on the selectivity of Carassius auratus under different environment colors and luminous intensities[J]. Journal of Biology, 2016, 33(5): 13-18. DOI:10.3969/j.issn.2095-1736.2016.05.013 |
| [18] |
DAVIES W I L, TAMAI T K, ZHENG L, et al. An extended family of novel vertebrate photopigments is widely expressed and displays a diversity of function[J]. Genome Research, 2015, 25(11): 1666-1679. DOI:10.1101/gr.189886.115 |
| [19] |
LUBBOCK J. Observations on ants, bees, and wasps. -Part Ⅹ. With a description of a new genus of honey-ant[J]. Zoological Journal of the Linnean Society, 1883, 17(98): 41-52. DOI:10.1111/j.1096-3642.1883.tb00235.x |
| [20] |
CHITTKA L, SHMIDA A, TROJE N, et al. Ultraviolet as a component of flower reflections, and the colour perception of Hymenoptera[J]. Vision Research, 1994, 34(11): 1489-1508. DOI:10.1016/0042-6989(94)90151-1 |
| [21] |
LOSEY G S, CRONIN T W, GOLDSMITH T H, et al. The UV visual world of fishes: a review[J]. Journal of Fish Biology, 1999, 54(5): 921-943. DOI:10.1111/j.1095-8649.1999.tb00848.x |
| [22] |
BENNETT A T D, CUTHILL I C, PARTRIDGE J C, et al. Ultraviolet vision and mate choice in zebra finches[J]. Nature, 1996, 380(6573): 433-435. DOI:10.1038/380433a0 |
| [23] |
JACOBS G H, DEEGAN Ⅱ J F. Sensitivity to ultraviolet light in the gerbil (Meriones unguiculatus): characteristics and mechanisms[J]. Vision Research, 1994, 34(11): 1433-1441. DOI:10.1016/0042-6989(94)90144-9 |
| [24] |
SMITH E J, PARTRIDGE J C, PARSONS K N, et al. Ultraviolet vision and mate choice in the guppy (Poecilia reticulata)[J]. Behavioral Ecology, 2002, 13(1): 11-19. DOI:10.1093/beheco/13.1.11 |
| [25] |
NOVALES-FLAMARIQUE H, HAWRYSHYN C. Ultraviolet photoreception contributes to prey search behaviour in two species of zooplanktivorous fishes[J]. Journal of Experimental Biology, 1994, 186(1): 187-198. DOI:10.1242/jeb.186.1.187 |
| [26] |
FUKUNISHI Y, MASUDA R, YAMASHITA Y. Ontogeny of tolerance to and avoidance of ultraviolet radiation in red sea bream Pagrus major and black sea bream Acanthopagrus schlegeli[J]. Fisheries Science, 2006, 72(2): 356-363. DOI:10.1111/j.1444-2906.2006.01157.x |
| [27] |
YLÖNEN O, HUUSKONEN H, KARJALAINEN J. UV avoidance of coregonid larvae[J]. Annales Zoologici Fennici, 2004, 41(1): 89-98. |
| [28] |
SABBAH S, LARIA R L, GRAY S M, et al. Functional diversity in the color vision of cichlid fishes[J]. BMC Biology, 2010, 8(1): 133. DOI:10.1186/1741-7007-8-133 |
| [29] |
WARD M N, CHURCHER A M, DICK K J, et al. The molecular basis of color vision in colorful fish: four long wave-sensitive (LWS) opsins in guppies (Poecilia reticulata) are defined by amino acid substitutions at key functional sites[J]. BMC Evolutionary Biology, 2008, 8(1): 210. DOI:10.1186/1471-2148-8-210 |
| [30] |
MUELLER K P, NEUHAUSS S C F. Sunscreen for fish: co-option of UV light protection for camouflage[J]. PLoS One, 2014, 9(1): e87372. DOI:10.1371/journal.pone.0087372 |
| [31] |
KOJIMA D, MANO H, FUKADA Y. Vertebrate ancient-long opsin: a green-sensitive photoreceptive molecule present in zebrafish deep brain and retinal horizontal cells[J]. Journal of Neuroscience, 2000, 20(8): 2845-2851. DOI:10.1523/JNEUROSCI.20-08-02845.2000 |
| [32] |
KOKEL D, DUNN T W, AHRENS M B, et al. Identification of nonvisual photomotor response cells in the vertebrate hindbrain[J]. Journal of Neuroscience, 2013, 33(9): 3834-3843. DOI:10.1523/JNEUROSCI.3689-12.2013 |
| [33] |
MATOS-CRUZ V, BLASIC J, NICKLE B, et al. Unexpected diversity and photoperiod dependence of the zebrafish melanopsin system[J]. PLoS ONE, 2011, 6(9): e25111. DOI:10.1371/journal.pone.0025111 |
| [34] |
FERNANDES A M, FERO K, ARRENBERG A B, et al. Deep brain photoreceptors control light-seeking behavior in zebrafish larvae[J]. Current Biology, 2012, 22(21): 2042-2047. DOI:10.1016/j.cub.2012.08.016 |
| [35] |
SPENCE R, GERLACH G, LAWRENCE C, et al. The behaviour and ecology of the zebrafish, Danio rerio[J]. Biological Reviews, 2008, 83(1): 13-34. |
| [36] |
BOOTH C R, MORROW J H. The penetration of UV into natural waters[J]. Photochemistry and Photobiology, 1997, 65(2): 254-257. DOI:10.1111/j.1751-1097.1997.tb08552.x |
| [37] |
FLEISCH V C, NEUHAUSS S C F. Visual behavior in zebrafish[J]. Zebrafish, 2006, 3(2): 191-201. DOI:10.1089/zeb.2006.3.191 |
| [38] |
ROBINSON J, SCHMITT E A, HÁROSI F I, et al. Zebrafish ultraviolet visual pigment: absorption spectrum, sequence, and localization[J]. Proceedings of the National Academy of Sciences of the United States of America, 1993, 90(13): 6009-6012. DOI:10.1073/pnas.90.13.6009 |
 2022,
Vol. 31
2022,
Vol. 31


