2. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
水产养殖中,养殖动物生长缓慢及饲料利用率低等问题在一定程度上制约着水产养殖业的健康发展,而一些饲料添加剂如酵母类产品、酶制剂等的应用被认为是改善这些问题的可行的方法[1]。酵母菌蛋白质含量高,且富含酵母多糖、几丁质以及其他有益于鱼类生长和发育的生物活性成分[2]。以酵母菌为基础原料,目前已开发了多种饲料添加剂,并已经在多种养殖品种上获得了良好的应用效果。ZHANG等[3]研究表明,饲料中添加酵母水解物可以显著提高中华绒螯蟹(Eriocheir sinensis)的抗氧化能力。在尼罗罗非鱼(Oreochromis niloticus)的研究中也发现,酵母水解物的添加对其生长具有促进作用[4]。邱燕[5]研究发现,饲料中添加酵母培养物可以提高草鱼的生长性能,并降低饲料系数。β-葡聚糖是酵母多糖的主要成分,约占细胞壁干质量的50%~60%[6]。相关研究发现,饲料中添加β-葡聚糖可以显著提高锦鲤(Cyprinus carpio)[7]、大黄鱼(Larimichthys crocea)[8]和海参(Apostichopus japonicus)[9]等水生动物的生长性能和饲料效率。然而,添加β-葡聚糖对于暗纹东方鲀(Takifugu obscurus)[10]和虹鳟(Oncorhynchus mykiss)[11]的生长性能无显著性影响。尽管目前酵母类产品已广泛应用于水产饲料中,但不同酵母类产品对于同一种水产动物作用效果的研究较少。
大口黑鲈(Micropterus salmoides)又称加州鲈,因其味道鲜美、抗逆性强且养殖周期短,已成为淡水养殖主要品种之一。本实验在大口黑鲈饲料中添加3种酵母类产品(酵母水解物、去除β-葡聚糖的酵母水解物和酵母培养物),拟通过分析其生长性能、饲料效率及抗氧化能力等指标,以评估不同酵母类产品在大口黑鲈饲料中的应用效果,从而为酵母类产品在大口黑鲈饲料中的应用提供参考。
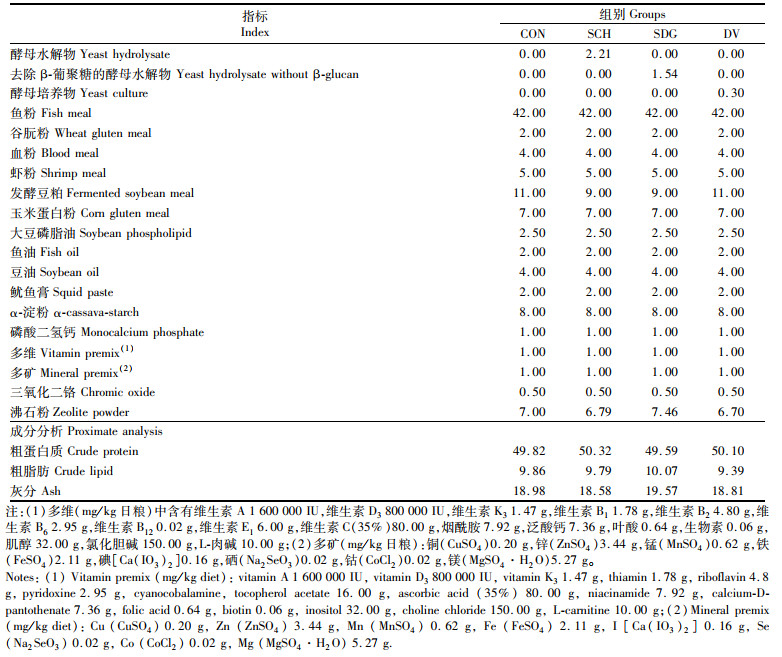
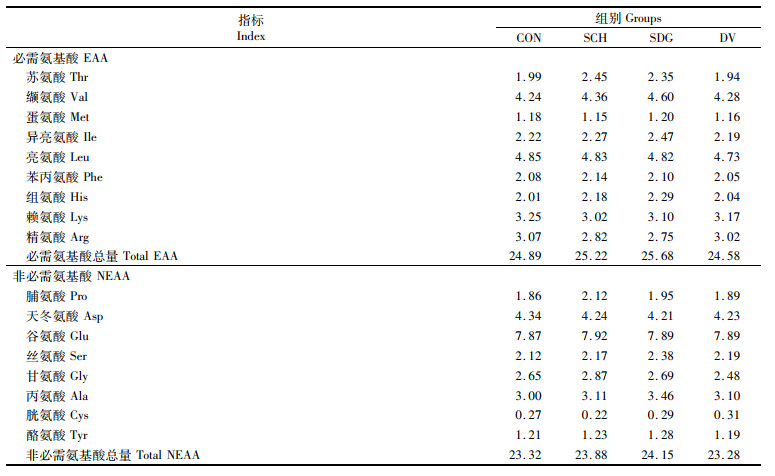
1 材料与方法 1.1 实验饲料配制4种等氮等脂的饲料,以未添加酵母类产品为对照组(CON),其他3组分别添加2.21%的酵母水解物(SCH)、1.54%的去除β-葡聚糖的酵母水解物(SDG)和0.3%的酵母培养物(DV)。其中酵母水解物为面包酵母水解物,去除β-葡聚糖的酵母水解物为面包酵母水解物经水解后去除了其中的β-葡聚糖制得。酵母培养物是酵母菌在培养基上发酵后经一系列工艺加工制得。酵母水解物的添加量参照本实验室之前的研究结果,去除β-葡聚糖的酵母水解物的添加量根据与酵母水解物等蛋白质原则确定。酵母培养物的添加量按产品推荐用量添加。具体饲料配方见表 1,饲料氨基酸组成见表 2。所有原料经过粉碎后过80目筛网,逐级扩大充分混匀,加入油脂类再次进行混匀,加适量水搅拌均匀后经饲料机挤压制粒,于60 ℃烘箱中烘干。将制好的饲料进行密封放于-20 ℃冰箱备用。
|
表 1 实验饲料配方及概略分析(%干饲料) Tab.1 Formulation and chemical composition of experimental diets (% dry matter) |
|
表 2 实验饲料氨基酸含量(%干饲料) Tab.2 Amino acid contents of experimental diets (% dry matter) |
养殖实验于上海市金山区农好饲料厂室内循环水养殖系统进行。鱼苗运到农好养殖基地后,采用商品饲料(浙江欣欣天恩水产饲料有限公司)在淡水循环水养殖系统中驯化3周,以适应养殖环境。禁食24 h后,将初始体质量为(16.26±0.02)g的360尾鱼随机分配到12个容量为800 L的养殖桶中。实验共分4组,每组3个重复,每个重复30尾。实验饲料为每天8点和16点表观饱食投喂2次,连续投喂11周。养殖用水经过紫外线灯24 h杀菌,并经珊瑚砂、海绵过滤。每天排污2次,换水量10%。定期检测水质,水温为(27 ± 1)℃,pH为7.2 ± 0.2。
1.3 样品采集养殖实验开始前,随机选择10尾与实验用鱼体质量接近的鱼放于-20 ℃冰箱中,用于初始鱼体成分分析。在实验开始后的第3周参考LEE[12]的方法收集粪便并保存于-20 ℃冰箱中,用于营养物质表观消化率的测定;饲养实验结束后,空腹24 h,用丁香酚进行麻醉,记录各个养殖桶中鱼的数量。然后,随机抽取3条,在-80 ℃保存用于体成分分析。每个养殖桶再随机采集10条鱼,测量鱼的体长和体质量,从10条鱼中任取6条用来解剖,取出内脏团,并对肝脏和内脏团进行分离并称重记录,用于计算脏体比、肝体比和肥满度。将分离的肝脏于-80 ℃保存,用于肝脏常规成分分析以及抗氧化指标的测定。采集鱼体侧线上方的肌肉用于肌肉常规成分分析。
1.4 体成分分析全鱼、饲料、肌肉和肝脏的粗蛋白质、粗脂肪、灰分及水分含量的测定:水分含量采用恒温干燥法(GB/T 6435—2014)测定,将样品在105 ℃烘箱中烘干至恒重;灰分含量是通过将样品在550 ℃马弗炉中燃烧至恒重进行测定(GB/T 6438—1992);粗蛋白质含量采用凯氏定氮仪(OPSIS,瑞典)测定(GB/T 5009.124—2016);粗脂肪含量采用氯仿-甲醇萃取法[13]测定。
1.5 营养成分消化率测定饲料、粪便的Cr2O3含量参照DIVAKARAN等[14]的方法:精确称量样品50~100 mg置于凯氏烧瓶中,加入5 mL浓硝酸,在消化炉(OPSIS DI310,瑞典)上260 ℃加热,当溶液中产生白色固形物时停止加热,放于室温下冷却后徐徐注入3 mL高氯酸。然后继续加热使溶液从绿色经黄色变为砖红色,继续加热10 min,室温下冷却后加入蒸馏水定容至100 mL。以蒸馏水作为对照,在波长350 nm处测量其吸光度(上海MAPADA UV-3200紫外可见分光光度计)。
标准曲线的制备:精确称量5 mg分析纯Cr2O3,用与样品一样的方法进行处理。最后用蒸馏水定容至10 mL作为母液(Cr2O3含量为0.5 mg/mL)。分别吸取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8和0.9 mL的母液放于10 mL容量瓶中并用蒸馏水定容至10 mL,得到相当于每100 mL的溶液分别含Cr2O3 0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0和4.5 mg的系列溶液,同样在波长350 nm处测量其吸光度,并制备标准曲线。将样品中的吸光度代入到标准曲线中即可得到样品中Cr2O3含量,再将饲料及粪便中营养物质含量数据代入公式即可得到营养物质的消化率。
1.6 氨基酸分析肌肉氨基酸的测定参照LLAMES等[15]的方法:准确称取样品于水解管中,加入15 mL的盐酸(6 mol/L)溶液,水解管接在真空泵的抽气管上,在冰上将水解管抽真空后通入氮气,重复3次,最后一次在管内充满氮气的情况下拧紧螺丝盖。将水解管放在水解炉(110 ℃)上水解22 h。将水解管放于室温下冷却,然后过滤至50 mL容量瓶中,用超纯水反复冲洗水解管后倒入容量瓶中,然后定容至50 mL。准确抽取1 mL溶液于小烧杯中,然后在真空干燥箱中45 ℃蒸干。再加1 mL超纯水再次蒸干,反复2次。最后加入1 mL柠檬酸钠缓冲液(pH 2.2)并混匀,将溶液经过0.22 μm针式过滤器过滤到进样瓶中,然后进行上机测定。氨基酸含量采用德国SYKAMS-433D全自动氨基酸分析仪测定。
1.7 肝脏抗氧化指标的测定总超氧化物歧化酶活力用羟胺法测定;总抗氧化能力用比色法测定;丙二醛含量用硫代巴比妥酸法测定;溶菌酶活力采用比浊法进行测定。均采用南京建成生物工程研究所提供的试剂盒进行测定。
1.8 计算公式与数据统计计算公式如下:
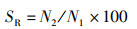 (1)
(1)
式中:SR为存活率,%;N2为终末尾数,尾;N1为初始尾数,尾。
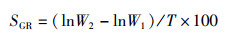 (2)
(2)
式中:SGR为特定生长率,%/d;W1为初始体质量,g; W2为终末体质量,g;T为试验天数,d。
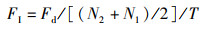 (3)
(3)
式中:FI为摄食率,g/(尾·d);Fd为干饲料摄入量,g;N2为终末尾数,尾;N1为初始尾数,尾;T为试验天数,d。
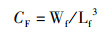 (4)
(4)
式中:CF为肥满度,g/cm3;Wf为鱼体质量,g;Lf为体长,cm。
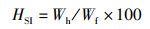 (5)
(5)
式中:HSI为肝体比,%;Wh为肝脏质量,g;Wf为鱼体质量,g。
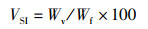 (6)
(6)
式中:VSI为脏体比,%;Wv为内脏质量,g;Wf为鱼体质量,g。
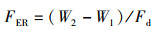 (7)
(7)
式中:FER为饲料效率;W2为终末体质量,g; W1为初始体质量,g; Fd为干饲料摄入量,g。
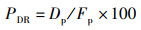 (8)
(8)
式中:PDR为蛋白质沉积率,%;Dp为鱼体蛋白质沉积质量,g;Fp为摄入蛋白质质量,g。
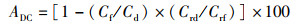 (9)
(9)
式中:ADC为营养物质表观消化率,%;Cf为粪便中营养物质含量,%;Cd为饲料中营养物质含量,%;Crd为饲料中Cr2O3含量,%;Crf为粪便中Cr2O3含量,%。
实验数据采用平均值±标准误表示。所有数据均采用SPSS 19.0进行单因素方差分析(One-Way ANOVA)。多重比较采用Tukey氏检验方法,显著水平为P<0.05。
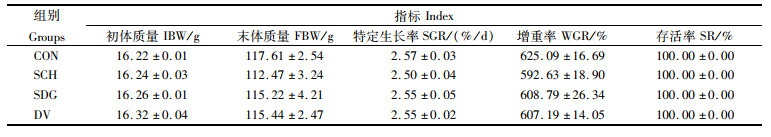
2 结果 2.1 酵母类产品对大口黑鲈生长、体型指标和饲料利用的影响如表 3所示,各处理组间大口黑鲈的存活率没有统计学差异(P>0.05)。酵母类产品的添加对大口黑鲈的增重率和特定生长率没有显著性影响(P>0.05)。
|
表 3 酵母类产品对大口黑鲈生长性能的影响 Tab.3 Effects of yeast products supplementation on growth performance of largemouth bass |
如表 4所示,饲料中添加酵母类产品对大口黑鲈摄食率、蛋白质沉积率和脂肪的表观消化率均无显著性影响(P>0.05)。CON组饲料效率显著低于SCH组(P < 0.05)。SCH组蛋白质的表观消化率显著高于其他各组(P < 0.05)。
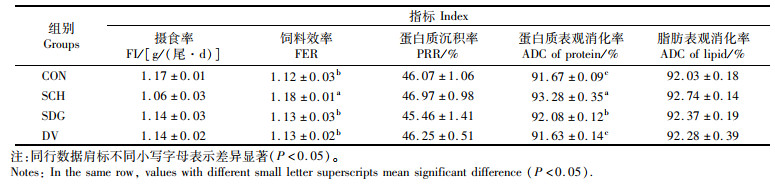
|
表 4 酵母类产品对大口黑鲈饲料利用的影响 Tab.4 Effects of yeast products supplementation on nutrient utilization of largemouth bass |
如表 5所示,饲料中添加酵母类产品对大口黑鲈的肥满度、肝体比和脏体比没有显著性影响(P>0.05)。
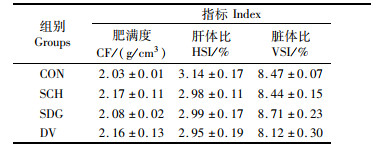
|
表 5 酵母类产品对大口黑鲈肥满度、肝体比、脏体比的影响 Tab.5 Effects of yeast products supplementation on CF, HSI, VSI of largemouth bass |
如表 6所示,各组间全鱼的水分和灰分,肝脏的粗蛋白质含量、粗脂肪含量、水分和灰分以及肌肉的粗蛋白质含量、水分和灰分含量均没有显著性差异(P>0.05)。SDG组全鱼粗蛋白质含量显著低于CON组(P < 0.05)。CON组和SCH组全鱼粗脂肪含量显著高于SDG组和DV组(P < 0.05)。CON组和DV组肌肉粗脂肪含量显著低于另外两组(P < 0.05)。
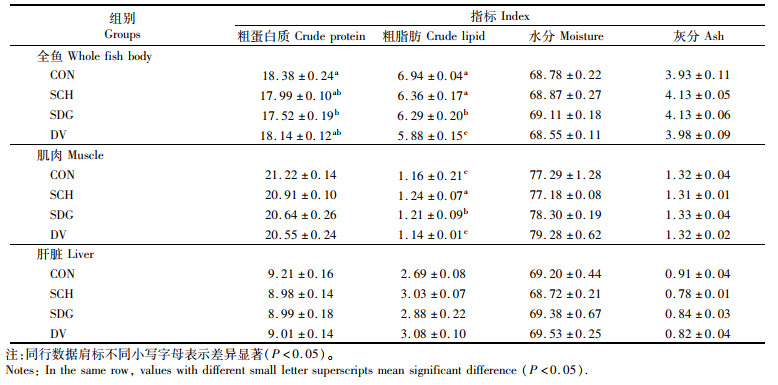
|
表 6 酵母类产品对大口黑鲈鱼体组成的影响(% 湿质量) Tab.6 Effects of yeast products supplementation on body composition of largemouth bass (% wet mass) |
如表 7所示,SCH组蛋氨酸含量显著低于SDG组(P < 0.05)。DV组异亮氨酸含量显著低于其他各组(P < 0.05)。SDG组赖氨酸含量显著高于CON组和SCH组(P < 0.05)。CON组必需氨基酸总量显著低于SDG组(P < 0.05)。DV组谷氨酸含量显著高于其他各组(P < 0.05)。DV组丝氨酸含量显著低于CON组(P < 0.05)。SDG组丙氨酸含量显著高于CON组和DV组(P < 0.05)。各组间非必需氨基酸总量无显著性差异(P>0.05)。
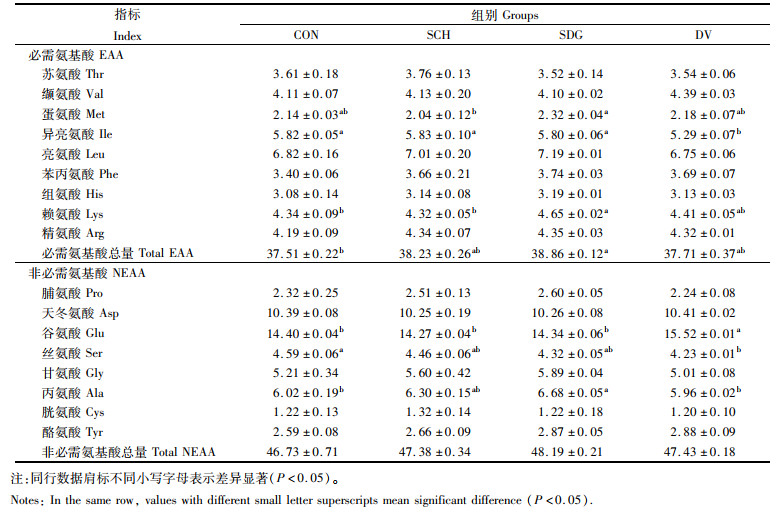
|
表 7 酵母类产品对大口黑鲈肌肉氨基酸含量的影响(% 干物质) Tab.7 Effects of yeast products supplementation on amino acid contents of muscle (% dry matter) |
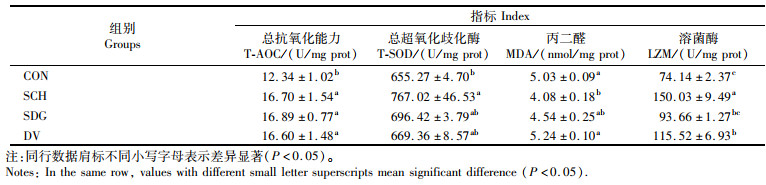
如表 8所示CON组总抗氧化能力显著低于其他各组(P < 0.05)。SCH组总超氧化物歧化酶活力显著高于其他各组(P < 0.05),其他各组差异不显著(P>0.05)。SCH组肝脏丙二醛含量显著低于CON组,其他各组间该指标无显著性差异。CON组肝脏溶菌酶活力显著低于SCH组和DV组(P < 0.05)。
|
表 8 酵母类产品对大口黑鲈肝脏抗氧化指标及溶菌酶活力的影响 Tab.8 Effects of yeast products supplementation on hepatic antioxidant capacity and lysozyme activity of largemouth bass |
酵母类产品的促生长效果已在凡纳滨对虾(Litopenaeus vannamei )[16]、杂交罗非鱼(Oreochromis niloticus ♀ × Oreochromis aureus ♂)[17]、青鱼(Mylopharyngodon piceus)[18]和大菱鲆(Scophthalmus maximus)[19]等养殖动物上得到了验证。然而,在本实验中发现酵母类产品的添加对大口黑鲈的生长没有显著性影响,这与先前在欧洲鲈(Dicentrarchus labrax)[20]、大口黑鲈[21]和草鱼(Ctenopharyngodon idellus)[22]中的研究结果一致。曾本和等[23]研究表明,酵母水解物可以提高草鱼的饲料效率和蛋白质沉积率;时博等[24]也发现酵母水解物对于大口黑鲈的饲料效率具有显著的提升作用。类似地,在本实验中,酵母水解物的添加显著提高了大口黑鲈的饲料效率。酵母水解物富含核苷酸、β-葡聚糖和小肽等功能性成分和营养物质,其中β-葡聚糖和小肽可以修复水生动物肠道损伤并增大肠道绒毛的吸收面积,有助于提高对饲料中营养物质的吸收效率[25],这可能是造成本实验SCH组饲料效率升高的重要原因之一。李高峰[26]研究表明,添加0.2%的酵母培养物就可以显著提高团头鲂(Megalobrama amblycephala)的饲料效率。在建鲤(Cyprinus carpio var. Jian)的试验中发现,酵母培养物添加量需要提高到0.5%才可以显著改善其饲料效率[27]。本实验中DV组酵母培养物的添加量为0.3%,与CON组相比,其饲料效率数值上虽有提高,但未达到差异显著水平,这可能与酵母培养物的添加量以及饲养对象有关。因此,酵母培养物在大口黑鲈饲料中的最适添加量需进一步探究。
活性氧自由基是机体代谢产生的一类含氧化学物质,若不及时清除,会严重威胁鱼体健康[28]。丙二醛是脂质过氧化的代谢产物,其含量变化代表细胞膜受活性氧自由基攻击的严重程度,间接反映了机体抗氧化能力的强弱[29]。本实验结果显示,酵母水解物的添加显著降低了大口黑鲈肝脏丙二醛的含量。柳茜等[30]研究发现,添加酵母水解物可以降低肝脏丙二醛的含量,改善大菱鲆幼鱼的抗氧化能力。酵母菌经水解破壁后,其中大量的β-葡聚糖、核苷酸和小肽的功效得到了最大的利用。小肽是脂质过氧化抑制剂[31-32]和自由基清除剂[33],可以激活相关抗氧化酶的活性,提高机体清除活性氧自由基的效率,从而改善机体抗氧化能力。β-葡聚糖对于机体抗氧化能力的提升也在花鲈(Lateolabrax japonicus)[34]和凡纳滨对虾[35]等研究中得到了验证。不仅如此,有研究[36]表明酵母水解物对于氧化应激对机体造成的损伤也有一定的修复作用。正是酵母水解物中所富含的这些功能性成分,SCH组才具有如此良好的抗氧化效果。SDG组与SCH组相比,丙二醛含量略有升高,这表明酵母水解物对于大口黑鲈抗氧化能力的提升与β-葡聚糖的含量密切相关。溶菌酶作为机体防御系统的重要组成部分,普遍存在于各种生物体内,可以促进吞噬细胞的吞噬作用,是衡量机体非特异性免疫的重要指标。在本实验中,酵母水解物的添加显著提高了大口黑鲈肝脏溶菌酶的活力,这与在大西洋鲑(Salmo salar)[37]和凡纳滨对虾[38]中的实验结果相似。酵母菌水解后含有大量β-葡聚糖,而β-葡聚糖是最常用的免疫调节剂之一,可以激活白细胞,防止感染,并修复受损组织,这可能是SCH组溶菌酶活力显著升高的重要原因。此外,与SCH组相比,去除β-葡聚糖后大口黑鲈的溶菌酶活力显著降低,由此也进一步证实了β-葡聚糖对大口黑鲈免疫功能的影响。本实验中,DV组肝脏溶菌酶活力显著高于CON组,这与在黄颡鱼(Pelteobagrus fulvidraco)[39]中的研究结果一致,据推测可能与酵母培养物中所富含的B族维生素有关。本实验仅添加0.3%的酵母培养物,其溶菌酶活力显著提高,这也表明酵母培养物在提高大口黑鲈非特异性免疫方面具有较大的应用潜力。
综上,酵母水解物的添加可以显著提高大口黑鲈的饲料效率,且酵母类产品的添加均能在不同程度上提高其抗氧化能力和溶菌酶活性。
| [1] |
LOVATELLI A, CHEN J X. Use of environmental friendly feed additives and probiotics in Chinese aquaculture[J]. FAO Aquaculture Newsletter, 2009(42): 32-35. |
| [2] |
黄路. 酿酒酵母在鱼类中的益生效应研究[D]. 武汉: 华中农业大学, 2015. HUANG L. Probiotic effects of dietery Saccharomyces cerevisiae on fish[D]. Wuhan: Huazhong Agricultural University, 2015. |
| [3] |
ZHANG R Q, JIANG Y, ZHOU L, et al. Effects of dietary yeast extract supplementation on growth, body composition, non-specific immunity, and antioxidant status of Chinese mitten crab (Eriocheir sinensis)[J]. Fish & Shellfish Immunology, 2019, 86: 1019-1025. |
| [4] |
ANDRIAMIALINIRINA H J T, IRM M, TAJ S, et al. The effects of dietary yeast hydrolysate on growth, hematology, antioxidant enzyme activities and non-specific immunity of juvenile Nile tilapia, Oreochromis niloticus[J]. Fish & Shellfish Immunology, 2020, 101: 168-175. |
| [5] |
邱燕. 三种微生态制剂对草鱼(Ctenopharyngodon idellus)生长性能、生理机能及肠道黏膜的影响[D]. 苏州: 苏州大学, 2010. QIU Y. Effects of three microecologicalagents on growth performance, physiological function and intestinal mucosa of grass carp (Ctenopharyngodon idellus)[D]. Suzhou: Soochow University, 2010. |
| [6] |
CABIB E, ROBERTS R, BOWERS B. Synthesis of the yeast cell wall and its regulation[J]. Annual Review of Biochemistry, 1982, 51: 763-793. DOI:10.1146/annurev.bi.51.070182.003555 |
| [7] |
张耀武, 屈文俊, 李文辉, 等. β (1, 3) -葡聚糖对锦鲤非特异性免疫功能的影响[J]. 淡水渔业, 2006, 36(4): 53-55. ZHANG Y W, QU W J, LI W H, et al. The effect of β-1, 3-glucan on non- specific immunological function of koi[J]. Freshwater Fisheries, 2006, 36(4): 53-55. DOI:10.3969/j.issn.1000-6907.2006.04.013 |
| [8] |
AI Q H, MAI K S, ZHANG L, et al. Effects of dietary β-1, 3 glucan on innate immune response of large yellow croaker, Pseudosciaena crocea[J]. Fish & Shellfish Immunology, 2007, 22(4): 394-402. |
| [9] |
GU M, MA H M, MAI K S, et al. Effects of dietary β-glucan, mannan oligosaccharide and their combinations on growth performance, immunity and resistance against Vibrio splendidus of sea cucumber, Apostichopus japonicus[J]. Fish & Shellfish Immunology, 2011, 31(2): 303-309. |
| [10] |
CHEN Y Y, SIM S S, CHIEW S L, et al. Dietary administration of a Gracilaria tenuistipitata extract produces protective immunity of white shrimp Litopenaeus vannamei in response to ammonia stress[J]. Aquaculture, 2012, 370-371: 26-31. DOI:10.1016/j.aquaculture.2012.09.031 |
| [11] |
SKOV J, KANIA P W, HOLTEN-ANDERSEN L, et al. Immunomodulatory effects of dietary β-1, 3-glucan from Euglena gracilis in rainbow trout (Oncorhynchus mykiss) immersion vaccinated against Yersinia ruckeri[J]. Fish & Shellfish Immunology, 2012, 33(1): 111-120. |
| [12] |
LEE S M. Apparent digestibility coefficients of various feed ingredients for juvenile and grower rockfish (Sebastes schlegeli)[J]. Aquaculture, 2002, 207(1/2): 79-95. |
| [13] |
LEE C M, TREVINO B, CHAIYAWAT M, et al. A simple and rapid solvent extraction method for determining total lipids in fish tissue[J]. Journal of AOCS International, 1996, 79(2): 487-492. |
| [14] |
DIVAKARAN S, OBALDO L G, FORSTER I P. Note on the methods for determination of chromic oxide in shrimp feeds[J]. Journal of Agricultural and Food Chemistry, 2002, 50(3): 464-467. DOI:10.1021/jf011112s |
| [15] |
LLAMES M, FONTAINE J. Determination of amino acids in feeds: collaborative study[J]. Journal of AOAC International, 1994, 77(6): 1994. |
| [16] |
王武刚. 酵母提取物替代鱼粉在凡纳滨对虾饲料中的应用研究[D]. 上海: 上海海洋大学, 2012. WANG W G. The study on replacement of fish meal by yeast extract in diet of Litopenaeus vannamei[D]. Shanghai: Shanghai Ocean University, 2012. |
| [17] |
XU L, RAN C, HE S X, et al. Effects of dietary yeast nucleotides on growth, non-specific immunity, intestine growth and intestinal microbiota of juvenile hybrid tilapia Oreochromis niloticus♀×Oreochromis aureus♂[J]. Animal Nutrition, 2015, 1(3): 244-251. DOI:10.1016/j.aninu.2015.08.006 |
| [18] |
蒋敏敏, 叶金云, 邵仙萍, 等. 酵母水解物对青鱼幼鱼生长性能、肌肉品质及肝胰脏抗氧化指标和组织形态的影响[J]. 动物营养学报, 2020, 32(5): 2326-2341. JIANG M M, YE J Y, SHAO X P, et al. Effects of yeast hydrolysate on growth performance, muscle quality, hepatopancreases antioxidant indexes and tissue morphology of juvenile black carp (Mylopharyngodon piceus)[J]. Chinese Journal of Animal Nutrition, 2020, 32(5): 2326-2341. DOI:10.3969/j.issn.1006-267x.2020.05.042 |
| [19] |
赵贵萍. 不同豆粕水平的饲料中添加一种酵母培养物(益康XP®)对大菱鲆生长、组织学结构以及肠道菌群的影响[D]. 青岛: 中国海洋大学, 2008. ZHAO G P. Effects of yeast culture® supplemented to the diets containing different levels of soybean meal on growth performance, histological structure and microbiology of turbot (Scophthatmus maximus)[D]. Qingdao: Ocean University of China, 2008. |
| [20] |
JARMOŁOWICZ S, ROẐYĦSKI M, KOWALSKA A, et al. Growth in juvenile pikeperch (Sander lucioperca L.) stimulated with yeast, Saccharomyces cerevisiae, extract[J]. Aquaculture Research, 2018, 49(2): 614-620. DOI:10.1111/are.13490 |
| [21] |
ZHOU M, LIANG R S, MO J F, et al. Effects of brewer's yeast hydrolysate on the growth performance and the intestinal bacterial diversity of largemouth bass (Micropterus salmoides)[J]. Aquaculture, 2018, 484: 139-144. DOI:10.1016/j.aquaculture.2017.11.006 |
| [22] |
李永娟, 张含乐, 周文豪. 酵母培养物(百惠康)替代鱼粉对草鱼生长性能和抗病力的影响[J]. 广东畜牧兽医科技, 2017, 42(6): 40-43. LI Y J, ZHANG H L, ZHOU W H. Effect of yeast culture instead of fish meal on growth performance and anti-disease capacity in Ctenopharyngodon idellus[J]. Guangdong Journal of Animal and Veterinary Science, 2017, 42(6): 40-43. DOI:10.3969/j.issn.1005-8567.2017.06.011 |
| [23] |
曾本和, 向枭, 杨文娇, 等. 酵母水解物对草鱼生长性能和体成分的影响[J]. 饲料工业, 2015, 36(16): 16-19. ZENG B H, XIANG X, YANG W J, et al. Effects of yeast hydrolyzate on growth and body composition of juvenile Ctenopharyngodon idellus[J]. Feed Industry, 2015, 36(16): 16-19. |
| [24] |
时博, 郁欢欢, 梁晓芳, 等. 酵母水解物对大口黑鲈生长性能、血浆生化指标以及肝脏组织健康的影响[J]. 动物营养学报, 2018, 30(7): 2772-2781. SHI B, YU H H, LIANG X F, et al. Effects of yeast hydrolysate on growth performance, plasma biochemical indexes and hepatic tissue health of largemouth bass (Micropterus salmoides)[J]. Chinese Journal of Animal Nutrition, 2018, 30(7): 2772-2781. DOI:10.3969/j.issn.1006-267x.2018.07.038 |
| [25] |
李向, 华雪铭, 魏翔, 等. 饲料中维生素D3含量对大口黑鲈生长和抗氧化能力的影响[J]. 上海海洋大学学报, 2021, 30(1): 94-102. LI X, HUA X M, WEI X, et al. Effects of dietary vitamin D3 on the growth and antioxidant capacity of largemouth bass (Micropterus salmoides)[J]. Journal of Shanghai Ocean University, 2021, 30(1): 94-102. |
| [26] |
李高锋. 酵母培养物在团头鲂饲料中的应用研究[D]. 苏州: 苏州大学, 2009. LI G F. Studies on application of Yeast Culture in artificial feed of Megalobrama amblycephala[D]. Suzhou: Soochow University, 2009. |
| [27] |
刘哲, 魏时来. 酵母培养物对建鲤生长性能影响的研究[J]. 饲料工业, 2003, 24(4): 52-53. LIU Z, WEI S L. Effect of yeast cultivation for Cyprinus carpio var. jian growth performance[J]. Feed Industry, 2003, 24(4): 52-53. DOI:10.3969/j.issn.1001-991X.2003.04.017 |
| [28] |
张尔贤. 海洋生物抗活性氧资源的研究与开发前景[J]. 中国生化药物杂志, 1992(3): 17-21. ZHANG E X. Research and development prospect of Marine biological resistance to reactive oxygen species[J]. Chinese Journal of Biochemical Pharmaceutics, 1992(3): 17-21. |
| [29] |
王伟, 姜志强, 孟凡平, 等. 急性温度胁迫对太平洋鳕仔稚鱼成活率、生理生化指标的影响[J]. 水产科学, 2012, 31(8): 463-466. WANG W, JIANG Z Q, MENG F P, et al. The effects of sharply changes in temperature on survival and indices of physiology and biochemistry in Pacific cod Gadus macrocephalus[J]. Fisheries Science, 2012, 31(8): 463-466. DOI:10.3969/j.issn.1003-1111.2012.08.003 |
| [30] |
柳茜, 杨文娇, 吴振, 等. 酵母水解物对大菱鲆幼鱼非特异性免疫及抗应激能力的影响[J]. 饲料工业, 2015, 36(18): 33-37. LIU X, YANG W J, WU Z, et al. Effects of yeast hydrolysate on non-specific immunity and anti-stress abilities of juvenile turbot (Scophthalmus maximus)[J]. Feed Industry, 2015, 36(18): 33-37. |
| [31] |
MOURE A, DOMíNGUEZ H, PARAJó J C. Antioxidant properties of ultrafiltration-recovered soy protein fractions from industrial effluents and their hydrolysates[J]. Process Biochemistry, 2006, 41(2): 447-456. DOI:10.1016/j.procbio.2005.07.014 |
| [32] |
WU H C, CHEN H M, SHI C Y. Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel (Scomber austriasicus)[J]. Food Research International, 2003, 36(9/10): 949-957. |
| [33] |
王璞, 喻一峰, 李小勤, 等. 低磷饲料中补充柠檬酸对大口黑鲈生长和营养物质利用率的影响[J]. 上海海洋大学学报, 2021, 30(3): 475-483. WANG P, YU Y F, LI X Q, et al. Effects of citric acid supplementation in low phosphorus diets on growth and nutrient utilization of largemouth bass (Micropterus salmoides)[J]. Journal of Shanghai Ocean University, 2021, 30(3): 475-483. |
| [34] |
曹俊明, 吴春玉, 黄燕华, 等. β-葡聚糖对花鲈免疫和抗氧化指标的影响[J]. 水产科学, 2015, 34(1): 1-7. CAO J M, WU C Y, HUANG Y H, et al. Effects of dietary β-glucan on immunity and antioxidation indices in Japanese Seabass Lateolabrax japonicus[J]. Fisheries Science, 2015, 34(1): 1-7. |
| [35] |
沈文英, 阳会军, 柯慧芬, 等. β-葡聚糖对凡纳滨对虾免疫相关酶活性的影响[J]. 水产科学, 2007, 26(7): 381-383. SHEN W Y, YANG H J, KE H F, et al. Effect of β-glucan on enzyme activity of immunity in Pacific White Leg Shrimp Litopenaeus vannmei[J]. Fisheries Science, 2007, 26(7): 381-383. |
| [36] |
高敏敏. 酵母源饲料添加剂对异育银鲫生长、健康、氧化油脂损伤修复和抗病力的影响[D]. 苏州: 苏州大学, 2019. GAO M M. Effects of yeast source feed additive on growth, health, repairing of oxidized oil injury and disease resistance for allogynogenetic silver crucian carp (Carassius auratus gibelio♀×Cyprinus carpio♂)[D]. Suzhou: Soochow University, 2019. |
| [37] |
ENGSTAD R E, ROBERTSEN B, FRIVOLD E. Yeast glucan induces increase in lysozyme and complement-mediated haemolytic activity in Atlantic salmon blood[J]. Fish & Shellfish Immunology, 1992, 2(4): 287-297. |
| [38] |
杨福刚, 周洪琪, 黄旭雄. 不同β-葡聚糖对凡纳滨对虾稚虾生长及非特异免疫功能的影响[J]. 上海水产大学学报, 2005, 14(3): 263-269. YANG F G, ZHOU H Q, HUANG X X. Effect of beta-glucans on growth and non-specific immune response of Litopenaeus vannamei[J]. Journal of Shanghai Fisheries University, 2005, 14(3): 263-269. |
| [39] |
程鑫, 潘婷婷, 金敏, 等. 饲料中添加酵母培养物对黄颡鱼生长性能、非特异性免疫和肠道健康的影响[J]. 水产学报, 2019, 43(4): 1080-1091. CHENG X, PAN T T, JIN M, et al. Effects of dietary yeast culture supplementation on growth performance, nonspecific immunity and intestinal health of Pelteobagrus fulvidraco[J]. Journal of Fisheries of China, 2019, 43(4): 1080-1091. |
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


