2. 大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心, 辽宁 大连 116034;
3. 上海水产品加工贮藏工程技术研究中心, 上海 201306;
4. 农业农村部水产品贮藏保鲜质量安全风险评估实验室, 上海 201306;
5. 上海海洋大学 食品热加工工程技术研究中心, 上海 201306
单增李斯特菌是革兰氏阳性食源性病原菌,与人类疾病有关。孕妇、胎儿、老年人和免疫力低下的人最易受感染,这些人在感染后可能会遭受很高的死亡率(10% ~40%)[1]。重要的是,单增李斯特菌对与食品生产、加工和储存相关的各种压力条件具有抵抗力。例如,它可以在高盐度(10%)、低温(4 ℃)、低水分活度(<0.9)和广泛的pH范围(4.1~9.6)[2]下生长, 食品的生产和储存环境为单增李斯特菌提供了广泛的栖息地,其也可以在食品的不同阶段进行加工,并在加工现场形成生物被膜。李斯特菌病的发生主要是由于食用了被单增李斯特菌污染的食物,其可能会污染各种食品[3],包括即食产品、蘑菇、水产品、肉和肉类产品以及冷冻食品[4]。随着经济的改善和生活节奏的加快,冷冻和冷藏食品因其便利性和明显的高营养价值而受到消费者的青睐[5],不仅可以最大程度地保持食物的质地、风味和营养价值、成本低廉,而且可以抑制微生物的生长和繁殖[6]。尽管它是目前最好的保存方法之一,但它没有有效的杀菌作用,因此对人类健康构成更大的风险[7-8]。这些发现强调了冷冻冷藏并不会对食品进行灭菌的事实。例如,2019年的新型冠状病毒COVID-19可以在冷藏和冷冻食品中检测到,当冷藏温度为4 ℃时,它具有很高的稳定性,并且有望在2 ℃以下保持传染性[9]。因此,冷冻食品并非绝对安全,且不能直接食用[10]。
已有研究评估了酸性电解水(AEW)的作用,该抑菌剂具有低pH、高氧化还原电位(ORP)和高有效氯(ACC)[11],是一种新型、高效、安全且无残留的杀菌剂,具有广谱活性。另外,它生产方便,使用简单,可作为一种实用的消毒方法。AEW在食品加工、医学和临床科学以及农业生产领域可能具有非常重要的潜在应用价值[12]。然而该技术在冷藏食品中有害嗜冷微生物方面的应用却鲜有报道。
目前冷冻食品卫生管理的研究主要集中在控制25 ℃以及37 ℃下微生物的生长情况。此外,大多数研究人员在短时间内使用冷模拟来检查微生物的生长[13],却忽略了冷冻食品被长期运输和储存的事实,这为有害细菌的生长提供了足够的时间,增加了食品污染的风险[14],并且在食品工业中引起极大关注。已有研究表明,酸性电解水对37 ℃培养条件下副溶血性弧菌[15]、大肠杆菌、单增李斯特菌等[16]有较强的杀菌效果,而酸性电解水对4 ℃条件下的单增李斯特菌灭活作用及其机制尚不清楚,对其生物被膜的清除效果少有报道。因此,本研究将系统探究酸性电解水对低温条件下单增李斯特菌、生物被膜及其冷藏金针菇上单增李斯特菌的抗菌效果,从而为酸性电解水杀菌技术在冷藏食品中应用提供新的理论依据。
1 材料与方法 1.1 酸性电解水的制备酸性电解水的制备方法参照文献[11],酸性电解水由不同浓度的电解质电解得到,将0.05%、0.10%的NaCl盐溶液倒入酸性电解水电解槽中。本实验使用电解水制备仪(FW-200,日本)制备不同理化特性电解水,所需要的NaCl溶液浓度参照本实验室实验数据。电解水制备仪具有二槽隔膜式电解槽,电解过程在电解槽中完成,最终在阳极生成具有氧化能力的酸性电解水(acidic electrolyzed water,AEW),及在阴极生成具有还原能力的碱性电解水(basic electrolyzed water,BEW)。本试验中电解条件设置为电解时间15 min、电流强度10 A[11, 17],制备获得的电解水pH和ORP值使用pH/ORP测量仪表进行测量。电解水中的有效氯浓度(ACC)运用数字化有效氯测定仪(MHY-145446型手持式有效氯测定仪,北京美华仪科技有限公司)进行测定。
1.2 菌株的制备本实验采用的单增李斯特菌株4bLM (从生猪肉中分离得到)和标株ATCC19115。菌株(保存在25%甘油,温度为-80 ℃)在37 ℃的PALCAM培养板上传代培养36~48 h。取形态大小单菌落在试管(18 mm×18 mm)中以200 r/min(4 ℃、37 ℃) 的速度进行摇动培养。所有培养好后得到的悬浮液分别收集在50 mL试管中,然后离心。将获得细菌细胞用磷酸盐缓冲液(PBS)洗涤并重新悬浮,得到细菌细胞~8 log CFU/mL,作为母液进行试验。
1.3 悬液定量抑菌试验应用电解水制备仪将一定的NaCl溶液电解制备出所需要的电解水,电解水的电解时间为15 min,电流强度为10 A。细菌悬液按照上述方式培养后得到~8 log CFU/mL。将制备好的AEW和菌液(4 ℃、37 ℃)以体积比1∶ 1进行混合处理一定时间后,再加入与电解水同容量终止液(0.8%Na2S2O3溶液)终止AEW的处理。
1.4 生物被膜的形成研究其生物被膜的形成,将10 μL单增李斯特菌液(OD600=0.4)接种到990 μL新鲜的BHI培养基中,然后吸附到24聚苯乙烯微量滴定孔板中,孔板中也含有未接种菌液的BHI作为空白对照。然后将24孔板放在37 ℃下静态孵育48 h以形成被膜,并使用保鲜膜将孔板密封以最大程度减少蒸发损失。然后使用1×磷酸盐缓冲液(PBS,pH 7.4)轻轻冲洗孔板3次,并在室温(25 ℃)下用1 000 μL的0.1%结晶紫(生工,上海,中国)染色30 min,用PBS洗涤除去过量的结晶紫,并将其重悬浮于95%乙醇中。通过测量相应的OD600 nm对生物被膜进行定量。
1.5 酸性电解水处理对胞外聚合物的影响被膜培养后,用超声破壁法提取胞外聚合物(EPS)。被膜培养后,吸取孔板中悬浮液200 μL,其OD595 nm检测浓度,去除多余悬浮液,用PBS清洗3次。AEW处理以后,每孔加入1 mL 0.01 mol/L的KCl溶液, 再进行多次吹打,使孔板底部被膜加速溶解,收集到1.5 mL离心管中,然后进行超声破壁处理(超声处理参数:每次超声5 s,超声处理6个循环,每个循环之间间隔5 s),处理结束后,4 ℃条件下离心20 min,转速4 000 g,再使用0.22 μm的滤膜将离心后的液体进行过滤,转移到新的1.5 mL的离心管中。生理盐水处理为对照组。
苯酚-硫酸法测定胞外多糖:上述过滤好的液体取出100 μL至1.5 mL离心管,加入200 μL 99.9 %的浓硫酸(AR),在室温下静置30 min后加入25 μL 6%的苯酚,放于90 ℃金属浴中5 min,然后测定其OD490 nm,OD490 nm/OD595 nm即为所测样品中的胞外多糖含量。Lowry法测定胞外蛋白:上述过滤好的液体取出40 μL至1.5 mL离心管,加入200 μL Lowry reagent试剂,室温静置10 min,然后加入20 μL福林-酚试剂,室温放置30 min,测定OD750 nm,计算出蛋白泄露量。
1.6 共聚焦显微镜(CLSM)生物被膜的预处理用于显微镜分析参照FOLSOM等[18]。使用CLMS机器(LSM710,德国)捕获并采集所有显微图像。40×物镜用于监测在488 nm激发并在500~550 nm发射的SYBR Green Ⅰ荧光。通过ISA-2软件从三维CLSM图像中提取生物膜结构的定量参数(生物体积,均质性,质地熵,表面粗糙度)。对于每个样品,随机获取载玻片上9个不同位置的代表性图像。
1.7 q-PCRq-PCR的循环次数:95 ℃变性5 min,95 ℃变性30 s,60 ℃变性30 s,引物延伸,72 ℃变性30秒,共35个循环,每个循环延伸步骤后检测荧光产物。根据RT-qPCR数据,分析相应基因的表达(表 1)。
|
表 1 寡核苷酸引物序列 Tab.1 Sequences of oligonucleotide primers |
将样品随机分成3个等份,并在4 ℃下储存。样品的感官、生物化学和微生物评估在第0、1、2、3、4、5、6、7和9天进行。每个实验进行3次重复。金针菇接种约6.5 log CFU/mL单增李斯特菌。使用色差仪对每份样品选取3个不同地方进行测量,取其平均值。
1.9 数据处理实验结果为3次重复的平均值,实验数据表示为平均值±标准差。使用SPSS 17.0 (SPSS Inc.,Chicago,IL),使用单向方差分析比较值差异,P<0.05表示差异有统计学意义。
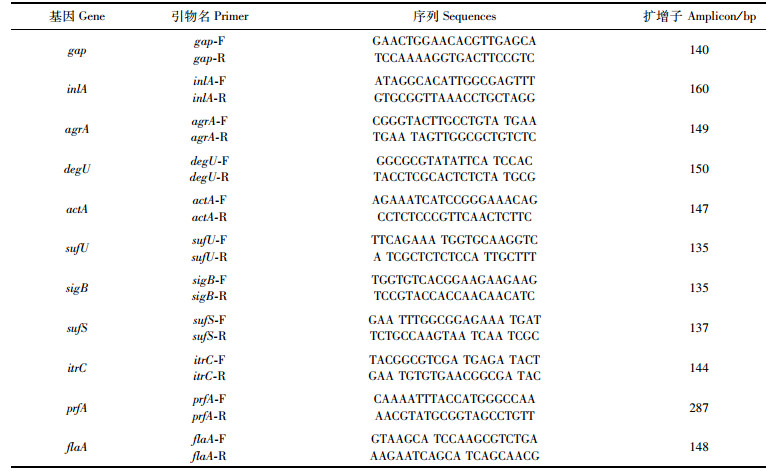
2 结果与分析 2.1 酸性电解水对低温条件下的浮游单增李斯特菌的杀菌效果单增李斯特菌2组温度阴性对照组的菌落总数大约为8.2 log CFU/mL,2种温度培养的单增李斯特菌,仅处理1 min或增加电解质NaCl浓度(0.10%),菌落总数产生显著变化。电解质NaCl浓度为0.05%时,用浓度为0.10%的NaCl灭活处理37 ℃条件下的单增李斯特菌1 min时,在平板上检测不到任何菌落。然而同样处理条件,4 ℃条件下的单增李斯特菌的菌落总数仅下降至3.06 log CFU/mL。见图 1a。
|
柱状图上方含“*”代表差异显著。*.P<0.05; **.P<0.01; ***.P<0.001。 The "*" above the histogram shows significant difference. *.P < 0.05; **.P < 0.01; ***.P < 0.001. 图 1 不同浓度电解质NaCl对不同温度的单增李斯特菌的杀菌效果 Fig. 1 Sterilization effect of different concentrations of AEW on L. monocytogenes under different temperature |
与阴性对照组相比,当用0.05% NaCl的酸性电解水,杀灭4 ℃条件下的单增李斯特菌,处理时间从1 min增加到15 min后,单增李斯特菌的菌落总数分别减少至4.65 log CFU/mL、4.18 log CFU/mL、3.76 log CFU/mL,当处理时间增加到30 min,菌落总数减少至3.36 log CFU/mL。当用0.10% NaCl的酸性电解水,处理时间从1 min增加至5 min,单增李斯特菌的菌落总数分别减少3.06、2.41 log CFU/mL,当处理时间为15 min时,在平板上已经检测不到菌落(图 1b)。低浓度0.05%NaCl的酸性电解水在处理37 ℃条件下的单增李斯特菌,出现类似的趋势,处理时间从1 min延长至30 min,菌落总数分别为3.77、3.01、2.72、2.47 log CFU/mL。但是当浓度为0.10% NaCl时,处理时间仅1 min,在平板上则无法检测到菌落。因此酸性电解水对37 ℃条件下的单增李斯特菌灭活表现较好的抑菌效果,但相同处理条件时,对4 ℃条件下的单增李斯特菌抑菌效果不显著。见图 1b。
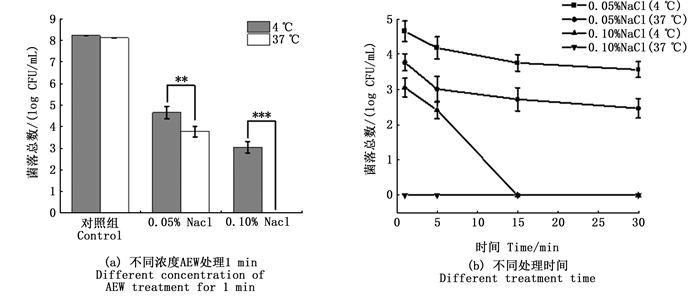
2.2 酸性电解水对单增李斯特菌生物被膜清除效果利用结晶紫染色法检测了不同温度条件的单增李斯特菌生物被膜量。当NaCl浓度为0.05% (图 2a) 时,阴性对照组已经出现显著性差异,处理时间为1 min时,4 ℃、37 ℃条件下单增李斯特菌生物被膜总生物量分别降低31.44%、30.83 %,有显著性差异,时间从5 min增加至30 min,其生物被膜总生物量分别降低45.84%、65.22%、85.66% (58.00%、78.36%、94.06%)。此外当NaCl浓度为0.10%(图 2b)时,酸性电解水清除单增李斯特菌生物被膜的试验中也得到了类似的结果,时间为30 min时,37 ℃条件下的生物被膜总生物量下降了97.46 %,几乎被清除,而4 ℃条件下的单增李斯特菌生物被膜总生物量下降了85.66%。
|
柱状图上方含“*”代表差异显著。*.P<0.05; **.P<0.01; ***.P<0.001。 The "*" above the histogram shows significant difference. *.P < 0.05; **.P < 0.01; ***.P < 0.001. 图 2 酸性电解水对单增李斯特菌生物被膜的清除影响 Fig. 2 Effect of AEW on the removal of L. monocytogenes biofilms |
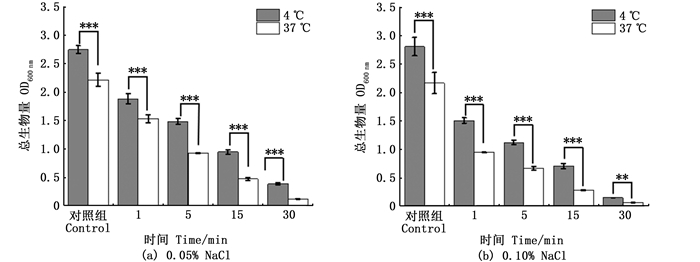
在4 ℃条件下的单增李斯特菌菌株抵抗ACC的能力与生物被膜产生的胞外多糖的数量可能比生物被膜所含细胞的数量更紧密相关[19]。在低温环境中,低温细菌会合成几种低温保护性化合物,例如细胞外多糖,它们可以改变分子的微观结构,促进表面黏附、细胞聚集和生物膜形成。细菌胞外聚合物在生物被膜结构的稳定性中起着重要作用,并且对生物被膜细菌具有很强的保护作用,导致食品交叉污染和其他危害[20]。为了进一步研究AEW对生物被膜的破坏,我们探讨了AEW对细胞外聚合物中细胞外多糖和细胞外蛋白质含量的影响,采用苯酚-硫酸法测定生物被膜胞外多糖的相对表达量,Lowry法测定胞外蛋白。图 3显示了单增李斯特菌的生物被膜经AEW处理后细胞外多糖和细胞外蛋白质含量的变化,与37 ℃相比,在4 ℃条件下培养的单增李斯特菌的胞外多糖和细胞外蛋白质明显增多。经过不同浓度AEW处理后,37 ℃条件的胞外多糖和胞外蛋白质减少量更多。
|
柱状图上方含“*”代表差异显著。*.P<0.05; **.P<0.01; ***.P<0.001。 The "*" above the histogram shows significant difference. *.P < 0.05; **.P < 0.01; ***.P < 0.001. 图 3 酸性电解水处理对生物被膜胞外聚合物EPS的影响 Fig. 3 Effect of acidic electrolyzed water treatment on EPS of biofilms |
在此基础上,进一步通过CLSM表征酸性电解水对低温条件下的单增李斯特菌被膜的清除效果,结果如图 4所示。未处理组2组温度条件的单增李斯特菌都呈现出紧凑且密集分布,且4 ℃条件下单增李斯特菌呈现更密集。当NaCl浓度分别为0.05%和0.10%,处理时间为1 min时,两组温度条件之间呈现明显差异。随着处理时间从1 min增加到30 min,生物被膜的数量和稀疏度大大降低(图 4)。

|
A0-A4、B0-B4.37 ℃; a0-a4、b0-b4. 4 ℃。 图 4 酸性电解水处理不同温度条件下的单增李斯特菌的CLSM图像 Fig. 4 CLSM images of L. monocytogenes treated with AEW at concentrations of 0.05% NaCl (a) and 0.10% NaCl (b) at different temperature |
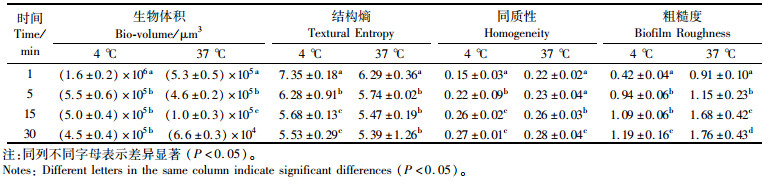
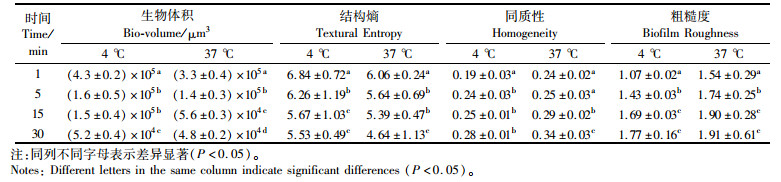
表 2定量分析表明,AEW处理1 min、5 min、15 min及30 min后,生物膜体积分别为1.6×106 μm3和5.3×105 μm3、5.5×105 μm3和4.6×105 μm3、5.0×105 μm3和1.0×105 μm3、4.5×105 μm3和6.6×104 μm3。同质性通常用于衡量细胞簇的相似性。同质性越高,表明簇结构越均匀[21]。如表 2所示,经AEW处理的生物被膜的同质性得到了显著改善。通常,同质性的数量随着细胞簇数量的减少而增加[22]。基于此,我们得出结论,AEW处理可以消除37 ℃条件下培养的大量单增李斯特菌。4 ℃条件下单增李斯特菌展现较强的活性,在AEW处理之后,TE值分别从7.35、6.29显著降低至5.53、5.39。通常认为,结构熵值越高,生物膜的异质性越强。因此,我们推测表 2中的TE值降低可能是由于生物膜异质性降低。粗糙度是生物膜厚度变化的量度。随着AEW处理时间的增加,生物膜的粗糙度显着增加(P<0.05),这与生物膜同质性的变化一致[23]。但是,观察到两组膜的粗糙度存在显著差异。在4 ℃形成的生物膜上培养的单增李斯特菌比37 ℃下培养的单增李斯特菌更光滑。这表明相比于37 ℃条件,在4 ℃下生物被膜结构没有受到严重破坏,表 3定量分析结果亦是如此。
|
表 2 0.05%NaCl酸性电解水处理单增李斯特菌生物被膜结构参数变化 Tab.2 Changes in structural parameters of L. monocytogenes biofilms treated with acidic electrolyzed water of 0.05% NaCl |
|
表 3 0.10%NaCl酸性电解水处理单增李斯特菌生物被膜结构参数变化 Tab.3 Changes in structural parameters of L. monocytogenes biofilms treated with acidic electrolyzed water of 0.10% NaCl |
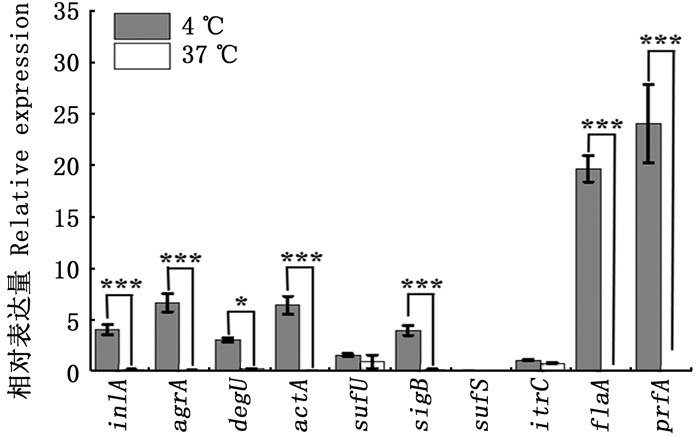
进一步从微观层面来证明酸性电解水灭活4 ℃、37 ℃条件下的单增李斯特菌的差异性。单增李斯特菌在很长一段时间的进化中,获得了1组不同的基因和相应的蛋白,每个基因和相应的蛋白在这种微生物的生存和致病过程中都有自己独特的属性和功能。转录调节因子prfA是一种重要的转录因子,控制细菌从细胞外到细胞内的转化,并上调几个毒力基因的转录。先前的研究表明,该因子是这种有机体生物膜形成的重要调节因子。除了毒力基因,还有一些应激反应基因,在单增李斯特菌的情况下,由转录因子SigB控制,研究已经证明它参与了这种微生物对低温的适应。
单增李斯特菌在4 ℃下生长,sigB和prfA基因转录水平均显著提高(P<0.05)。低温对食品加工环境中的单增李斯特菌来说是额外的压力,prfA可以在低温下转录,转录因子prfA可以根据生长温度在活性和非活性之间切换, 在目前的研究中,上调的prfA,表明低温增加了单核细胞增生李斯特菌的应激反应,以抵抗外界恶劣的环境。sigB和prfA的观察结果一致,这两个基因都参与了胁迫反应和毒力的调节,支持degU参与了单增李斯特菌的致病性、抗性和持久性的基本机制。degU也被鉴定为生物合成的积极激活剂,在37 ℃较少甚至没有表达[24]。
|
柱状图上方含“*”代表差异显著。*.P<0.05; **.P<0.01; ***.P<0.001。 The "*" above the histogram shows significant difference. *.P < 0.05; **.P < 0.01; ***.P < 0.001. 图 5 温度对单增李斯特菌相关被膜基因表达的影响 Fig. 5 Effect of temperature on the expression of Listeria monocytogenes related virulence genes |
综上,与在37 ℃条件下观察到的转录水平相比,这些数据表明,大多数基因在4 ℃时的转录水平都有所增加。结果证明了单增李斯特菌在应激条件下激活几种遗传机制的能力,以便在暴露于具有挑战性的情况下保持生存能力和致病性。此外,这些结果强化了控制冷链中存在的单增李斯特菌的重要性,这些冷链是广泛使用的,例如乳制品、即食食品行业和冷藏食品。同样有趣的是,这两株菌导致了许多人类单增李斯特菌病病例,在4 ℃和37 ℃的温度下呈现出不同的分子机制,这表明继续对其他相关基因进行类似实验的重要性[25]。
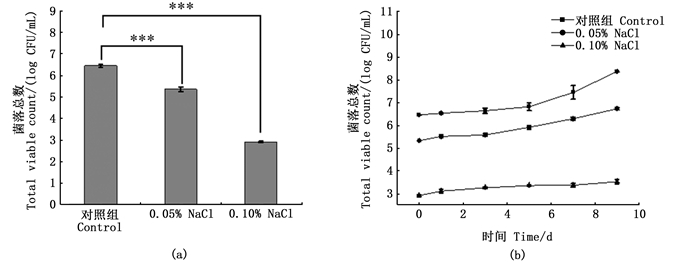
2.3 酸性电解水对冷藏金针菇中单增李斯特菌杀菌效果经过对单增李斯特菌的浮游态、生物被膜态的灭活试验,为了使酸性电解水的理论基础能够与实际应用相结合,进行金针菇样品抑菌试验。NaCl浓度选择0.05%、0.10%,处理时间为30 min,菌落总数分别减少至5.35 log CFU/mL和2.91 log CFU/mL(图 6a)。随着储藏时间的增加,亚致死单增李斯特菌在金针菇上慢慢恢复且不断增殖。经NaCl浓度为0.05%的酸性电解水处理后,菌落总数从5.35 log CFU/mL增加至6.73 log CFU/mL。而经NaCl浓度为0.10%的酸性电解水处理后,菌落总数从2.91 log CFU/mL仅增加至3.51 log CFU/mL (图 6b)。说明后者能够有效抑制单增李斯特菌。
|
柱状图上方含“*”代表差异显著。*.P<0.05; **.P<0.01; ***.P<0.001。 The "*" above the histogram shows significant difference. *.P < 0.05; **.P < 0.01; ***.P < 0.001. 图 6 经酸性电解水处理后单增李斯特菌在金针菇上的恢复与增殖 Fig. 6 Recovery and proliferation of L. monocytogenes on F. velutipes after acidic electrolyzed water treatment |
感官质量是对采后金针菇的最直接的评价,也是决定货架期的一个重要指标[26]。由图 7所示,金针菇的菌盖在贮藏过程中会随着时间的推移而变质和腐烂,未处理组在第9天达到货架期终点,菌毛大部分黏稠、凹陷,菌柄出现大开孔、变黄、开裂等现象。大多数固体表面都附着在模具上,蘑菇已经失去了作为商品的价值。处理组在第9天时,一直保持良好的气味和菌毛形态,明显优于同期的对照组。由此可见,酸性电解水能显著抑制金针菇在贮藏过程中的腐烂变质,从而延长货架期。
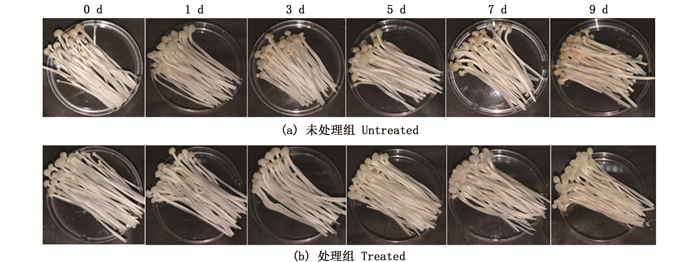
|
图 7 经酸性电解水处理后金针菇在4 ℃下子实体感官品质的影响试验 Fig. 7 Effect of acid electrolyzed water treatment on the sensory quality of F. velutipes at 4 ℃ |
失重率是评价水果和蔬菜新鲜度的重要指标[27]。金针菇收获后储存期间的重量下降主要是由于细胞呼吸过程中养分的消耗和蒸腾作用中水分的损失[28]。新鲜金针菇含水量高,营养丰富。在贮藏过程中,失重会导致子实体的软化、枯萎和收缩,降低新鲜度并影响其商业价值。如表 4所示,处理组在储存温度4 ℃下,1 d的失重率为2.00%,3 d的失重率为3.20%,储藏时间增加到第9天,失重率为13.52%。而未处理组储藏9 d后,失重率达到25.8%,在这一点上,F.velutipe已经失去了大部分的商业价值。由表 4所示,经过酸性电解水处理后的金针菇在4 ℃条件下储藏时间相对更久。
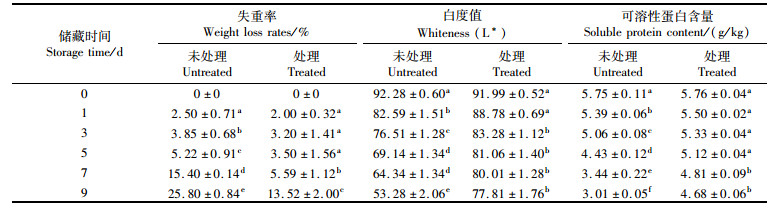
|
表 4 经酸性电解水杀菌后的金针菇贮藏特性分析 Tab.4 Analysis of storage characteristics of F. velutipes after sterilization by acidic electrolyzed water |
白度值是金针菇商业价值的重要指标[27]。在贮藏过程中,白度值在4 ℃条件下持续缓慢下降,未处理组的金针菇下降最大,白度值在第9天降至53.28。处理组,9 d后白度值仍为77.81,显著优于未处理组(P<0.05)。结果表明,酸性电解水有效抑制了金针菇子实体的褐变,延缓了贮藏过程中的腐烂[29]。见表 4。
贮藏期间,蛋白水解酶保持活性,将这些蛋白质水解成更小的分子,从而导致金针菇风味的改变[30-31]。如表 4所示,可溶性蛋白质在储藏期内含量有所下降。在4 ℃储藏下,未处理组可溶性蛋白含量持续下降,最终浓度为3.01 g/kg,处理组可溶性蛋白含量在贮藏过程中缓慢下降,9 d时仍维持在4.68 g/ kg,显著高于未处理组的含量(P<0.0 5)。酸性电解水对冷藏金针菇中单增李斯特菌有明显的杀菌效果[32]。
3 讨论本研究主要分析AEW对在冷藏温度4 ℃下生长的单增李斯特菌的浮游、生物膜的抗菌作用。结果表明,AEW短时间内对在4 ℃下培养的单增李斯特菌的影响不显著,相反,AEW对同期在37 ℃下培养的单增李斯特菌具有显著的抑菌作用。pH、ORP、ACC是AEW破坏细菌细胞活力的主要因素,而ACC是主要原因。ACC首先作用于细菌细胞壁,引起脂多糖结构的改变和金属离子通道蛋白的变性,从而导致K+和Ca2+从细胞中迅速漏出,破坏肽聚糖层,使细胞松散,并增加细胞壁的通透性。ACC攻击细菌细胞膜,导致细胞膜通透性增加,这有助于AEW进入细胞并最终导致细菌死亡[33]。单增李斯特菌对氯的抗性还取决于生长底物、离子浓度和温度。温度是影响生物存活的限制因素。当温度降低时,膜的流动性降低,从而影响膜的相结构(固相和液相)和膜的正常功能,并且细胞膜的选择性、渗透性基于细胞膜的流动性,即温度可能改变细胞膜流动性,当ACC攻击时,细胞膜通透性增加不明显,从而对酸性电解水有效氯有一定的抗性。相比37 ℃条件下的单增李斯特菌,酸性电解水短时间内不能有效清除其成熟的生物被膜。通过结晶紫法定量生物被膜、生物被膜聚合物的测定,在4 ℃环境中,低温细菌会合成几种低温保护性化合物,例如细胞外多糖,它们可以改变分子的微观结构,促进表面黏附、细胞聚集和生物被膜形成。细菌胞外聚合物在生物膜结构的稳定性中起着重要作用,并且对生物被膜细菌具有很强的保护作用,这可能是导致相同酸性电解水处理4 ℃、37 ℃条件下的单增李斯特菌浮游态、生物被膜态均出现显著性差异的重要因素。毒力基因相对表达量的测定分析,单增李斯特菌在4 ℃应激条件下可能激活几种遗传机制的能力,以便在暴露于酸性电解水下保持生存能力和致病性。酸性电解水杀灭4 ℃条件下的单增李斯特菌,15 min内并不能灭活,需要延长处理时间,或增加NaCl的浓度,造成该现象的主要原因,除去其低温下单增李斯特菌本身就难以杀灭外,还有样品自身条件对酸性电解水的影响。因此,酸性电解水在应用于控制冷冻冷藏环境中的微生物时应提出更高要求,从而大大降低食品的安全风险。
| [1] |
HOF H. An update on the medical management of listeriosis[J]. Expert Opinion on Pharmacotherapy, 2004, 5(8): 1727-1735. DOI:10.1517/14656566.5.8.1727 |
| [2] |
GUENTHER S, HUWYLER D, RICHARD S, et al. Virulent bacteriophage for efficient biocontrol of Listeria monocytogenes in ready-to-eat foods[J]. Applied and Environmental Microbiology, 2009, 75(1): 93-100. DOI:10.1128/AEM.01711-08 |
| [3] |
CHEN M T, CHENG J H, ZHANG J M, et al. Isolation, potential virulence, and population diversity of Listeria monocytogenes from meat and meat products in China[J]. Frontiers in Microbiology, 2019, 10: 946. DOI:10.3389/fmicb.2019.00946 |
| [4] |
PAPAGEORGIOU D K, BORI M, MANTIS A. Survival of Listeria monocytogenes in frozen ewe's milk and feta cheese curd[J]. Journal of Food Protection, 1997, 60(9): 1041-1045. DOI:10.4315/0362-028X-60.9.1041 |
| [5] |
MCLENNON J, BORZA A, EISEBRAUN M, et al. Improved recovery of stressed Listeria monocytogenes from frozen foods[J]. Food Analytical Methods, 2018, 11(2): 403-414. DOI:10.1007/s12161-017-1011-2 |
| [6] |
GEIGES O. Microbial processes in frozen food[M]//BRACK A, HORNECK G, FRIEDMANN E I, et al. Life Sciences: Space and Mars Recent Results. 1996: 109-118.
|
| [7] |
DATTA A R, LAKSANALAMAI P, SOLOMOTIS M. Recent developments in molecular sub-typing of Listeria monocytogenes[J]. Food Additives & Contaminants: Part A, 2013, 30(8): 1437-1445. |
| [8] |
MORTAZAVI N, ALIAKBARLU J. Antibacterial effects of ultrasound, cinnamon essential oil, and their combination against Listeria monocytogenes and Salmonella typhimurium in milk[J]. Journal of Food Science, 2019, 84(12): 3700-3706. DOI:10.1111/1750-3841.14914 |
| [9] |
LIU P P, YANG M J, ZHAO X, et al. Cold-chain transportation in the frozen food industry may have caused a recurrence of COVID-19 cases in destination: successful isolation of SARS-CoV-2 virus from the imported frozen cod package surface[J]. Biosafety and Health, 2020, 2(4): 199-201. DOI:10.1016/j.bsheal.2020.11.003 |
| [10] |
BERGHOLZ T M, TANG S L, WIEDMANN M, et al. Nisin resistance of Listeria monocytogenes is increased by exposure to salt stress and is mediated via LiaR[J]. Applied and Environmental Microbiology, 2013, 79(18): 5682-5688. DOI:10.1128/AEM.01797-13 |
| [11] |
WANG J J, ZHANG Z H, LI J B, et al. Modeling Vibrio parahaemolyticus inactivation by acidic electrolyzed water on cooked shrimp using response surface methodology[J]. Food Control, 2014, 36(1): 273-279. DOI:10.1016/j.foodcont.2013.08.031 |
| [12] |
LI Y F, ZENG Q H, LIU G, et al. Food-grade emulsions stabilized by marine Antarctic krill (Euphausia superba) proteins with long-term physico-chemical stability[J]. LWT, 2020, 128: 109492. DOI:10.1016/j.lwt.2020.109492 |
| [13] |
ALVES Ã, MAGALHÃES R, BRANDÃO T R S, et al. Impact of exposure to cold and cold-osmotic stresses on virulence-associated characteristics of Listeria monocytogenes strains[J]. Food Microbiology, 2020, 87: 103351. DOI:10.1016/j.fm.2019.103351 |
| [14] |
KRAGH M L, MUCHAAMBA F, TASARA T, et al. Cold-shock proteins affect desiccation tolerance, biofilm formation and motility in Listeria monocytogenes[J]. International Journal of Food Microbiology, 2020, 329: 108662. DOI:10.1016/j.ijfoodmicro.2020.108662 |
| [15] |
ROY P K, MIZAN F R, HOSSAIN I, et al. Elimination of Vibrio parahaemolyticus biofilms on crab and shrimp surfaces using ultraviolet C irradiation coupled with sodium hypochlorite and slightly acidic electrolyzed water[J]. Food Control, 2021, 128: 108179. DOI:10.1016/j.foodcont.2021.108179 |
| [16] |
ZHANG J Y, WANG J Y, ZHAO D D, et al. Efficacy of the two-step disinfection with slightly acidic electrolyzed water for reduction of Listeria monocytogenes contamination on food raw materials[J]. LWT, 2021, 140: 110699. DOI:10.1016/j.lwt.2020.110699 |
| [17] |
HINTON JR A, NORTHCUTT J K, SMITH D P, et al. Spoilage microflora of broiler carcasses washed with electrolyzed oxidizing or chlorinated water using an inside-outside bird washer[J]. Poultry Science, 2007, 86(1): 123-127. DOI:10.1093/ps/86.1.123 |
| [18] |
TAN L, ZHAO F, HAN Q, et al. High correlation between structure development and chemical variation during biofilm formation by Vibrio parahaemolyticus[J]. Frontiers in Microbiology, 2018, 9: 1881. DOI:10.3389/fmicb.2018.01881 |
| [19] |
FOLSOM J P, FRANK J F. Chlorine resistance of Listeria monocytogenes biofilms and relationship to subtype, cell density, and planktonic cell chlorine resistance[J]. Journal of Food Protection, 2006, 69(6): 1292-1296. DOI:10.4315/0362-028X-69.6.1292 |
| [20] |
KOO H, FALSETTA M L, KLEIN M I. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm[J]. Journal of Dental Research, 2013, 92(12): 1065-1073. DOI:10.1177/0022034513504218 |
| [21] |
BEYENAL H, DONOVAN C, LEWANDOWSKI Z, et al. Three-dimensional biofilm structure quantification[J]. Journal of Microbiological Methods, 2004, 59(3): 395-413. DOI:10.1016/j.mimet.2004.08.003 |
| [22] |
BEYENAL H, LEWANDOWSKI Z, HARKIN G. Quantifying biofilm structure: facts and fiction[J]. Biofouling, 2004, 20(1): 1-23. DOI:10.1080/0892701042000191628 |
| [23] |
BRIDIER A, DUBOIS-BRISSONNET F, BOUBETRA A, et al. The biofilm architecture of sixty opportunistic pathogens deciphered using a high throughput CLSM method[J]. Journal of Microbiological Methods, 2010, 82(1): 64-70. DOI:10.1016/j.mimet.2010.04.006 |
| [24] |
MURRAY E J, KILEY T B, STANLEY-WALL N R. A pivotal role for the response regulator DegU in controlling multicellular behaviour[J]. Microbiology, 2009, 155(1): 1-8. DOI:10.1099/mic.0.023903-0 |
| [25] |
PIETA L, GARCIA F B, RIBOLDI G P, et al. Transcriptional analysis of genes related to biofilm formation, stress-response, and virulence in Listeria monocytogenes strains grown at different temperatures[J]. Annals of Microbiology, 2014, 64(4): 1707-1714. DOI:10.1007/s13213-014-0814-2 |
| [26] |
SHI C, WU Y Y, FANG D L, et al. Effect of nanocomposite packaging on postharvest senescence of Flammulina velutipes[J]. Food Chemistry, 2018, 246: 414-421. DOI:10.1016/j.foodchem.2017.10.103 |
| [27] |
OZ A T, ULUKANLI Z, BOZOK F, et al. The postharvest quality, sensory and shelf life of Agaricus Bisporus in active map[J]. Journal of Food Processing and Preservation, 2015, 39(1): 100-106. DOI:10.1111/jfpp.12301 |
| [28] |
SHAPERO M, NELSON D A, LABUZA T P. Ethanol inhibition of staphylococcus aureus at limited water activity[J]. Journal of Food Science, 1978, 43(5): 1467-1469. DOI:10.1111/j.1365-2621.1978.tb02520.x |
| [29] |
刘青, 申雨苗, 张瑶, 等. 臭氧处理对金针菇保鲜效果的影响[J]. 食品工业科技, 2019, 40(17): 280-284. LIU Q, SHEN Y M, ZHANG Y, et al. Effects of ozone treatment on preservation effect of Flammulian velutipes[J]. Science and Technology of Food Industry, 2019, 40(17): 280-284. DOI:10.13386/j.issn1002-0306.2019.17.046 |
| [30] |
ARES G, PARENTELLI C, GáMBARO A, et al. Sensory shelf life of shiitake mushrooms stored under passive modified atmosphere[J]. Postharvest Biology and Technology, 2006, 41(2): 191-197. DOI:10.1016/j.postharvbio.2006.03.013 |
| [31] |
MILES P G, CHANG S T. Mushrooms: cultivation, nutritional value, medicinal effect, and environmental impact[M]. Baton Rouge: CRC Press, 2004: 480.
|
| [32] |
许愈, 张昭寰, 赵莉, 等. 应用酸性电解水联合超声波杀灭副溶血性弧菌[J]. 上海海洋大学学报, 2020, 29(4): 578-584. XU Y, ZHANG Z H, ZHAO L, et al. Combination of acidic electrolyzed water with ultrasonic for killing Vibrio parahaemolyticus[J]. Journal of Shanghai Ocean University, 2020, 29(4): 578-584. |
| [33] |
齐家伟, 董旭日, 柴旭锋, 等. 不同振动模式对副溶血性弧菌生物被膜形成的影响[J]. 上海海洋大学学报, 2020, 29(6): 950-960. QI J W, DONG X R, CHAI X F, et al. Effects of different vibration modes on Vibrio parahaemolyticus biofilm[J]. Journal of Shanghai Ocean University, 2020, 29(6): 950-960. |
2. Collaborative Innovation Center of Seafood Deep Processing, Dalian Polytechnic University, Dalian 116034, Liaoning, China;
3. Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China;
4. Laboratory of Quality & Safety Risk Assessment for Aquatic Product on Storage and Preservation, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
5. Engineering Research Center of Food Thermal-processing Technology, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


