2. 上海海洋大学 上海市水产养殖工程技术研究中心, 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
日本沼虾(Macrobranchium nipponense),俗称青虾、河虾,隶属甲壳纲(Crustacea)十足目(Decapoda),主要分布在中国、日本以及东南亚等国家[1]。日本沼虾具有生长快、繁殖能力强和肉质细嫩的优点,从而具有较高的经济价值[2]。在池塘养殖中日本沼虾雌虾性早熟现象较普遍,有的个体甚至在孵化后约45 d、体长不足3 cm时便开始抱卵[3]。甲壳动物过早的性腺成熟不仅会使其寿命减短[4],同时还会使其生产效益下降。随着养殖集约化程度和遗传育种技术的不断提高,环境因素对水产动物表型的作用也越来越明显[5]。因此,了解水产动物特定环境下的生长、发育及繁殖性能,对品种的遗传改良和提高生产效益等具有重要的现实意义[6-7]。
甲壳动物的生长、发育及繁殖性能主要受营养和环境两个方面影响[8]。甲壳动物通过其内源性机制调节以适应外界环境的变化从而完成其发育及生殖[9-10]。有关营养物质如蛋白质[11]、脂质[12]、碳水化合物[13]、维生素[14]以及矿物质[15]等对日本沼虾生长繁殖性能的研究已有较多报道,而环境因子对其生长繁殖性能的影响缺少较为深入的研究。现有的研究表明,温度是影响虾类生长、发育和繁殖的重要环境因素之一。温度影响红螯螯虾(Cherax quadricarinatus)的抱卵和孵化[16],也影响中国明对虾(Fenneropenaeus chinensis)的产卵[17]。温度影响日本沼虾幼虾的生长、ATPase活性已见报道[18],马盛群等[19]将日本沼虾的末期幼体转移到不同温度的水体中,发现不同温度水体中末期幼体的变态有差异;然而该研究尚不能确定这种差异是温度变化的结果还是不同温度下的结果、是否只在末期幼体出现。另外,刚孵化出的溞状幼体的发育温度是否影响成体的繁殖性能也未见报道。本文研究了21 ℃,26 ℃及31 ℃等3种温度条件下日本沼虾溞状幼体发育和成体繁殖性能,以期为后续开展日本沼虾高效人工育苗提供理论基础,也可为后续开展生殖调控奠定基础。
1 材料与方法 1.1 亲本选择本研究所选择的日本沼虾亲本为来自本实验室构建的日本沼虾单系内同胞近交繁殖得到的F2群体,从F2群体中选择雌雄个体一一配对后繁殖得到的溞状幼体(F3)用于本研究。
1.2 实验设计将刚孵化出来的日本沼虾溞状幼体转移到12个含900 mL盐度10[20]的人工半咸水的1 L烧杯中培养,每个烧杯放养50尾溞状幼体,将烧杯分别放入三温区光照培养箱。设定3个温度处理组)[(31.0±0.5)℃,(26.0±0.5) ℃,(21.0±0.5 ℃)],每个温度处理组设4个重复,其中1个重复用于过程采样。幼体培育期间控制光周期(L∶ D)14∶ 10,光照强度1 500 lx,连续微充气,每日早晚投喂足量初孵卤虫无节幼体。当溞状幼体完全变态为仔虾并具备平游能力时,将完全变态的仔虾转移到小型玻璃缸(30 cm×30 cm×30 cm)中,养殖用水改为曝气后的自来水,放在相同的温度下继续培养至90 d。玻璃缸内投放一定量的水草供仔虾攀附。仔虾和亲本养殖过程中投喂足量的人工配合饲料(粗蛋白质:38.0%±0.5%、粗脂肪:5.0%±0.5%、粗灰分:16.0%±0.2%、粗纤维:6.0%±0.2%、水分:12.0%±0.6%)。养殖期间,每2天换水1次,每次换水1/3。
1.3 样品采集及观测培育期间,每10 d及变态完成时从各温度处理组的特定重复内随机取3尾幼体观测并测量其生长参数,并记录幼体变态为仔虾、幼虾性成熟抱卵的时间,统计在不同温度下日本沼虾雌虾首次抱卵的抱卵量及规格,并将卵按照组别收集用于有关营养成分的测定。
养殖90 d后,停止投喂24 h,逐个平行组称重、计数。然后从每个平行组中挑取腹部无卵的5尾雌虾在冰盘上快速解剖肝胰腺,保存在2 mL的离心管中,立即放入液氮速冻后于-80 ℃冰箱保存,用于相关指标的测定。生长指标如下:
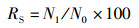 (1)
(1)
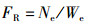 (2)
(2)
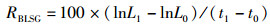 (3)
(3)
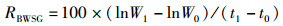 (4)
(4)
式中:RS为存活率, %;N0为试验开始时平行组中的放养个体数;N1为试验结束后平行组中存活数;FR为相对繁殖力; Ne为抱卵虾受精卵数量;We为抱卵虾的单位体质量, g;RBLSG为体长特定生长率, %;RBWSG为体质量特定生长率, %;L0、L1分别为实验初始和终末体长,mm; W0、W1分别为实验初始和终末体质量,g。
1.4 样品的检测分析 1.4.1 酶活性的测定精确称取保存在-80 ℃的肝胰腺组织样品装于1.5 mL的离心管中,加入0.85%预冷4 ℃灭菌生理盐水,根据质量体积1∶ 9制成10%的组织匀浆液,冰水浴匀浆处理,匀浆液于3 000 r/min,4 ℃离心10 min,取上清液用于测定消化酶活性。肝胰腺脂肪酶活性采用对硝基苯酚法[5],蛋白酶活性参照SU等[21]方法测定,淀粉酶活性采用淀粉-碘比色法(南京建成试剂盒),匀浆液蛋白含量测定采用考马斯亮蓝法(南京建成试剂盒)。
1.4.2 日本沼虾受精卵相关营养组成的测定将各温度组收集的受精卵进行营养组分分析。水分的测定采用105 ℃烘箱干燥法[15];蛋白质含量采用考马斯亮蓝法;总脂采用氯仿-甲醇法[22]。
1.5 数据处理和统计分析所有数据以平均值±标准差(Mean ± SD)表示,数据使用SPASS Statistics 18.0软件中的单因素方法分析(One-Way ANOVA)和Duncan氏多重比较进行各组实验数据的差异显著性分析,两两比较则选用独立样本t检验进行各组实验数据的差异显著性分析,P < 0.05则表示为差异显著。
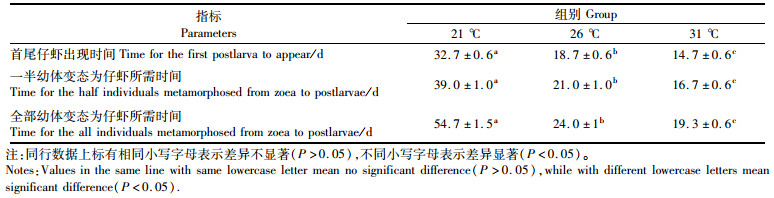
2 结果与分析 2.1 温度对日本沼虾溞状幼体变态发育的影响 2.1.1 溞状幼体变态所需的时间温度显著影响日本沼虾溞状幼体变态发育速度(表 1)。在31、26及21 ℃条件下日本沼虾完全变态时间平均分别为19.3、24.0以及54.7 d,在21 ℃条件下幼体变态所需要的时间显著高于其他两个温度组(P < 0.05);同时,各温度下幼体出现仔虾到全部变态为仔虾所经历的时间也不相同,在31、26及21 ℃条件下分别需要4.6、5.3和22.0 d。结果表明,温度升高能够加快日本沼虾幼体的变态速度和变态同步性。
|
表 1 不同温度下日本沼虾溞状幼体变态成仔虾需要的时间 Tab.1 Metamorphosis time of M. nipponense larvae from zoea to postlarvae at different temperatures |
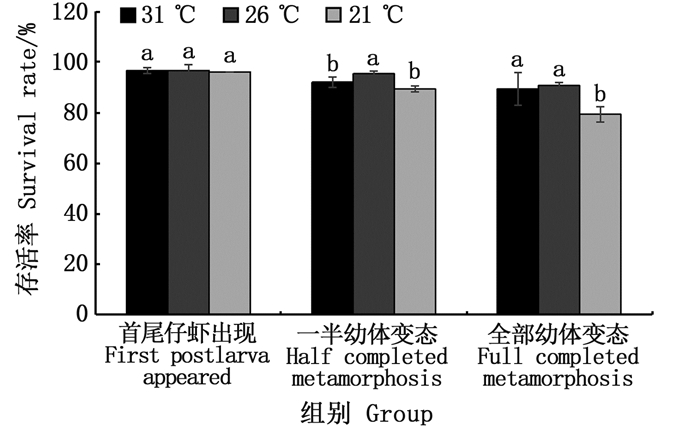
日本沼虾溞状幼体在出现仔虾前,温度对溞状幼体存活率无显著性影响(P > 0.05)(图 1),而当各试验组的溞状幼体全部变态为仔虾后,26 ℃试验组的存活率要高于31 ℃和21 ℃试验组,且与21 ℃试验组差异显著(P < 0.05),表明温度不影响溞状幼体在变态成仔虾前的存活率,而影响其在变态为仔虾过程中的存活率。
|
相同小写字母表示差异不显著(P > 0.05),不同小写字母表示差异显著(P < 0.05)。 Values with same lowercase letters mean no significant difference(P > 0.05), while with different lowercase letters mean significant difference(P < 0.05). 图 1 不同温度对日本沼虾溞状幼体存活率的影响 Fig. 1 Effects of temperature on survival rate of M. nipponense from zoea to postlarvae |
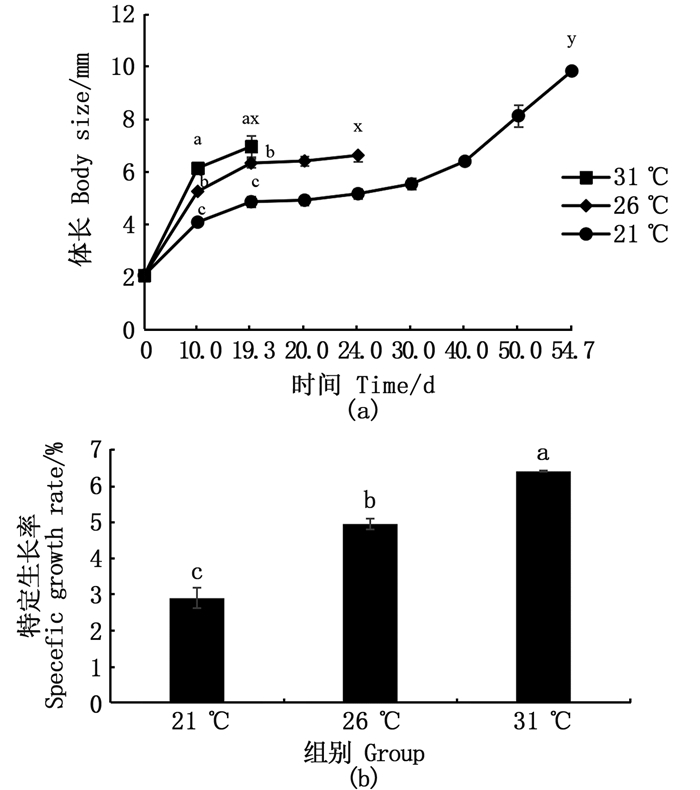
温度显著影响日本沼虾溞状幼体的个体生长(图 2)。在相同时间点,溞状幼体的大小与温度呈正相关,温度越高,个体越大。而当3个温度的溞状幼体分别变态成Ⅰ期仔虾时,21 ℃组仔虾平均体长[(9.84±0.08)mm]显著高于31 ℃组[(6.95±0.41)mm]及26 ℃组[(6.61±0.24)mm][图 2(a)]。随着温度的升高,溞状幼体的特定生长率越高[图 2(b)]。
|
a、b、c表示同一时间不同温度条件下的显著性比较,x、y表示完全部变态为仔虾时显著性比较,其中相同小写字母表示差异不显著(P > 0.05),不同小写字母表示差异显著(P < 0.05)。 Values with a, b, c represent a significant comparison when the zoea under different temperature at the same time, while x, y represent all individuals metamorphosed from zoea to postlarvae, same lowercase letter mean no significant difference(P > 0.05)different lowercase letters mean significant difference(P < 0.05). 图 2 不同温度对日本沼虾溞状幼体体长及体长特定生长率的影响 Fig. 2 Effects of temperature on body size and specific growth rate of M.nipponense zoea |
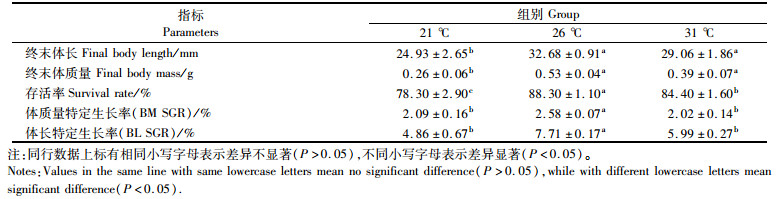
温度显著影响日本沼虾的生长(表 2)。试验周期结束后,26 ℃组日本沼虾的终末体长、体质量、存活率及特定生长率均最高。除存活率外,21 ℃试验组和31 ℃试验组在终末体长、体质量及特定生长率无显著性差异但存活率显著低于21 ℃试验组(P < 0.05)。
|
表 2 温度对日本沼虾生长性能的影响 Tab.2 Effects of temperature on growth performances of M.nipponense postlarvae in 90-day breeding |
随着温度的升高,日本沼虾肝胰腺中淀粉酶活性降低(P < 0.05),而脂肪酶及蛋白酶活力随着温度的升高呈先上升后下降趋势,在26 ℃时其蛋白酶及脂肪酶活力均达到最高。见表 3。
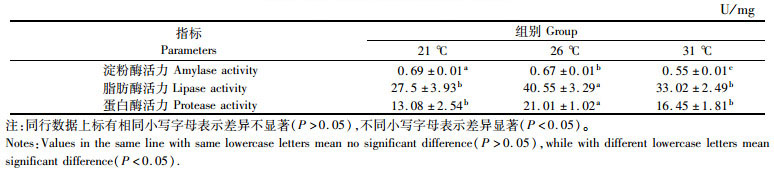
|
表 3 温度对日本沼虾肝胰腺消化酶的影响 Tab.3 Effects of temperature on digesstive enzyme activities in hepatopancreas of M. nipponense after 90-day breeding |
温度对日本沼虾的繁殖性能产生影响(图 3)。随着温度的升高,日本沼虾首次抱卵时间缩短,在31 ℃和26 ℃试验组,日本沼虾抱卵分别需要56.67 d及73.33 d,而21 ℃实验组在试验周期结束后也并未出现抱卵现象[图 3(a)]。与此同时, 26 ℃组中日本沼虾的首次抱卵量显著高于31 ℃试验组(P < 0.05),日本沼虾在31 ℃、26 ℃试验组抱卵量分别为294.94粒和416.67粒[图 3(b)],而相对繁殖力却无显著性差异(P > 0.05)[图 3(c)]。
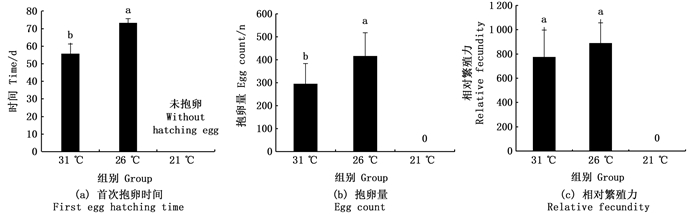
|
注:相同小写字母表示差异不显著(P > 0.05),不同小写字母表示差异显著(P < 0.05)。 Notes: Values with same lowercase letter mean no significant difference(P > 0.05), while with different lowercase letters mean significant difference(P < 0.05). 图 3 不同温度对日本沼虾繁殖性能的影响 Fig. 3 Effects of temperature on reproductive performances of M. nipponense in 90-day breeding |
31 ℃试验组日本沼虾受精卵中水分含量显著高于其在26 ℃试验组(P < 0.05),而总脂以及总蛋白含量在26 ℃试验组中最高且差异显著(P < 0.05)。见表 4。

|
表 4 温度对日本沼虾受精卵常规营养组成的影响 Tab.4 Nutritional composition for M. nipponense at various temperatures after 90-day breeding |
对于变温水生动物,周围环境温度的变化会显著影响其代谢水平和生理状况[23]。JESUSP等[24]研究表明,在一定温度范围内,随着温度升高,南美白对虾(Penaeus vannamei)幼体体长越大,增长率越高。此现象在藻钩虾(Ampithoe valida)[25]、克氏原螯虾(Procambarus clarkii)[26]等的研究中也有相关报道。这与本研究结果相一致。然而,21 ℃组日本沼虾溞状幼体全部变态为仔虾时的平均体长要显著高于其他两个温度组,而试验周期结束时又显著低于其他两个温度组。李青等[27]研究表明,当温度过高时,甲壳动物体内的营养物质的代谢率要高于其同化率,不能够积累足够的能量用于生长,导致生长受限,因此,在低温条件下日本沼虾溞状幼体完全变态成仔虾时的体长要高于高温组,而在试验周期结束后由于日本沼虾在21 ℃组摄食能力降低导致发育速度迟缓,最终导致规格最小。然而,WANG等[18]研究表明,随着驯化温度的降低,日本沼虾幼体的存活率显著提高,这可能与其驯化过程中高温组温度突变过大引起应激反应有关。
3.2 温度对日本沼虾消化酶活性的影响肝胰腺是重要的消化器官,能够产生消化酶来促进物质的消化吸收[28-29]。因此,肝胰腺中消化酶的活性高低可以反映动物对营养物质的消化与吸收的能力从而影响动物的生长[30]。本实验结果表明,肝胰腺中脂肪酶及蛋白酶活性在26 ℃试验组中均要高于其他两个试验组,这表明在26℃条件下,日本沼虾对营养物质的消化能力要高于其他两个温度组,从而更有利于将食物转化为能量储存在体内,加之高温组新陈代谢的消耗增大,低温组发育迟缓,最终导致规格最大。薛素燕等[31]研究表明,不同消化酶活性的差别可以直接反应动物对不同营养物质吸收利用的能力,在动物发育过程中其食性一般是由植食性或偏植食性向肉食性或偏肉食性转换的过程,其中伴随着淀粉酶活性的降低和蛋白酶活性的增加的规律。本实验中,21℃试验组的日本沼虾肝胰腺中脂肪酶和蛋白酶活性均最低,但淀粉酶活性却最显著高于其他两个试验组,因此温度是否会对日本沼虾食性产生影响的结论还需要进一步地研究证明。
3.3 温度对日本沼虾性成熟及繁殖性能的影响性腺的成熟与产卵的时间取决于有效温度的积累,因此温度对水生生物的性腺发育有着重要作用[32-33],如冬季加温可加快克氏原鳌虾性腺成熟,刺激雌虾提前抱卵[34]。本研究结果表明,与26 ℃条件下生长的日本沼虾相比,31 ℃组的日本沼虾首次抱卵时间提前了17 d,而21 ℃组的日本沼虾在试验周期结束后依旧没有出现抱卵现象。因此,高温虽能够加快日本沼虾的生长速度,但过高的温度会缩短日本沼虾的性成熟时间,使其提前抱卵。
温度对日本沼虾繁殖性能的研究目前还未见相关报道。甲壳动物在发育过程中,其生殖系统受多种激素的调控,这些激素水平会随着外界环境的变化而不断调整从而使其在最佳的环境条件下进行生殖[27],温度作为重要的环境因子能够调控这些激素的合成和分泌水平进而影响甲壳动物的生殖过程[30],因此许多生物包括甲壳动物在内,其繁殖能力随着温度的变化而发生改变[32]。抱卵量被认为是评估虾类繁殖性能的重要参数[33]。本研究表明,在31 ℃条件下日本沼虾的抱卵量要显著低于26 ℃实验组,这可能是由于在较高的温度条件下,个体的代谢所消耗的能量增加导致分配给繁殖的能量减少[34]。因此,在一般情况下夏季产卵量也要少于冬季的产卵量,然而他们的相对繁殖力却无差异,笔者认为造成此现象可能是由于26 ℃试验组日本沼虾规格高,而规格的大小直接影响其相对繁殖力从而使得日本沼虾在26 ℃的相对繁殖力与31 ℃试验组无差异。除了规格使得26 ℃试验组的抱卵量多的原因外,对于大多数水产动物而言,性成熟的个体繁殖需要从性腺的发育以及机体的生长过程中吸收一定的能量[35],因此产卵量的多少还受到雌虾所分配给繁殖的能量限制[36]。卵黄的营养状况主要由卵巢提供,这一过程对甲壳类动物卵的质量及产量均有显著性的影响[37],因此,受精卵的营养水平可以用来衡量亲本在繁殖中所获得的能量的多少从而影响其繁殖性能[38]。
| [1] |
FU H T, JIANG S F, XIONG Y W. Current status and prospects of farming the giant river prawn (Macrobrachium rosenbergii) and the oriental river prawn (Macrobrachium nipponense) in China[J]. Aquaculture Research, 2012, 43(7): 993-998. DOI:10.1111/j.1365-2109.2011.03085.x |
| [2] |
GU X Z, FU H T, SUN S M, et al. Effects of cholesterol on growth, feed utilization, body composition and immune parameters in juvenile oriental river prawn, Macrobrachium nipponense (De Haan)[J]. Aquaculture Research, 2017, 48(8): 4262-4271. DOI:10.1111/are.13247 |
| [3] |
QIAO H, XIONG Y W, ZHANG W Y, et al. Characterization, expression, and function analysis of gonad-inhibiting hormone in Oriental River prawn, Macrobrachium nipponense and itsinduced expression by temperature[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2015, 185: 1-8. |
| [4] |
JIN G, LI Z, XIE P. The growth patterns of juvenile and precocious Chinese mitten crabs, Eriocheir sinensis (Decapoda, Grapsidae), stocked in freshwater lakes of China[J]. Crustaceana, 2001, 74(3): 261-273. DOI:10.1163/156854001505505 |
| [5] |
WANG W L, ISHIKAWA M, KOSHIO S, et al. Effects of dietary astaxanthin supplementation on juvenile kuruma shrimp, Marsupenaeus japonicus[J]. Aquaculture, 2018, 491: 197-204. DOI:10.1016/j.aquaculture.2018.03.025 |
| [6] |
CHANDLER J C, AIZEN J, FITZGIBBON Q P, et al. Applying the power of transcriptomics: understanding male sexual development in decapod Crustacea[J]. Integrative and Comparative Biology, 2016, 56(6): 1144-1156. DOI:10.1093/icb/icw007 |
| [7] |
JUNG H, YOON B H, KIM W J, et al. Optimizing hybrid de Novo transcriptome assembly and extending genomic resources for giant freshwater prawns (Macrobrachium rosenbergii): the identification of genes and markers associated with reproduction[J]. International Journal of Molecular Sciences, 2016, 17(5): 690. DOI:10.3390/ijms17050690 |
| [8] |
王琪雯. 饲料营养水平对动物繁殖性能的影响[J]. 山西农经, 2020(10): 133-134. WANG Q W. The effect of feed nutrition level on animal reproduction performance[J]. Shanxi Agricultural Economy, 2020(10): 133-134. |
| [9] |
JACKSON C J, WANG Y G. Modelling growth rate of Penaeus monodon Fabricius in intensively managed ponds: effects of temperature, pond age and stocking density[J]. Aquaculture Research, 1998, 29(1): 27-36. DOI:10.1111/j.1365-2109.1998.tb01358.x |
| [10] |
BROWDY C L. Recent developments in penaeid broodstock and seed production technologies: improving the outlook for superior captive stocks[J]. Aquaculture, 1998, 164(1/4): 3-21. |
| [11] |
丁志丽, 张易祥, 叶金云, 等. 鱼粉蛋白与发酵酶解豆粕蛋白不同配比对日本沼虾生长及免疫性能的影响[J]. 动物营养学报, 2015, 27(1): 154-164. DING Z L, ZHANG Y X, YE J Y, et al. Effects of different protein ratios of fish meal to fermented and enzymolysis soybean meal on growth and immune performance of Oriental River Prawn (Macrobrachium nipponense)[J]. Chinese Journal of Animal Nutrition, 2015, 27(1): 154-164. DOI:10.3969/j.issn.1006-267x.2015.01.019 |
| [12] |
LI L Q, WANG W L, YUSUF A, et al. Effects of dietary lipid levels on the growth, fatty acid profile and fecundity in the oriental river prawn, Macrobrachium nipponense[J]. Aquaculture Research, 2020, 51(5): 1893-1902. DOI:10.1111/are.14539 |
| [13] |
刘存歧, 王军静, 王军霞, 等. 饥饿时间对日本沼虾能源物质利用和能量收支的影响[J]. 河北大学学报(自然科学版), 2010, 30(6): 706-710. LIU C Q, WANG J J, WANG J X, et al. Effects of starvation time on utilization of energy materials and energy budget of Macrobrachium nipponense[J]. Journal of Hebei University (Natural Science Edition), 2010, 30(6): 706-710. DOI:10.3969/j.issn.1000-1565.2010.06.020 |
| [14] |
LI Y M, FAN B, HUANG Y H, et al. Effects of dietary vitamin E on reproductive performance and antioxidant capacity of Macrobrachium nipponense female shrimp[J]. Aquaculture Nutrition, 2018, 24(6): 1698-1708. DOI:10.1111/anu.12804 |
| [15] |
王维娜, 王安利, 孙儒泳. 水环境中的铜锌铁钴离子对日本沼虾消化酶和碱性磷酸酶的影响[J]. 动物学报, 2001, 47(S1): 72-77. WANG W N, WANG A L, SUN R Y. Effects of Cu2+, Zn2+, Fe3+ and Co2+ in freshwater on digestive enzyme and alkaline phosphatase activity of Macrobrachium nipponense[J]. Acta Zoologica Sinica, 2001, 47(S1): 72-77. |
| [16] |
李进, 温海深. 温度对红螯螯虾抱卵率和孵化的影响[J]. 现代农业科学, 2009, 16(4): 193-194, 196. LI J, WEN H S. Effects of temperature on holding egg rate and hatch in Cherax quadricarinatus[J]. Modern Agricultural Sciences, 2009, 16(4): 193-194, 196. |
| [17] |
李明云. 温度对中国对虾(Penaeus orientalis)越冬亲虾性腺发育与存活率的影响[J]. 生态学报, 1995, 15(4): 378-384. LI M Y. Effects of temperature on the gonad development and survival rate of parent prawn Penaeus orientalis[J]. Acta Ecologica Sinica, 1995, 15(4): 378-384. DOI:10.3321/j.issn:1000-0933.1995.04.006 |
| [18] |
WANG W N, WANG A L, LIU Y, et al. Effects of temperature on growth, adenosine phosphates, ATPase and cellular defense response of juvenile shrimp Macrobrachium nipponense[J]. Aquaculture, 2006, 256(1/4): 624-630. |
| [19] |
马盛群, 李爱顺, 茆建强, 等. 温度对日本沼虾末期幼体变态发育的影响[J]. 江苏农业科学, 2014, 42(8): 239-240. MA S Q, LI A S, MAO J Q, et al. The effect of temperature on the metamorphic development of the larvae of Macrobrachium nipponense[J]. Jiangsu Agricultural Sciences, 2014, 42(8): 239-240. DOI:10.3969/j.issn.1002-1302.2014.08.087 |
| [20] |
邢克智, 刘茂春, 王金华. 温度、盐度对青虾幼体生长发育的影响[J]. 南开大学学报(自然科学版), 1997, 30(3): 88-93, 105. XING K Z, LIU M C, WANG J H. Effect of temperature-salinity on growth and development of the larvae of Macrobrachium nipponense[J]. Acta Scientiarum Naturalium Universitatis Nankaiensis, 1997, 30(3): 88-93, 105. |
| [21] |
SU X G, LI X Q, LENG X J, et al. The improvement of growth, digestive enzyme activity and disease resistance of white shrimp by the dietary citric acid[J]. Aquaculture International, 2014, 22(6): 1823-1835. DOI:10.1007/s10499-014-9785-3 |
| [22] |
HUANG X X, FENG L F, WEN W, et al. The changes in lipid and fatty acid profiles of devil stinger Inimicus japonicas during the development of embryo and yolk-sac larvae[J]. Journal of Fisheries of China, 2013, 37(4): 526-535. DOI:10.3724/SP.J.1231.2013.38335 |
| [23] |
朱孟凯, 姚翠鸾. 温度胁迫对凡纳滨对虾肝胰腺氧代谢及能量代谢的影响[J]. 水产学报, 2015, 39(5): 669-678. ZHU M K, YAO C L. The impact of temperature stress on the oxygen metabolism and energy metabolism in the hepatopancreas of shrimp Litopenaeus vannamei[J]. Journal of Fisheries of China, 2015, 39(5): 669-678. |
| [24] |
JESUSP P, CARLOS A, LINDSAY G R. The effects of salinity andtemperature on the growth and survival rates of juvenile whiteshrimp, Penaeus vannamei, Boone, 1931[J]. Aquaculture, 1997, 157(1/2): 107-115. |
| [25] |
PARDAL M A, MARQUES J C, METELO I, et al. Impact of eutrophication on the life cycle, population dynamics and production of Ampitho evalida (Amphipoda) along an estuarine spatial gradient (Mondego estuary, Portugal)[J]. Marine Ecology Progress Series, 2000, 196: 207-219. DOI:10.3354/meps196207 |
| [26] |
张龙岗, 钟君伟, 朱永安. 温度对克氏原螯虾苗种生长和存活的影响[J]. 河北渔业, 2015(1): 4-5. ZHANG L G, ZHONG J W, ZHU Y A. The effect of temperature on the growth and survival of Procambarus clarkii[J]. Hebei Fisheries, 2015(1): 4-5. DOI:10.3969/j.issn.1004-6755.2015.01.002 |
| [27] |
李青, 陈永祥. 温度对虾蟹生长发育影响的研究进展[J]. 江苏农业科学, 2019, 47(10): 26-31. LI Q, CHEN Y X. Research progress of effects of temperature on growth and development of shrimp and crab[J]. Jiangsu Agricultural Sciences, 2019, 47(10): 26-31. |
| [28] |
周丰林, 陶丽竹, 王安琪, 等. 养殖青鱼组织状态评估及肠道消化酶和抗氧化酶分布特征[J]. 上海海洋大学学报, 2021, 30(2): 205-213. ZHOU F L, TAO L Z, WANG A Q, et al. Evaluation of tissue status of cultured black carp and distribution characteristics of digestive enzyme and antioxidant enzyme in the intestine[J]. Journal of Shanghai Ocean University, 2021, 30(2): 205-213. |
| [29] |
肖英平, 吴志强, 胡向萍, 等. 克氏原螯虾幼体发育时期消化酶活力及氨基酸含量研究[J]. 淡水渔业, 2009, 39(1): 41-44. XIAO Y P, WU Z Q, HU X P, et al. Study on digestive enzyme activities and the contents of Amino Acid during the larval development of Procambarus clarkii[J]. Freshwater Fisheries, 2009, 39(1): 41-44. DOI:10.3969/j.issn.1000-6907.2009.01.008 |
| [30] |
袁新程, 谢永德, 刘永士, 等. 两种养殖密度对刀鲚当年鱼种生长性能、消化及非特异性免疫能力的影响[J]. 上海海洋大学学报, 2021, 30(2): 222-230. YUAN X C, XIE Y D, LIU Y S, et al. Effects of two stocking densities on growth performance, digestion and non-specific immunity of the current year Coilia nasus[J]. Journal of Shanghai Ocean University, 2021, 30(2): 222-230. |
| [31] |
薛素燕, 毛玉泽, 赵法箴, 等. 温度对中华原钩虾(Eogammarus possjeticus)摄食率和消化酶活力的影响[J]. 渔业科学进展, 2015, 36(4): 94-98. XUE S Y, MAO Y Z, ZHAO F Z, et al. Effects of temperature on the feeding rate and the digestive enzymes activities of Eogammarus possjeticus[J]. Progress in Fishery Sciences, 2015, 36(4): 94-98. |
| [32] |
DING Z L, CHEN L Q, DU Z Y, et al. A mixture of fish oil and soybean oil as a dietary lipid source prevents precocity and promotes growth in juvenile Macrobrachium nipponense(De Haan)[J]. Aquaculture Research, 2014, 45(9): 1567-1572. DOI:10.1111/are.12088 |
| [33] |
XUE S Y, FANG J G, ZHANG J H, et al. Effects of temperature and salinity on the development of the amphipod crustacean Eogammarus sinensis[J]. Chinese Journal of Oceanology and Limnology, 2013, 31(5): 1010-1017. DOI:10.1007/s00343-013-2302-0 |
| [34] |
MARANHAO P, MARQUES J C. The influence of temperature and salinity on the duration of embryonic development, fecundity and growth of the amphipod Echinogammarus marinus Leach (Gammaridae)[J]. ActaOecologica, 2003, 24(1): 5-13. |
| [35] |
SAINTE-MARIEB. A review of the reproductive bionomics of aquatic gammaridean amphipods: variation of life history traits with latitude, depth, salinity and superfamily[J]. Hydrobiologia, 1991, 223(1): 189-227. DOI:10.1007/BF00047641 |
| [36] |
CHAI Y M, YU S S, ZHAO X F, et al. Comparative proteomic profiles of the hepatopancreas in Fenneropenaeus chinensis response to white spot syndrome virus[J]. Fish & Shellfish Immunology, 2010, 29(3): 480-486. |
| [37] |
DA SILVA DE MORAISI, REISV R, DE ALMEIDAF L. The influence of the water pH on the sex ratio of tambaqui Colossoma macropomum (CUVIER, 1818)[J]. Aquaculture Reports, 2020, 17: 100334. DOI:10.1016/j.aqrep.2020.100334 |
| [38] |
OLLIVAUX C, VINH J, SOYEZ D, et al. Crustacean hyperglycemic and vitellogenesis-inhibiting hormones in the lobster Homarus gammarus[J]. The FEBS Journal, 2006, 273(10): 2151-2160. DOI:10.1111/j.1742-4658.2006.05228.x |
2. Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


