2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306;
3. 农业农村部水产品贮藏保鲜质量安全风险评估实验室, 上海 201306
随着经济的发展,生活水平的不断提升,人们对食品质量和安全的要求逐渐提高。肺炎克雷伯氏菌(Klebsiella pneumoniae)是一类广泛存在于生鲜蔬菜、奶粉、鱼类和肉类中的食源性致病菌,可引起腹痛、腹泻、呕吐等食物中毒症状以及肺炎、尿路感染、肝脓肿和菌血症等疾病[1-2]。此外,肺炎克雷伯氏菌感染引起的奶牛乳腺炎会严重降低牛奶的产量和品质,给奶业生产造成了巨大的经济损失[3]。抗生素是防治奶牛乳腺炎的重要抗菌药物,但是长期和过量使用抗生素会导致肺炎克雷伯氏菌产生多重耐药性(multidrug-resistant,MDR)、抗生素的治疗效果变差,还会导致抗生素在乳品中残留,影响食品安全,对全球人类的生命健康造成了严重的威胁[4]。在美国,每年因食源性致病菌引起的感染人数为20万人,其中肺炎克雷伯氏菌感染人数占20%[5]。中国细菌耐药性监测网(CHINET)数据表明,2005—2020年肺炎克雷伯氏菌对被称为“最后一道防线”的碳青霉烯类抗生素的耐药水平呈现递增趋势。肺炎克雷伯氏菌对亚胺培南的耐药率从3.0%增长至26.4%,对美罗培南的耐药率从2.9%上升至28.0% [6]。目前,抗生素仍然是治疗肺炎克雷伯氏菌感染的首选药物,然而开发新型抗生素周期长、难度大、成本高,迄今为止,成功研发出新型抗生素这一目标还远未实现。因此,恢复或增强MDR肺炎克雷伯氏菌对现有抗生素的敏感性是控制食源性致病菌耐药性持续发展的有效措施。
天然产物具有抗氧化、抗炎、抗菌等生物活性,还具有不易产生耐药性、低毒无残留等优点[7-8]。研究[9-10]表明,天然产物与抗生素联合使用是消减食源性致病菌耐药性的有效策略之一,可减少抗菌剂的使用剂量,降低抗生素的残留和潜在的毒副作用,在一定程度上满足了人类对高质量、安全的食品追求。MAISURIA等[11]报道了蔓越莓原花青素与四环素联合使用能提高MDR大肠杆菌对四环素的敏感性。DHARA等[12]研究表明肉桂醛与头孢噻肟联合应用能增强MDR肺炎克雷伯氏菌对头孢噻肟的敏感性。K ĘPA等[13]研究表明咖啡酸与抗生素(红霉素、克林霉素和头孢西丁)合用可增强MDR金黄色葡萄球菌对抗生素的敏感性。由此可知,联合疗法在提高多重耐药菌对抗生素的敏感性方面具有广阔的应用前景。
因此,本研究检测了肺炎克雷伯氏菌对8大类共8种抗生素的耐药性,探究了3种天然产物(花青素、咖啡酸和肉桂醛)与抗生素联合使用对肺炎克雷伯氏菌的协同抗菌作用,并筛选出能增强多重耐药肺炎克雷伯氏菌对抗生素敏感性的天然产物,为天然产物在消减肺炎克雷伯氏菌耐药性的应用提供了理论依据。
1 材料与方法 1.1 试验材料 1.1.1 主要试验材料蓝莓购自杭州市余杭区仙宅村蓝莓种植基地,贮存于-80 ℃冰箱; 咖啡酸(纯度> 98%)、肉桂醛(纯度> 99%)购自上海Adamas有限公司。
1.1.2 菌株肺炎克雷伯氏菌(K. pneumoniae 305)(ST405序列型,fimH+,mrkD+,wabG+,entB+)分离自上海某奶牛养殖场的生鲜乳中,由本实验室保存; 大肠埃希菌(E. coli ATCC 25922)购自美国菌种保藏中心,于-80 ℃冰箱中保存。
1.1.3 主要试剂药敏纸片、抗生素粉末,青岛海博生物技术有限公司; 无水甲醇、98%甲酸、无水乙醇、盐酸、氢氧化钠、乙酸乙酯、冰醋酸、二甲基亚砜(DMSO)、甘油,国药集团化学试剂有限公司; Luria-Bertani肉汤培养基(LB)、麦康凯琼脂(MAC)、Mueller-Hinton琼脂培养基(MHA),北京陆桥技术股份有限公司。
1.1.4 主要仪器与设备电子天平,瑞士Mettler Toledo仪器有限公司; 恒温振荡培养箱,上海知楚仪器有限公司; 隔水式恒温培养箱,上海一恒科技有限公司; Bio-Tek酶标仪,美国伯腾仪器有限公司; 旋转蒸发仪、电热恒温水浴锅,上海申生科技有限公司; ESCO生物安全柜,上海生叉贸易有限公司。
1.2 实验方法 1.2.1 菌悬液的制备取-80 ℃甘油管中保存的菌株K. pneumoniae 305划线于MAC平板,37 ℃过夜培养12 h后,挑取单菌落接种于LB液体培养基中,37 ℃恒温振荡培养4 h至对数期(OD600nm=0.8)。使用0.5号麦氏单位标准比浊管比浊,将菌悬液调整为0.5号麦氏浓度,即菌液的浓度为1×108~2×108 CFU/mL。
1.2.2 抗菌化合物溶液的制备参考YANG等[14]方法制备花青素。取蓝莓冻干粉加入适量甲醇∶水∶甲酸=85∶ 15∶ 0.5(体积比)提取花青素,然后通过树脂纯化法制备终浓度为210 μg/mL的花青素原液,于-20 ℃下保存备用。咖啡酸、肉桂醛均溶于无水乙醇中并用水稀释,制成质量浓度分别为30 mg/mL和1 mg/mL的原液备用。选用动物养殖中常用的8大类共8种抗生素,并分别使用相应的溶剂对其进行溶解[15],抗生素名称和浓度见表 1。
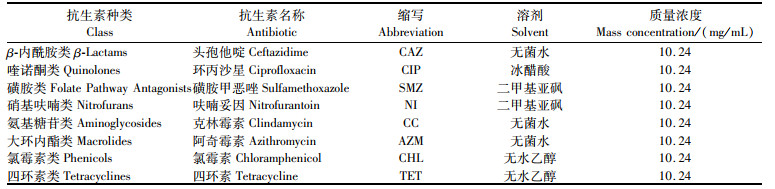
|
表 1 抗生素溶液的质量浓度 Tab.1 Concentration of antibiotic solution |
参照美国临床与实验室标准研究所(Clinical and Laboratory Standards Institute,CLSI,M100-S28)推荐的药敏纸片扩散法检测菌株K. pneumoniae 305对8种抗生素的耐药情况[16]。取300 μL菌悬液(108 CFU/mL)置于MHA平板中央,用无菌棉拭子均匀涂布MHA平板,静置3~5 min后,将药敏纸片均匀分置于平板表面,15 min内倒置平板,置于37 ℃培养箱中孵育16~20 h后测量抑菌圈直径大小。依据CLSI的标准,测定的抑菌圈直径可以判定为敏感、中介敏感和耐药3类,并使用菌株E. coli ATCC 25922作为质控菌株。
1.2.4 最小抑菌质量浓度的测定采用微量肉汤稀释法[17]测定天然产物和抗生素对菌株K. pneumoniae 305的最小抑菌浓度(MIC)。向96孔板中加入100 μL的LB液体培养基,将100 μL的花青素(210 μg/mL)、咖啡酸(30 mg/mL)、肉桂醛(1 mg/mL)和抗生素(1024 μg/mL)分别加入到96孔板的第一行,采用两倍稀释法进行连续稀释,最后一行弃去100 μL混合液。取100 μL稀释后的菌悬液(106 CFU/mL)依次加入到每个孔中,置于37 ℃恒温培养24 h后,用肉眼观察无可见菌生长,并使用酶标仪测定OD600nm,与阴性对照组OD值无显著性差异的孔所含最低抗菌化合物浓度即为最小抑菌质量浓度。设置阳性对照(含有菌悬液的液体培养基)和阴性对照(含或不含抗菌化合物的液体培养基)。
1.2.5 天然产物与抗生素联合使用对肺炎克雷伯氏菌抗菌活性的测定采用棋盘法[18]测定天然产物与抗生素联合使用对菌株K. pneumoniae 305的协同作用。向含LB液体培养基的96孔板中分别加入0~1 024 μg/mL的抗生素和0~1 875 μg/mL的咖啡酸或0~25 μg/mL的花青素,进行一系列的排列组合,混合均匀。随后在每个孔中加入100 μL的菌液(106 CFU/mL),于37 ℃恒温培养箱中培养24 h。参考WANG等[19]方法,按照下列公式计算分数抑制浓度指数(fractional inhibitory concentration index,FICI)来评估抗生素和天然产物的组合效应。FICI ≤ 0.5则抗生素与天然产物具有协同作用; 0.5 < FICI ≤ 4.0则抗生素与天然产物无相互作用; FICI > 4.0时则抗生素与天然产物具有拮抗作用[19]。
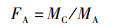 (1)
(1)
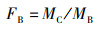 (2)
(2)
 (3)
(3)
式中:FA为抗生素的抑菌分数; FB为咖啡酸或者花青素的抑菌分数; F为分数抑制浓度指数; MC为抗生素与咖啡酸混合使用时抗生素或咖啡酸的最小抑菌浓度或者抗生素与花青素混合使用时抗生素或花青素的最小抑菌浓度; MA为抗生素单独使用时的最小抑菌浓度; MB为咖啡酸或者花青素单独使用时的最小抑菌浓度; A为抗生素; B为咖啡酸或者花青素; C为抗生素与咖啡酸的混合物或抗生素与花青素的混合物。
1.2.6 时间依赖性生长曲线的测定参考LU等[20]的方法,通过测定时间依赖性生长曲线评估咖啡酸与抗生素联用对菌株K. pneumoniae 305的协同抑菌作用。在LB液体培养基中分别添加抗生素、咖啡酸和抗生素与咖啡酸的混合液,设置对照组(仅含LB液体培养基),总体积均为2 mL。取10 μL对数期的菌悬液(108 CFU/mL)分别加入到2 mL处理组和对照组中,置于恒温摇床中(37 ℃,180 r/min)培养24 h。使用酶标仪,选取不同的时间点(0、2、4、6、8、12、24 h)测定OD600nm,绘制生长曲线评估抗生素、咖啡酸及它们的组合对菌株K. pneumoniae 305生长的影响。
1.2.7 数据分析所有试验重复3次,使用Graph pad Prism 8.0软件作图,采用SPSS 22.0软件进行方差分析(One-Way ANOVA),结果以平均值±标准差(X±SD)表示。
2 结果 2.1 肺炎克雷伯氏菌的耐药谱采用药敏纸片扩散法检测菌株K. pneumoniae 305对8种抗生素的耐药情况(图 1)。结果显示,头孢他啶(CAZ)、环丙沙星(CIP)、磺胺甲恶唑(SMZ)、呋喃妥因(NI)、克林霉素(CC)、阿奇霉素(AZM)、氯霉素(CHL)和四环素(TET)的抑菌圈直径分别为(13.5±1.3) mm、(13.5±2.2) mm、(1.5±0.5) mm、(13.2±1.3) mm、(3.0±2.0) mm、(23.5±1.3) mm、(3.2±0.8) mm和(2.8±0.8) mm。结果表明:菌株K. pneumoniae 305对8种抗生素均耐药,是多重耐药菌株。此外,菌株K. pneumoniae 305对SMZ、CC、CHL和TET完全耐药,导致这些抗生素的治疗效果不佳。
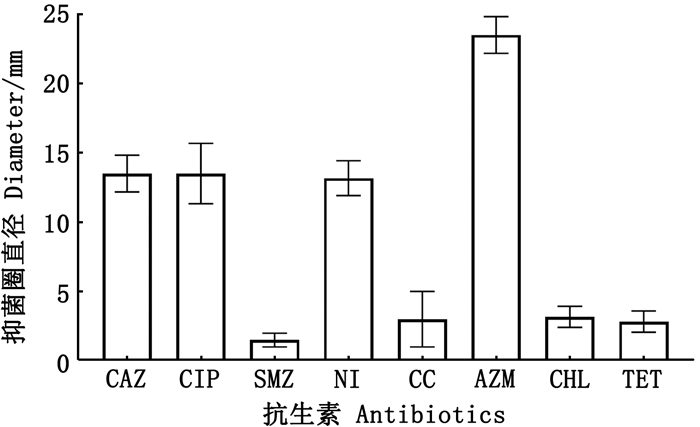
|
图 1 肺炎克雷伯氏菌305的耐药谱 Fig. 1 Drug resistance spectrum of Klebsiella pneumoniae 305 |
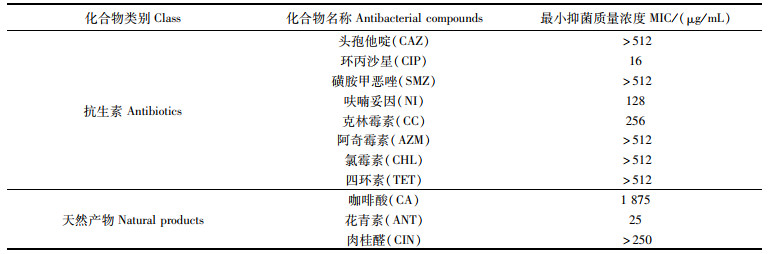
CIP、NI和CC对菌株K. pneumoniae 305的MIC值分别为16、128和256 μg/mL,CAZ、SMZ、AZM、CHL和TET的MIC值均高于512 μg/mL。与药敏纸片法测定的结果一致,CAZ、SMZ、AZM、CHL和TET几乎不具有抗菌活性,即使其在很高的浓度下也无法抑制菌株K. pneumoniae 305的生长。花青素、咖啡酸和肉桂醛的MIC值分别为25 μg/mL、1 875 μg/mL和>250 μg/mL。结果表明,在3种天然产物中,花青素对菌株K. pneumoniae 305的抑菌效果最强,咖啡酸次之肉,桂醛不具备抗菌作用(MIC值已超出其最大溶解度),见表 2。
|
表 2 不同抗菌化合物对肺炎克雷伯氏菌305的MIC值 Tab.2 MIC values of different antibacterial compounds against Klebsiella pneumoniae 305 |
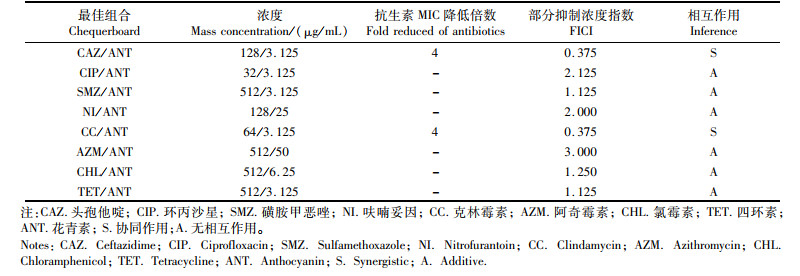
采用棋盘法研究亚抑菌浓度的花青素与抗生素联合使用对菌株K. pneumoniae 305的协同抗菌作用,结果见表 3。花青素与CAZ和CC联用的FICI值为0.375(FICI ≤ 0.5),具有协同抗菌作用。花青素能将CAZ和CC的MIC值降低4倍,增强了菌株K. pneumoniae 305对这2种抗生素的敏感性。花青素与其他6种抗生素联用的FICI值为1.125~3.000(0.5 < FICI ≤ 4),表明花青素与其他6种抗生素之间不存在协同作用。
|
表 3 花青素与抗生素联合使用对肺炎克雷伯氏菌305的协同作用 Tab.3 Synergistic effect of anthocyanins in combination with antibiotics on Klebsiella pneumoniae 305 |
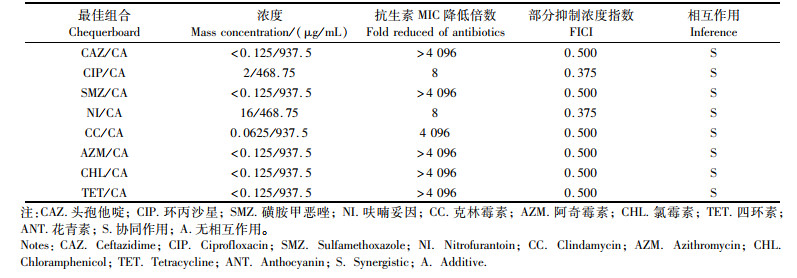
亚抑菌浓度的咖啡酸与抗生素联合使用对菌株K. pneumoniae 305的协同抗菌作用结果如表 4所示。咖啡酸与8种抗生素联合使用的FICI值为0.375~0.500(FICI ≤ 0.5),均具有协同抗菌作用。咖啡酸能将CAZ、SMZ、CC、AZM、CHL和TET的MIC值至少降低4 096倍,显著提高了菌株K. pneumoniae 305对这6种抗生素的敏感程度。虽然咖啡酸与CIP和NI之间的协同作用不显著,但也能将这2种抗生素的MIC值降低8倍。结果表明,咖啡酸能显著增强菌株K. pneumoniae 305对所选用8种抗生素的敏感性。咖啡酸与花青素相比与抗生素之间的协同抗菌作用更显著,可大幅度减少抗生素的使用剂量。
|
表 4 咖啡酸与抗生素联合使用对肺炎克雷伯氏菌305的协同作用 Tab.4 Synergistic effect of caffeic acid in combination with antibiotics on Klebsiella pneumoniae 305 |
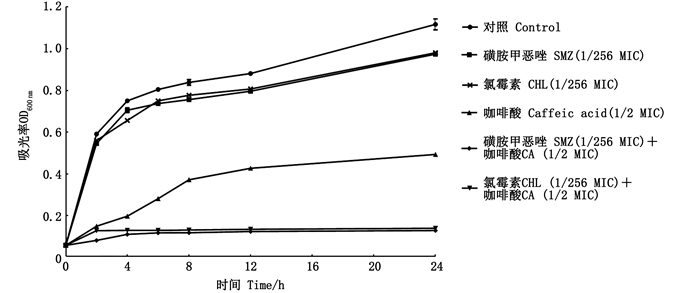
亚抑菌浓度的咖啡酸、抗生素以及咖啡酸与抗生素混合液对菌株K. pneumoniae 305的生长的影响结果如图 2所示。SMZ(1/256 MIC)和CHL(1/256 MIC)处理组的生长曲线与对照组相似,无法抑制菌株K. pneumoniae 305的生长。用1/2 MIC咖啡酸处理的实验组对菌株K. pneumoniae 305的抑制作用较弱,在前2 h可以抑制菌体生长,之后菌体量明显增多。咖啡酸(1/2 MIC)与SMZ(1/256 MIC)和CHL(1/256 MIC)联合使用能显著抑制菌株K. pneumoniae 305生长,协同抑菌持续24 h。
|
图 2 咖啡酸和抗生素对肺炎克雷伯氏菌305生长的影响 Fig. 2 Effects of caffeic acid and antibiotics on the growth of Klebsiella pneumoniae 305 |
牛乳因其营养成分丰富、口感细腻而广受人们的喜爱,但是由于肺炎克雷伯氏菌的存在,奶牛乳腺炎感染发病率升高,严重影响牛奶的产量和质量,阻碍全球食品产业的发展,威胁人类健康[21]。如今,为了防治肺炎克雷伯氏菌感染,长期大量使用抗生素加速了肺炎克雷伯氏菌多重耐药性的传播和发展,导致抗生素治疗效果不佳,给乳品产业造成了沉重的经济负担[22]。肺炎克雷伯氏菌对8类抗生素产生了广谱耐药性,且对磺胺类(SMZ)、氨基糖苷类(CC)、氯霉素类(CHL)和四环素类(TET)完全耐药,4种抗生素的抑菌圈直径为1.5~3.2 mm,MIC值>512 μg/mL。蒙正群等[23]等检测肺炎克雷伯氏菌的耐药性时发现,菌株对β-内酰胺类、磺胺类和大环内酯类等药物表现出严重耐药,氨苄西林、头孢呋辛和磺胺甲恶唑的抑菌圈直径为0~13 mm。肺炎克雷伯氏菌的耐药性日益加重,导致肺炎克雷伯氏菌感染的治愈率急剧降低,此外,耐药性在全球范围内的广泛传播更是令人担忧,因此迫切需要一种科学有效的方法控制细菌耐药性的发展。
天然产物与抗生素联合使用是解决细菌耐药性问题的有效措施。酚类化合物与其他化合物相比具有更广谱的抗菌活性,研究[24]发现酚类化合物与抗生素联用对MDR致病菌具有显著协同抗菌作用,能通过大幅度降低抗菌药物的使用剂量有效增强抗生素的抗菌活性。姜黄素能够提高MDR脓肿分枝杆菌对4种抗生素(阿米卡星、克拉霉素、环丙沙星和利奈唑胺)的敏感性,并将4种抗生素的MIC值降低4~128倍[25]。丁香酚能够增强MDR大肠杆菌对2种抗生素(头孢噻肟和环丙沙星)的敏感性,将2种抗生素的MIC值降低2~1 024倍[26]。本研究中,选用的花青素和咖啡酸都是重要的酚类化合物,能通过降低抗生素的MIC值消减肺炎克雷伯氏菌的耐药性。花青素能将CAZ和CC的MIC值减少4倍,咖啡酸能将8种抗生素的MIC值降低8~>4 096倍。VÁZQUEZ-UCHA等[27]研究百里香精油与多黏菌素联用对MDR肺炎克雷伯氏菌耐药性的消减作用时发现,精油能将多粘菌素的MIC值降低8~128倍。抗生素与咖啡酸联用对MDR肺炎克雷伯氏菌的协同抗菌效果明显优于其与花青素或百里香精油的组合。这可能是因为咖啡酸作为极性化合物具有亲脂性,能够增强细菌细胞膜通透性,提高抗生素的渗入率,降低MDR肺炎克雷伯氏菌的有氧代谢活性,从而显著增强MDR肺炎克雷伯氏菌对抗生素的敏感性[28]。因此,咖啡酸有被开发为MDR肺炎克雷伯氏菌的增敏剂,提高抗生素治疗效果的潜力。
综上所述,联合疗法能有效消减肺炎克雷伯氏菌的耐药性,减少抗生素的使用和残留,在奶牛乳腺炎的防治中具有广阔的应用前景。未来还需深入研究咖啡酸与抗生素联用对多重耐药菌的协同抗菌作用机理,并通过动物实验评价联合疗法的安全性与有效性。
| [1] |
BOBBADI S, CHINNAM B K, NELAPATI S, et al. Occurrence and genetic diversity of ESBL producing Klebsiella species isolated from livestock and livestock products[J]. Journal of Food Safety, 2020, 40(1): e12738. |
| [2] |
WU H, WANG M Y, LIU Y Q, et al. Characterization of antimicrobial resistance in Klebsiella species isolated from chicken broilers[J]. International Journal of Food Microbiology, 2016, 232: 95-102. DOI:10.1016/j.ijfoodmicro.2016.06.001 |
| [3] |
格松. 主要致病菌引发的奶牛乳房炎的防治[J]. 甘肃畜牧兽医, 2016, 46(7): 66-67. GE S. Prevention and treatment of cow mastitis caused by main pathogenic bacteria[J]. Gansu Animal and Veterinary Sciences, 2016, 46(7): 66-67. DOI:10.3969/j.issn.1006-799X.2016.07.038 |
| [4] |
GUO Y M, ZHOU H J, QIN L Y, et al. Frequency, antimicrobial resistance and genetic diversity of Klebsiella pneumoniae in food samples[J]. PLoS One, 2016, 11(4): e0153561. DOI:10.1371/journal.pone.0153561 |
| [5] |
LOGAN L K, NGUYEN D C, HUANG F A S, et al. A multi- centered case-case-control study of factors associated with Klebsiella pneumoniae carbapenemase-producing enterobacteriaceae infections in children and young adults[J]. The Pediatric Infectious Disease Journal, 2019, 38(5): 490-495. DOI:10.1097/INF.0000000000002176 |
| [6] |
Chinet China Bacterial Resistance Monitoring. Monitoring results of bacterial resistance in China by CHINET in 2020[EB/OL]. [2020-09-04]. http://www.chinests.com/Document.
|
| [7] |
李元政, 胡文忠, 萨仁高娃, 等. 天然植物提取物的抑菌机理及其在果蔬保鲜中的应用[J]. 食品与发酵工业, 2019, 45(14): 239-244. LI Y Z, HU W Z, SAREN G W, et al. Antimicrobial mechanisms of natural plant extracts and applications in preserving fruits and vegetables[J]. Food and Fermentation Industries, 2019, 45(14): 239-244. |
| [8] |
KALI A, BHUVANESHWAR D, CHARLES P M V, et al. Antibacterial synergy of curcumin with antibiotics against biofilm producing clinical bacterial isolates[J]. Journal of Basic and Clinical Pharmacy, 2016, 7(3): 93-96. DOI:10.4103/0976-0105.183265 |
| [9] |
SANHUEZA L, MELO R, MONTERO R, et al. Synergistic interactions between phenolic compounds identified in grape pomace extract with antibiotics of different classes against Staphylococcus aureus and Escherichia coli[J]. PLoS One, 2017, 12(2): e0172273. DOI:10.1371/journal.pone.0172273 |
| [10] |
CHEESMAN M J, ILANKO A, BLONK B, et al. Developing new antimicrobial therapies: are synergistic combinations of plant extracts/compounds with conventional antibiotics the solution?[J]. Pharmacognosy Reviews, 2017, 11(22): 57-72. DOI:10.4103/phrev.phrev_21_17 |
| [11] |
MAISURIA V B, OKSHEVSKY M, DÉZIEL E, et al. Proanthocyanidin interferes with intrinsic antibiotic resistance mechanisms of gram-negative bacteria[J]. Advanced Science, 2019, 6(15): 1802333. DOI:10.1002/advs.201802333 |
| [12] |
DHARA L, TRIPATHI A. Cinnamaldehyde: a compound with antimicrobial and synergistic activity against ESBL-producing quinolone-resistant pathogenic Enterobacteriaceae[J]. European Journal of Clinical Microbiology & Infectious Diseases, 2020, 39(1): 65-73. |
| [13] |
KĘPA M, MIKLASIŃSKA-MAJDANIK M, WOJTYCZKA R D, et al. Antimicrobial potential of caffeic acid against Staphylococcus aureus clinical strains[J]. Biomed Research International, 2018, 2018: 7413504. |
| [14] |
杨晗, 孙晓红, 吴启华, 等. 野生蓝莓和花青素提取物对高脂饮食小鼠肠道菌群的影响[J]. 微生物学通报, 2015, 42(1): 133-141. YANG H, SUN X H, WU V C H, et al. Influence of dietary wild blueberry and anthocyanins extract on intestinal microorganisms in high-fat diet-induced mice[J]. Microbiology China, 2015, 42(1): 133-141. |
| [15] |
JO A, AHN J. Phenotypic and genotypic characterisation of multiple antibiotic-resistant Staphylococcus aureus exposed to subinhibitory levels of oxacillin and levofloxacin[J]. BMC Microbiology, 2016, 16: 170. DOI:10.1186/s12866-016-0791-7 |
| [16] |
Clinical and Laboratory Standards Institute (CLSI). M100-S28 performance standards for antimicrobial susceptibility testing: twenty-eighth informational supplement[S]. Wayne, PA, USA: Clinical and Laboratory Standards Institute, 2018.
|
| [17] |
GOHIL N, BHATTACHARJEE G, SINGH V. Synergistic bactericidal profiling of prodigiosin extracted from Serratia marcescens in combination with antibiotics against pathogenic bacteria[J]. Microbial Pathogenesis, 2020, 149: 104508. DOI:10.1016/j.micpath.2020.104508 |
| [18] |
LEE S, AL RAZQAN G S, KWON D H. Antibacterial activity of epigallocatechin-3-gallate (EGCG) and its synergism with β-lactam antibiotics sensitizing carbapenem-associated multidrug resistant clinical isolates of Acinetobacter baumannii[J]. Phytomedicine, 2017, 24: 49-55. DOI:10.1016/j.phymed.2016.11.007 |
| [19] |
WANG Q, LV Y M, PANG J, et al. In vitro and in vivo activity of D-serine in combination with β-lactam antibiotics against methicillin-resistant Staphylococcus aureus[J]. Acta Pharmaceutica Sinica B, 2019, 9(3): 496-504. DOI:10.1016/j.apsb.2019.01.017 |
| [20] |
LU X, YANG X Y, LI X, et al. In vitro activity of sodium new houttuyfonate alone and in combination with oxacillin or netilmicin against methicillin-resistant Staphylococcus aureus[J]. PLoS One, 2013, 8(7): e68053. DOI:10.1371/journal.pone.0068053 |
| [21] |
江静宜. 奶牛乳腺炎病原菌感染模式与乳品质性状的相关性及耐药基因分析[D]. 扬州: 扬州大学, 2019. JIANG J Y. Correlation between infection patterns of dairy cow mastitis pathogens and milk quality traits and analysis of drug resistance genes[D]. Yangzhou: Yangzhou University, 2019. |
| [22] |
LALRUATDIKI A, DUTTA T K, ROYCHOUDHURY P, et al. Extended-spectrum β-lactamases producing multidrug resistance Escherichia coli, Salmonella and Klebsiella pneumoniae in pig population of Assam and Meghalaya, India[J]. Veterinary World, 2018, 11(6): 868-873. DOI:10.14202/vetworld.2018.868-873 |
| [23] |
蒙正群, 冷依伊, 任梅渗, 等. 一株牛源肺炎克雷伯氏菌的分离鉴定与耐药基因型检测[J]. 浙江农业学报, 2017, 29(4): 534-541. MENG Z Q, LENG Y Y, REN M S, et al. Isolation, identification and drug resistance detection of a calf Klebsiella pneumoniae strain[J]. Acta Agriculturae Zhejiangensis, 2017, 29(4): 534-541. DOI:10.3969/j.issn.1004-1524.2017.04.03 |
| [24] |
MIKLASIŃSKA-MAJDANIK M, KĘPA M, WOJTYCZKA R D, et al. Phenolic compounds diminish antibiotic resistance of Staphylococcus aureus clinical strains[J]. International Journal of Environmental Research and Public Health, 2018, 15(10): 2321. DOI:10.3390/ijerph15102321 |
| [25] |
MARINI E, DI GIULIO M, MAGI G, et al. Curcumin, an antibiotic resistance breaker against a multiresistant clinical isolate of Mycobacterium abscessus[J]. Phytotherapy Research, 2018, 32(3): 488-495. DOI:10.1002/ptr.5994 |
| [26] |
DHARA L, TRIPATHI A. The use of eugenol in combination with cefotaxime and ciprofloxacin to combat ESBL-producing quinolone-resistant pathogenic Enterobacteriaceae[J]. Journal of Applied Microbiology, 2020, 129(6): 1566-1576. DOI:10.1111/jam.14737 |
| [27] |
VÂZQUEZ-UCHA J C, MARTINEZ-GUITIAN M, LASARTE-MONTERRUBIO C, et al. Syzygium aromaticum (clove) and Thymus zygis (thyme) essential oils increase susceptibility to colistin in the nosocomial pathogens Acinetobacter baumannii and Klebsiella pneumoniae[J]. Biomedicine & Pharmacotherapy, 2020, 130: 110606. |
| [28] |
LUÍS A, SILVA F, SOUSA S, et al. Antistaphylococcal and biofilm inhibitory activities of Gallic, caffeic, and chlorogenic acids[J]. Biofouling, 2014, 30(1): 69-79. DOI:10.1080/08927014.2013.845878 |
2. Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China;
3. Laboratory of Quality & Safety Risk Assessment for Aquatic Products on Storage and Preservation, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


