2. 大洋渔业资源可持续开发教育部重点实验室,上海 201306;
3. 国家远洋渔业工程技术研究中心,上海 201306;
4. 农业农村部大洋渔业开发重点实验室,上海 201306
太平洋褶柔鱼(Todarodes pacificus)主要分布在日本海及太平洋沿岸以及我国的黄海和东海[1], 是世界上重要的大洋性经济头足类和我国重要的捕捞对象之一。太平洋褶柔鱼主要有冬生、夏生和秋生3个产卵群体,其中冬生和秋生群体为日本的主要捕捞对象[2]。冬生群分布最广、数量最大,该群体产卵期主要集中于1—3月,产卵场主要分布在日本九州西南东海大陆架外缘区域,集中分布在东海东北部。索饵期主要集中在6—7月,该群体沿着日本毗邻太平洋沿岸北上索饵,南下产卵[3]。
太平洋褶柔鱼为一年生的短生命周期物种,产卵后即死亡,其资源补充量对其资源丰度起决定性作用。已有研究[4-6]表明,海洋环境与鱼类资源补充量密切相关,因此探究环境变化与资源丰度的关系并分析其影响机理,为后续渔业资源评估和管理提供基础。张硕等[7]和杨林林等[8]利用相关性分析认为太平洋褶柔鱼冬生群体产卵场海表面温度(sea surface temperature,SST)是导致单位捕捞努力量渔获量(catch per unit effort,CPUE)变化的重要因子。解明阳等[9]利用灰色系统分析5种环境因子对太平洋褶柔鱼冬春生群CPUE变化的影响趋势。但目前对影响太平洋褶柔鱼冬生群体资源丰度的环境因子研究及其机理分析涉及较少[10]。因此,本研究根据1998—2018年太平洋褶柔鱼冬生群体产卵场和索饵场资源丰度以及环境因子数据,选取影响显著的环境因子与资源丰度进行回归分析,找出资源分布相对集中的海域,并对其影响因子进行机理分析,为科学评估和管理太平洋褶柔鱼资源提供依据。
1 材料与方法 1.1 数据来源太平洋褶柔鱼冬生群资源丰度数据来自加賀敏樹等[11]的2019年太平洋褶柔鱼冬生群资源评估报告(http://abchan.fra.go.jp/digests2019/html/2019_18.html),时间为1998—2018年。SST数据来自美国NOAA Ocean Watch数据库(https://oceanwatch.pifsc.noaa.gov/erddap/griddap/CRW_sst_v1_0_monthly.html),时间为1998—2018年1—12月,空间范围为25°N~45°N和125°E~145°E海域,时间分辨率为月,空间分辨率为0.5°×0.5°。
1.2 研究方法(1) 环境因子选取。根据已有研究[3, 12]显示:太平洋褶柔鱼冬生群体产卵月份主要为每年1—3月,产卵场主要分布在28°N~34°N和125°E~134°E海域; 索饵期主要为每年6—7月,索饵场为35°N~45°N和128°E~145°E海域。对1998—2018年太平洋褶柔鱼冬生群体产卵场和索饵场范围内SST时间序列值和CPUE年序列值进行回归分析,选出与CPUE显著相关区域和月份,将此作为影响太平洋褶柔鱼冬生群体资源量变动的重要影响因子。
(2) 利用ArcMap10.4软件绘制分布图,将与CPUE显著相关的SST进行均值化处理,分析其温度变化对CPUE的影响,并绘制出与CPUE显著相关的SST的分布图,并将与CPUE显著相关月份的温度层叠加在海域中。结合黑潮及其分支海流势力强弱对产卵场和索饵场SST分布的影响进行探讨,解释其资源丰度变动的机理。
2 结果 2.1 CPUE年际变化1998—2018年太平洋褶柔鱼冬生群CPUE年间波动大且近年来持续下降(图 1),其CPUE为0.27~1.77 t/d, 2007—2009年CPUE持续高值位于波峰位置,2016—2018年CPUE持续下降处于低谷阶段。
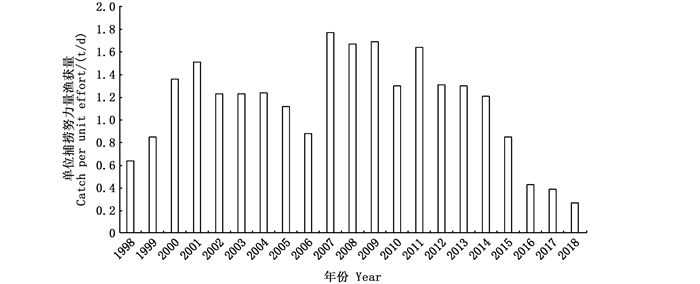
|
图 1 1998—2018年日本太平洋褶柔鱼冬生群各年CPUE分布图 Fig. 1 Distribution of CPUE of winter population of Todarodes pacificus from 1998 to 2018 in Japan |
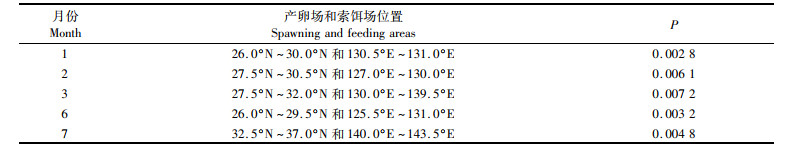
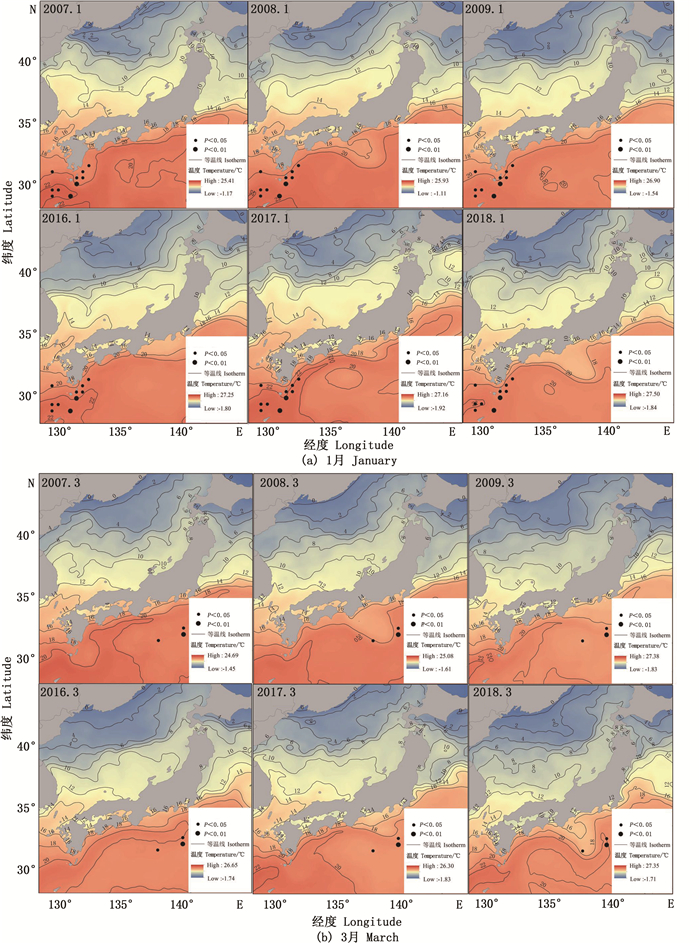
对产卵场1—3月SST序列值和CPUE做回归分析,SST与CPUE显著性相关的区域分布较集中(图 2),其产卵场1月SST与CPUE显著相关性高于2、3月(表 1),1月显著相关点相对比较集中(P=0.002 8),因此选取1月海域作为产卵场SST机理分析的研究区域。
|
表 1 1998—2018年产卵场和索饵场SST与CPUE回归分析结果 Tab.1 Regression analysis between CPUE and SST in the spawning and feeding grounds from 1998 to 2018 |
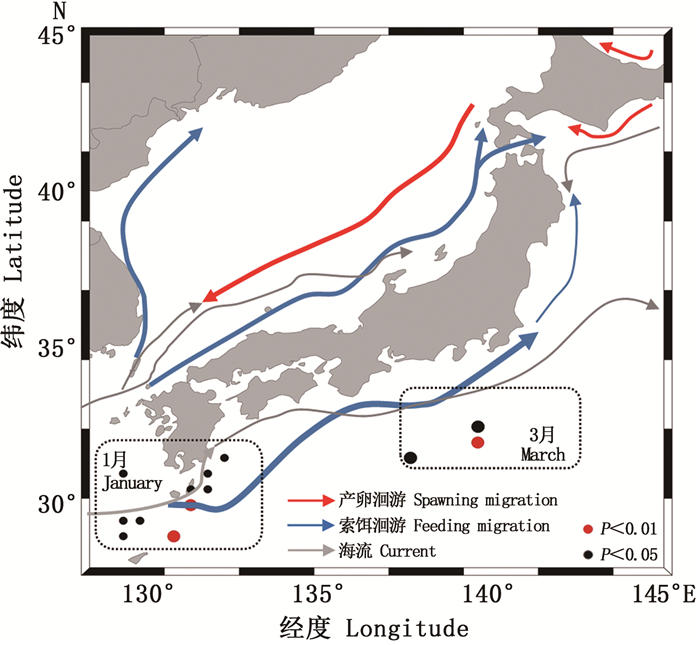
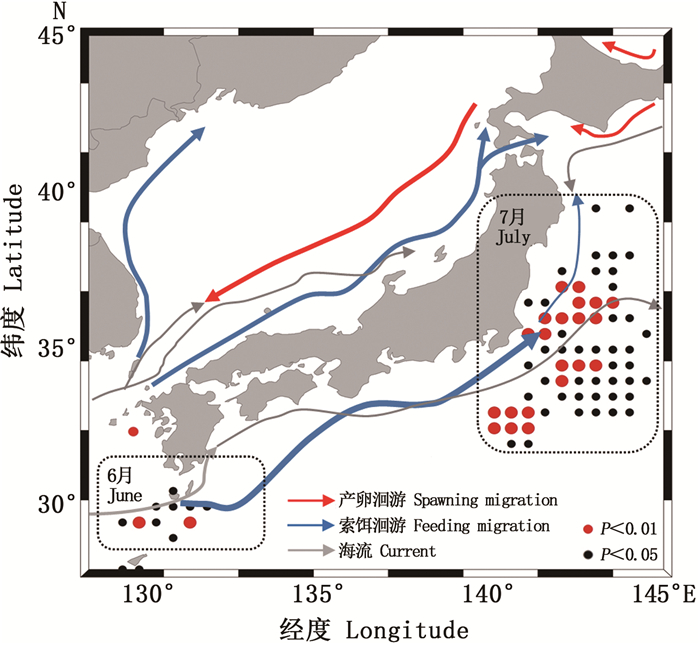
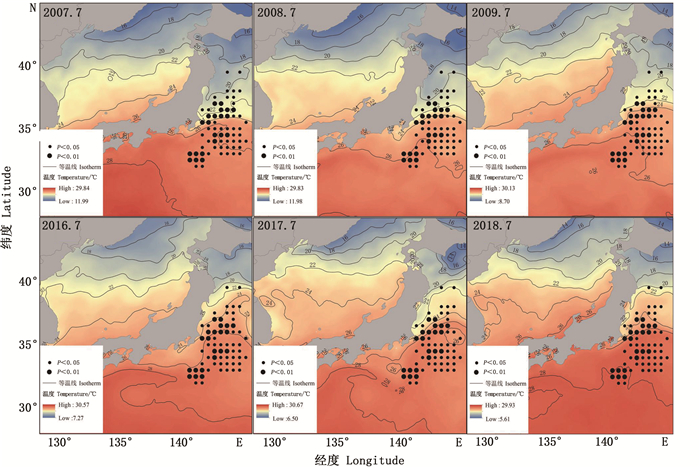
对索饵场6—7月SST序列值和CPUE做回归分析认为,SST与CPUE显著相关的点分布集中(图 3),其索饵场6月和7月SST与CPUE显著相关和相关海域相近(表 1),7月的显著相关区域较集中(P=0.004 8),主要集中在32.5°N~37.0°N和140.0°E~143.5°E海域内。因此选取7月作为索饵场SST机理分析的研究区域。
|
1—2月代表黑潮主轴及其分支; 3月份黑潮前锋。 January to February represents the main axis of Kuroshio and its branches; Kuroshio forward in March. 图 2 产卵期SST与太平洋褶柔鱼冬生群资源丰度显著相关的海区 Fig. 2 Areas with significant correlation between SST of spawning ground and CPUE of winter cohort of T. pacificus |
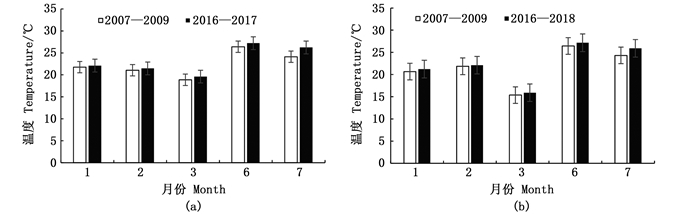
由图 2所示,产卵场(1月)产卵群体主要分布在九州岛以东、北太平洋以南沿日本沿岸集中分布,显著相关区域的等温线较密集(SST变化较大),该群体存在适宜性温度范围(18~24 ℃)。1月显著相关海域主要分布在对马暖流的前锋,黑潮主轴及其分支前锋少量分布,2月显著相关海域主要集中分布在黑潮主轴及分支前锋,3月显著相关海域主要集中在黑潮主轴前锋海域,分布区域的变化因黑潮势力强弱对SST造成影响,并对资源量及分布存在影响。CPUE连续高低值不同年份的SST进行成对样本差异性t检验,发现不同年份同一月份的温度值均表现出显著差异(P < 0.01), 而不同年份均值SST之间差异均不显著(P>0.05),CPUE高的年均值SST普遍低于CPUE低的(图 4),黑潮前锋的月均温比对马暖流前锋高(图 5),黑潮势力强弱使SST变化,进而对资源丰度造成影响。太平洋褶柔鱼的不同年份温度值差异较大但适宜性温度变化不大,且不同年份均值SST的变化与CPUE呈现负相关。温度升高不一定会带来资源量的增加,年间波动较大可能会造成资源量减少。
由图 3所示,索饵场(7月)主要分布在北太平洋以北、北海道以南海域黑潮第一分支前锋和亲潮的交汇处集中分布,索饵场海域等温线向北弯曲,显著相关的区域主要分布在18~28 ℃黑潮末端和亲潮的交汇处,主要集中在亲潮前锋区域,CPUE连续高值年份SST年均值低于CPUE连续低值年份(图 4),黑潮前锋的月均温比亲潮前锋高,CPUE与温度变化呈负相关。黑潮第一分支势力增强造成中高纬度索饵场7月水温偏高(图 4)。太平洋褶柔鱼冬生群的资源丰度与海温密切相关,温度对资源分布和资源量大小都会造成一定的影响,而黑潮势力强弱对SST造成直接影响。
|
6月为黑潮主轴; 7月为黑潮第一分支前锋。 June is the main axis of Kuroshio; July for the Kuroshio first branch forward. 图 3 索饵期SST与太平洋褶柔鱼冬生群资源丰度显著相关的海区 Fig. 3 Areas with significant correlation between SST of feeding ground and CPUE of winter cohort of T. pacificus |
|
图 4 产卵场和索饵场CPUE连续高值与连续低值年份的SST比较(a为P < 0.01, b为P < 0.05) Fig. 4 SST comparison of between continuous high CPUE and continuous low CPUE in spawning and feeding grounds (a stands for P < 0.01, b stands for P < 0.05) |
太平洋褶柔鱼作为短生命周期物种,其资源易受到海洋环境的影响。产卵场环境对资源量影响显著,其中以SST为直接影响因子。SAKURAI等[13]认为产卵场位置随温度的变化而变化。在温暖期,太平洋褶柔鱼冬生群种群数量增加,产卵场海域增大; 在寒冷期,种群数量减少。本文选取25°N~45°N和125°E~145°E的SST环境数据,将1998—2018年的1—3、6—7月SST与CPUE进行回归分析,CPUE受环境影响随之发生变化,产卵期(1—3月)资源分布随海流位置而发生变化,主要处在我国东海及其向东延伸至太平洋西海岸部分海域(图 2)。索饵期(6—7月)进行北上索饵主要分布在亲潮和黑潮第一分支交汇处(图 3)。
3.1 空间分布随温度的变化从月平均温度角度来看,JI等[14]认为太平洋褶柔鱼空间分布变化主要受产卵场影响(图 2),水温对其产卵、孵化生长有明显的影响[15]。本文分析SST对太平洋褶柔鱼冬生群产卵场和索饵场空间分布的影响。从回归分析的结果和图像拟合来看,产卵期间资源分布随着海流北上,对马暖流前锋温度低于黑潮主轴及其分支前锋(图 5和图 6),路径与太平洋褶柔鱼冬生群体空间分布变化的移动轨迹基本一致(图 2,图 3)。索饵期大部分群体位于北太平洋32°N以北区域,逐渐接近黑潮分支前锋路径先向西北,与亲潮汇合后转而向东部海域和亲潮的交汇处(图 3)。KIYOFUJI等[16]认为不同年代产卵场位置范围是不断发生变化的,黑潮对SST产生影响,SST对产卵场和索饵场的分布造成影响。
|
图 5 特定年份1月和3月作业海区(0.5×0.5)的SST与CPUE相关性的空间分布 Fig. 5 The spatial distribution of the correlation between SST and CPUE in the operation area (0.5 × 0.5) in January and March of the specific year |
|
图 6 特定年份7月作业海区(0.5×0.5)的SST与CPUE相关性的空间分布 Fig. 6 The spatial distribution of the correlation between SST and CPUE in the operation area (0.5 × 0.5) in July of the specific year |
从早期生活史角度来看,温度影响其胚胎发育的时间和发育速度[17],对调节种群动态和食物网结构具有重要作用[18]。太平洋褶柔鱼作为短生命周期物种,其胚胎发育高度依赖温度,其在14.7~22 ℃之间存活率增加70%[19]。产卵场CPUE与SST显著相关点分布的主轴主要位于20~22 ℃(图 5,图 6), 该范围等温线走向持续向北,与黑潮移动路径方向保持一致。大多数胚胎发育期超过25 ℃的温度、低于9~13.2 ℃会加快死亡降低胚胎存活率[19],本文研究产卵场的分布范围为18~24 ℃,索饵场为16~28 ℃,由此可见索饵场温度比产卵场温度高,物种生长环境会发生变化。该结果说明同一物种在同一海域不同生长阶段的温度分布范围存在差异,其主要是因为其生长阶段的不同生物特性对生长环境的适应程度,其中温度是重要的影响因素,黑潮是影响温度变化的重要影响因子。
3.3 海表面温度与资源丰度从资源丰度角度来看,作为短生命周期物种,其繁殖和生长多取决于物理和生物环境。CPUE连续高值年份的SST普遍低于CPUE连续低值年份(图 4),而连续低值年份黑潮势力较强,造成产卵场和索饵场海域温度升高,对物种的生存环境造成威胁,促使成活率降低,进而影响其资源丰度。以20 ℃等温线为基点,随着温度升高(图 4),该等温线逐渐北移(图 5,图 6),且CPUE也随之减少。因此黑潮对温度影响显著,温度进一步影响资源丰度。已有研究表明,20世纪40—70年代,环境变化与太平洋褶柔鱼资源量变化一致,种群数量波动主要是环境引起的繁殖与生长变化,进而引起资源丰度的变化[20]。该结论与本文研究一致,太平洋褶柔鱼冬生群体数量波动与产卵场和索饵场环境变化有关,等温线走向与黑潮移动路径一致(图 5,图 6),温度与CPUE呈负相关。由此可见,黑潮势力强弱是影响太平洋褶柔鱼资源丰度的主要原因之一。
由于本研究中使用的渔业数据全部来源于日本水产厅,对研究范围具有一定的局限性,环境因子局限于SST,忽略太平洋年代际涛动、叶绿素a质量浓度等环境因素对资源丰度的影响。今后的研究应考虑多种环境因子对太平洋褶柔鱼冬生群资源量的影响,对环境因子之间的交叉影响进行分析,在环境因子选择的同时要考虑早期生活史阶段,结合物理海洋学等学科,综合探究太平洋褶柔鱼资源量变化及其机制。
| [1] |
KIDOKOROH, GOTO T, NAGASAWA T, et al. Impact of a climate regime shift on the migration of Japanese common squid (Todarodes pacificus) in the Sea of Japan[J]. ICES Journal of Marine Science, 2010, 67(7): 1314-1322. DOI:10.1093/icesjms/fsq043 |
| [2] |
王尧耕, 陈新军. 世界大洋性经济柔鱼类资源及其渔业[M]. 北京: 海洋出版社, 2005. WANG Y G, CHEN X J. Oceanic economic squid resources and its fisheriesin the world[M]. Beijing: Ocean Press, 2005. |
| [3] |
方舟, 陈新军. 太平洋褶柔鱼渔业资源及渔场学研究进展[J]. 海洋渔业, 2018, 40(1): 102-116. FANG Z, CHEN X J. Review on fishery of Japanese flying squid Todarodes pacificus[J]. Marine Fisheries, 2018, 40(1): 102-116. DOI:10.3969/j.issn.1004-2490.2018.01.012 |
| [4] |
唐峰华, 史赟荣, 朱金鑫, 等. 海洋环境因子对日本海太平洋褶柔鱼渔场时空分布的影响[J]. 中国水产科学, 2015, 22(5): 1036-1043. TANG F H, SHI Y R, ZHU J X, et al. Influence of marine environment factors on temporal and spatial distribution of Japanese common squid fishing grounds in the Sea of Japan[J]. Journal of Fishery Sciences of China, 2015, 22(5): 1036-1043. |
| [5] |
SAKURAIY, KIYOFUJIH, SAITOH S I, et al. Stock fluctuations of the Japanese common squid, Todarodes pacificus, related to recent climate changes[J]. Fisheries Science, 2002, 68(s1): 226-229. |
| [6] |
李建生, 严利平. 东海太平洋褶柔鱼的数量分布及其与环境的关系[J]. 海洋渔业, 2004, 26(3): 193-198. LIJ S, YAN L P. Quantity distribution of Todarodes pacificus and its relation with environment in the East China Sea[J]. Marine Fisheries, 2004, 26(3): 193-198. DOI:10.3969/j.issn.1004-2490.2004.03.007 |
| [7] |
张硕, 李莉, 陈新军. 基于海表温因子的太平洋褶柔鱼冬生群资源丰度预测模型比较[J]. 水产学报, 2018, 42(5): 704-710. ZHANG S, LI L, CHEN X J. A comparative study on forecasting model of the stock abundance index forthe winter-spawning cohort of Todarodes pacificus in the Pacific Ocean based on the factor of SST[J]. Journal of Fisheries of China, 2018, 42(5): 704-710. |
| [8] |
杨林林, 姜亚洲, 程家骅. 东海太平洋褶柔鱼生殖群体的空间分布及其与环境因子的关系[J]. 生态学报, 2010, 30(7): 1825-1833. YANG L L, JIANG Y Z, CHENG J H. Spatial distribution ofmature stock of Pacific squid, Todarodes pacificus and its relation to environmental factors in the East China Sea[J]. Acta Ecologica Sinica, 2010, 30(7): 1825-1833. |
| [9] |
解明阳, 陈新军, 汪金涛. 基于灰色系统的太平洋褶柔鱼冬春生群资源丰度变化研究[J]. 海洋渔业, 2018, 40(6): 641-648. XIE M Y, CHEN X J, WANG J T. On changes of abundance index of winter-spring cohort of Todarodes pacificus in the northwest Pacific based on grey system theory[J]. Marine Fisheries, 2018, 40(6): 641-648. DOI:10.3969/j.issn.1004-2490.2018.06.001 |
| [10] |
HAYKINS, NETWORK N. A comprehensive foundation[J]. Neural Networks, 2004(2): 41. |
| [11] |
加賀敏樹, 山下紀生, 岡本俊, 等. 平成30年度スルメイカ冬季発生系群の資源評価[R]. 平成30年度我が国周辺水域の漁業資源評価, 水産庁. 水産研究. 教育機構, 2019: 652-697. TOSHIKI K, NORIO Y, SHUN O, et al. Resource evaluation of the winter generation family of the squid in 2018[R]. Fiscal Year 2015 Surveyon Survey Resources of Surrounding Fishery Resources in Japan, Fisheries Agency, Fisheries, education agency, 2019: 652-697 |
| [12] |
宁欣, 陆化杰, 刘凯, 等. 2018年春季拉尼娜发生期东海太平洋褶柔鱼的渔业生物学特性[J]. 水产学报, 2020, 44(10): 1676-1684. NING X, LU H J, LIU K, et al. Fisheries biological characteristics of Japanese common squid (Todarodes pacificus) in spring in the La Niña year of 2018 in the East China Sea[J]. Journal of Fisheries of China, 2020, 44(10): 1676-1684. |
| [13] |
SAKURAI Y, KIYOFUJI H, SAITOH S, et al. Changes in inferred spawning areas of Todarodes pacificus(Cephalopoda: Ommastrephidae) due to changing environmental conditions[J]. ICES Journal of Marine Science, 2000, 57(1): 24-30. DOI:10.1006/jmsc.2000.0667 |
| [14] |
JI F, GUO X Y, WANGY C, et al. Response of the Japanese flying squid (Todarodes pacificus) in the Japan Sea to future climate warming scenarios[J]. Climatic Change, 2020, 159(4): 601-618. DOI:10.1007/s10584-020-02689-3 |
| [15] |
KIMYH, CHOIK, LEEC I. Migrationand distribution of the common squid (Todarodes pacificus) in Korean waters[J]. Journal of Environmental Science International, 2017, 26(2): 173-181. DOI:10.5322/JESI.2017.26.2.173 |
| [16] |
KIYOFUJI H, SAITOHS I, SAKURAI Y. A visualization of the variability of spawning ground distribution of Japanese common squid (Todarades pacificus) using Marine-GIS and satellite data sets[J]. International Archives of Photogrammetry and Remote Sensing, 1998, 32: 882-887. |
| [17] |
MARQUEZ L, LARSONM, ALMANSAE. Effects of temperature on the rate of embryonic development of cephalopods in the light of thermal time applied to aquaculture[J]. Reviews in Aquaculture, 2021, 13(1): 706-718. DOI:10.1111/raq.12495 |
| [18] |
PARKT H, LEEC I, KANG C K, et al. Seasonal variation in food web structure and fish community composition in the East/Japan sea[J]. Estuaries and Coasts, 2020, 43(3): 615-629. DOI:10.1007/s12237-019-00530-4 |
| [19] |
MINOBES. A 50-70 year climatic oscillation over the North Pacific and north America[J]. Geophysical Research Letters, 1997, 24(6): 683-686. DOI:10.1029/97GL00504 |
| [20] |
GOTO T, TAKANASHI A. Changes in the strategy of a small-scale jigging fishery for Japanese flying squid Todarodes pacificus off northeastern Japan[J]. Fisheries Science, 2020, 86(1): 1-11. DOI:10.1007/s12562-019-01360-w |
2. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
3. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
4. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


