2. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306;
3. 上海海洋大学 上海水产养殖工程技术研究中心, 上海 201306
中华绒螯蟹(Eriocheir sinensis),俗称河蟹,是我国重要的水产养殖对象,近年来其养殖业获得了持续发展[1],已成为较多地方的支柱性产业[2]。中华绒螯蟹的生长发育受温度影响较大,其幼蟹对高温敏感,1龄幼蟹处于高温环境(30 ℃以上)下会在较短的时间死亡[3]。在适宜的水温范围(10~26 ℃)内,中华绒螯蟹幼蟹的生长率与水温成正相关[4],蜕壳间隔也会随着水温的升高而显著缩短[5]。此外,研究[6]表明:水温在5~10 ℃时,中华绒螯蟹仅有少量摄食;当水温升至10 ℃时,中华绒螯蟹开始正常摄食;水温升至15 ℃时,摄食开始增加;20~26 ℃时摄食最旺盛;而水温超过28 ℃时,中华绒螯蟹的生长和蜕壳会受到抑制;超过35 ℃时,中华绒螯蟹一般不摄食。
肠道微生物是指人和动物肠道内存在的数量巨大的微生物,通过帮助消化食物、提供营养物质、对抗病原体、维护机体免疫等过程来促进宿主的生长发育[7]。宿主体内肠道微生物的组成受多种因素的制约,其中温度会通过影响动物肠道微生物的组成,调控其生长发育[8]。在通常情况下,温度的变化会导致肠道菌群功能发生改变,从而影响对食物的消化吸收[9]。有研究[10]表明,在一定的温度范围内,随着温度的升高,南美白对虾肠道中的双歧杆菌(Bifidobacterium)和乳酸菌(Lactobacillus)等有益菌含量上升,抑制了病原菌的定植,从而促进宿主对食物的消化吸收。此外,陈紫单[11]发现阳澄湖中华绒螯蟹夏季较春季的微生物多样性有所增加,加速了机体的代谢,进而促进宿主对食物的吸收。
对中华绒螯蟹肠道微生物的研究已有较多报道,但主要集中在肠道微生物优势菌群的分类鉴定方面。如马清杨[12]研究了上海郊区养殖的中华绒螯蟹肠道中优势菌群主要为拟杆菌门(Bacteroidota)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和柔膜菌门(Tenericutes),陈小兵[13]也得到了相同的结论,而狄盼盼等[14]采用荧光计数法鉴定了中华绒螯蟹肠道内的优势菌群主要为γ-变形菌纲(Gammaproteobacteria),但对于影响中华绒螯蟹肠道微生物的因素(温度、盐度等)研究较少。而中华绒螯蟹的生长发育与温度密切相关,其生长差异是否因为温度的变化而引起其肠道微生物菌群的变化还缺乏深入研究。本研究根据前期的初步温度试验结果,设置了4个不同温度(26、29、32、35 ℃)对中华绒螯蟹的生长和肠道微生物菌群进行比较分析,探讨温度对中华绒螯蟹肠道微生物的影响以及肠道菌群与生长的关系。
1 材料与方法 1.1 实验蟹的饲养与管理本研究选取的实验河蟹为处于蜕壳间期的中华绒螯蟹“江海21”幼蟹,来自上海海洋大学水产动物种质试验站(上海市浦东新区新场镇),规格为(13.84±3.07) g/只,每只蟹附肢健全,饲养在河蟹个体恒温养殖系统内。每套该系统共有72个养殖盒(9行×8列),最上面一行种植绿萝用以净化水质,剩下64个养殖盒各自放养1只实验蟹,雌雄各一半,养殖盒为长35 cm、宽30 cm、高12.5 cm的长方体形状,水位高10 cm。本实验共设置了4个温度(26、29、32、35 ℃),每个温度用1套养殖系统,即每个温度组放养64只实验蟹。饲养过程中每天18:00投喂饲料,第2天8:00捞取剩余饲料与粪便。记录每只实验蟹的蜕壳日期,统计生长指标。相关公式如下:
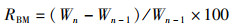 (1)
(1)
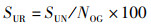 (2)
(2)
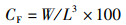 (3)
(3)
式中:RBM为增重率,%;W为体质量,g;L为头胸甲长,cm;SUR为存活率,%;SUN为实验结束时的存活个体数;NOG为实验开始时的放养个体数;n为蜕壳次数;CF为肥满度,%。采取的蜕壳间隔(MI)计算方法为:从放养日起至第1次蜕壳为第1次蜕壳间隔,从第1次蜕壳至第2次蜕壳为第2次蜕壳间隔,平均蜕壳间隔计算方法为两次蜕壳间隔相加后取平均值。其他生长指标也按此方法计算。
1.2 肠道微生物样本采集及测序在饲养的河蟹完成第2次蜕壳后的第15天,每个水温组选取10只河蟹进行肠道微生物检测(由于35 ℃水温组只蜕壳1次,故采样点为第1次蜕壳后的第15天)。在无菌环境下,用镊子挑取肠道后肠放入1.5 mL离心管中,随即放入液氮,并且置于-80 ℃冰箱内保存备用。
1.3 肠道菌群总DNA的提取与PCR扩增河蟹肠道DNA的提取参照FastDNA® Spin Kit for Soil试剂盒说明书进行,DNA经质检合格后,利用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′GGACTACHVG GGTWTCTAAT-3′)引物对河蟹肠道微生物的16S rRNA进行PCR扩增,构建双末端PE-300的测序文库,经IlluminaMiSeq平台高通量测序。
1.4 肠道微生物的测序数据处理和分析原始测序序列使用Fastp 0.19.6软件质控,使用FLASH软件进行拼接,根据97%的相似度对序列使用UPARSE 7.1软件进行运算分类单元(Operational Taxonomic Units,OTU)聚类,并在聚类的过程中去除单序列和嵌合体。利用RDP classifier (http://rdp.cme.msu.edu/) 对每条序列进行物种分类注释,将相似度高于97%的序列归为一个OTU,统计各样品中的OTU,去除无法分类的OTU后进行聚类分析和物种分类分析。利用Mothur 1.30.1软件计算每个样本的α多样性指数中的Chao、Ace、Shannon和Simpson指数,利用QIIME软件计算β多样性,利用非参数检验(ANOSIM相似性分析)基于unweighted_unifrac距离,检验组间(两组或多组)差异是否显著大于组内差异,然后利用R语言进行主坐标分析和画图。利用SPSS 20.0进行统计学差异分析。
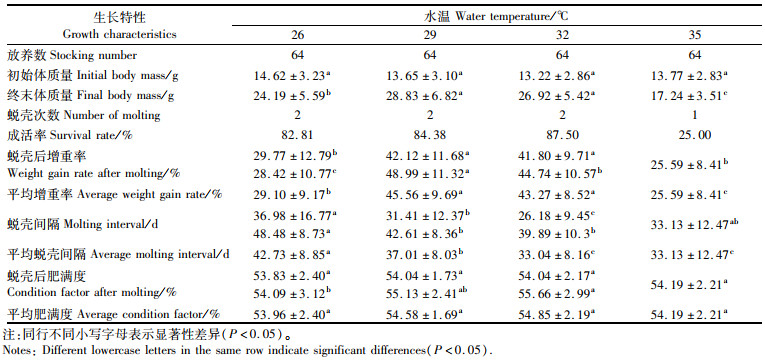
2 结果 2.1 不同水温条件下中华绒螯蟹的生长性能在121 d的饲养实验中,26、29、32 ℃水温组的中华绒螯蟹均蜕壳2次,35 ℃水温组仅蜕壳1次,成活率分别为82.81%、84.38%、87.50%和25.00%,平均蜕壳间隔分别为42.73 d、37.01 d、33.04 d和33.13 d, 26 ℃水温组的平均蜕壳间隔显著长于其他水温组(P < 0.05),29 ℃水温组的平均蜕壳间隔也显著高于32 ℃和35 ℃水温组(P < 0.05)。29 ℃水温组的平均蜕壳增重率最高,其次为32 ℃水温组,两者均显著高于26 ℃和35 ℃水温组(P < 0.05),35 ℃水温组的平均蜕壳增重率最低。此外,4个水温组的肥满度不存在显著性差异(P>0.05)。具体结果如表 1所示。
|
表 1 不同饲养水温下的中华绒螯蟹蜕壳与生长特性 Tab.1 The molting and growth characteristics of Chinese mitten crab cultured at different water temperatures |
通过16S rRNA测序,共得到1 974 125条有效序列,序列长度从401到440 bp不等,平均序列长度为423 bp,其中82.89%的序列长度在421到440 bp之间。对获得的序列经聚类分析后,26 ℃、29 ℃、32 ℃、35 ℃等4个水温组分别获得929、744、680、518个代表性的菌群OTU,表明随着温度的上升,OTU数目逐渐减少。4个水温组的共有OTU为249个,而特有的OTU分别为183、44、69、97个。见图 1。
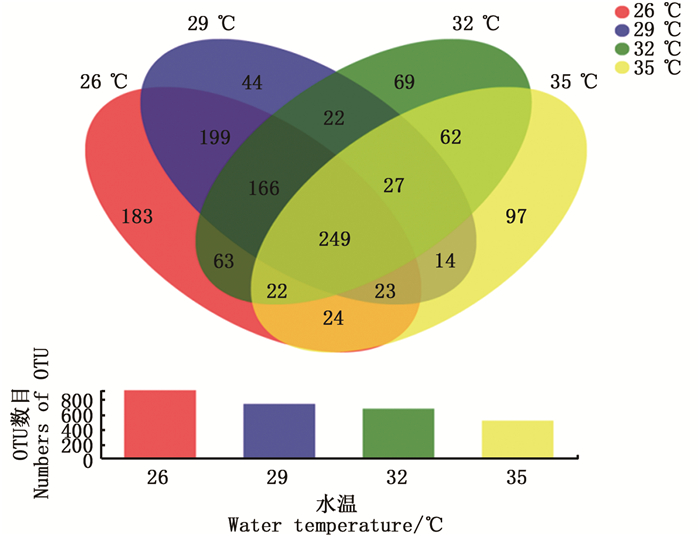
|
图 1 不同饲养水温下的中华绒螯蟹肠道微生物菌群运算分类单元比较 Fig. 1 Venn analysis of the OTU numbers of gut microbiota in Chinese mitten crab cultured at different water temperatures |
结果(表 2)表明:不同水温组显示出了显著差异的α多样性指数,其中Ace和Chao 1指数表现出随水温升高而明显下降的趋势,表明物种丰度随水温升高而有所降低;尽管Shannon和Simpson指数在29 ℃和32 ℃水温组没有表现出像Ace和Chao 1指数的规律性,但两者数值非常接近,总体上表现出Shannon指数随水温升高而下降,Simpson指数随水温升高而升高。β多样性(ANOSIM)分析结果显示4个水温组的肠道微生物菌群组成差异显著(P < 0.01),呈现出了不同的肠道微生物组成,见图 2。
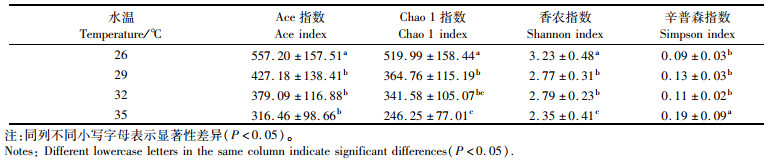
|
表 2 不同水温下中华绒螯蟹肠道微生物α多样性指数 Tab.2 The α diversity index of gut microbiota in Chinese mitten crab at different water temperatures |
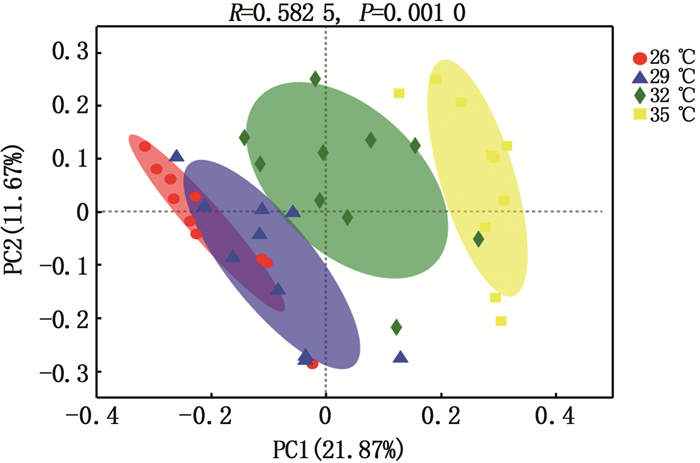
|
图 2 不同饲养水温下的中华绒螯蟹肠道微生物β多样性(ANOSIM) Fig. 2 The β diversity (ANOSIM) of gut microbiota in Chinese mitten crab cultured at different water temperatures |
物种组成分析结果(图 3)显示,4个水温组的中华绒螯蟹肠道优势菌群均为厚壁菌门、拟杆菌门和变形菌门,三者占整个中华绒螯蟹肠道菌群的96.26%,其余主要为放线菌门(Actinobacteriota)、弯曲杆菌门(Campilobacterota)和绿弯菌门(Chloroflexi)。
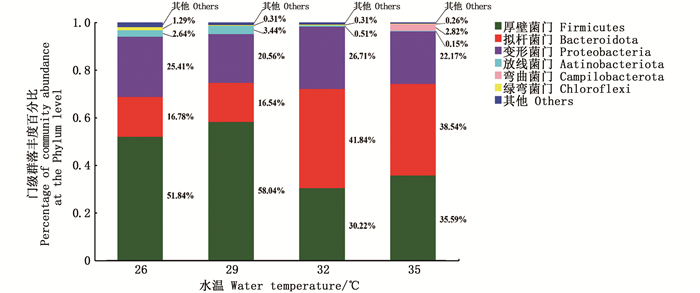
|
图 3 不同饲养水温下的中华绒螯蟹肠道微生物在门水平的菌群丰度 Fig. 3 Abundance at the phylum level of gut microbiota in Chinese mitten crab cultured at different water temperatures |
分析门水平的肠道微生物菌群组成发现,各水温组的菌群组成和丰度存在显著性差异,26 ℃水温组的髌骨菌门(Patescibacteria)和疣微菌门(Verrucomicrobia)丰度显著高于其他水温组(P < 0.05),29 ℃水温组的厚壁菌门和放线菌门丰度显著高于其他水温组(P < 0.05),32 ℃水温组的拟杆菌门丰度显著高于其他水温组(P < 0.05),35 ℃水温组的弯曲杆菌丰度高于其他水温组,但不存在显著性差异(P> 0.05)。见图 4。
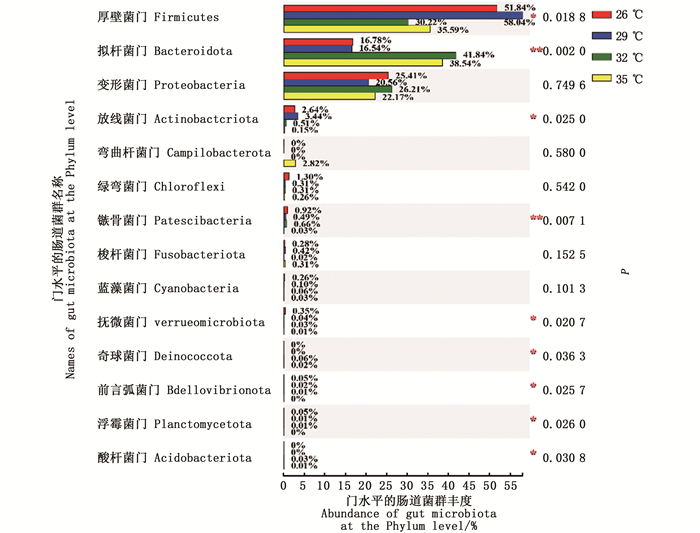
|
图 4 不同饲养水温下的中华绒螯蟹肠道微生物在门水平的菌群差异性比较 Fig. 4 Comparison of difference at the phylum level of gut microbiota in Chinese mitten crab cultured at different water temperatures |
在属水平,4个水温组的中华绒螯蟹肠道优势菌群为念珠菌属(genus Candidatus-Bacilloplasma)和营发酵单胞菌属(Dysgonomonas)。另外,肝浆念珠菌属(genus Candidatus-Hepatoplasma)、蔷薇菌属(Roseimarinus)等菌属丰度也相对较高。见图 5。
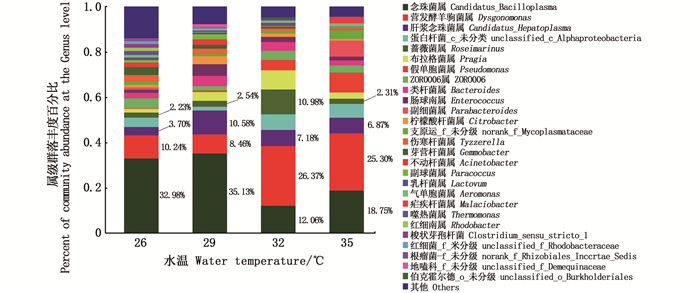
|
图 5 不同饲养水温下的中华绒螯蟹肠道微生物在属水平的肠道菌群丰度 Fig. 5 Abundance at the genus level of gutmicrobiota in Chinese mitten crab cultured under different water temperatures |
各水温组的肠道微生物菌群组成和丰度也存在显著性差异,26 ℃水温组的芽孢杆菌属(Gemmobacter)丰度显著高于其他水温组(P < 0.05),29 ℃水温组的柠檬酸杆菌属(Citrpbacter)丰度显著高于其他水温组(P < 0.05),32 ℃水温组的布拉格菌属(Pragia)丰度显著高于其他水温组(P < 0.05),35 ℃水温组的假单胞菌属(Pseudomonas)丰度显著高于其他水温组(P < 0.05)。见图 6。
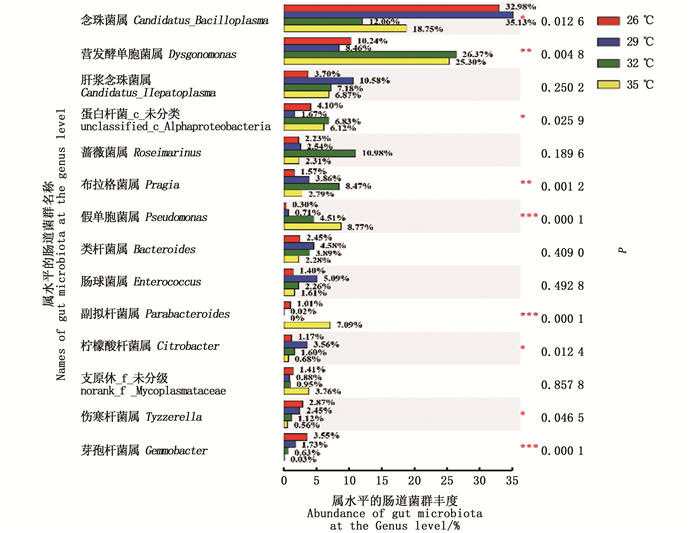
|
图 6 不同饲养水温下的中华绒螯蟹肠道微生物在属水平的菌群差异性比较 Fig. 6 Comparison of difference at the genus level of gut microbiota in Chinese mitten crab cultured at different water temperatures |
本研究应用个体恒温养殖系统饲养河蟹,探讨4个不同水温条件对河蟹生长及肠道微生物的影响。研究结果发现,随着水温从26 ℃升高到32 ℃,河蟹的成活率和蜕壳增重率有所增加,但超过32 ℃时,河蟹的生长受到了抑制,蜕壳间隔天数比李志华等[15]、黄姝等[16]所得到的结果要少,这可能是本研究设定的温度更高的缘故。有研究表明,生长在池塘、湖泊、河流等自然水体中的河蟹,当温度超过28 ℃时,其新陈代谢更旺盛,性腺发育也更旺盛,导致性早熟的发生,从而抑制了河蟹进一步的生长[17],同时过高的水温也易使养殖水体败坏,使河蟹生存困难[18]。此外,当水温超过33 ℃时,河蟹的体质会变弱,最终导致河蟹受到病害的侵袭,造成较高的死亡率[19]。本研究发现水温超过28 ℃至32 ℃时,河蟹也能较好地生长,且增重率和成活率也较高,表明河蟹在32 ℃以下也能较好生长,但本试验是在个体恒温养殖系统中进行的,水温恒定,没有野外水体中的水温高低变化,可较好反映温度对河蟹生长的影响。结合前期的研究结果(待发表资料),认为30 ℃左右时河蟹的生长最好。但河蟹作为低等的无脊椎动物,对温度较为敏感,温度对生长的影响还需进一步深入研究。
肠道微生物在动物的生长发育、免疫调控等方面具有重要的作用[20]。温度对动物的肠道微生物组成有重要影响。α多样性指数能够反应肠道微生物菌群组成的丰度及多样性,其中Ace和Chao指数反映群落丰度(Ace和Chao指数越大,群落丰度越高);而Shannon和Simpson反映群落的多样性(Shannon指数越大,群落多样性越高;Simpson指数越大,群落多样性越低)[21],如有研究表明,吉富罗非鱼(Oreochromis niloticus)在34 ℃时的肠道微生物多样性和丰度均低于28 ℃[22],拟穴青蟹(Scylla paramamosain)在26 ℃水温下的肠道菌群物种多样性高于30 ℃时的物种多样性[23]。在本研究中,肠道微生物的多样性和丰度均随着水温的升高而下降,表明较低温度更适合水产生物肠道微生物的生存和繁殖,特别是在35 ℃时,试验河蟹肠道微生物多样性最低,提示高温条件可能影响了肠道微生物的定植。本研究中,α多样性结果显示,26 ℃水温组的肠道微生物菌群的丰度和多样性均最高,但此水温下的生长并不是最好,印证了肠道微生物多样性并不是越高越好,而是存在一个最适的菌群比例[24]。
厚壁杆菌门和拟杆菌门菌群作为肠道微生物的两大优势菌群,对宿主的新陈代谢起着十分重要的作用[25]。厚壁杆菌菌群中部分细菌具有促进食物消化的作用[26],而拟杆菌菌群则是一类参与糖类代谢与运输的菌群,为宿主提供能量,进而促进宿主的生长[27]。本研究中这两种菌也是河蟹肠道微生物的优势菌群,同时在32 ℃水温组的拟杆菌门丰度显著高于其他水温组,因此生长较好。此外,有研究[13-14]发现,类杆菌属(Bacteroides)、营发酵单胞菌属、假单胞菌属、柠檬酸杆菌属(Citrobacter)等在河蟹肠道菌群中占比较高。本研究也得到了类似的发现。32 ℃水温组的优势菌群为营发酵单胞菌属,是有机化能营养菌,可以提供河蟹生长代谢所需要的营养,进而促进河蟹的生长。然而生物的生长不仅受到有益菌的促进作用,而且还受到有害菌的抑制作用,肠道内大量有害菌的存在会对宿主造成不利影响,如弯曲杆菌广泛存在于畜禽类,可以引起胃肠炎[28],又如疟疾杆菌属(Malaciobacter)会降低宿主的免疫力[29],这两种有害菌的存在会影响河蟹的摄食,导致无法积累足够的能量用于蜕壳生长,而弯曲杆菌和疟疾杆菌均在35 ℃水温组中被鉴定出,而其他组中均未被鉴定出,这在一定程度上解释了35 ℃水温组河蟹具有较高死亡率的原因。
| [1] |
张文博, 马旭洲. 2000年来中国水产养殖发展趋势和方向[J]. 上海海洋大学学报, 2020, 29(5): 661-674. ZHANG W B, MA X Z. China's aquaculture development trends since 2000 and future directions[J]. Journal of Shanghai Ocean University, 2020, 29(5): 661-674. |
| [2] |
管卫兵, 蔡天成, 杨牧川, 等. 河蟹的生态养殖现状及发展对策[J]. 湖南农业科学, 2012(3): 116-119. GUAN W B, CAI T C, YANG M C, et al. Status quo and developmental strategies of ecosystem approach to aquaculture of Chinese mitten crabin China[J]. Hunan Agricultural Sciences, 2012(3): 116-119. DOI:10.3969/j.issn.1006-060X.2012.03.034 |
| [3] |
彭姣. 养殖水环境对中华绒螯蟹幼蟹和成蟹生存与生长的影响[D]. 长沙: 湖南农业大学, 2017. PENG J. Effects of cultural water environment on survival and growth of juvenile and adult Eriocheir sinesis[D]. Changsha: Hunan Agricultural University, 2017. |
| [4] |
陈立侨, 堵南山, 赖伟. 水温饵料投饵率对河蟹生长和饵料转化率的影响[J]. 水产科技情报, 1993, 20(4): 153-157. CHEN L Q, DU N S, LAI W. Effects of water temperature, feeds and ration size on the growth and the feed conversion ratio of Chinese mitten crab(Eriocheir sinensis)[J]. Fisheries Science & Technology Information, 1993, 20(4): 153-157. |
| [5] |
YUAN Q, WANG Q D, ZHANG T L, et al. Effects of water temperature on growth, feeding and molting of juvenile Chinese mitten crab Eriocheir sinensis[J]. Aquaculture, 2017, 468: 169-174. DOI:10.1016/j.aquaculture.2016.10.007 |
| [6] |
董艳, 江和文, 于永清, 等. 稻田养蟹"盘山模式"的水温特征分析[J]. 安徽农业科学, 2010, 38(23): 12483-12485. DONG Y, JIANG H W, YU Y Q, et al. Characteristics of water-temperature of rice field crab "Panshan mode"[J]. Journal of Anhui Agricultural Sciences, 2010, 38(23): 12483-12485. DOI:10.3969/j.issn.0517-6611.2010.23.067 |
| [7] |
高渊, 陆晨希, 袁鹏, 等. 肠道微生物与环境健康关系的研究进展与展望[J]. 环境化学, 2021, 40(1): 1-10. GAO Y, LU C X, YUAN P, et al. Research progress and prospect of relationship between gut microbiotaand environmental health[J]. Environmental Chemistry, 2021, 40(1): 1-10. |
| [8] |
王振鑫, 邵丹, 宋志刚, 等. 热应激对家禽肠道微生物组成与功能的影响及其营养调控研究进展[J]. 中国家禽, 2020, 42(11): 91-99. WANG Z X, SHAO D, SONG Z G, et al. Research progress on effects of heat stress on composition and function of poultry intestinal microbes and nutritional regulation[J]. China Poultry, 2020, 42(11): 91-99. |
| [9] |
唐斌. 温度与饵料对绿盘鲍生长的影响研究[D]. 厦门: 厦门大学, 2019. TANG B. Influence of temperature and feed on the growth of "Green-pacific abalone hybrid"[D]. Xiamen: Xiamen University, 2019. |
| [10] |
尹军霞, 沈文英, 郦萍. 水温对南美白对虾肠道菌群影响的研究[J]. 海洋科学, 2004, 28(5): 33-36. YIN J X, SHEN WY, LI P. Study on the influence of water temperature on the intestinal microfloraof Penaeus vannamei[J]. Marine Sciences, 2004, 28(5): 33-36. DOI:10.3969/j.issn.1000-3096.2004.05.007 |
| [11] |
陈紫丹. 阳澄湖与太湖螃蟹生长环境及肠道微生物多样性与群落结构比较研究[D]. 苏州: 苏州科技学院, 2015. CHEN Z D. A comparative study on the microbialdiversity and community structure of thecrab gut in Tai Lake and YangchengLake[D]. Suzhou: Suzhou University of Science and Technology, 2015. |
| [12] |
马清扬. 上海郊区养殖中华绒螯蟹及其环境微生物多样性分析[D]. 上海: 上海海洋大学, 2020. MA Q Y. Microbial diversity analysis of cultured Chinese mitten crab (Eriocheir sinensis) and its environment in Shanghai suburb[D]. Shanghai: Shanghai Ocean University, 2020. |
| [13] |
陈小兵. 中华绒螯蟹肠道核心菌群初探[D]. 上海: 上海海洋大学, 2015. CHEN X B. Core bacterial community associated with the intestinal tract of Chinese mitten crab (Eriocheir sinensis)[D]. Shanghai: Shanghai Ocean University, 2015. |
| [14] |
狄盼盼, 陈小兵, 孙国伟, 等. 养殖中华绒螯蟹肠道内优势细菌群组成分析[J]. 微生物学杂志, 2014, 34(1): 58-61. DI P P, CHEN X B, SUN G W, et al. Constitution analysis of intestinal dominant bacteria community in cultured Chinese mitten crab(Eriocheir sinensis)[J]. Journal of Microbiology, 2014, 34(1): 58-61. DOI:10.3969/j.issn.1005-7021.2014.01.011 |
| [15] |
李志华, 卢德胤, 刘兆强, 等. 中华绒螯蟹在"蟹龙宫"饲养环境中的个体蜕壳与生长[J]. 上海海洋大学学报, 2019, 28(4): 511-518. LI Z H, LU D Y, LIU Z Q, et al. Individual molting and growth characters of Eriocheir sinensis reared in "Crab Palace" system[J]. Journal of Shanghai Ocean University, 2019, 28(4): 511-518. |
| [16] |
黄姝, 王中清, 茅海成, 等. 中华绒螯蟹在实验室条件下的成蟹阶段蜕壳与生长观察[J]. 上海海洋大学学报, 2014, 23(3): 359-365. HUANG S, WANG Z Q, MAO H C, et al. Observation on molting and growth of adult Chinese mitten crab reared in the laboratory condition[J]. Journal of Shanghai Ocean University, 2014, 23(3): 359-365. |
| [17] |
付龙龙, 周刚, 李跃华, 等. 中华绒螯蟹蟹种性早熟研究进展[J]. 江苏农业科学, 2017, 45(12): 19-23. FU L L, ZHOU G, LI Y H, et al. Research progress on precocious puberty of Chinese mitten crab (Eriocheir sinensis)[J]. Jiangsu Agricultural Sciences, 2017, 45(12): 19-23. |
| [18] |
张士罡, 李为学. 河蟹高温季节高产措施[J]. 农家顾问, 2016(7): 48-49. ZHANG S G, LI W X. High yield measures of crab in high temperature season[J]. Farmer's Consultant, 2016(7): 48-49. |
| [19] |
杨勇. 高温对河蟹养殖的危害及其控制[J]. 养殖与饲料, 2020(3): 52-54. YANG Y. Harm of high temperature to crab culture and its control[J]. Animals Breeding and Feed, 2020(3): 52-54. DOI:10.3969/j.issn.1671-427X.2020.03.020 |
| [20] |
钟奇祺, 张海波, 幸清凤, 等. 肠道微生物及代谢产物对动物肠道免疫的研究进展[J]. 中国畜牧杂志, 2021, 57(2): 28-33. ZHONG Q Q, ZHANG H B, XING Q F, et al. Advances in the effects of intestinal microorganisms and metabolites on host intestinal mucosal innate immune system[J]. Chinese Journal of Animal Science, 2021, 57(2): 28-33. |
| [21] |
徐晟云, 陈昆慈, 罗青, 等. 基于16S rRNA高通量测序的鳢肠道微生物群落结构研究[J]. 大连海洋大学学报, 2020, 35(5): 693-700. XU S Y, CHEN K C, LUO Q, et al. Microbial community in intestine of snakehead based on 16S rRNA high-throughput sequencing[J]. Journal of Dalian Ocean University, 2020, 35(5): 693-700. |
| [22] |
曾楠楠. 不同水温对吉富罗非鱼的饲料蛋白质需要量、生理代谢及肠道微生物的影响[D]. 上海: 上海海洋大学, 2020. ZENG N N. Effects of different temperatures on dietary protein requirement, physiological metabolism and intestinal microbial community of GIFT tilapia (Oreochromis niloticus)[D]. Shanghai: Shanghai Ocean University, 2020. |
| [23] |
罗金飞, 廖永岩, 李书迪, 等. 温度对拟穴青蟹循环水养殖系统微生物群落结构的影响[J]. 中国水产科学, 2020, 27(4): 393-405. LUO J F, LIAO Y Y, LI S D, et al. Influence of temperature on microbial community structure in a Scylla paramamosain recirculating aquaculture system[J]. Journal of Fishery Sciences of China, 2020, 27(4): 393-405. |
| [24] |
CHEN X W, LU D Y, LI Z H, et al. Plant and animal-type feedstuff shape the gut microbiota and metabolic processes of the Chinese mitten crab Eriocheir sinensis[J]. Frontiers in Veterinary Science, 2021, 8: 589624. DOI:10.3389/fvets.2021.589624 |
| [25] |
唐圆, 谢果珍. 多糖与肠道菌群的相互作用研究进展[J]. 现代农业科技, 2020(9): 225-227. TANG Y, XIE G Z. Research progress on interaction between polysaccharide and gut microbiota[J]. Modern Agricultural Science and Technology, 2020(9): 225-227. DOI:10.3969/j.issn.1007-5739.2020.09.135 |
| [26] |
吴金凤, 熊金波, 王欣, 等. 肠道菌群对凡纳滨对虾健康的指示作用[J]. 应用生态学报, 2016, 27(2): 611-621. WU J F, XIONG J B, WANG X, et al. Intestinal bacterial community is indicative for the healthy status of Litopenaeus vannamei[J]. Chinese Journal of Applied Ecology, 2016, 27(2): 611-621. |
| [27] |
卢德胤. 不同饵料组合、温度对中华绒螯蟹的蜕壳、代谢组学与肠道微生物研究[D]. 上海: 上海海洋大学, 2019. LU D Y. Studies on molting, metabolomics and gut microbiotas under different foods and temperatures of Chinese mitten crab[D]. Shanghai: Shanghai Ocean University, 2019. |
| [28] |
王爱霞. 猪空肠弯曲菌感染的防治[J]. 中国畜禽种业, 2020, 16(9): 165. WANG A X. Prevention and treatment of campilobacter jejuni infection in pigs[J]. The Chinese Livestock and Poultry Breeding, 2020, 16(9): 165. DOI:10.3969/j.issn.1673-4556.2020.09.134 |
| [29] |
高文燕. TLR2、TLR4、TLR7、TLR9在夏氏疟原虫感染BALB/c小鼠过程中对细胞免疫, 体液免疫及免疫记忆形成的生物学作用[D]. 沈阳: 中国医科大学, 2020. GAO W Y. Functions of TLR2, TLR4, TLR7, and TLR9 in cellular immunity, humoral immunity, and immunological memory formation during BALB/c mice infected with Plasmodium chabaudi[D]. Shenyang: China Medical University, 2020. |
2. National Demonstration Centre for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


