2. 中国水产科学研究院南海水产研究所 农业农村部水产品加工重点实验室, 广东 广州 510300
大黄鱼(Pseudosciaena crocea)是我国产量最高的海水养殖鱼类,主要分布在东南沿海地区,具有很高的商业价值[1]。根据2020年《中国渔业年鉴》[2],2019年大黄鱼产量增至22.6 t,目前大黄鱼主要是以冷冻、腌制和调理食品加工为主,在加工过程产生大量的内脏等下脚料[3],这部分未得到有效利用,小部分作为饲料,大部分丢弃,造成了资源的浪费与环境的污染。因此,将大黄鱼加工下脚料进行高值化利用,对于提高大黄鱼附加值和促进产业良性发展具有重要的意义。大黄鱼内脏中,鱼肝占36.65%,也占鱼体质量的4.75%[4],是内脏中最具开发潜力的原料。鱼肝的营养分析表明其脂质含量丰富,为37.97%,不饱和脂肪酸达62.63%,含有大量的n-3多不饱和脂肪酸,特别是二十碳五烯酸(EPA,C20∶ 5n-3)和二十二碳六烯酸(DHA,C22∶ 6n-3)含量达9.42% [5]。EPA、DHA具有调节血脂、降低血液黏度、增强大脑功能、改善和增加记忆力、增强人体免疫功能、抑制炎症等功效[6-8]。目前本研究团队建立了酶法从大黄鱼肝中提取大黄鱼肝油的工艺技术[9]。但未精制鱼肝油中含有大量杂质,而且腥臭味极厚重,所以需要对大黄鱼肝油进行精制和脱臭,以满足后续大黄鱼肝油食品或保健功能产品的开发。
目前对于鱼肝油的精制技术未见有报道。而鱼油的精制研究较多,常见主要是将鱼油进行脱胶、脱酸、脱色,以及分子蒸馏法、水蒸气蒸馏法等进行脱臭[10],而绿茶多酚(GTP)是绿茶中的提取物,用于食品中不仅防异味效果好, 而且安全、无毒, 无致癌、致畸、致突变等不良作用, 是一种非常理想的除臭剂[11],所以本文研究将酶法制备的大黄肝油进行脱胶、脱酸、脱色,并比较分子蒸馏法、水蒸气蒸馏法、液-液萃取法、固相吸附法、绿茶多酚(GTP)处理法几中脱臭方法处理之后,对大黄鱼肝油的理化性质(酸价、过氧化值、碘值),感官评价、脂肪酸及挥发性成分的影响,获得最佳的大黄鱼肝油精制技术,为后续大黄鱼肝油制品开发提供技术依据。
1 材料与方法 1.1 实验材料新鲜完整的大黄鱼肝由中国宁德金盛水产有限公司提供,运到实验室后分小袋包装,-18 ℃贮藏备用。脂肪酸标准品、14%三氟化硼甲醇、正己烷、碘化钾、GTP、活性白土、硅藻土、沸石、韦氏试剂、硫代硫酸钠、环己烷、苯乙酸异戊酯等购自上海麦克林生化技术有限公司。冰醋酸、氯仿、氢氧化钾购自北京依珊汇通科技有限公司,中性蛋白酶(200 U/mg)购自合肥博美生物科技有限责任公司。
1.2 大黄鱼肝油酶法制备冷冻大黄鱼肝解冻并捣碎,选用中性蛋白酶对大黄鱼肝油进行酶解制备[9]。酶解条件:酶添加量为鱼肝质量的2.5%,料液比1∶ 2(g/mL),pH为7,酶解时间3.0 h,酶解温度50 ℃。酶解后离心,取出上层油脂,即为粗制鱼肝油。
1.3 大黄鱼肝油精制工艺[10] 1.3.1 脱胶工艺将粗制鱼肝油进行脱胶处理,工艺参数:温度80 ℃,时间30 min,脱胶剂(85%磷酸)加入量为油量的1%,转速200 r/min,反应结束后,以10 000 r/min离心10 min。所得油样称为脱胶鱼肝油。
1.3.2 脱酸工艺将脱胶鱼肝油进行脱酸处理,工艺参数:温度40 ℃,时间20 min,碱液(20%NaOH)的加入量与脱胶油的酸值(AV)有关,理论加入量W理论值=7.13×10-4×W脱胶油×AV,W超量碱=4%×W脱胶油,W总加入量=W理论值+W超量碱,转速200 r/min,反应结束后,10 000 r/min离心10 min后,加入95 ℃热水洗涤3次,用量约占油质量的10%,用水冲洗至中性,产生的油样称为脱酸鱼肝油。
1.3.3 脱色工艺脱酸鱼肝油进行脱色处理,工艺参数:温度70 ℃,时间20 min,活性白土加入量占油质量的10%,转速200 r/min,反应结束后,以10 000 r/min离心10 min,得到脱色鱼肝油。
1.3.4 脱臭工艺按以下方法对脱色鱼肝油分别进行脱臭处理:
(1) 旋蒸:100 g脱色鱼肝油于旋转蒸发器,加热温度为100 ℃,时间为60 min,压力为0.06 MPa,旋蒸速度为120 r/min,反应结束后得到旋蒸脱臭鱼肝油。
(2) 固相吸附:100 g脱色鱼肝油于敞口容器,与吸附剂(10∶ 1,体积比)混合,混合物于70 ℃水浴静置吸附15 min,依次测试沸石、活性白土和硅藻土3种吸附剂,常温下,以10 000 r/min离心10 min,收集得到3种吸附脱臭鱼肝油。
(3) 脱臭液:将5 g氢氧化钾溶于1 000 mL乙醇-水溶液(45∶ 55,V/V),制成脱臭液。取100 g脱色鱼肝油于锥形瓶,加入500 mL碱性稀乙醇中,于70 ℃水浴加热,反应15 min,反应结束后,冷却至室温,以10 000 r/min离心10 min,分离油层,用水冲洗至中性,得到脱臭液脱臭鱼肝油。
(4) GTP处理:100 g脱色鱼肝油于锥形瓶中,加入10 g GTP,将混合物加热至60 ℃,并在真空(60 kPa)下以200 r/min速度搅拌20 min,反应结束后,冷却到常温,以10 000 r/min离心10 min。收集GTP脱臭鱼肝油。
1.4 鱼肝油理化特性测定根据国家标准GB 5009.229—2016、GB/T 5532—2008和GB 5009.227—2016,采用滴定法测定了油脂的酸值(AI)、碘值(IV)和过氧化值(POV)。AI、IV和POV的单位分别为mg/g、g/100 g和mmol/kg。
1.5 脂肪酸的测定QP2010 plus气相色谱-质谱仪用于脂肪酸的测定(日本岛津公司)。取上述不同精制阶段的鱼肝油200 μL,加入2 mL 14%三氟化硼-甲醇溶液,在60 ℃水浴中加热30 min,冷却至室温,与1 mL正己烷和1 mL蒸馏水混合。静置分层后,用0.22 μm有机滤膜过滤得到上清液,并用GC-MS对上清液进行分析。
(1) 色谱条件[12]:色谱柱为HP-5MS(30 m×0.25 mm,0.25 μm); 进样温度250 ℃; 分流比1∶ 30,进样体积1 μL,流速1.52 mL/min,载气为高纯氦; 加热程序为110 ℃加热4 min,10 ℃/min加热1 min,然后4 ℃/min加热1 min; 升温至210 ℃持续3 min,最后以4 ℃/min升温至240 ℃,并持续8 min。
(2) 质谱条件:离子源温度200 ℃; 电源电压70 eV; 溶剂延迟时间3 min。
1.6 挥发性风味成分的测定安捷伦7890A-5975C GC-MS用于挥发性风味成分的测定(美国,德国威尔明顿)。气相色谱柱为HP-5MS(60 m×250 μm×0.25 μm)。
1.6.1 样品制备鱼肝油在35 ℃的水浴中融化。将1 mL均匀样品放入2 mL液相小瓶中。加入50 μg苯乙酸异戊酯作为内标(1 mg/mL,加入50 μL),充分混合。将30 μL标准加入样品放入60 μL衬管中,放入进样衬管中,置于样品托盘中进行样品分析。
1.6.2 气相色谱-质谱条件GC条件:载气流速1.5 mL/min,分流比5∶ 1,气质传输线温度260 ℃; 升温程序:初始50 ℃,保持2 min,以5 ℃/min升温到100 ℃保持2 min; 4 ℃/min升温到140 ℃保持2 min; 3 ℃/min升温到190 ℃保持1 min; 10 ℃/min升温到250 ℃保持5 min。
MS条件:离子源温度230 ℃,四级杆温度150 ℃,EI电离70 eV, 全扫描35~550 da。
1.7 感官评价感官评定小组由10位有经验的感官评价员组成并设计了感官评价评分表(表 1),且团队成员健康,无嗅觉或味觉的不良状况[13]。
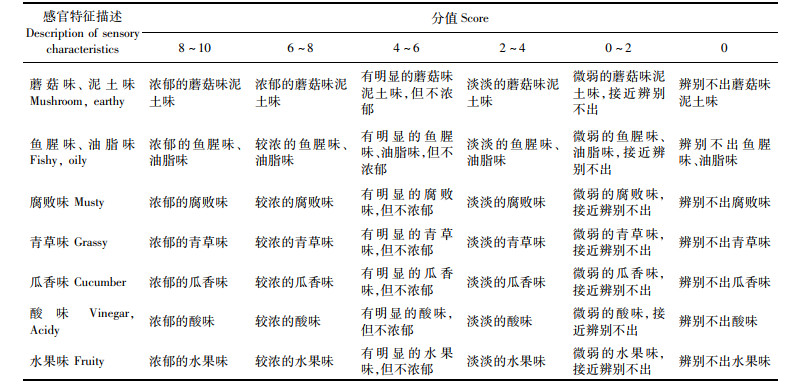
|
表 1 挥发性风味感官评价评分表 Tab.1 Sensory evaluation scale for volatile flavor |
样品进行3次平行实验,结果均表示为平均值±标准差后用Excel软件绘图,采用SPSS统计分析软件的ANOVA和Duncan氏法(α=0.05),P < 0.05为差异显著,P>0.05为差异不显著。
2 结果与分析 2.1 精制与脱臭对大黄鱼肝油理化性质的影响酸价越低,鱼肝油品质越好。碘值与鱼肝油中不饱和脂肪酸(UFA)的比例密切相关[14],碘值越高,鱼肝油品质越佳。过氧化值是衡量油中氧化降解产物的指标,过氧化值越低品质越好。由表 2可见精制过程中大黄鱼肝油酸价、碘值与过氧化值均发生了显著的变化,其中酸价降低63.54%、碘值提高1.19倍,过氧化值降低38.92%, 说明经脱胶、脱酸和脱色后的鱼肝油品质提到较大的提高。
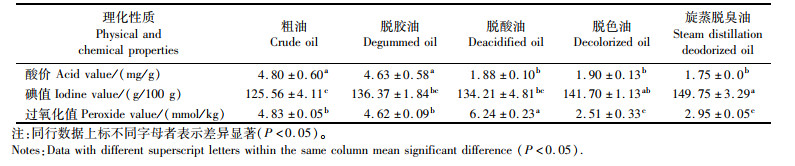
|
表 2 四个精制阶段大黄鱼肝油的理化性质 Tab.2 Physicochemical properties of large yellow croaker liver oil prepared by four refining stages |
对三脱后的鱼肝油采用不同脱臭方法处理后,其酸价、碘值与过氧化值结果见表 3,均符合国家标准[15]。由表 3可见,旋蒸、沸石或硅藻土吸附处理对鱼肝油酸价无显著区别。但脱臭液处理对鱼肝油酸价影响较大,与其他脱臭方法差异极显著(P < 0.05),其酸价是最低的,与脱色油相比降低了87.37%,原因应是脱臭液中含有KOH碱性化合物造成的。活性黏土吸附及GTP处理的鱼肝油酸价与脱色油相比略有增加,可能是由于温度及脱臭时间的影响造成鱼肝油酸价的增加。不同脱臭方法所制备的鱼肝油碘值略有差异,但均符合国家标准[15],旋蒸法得到的鱼肝油碘值最低,主要原因应为处理过程的温度过高。GTP处理的鱼肝油碘值最高,与脱色油相比碘值增加了1.12倍,脱臭液处理的鱼肝油碘值与GTP脱腥鱼肝油相差不大。过氧化值中,GTP法制得鱼肝油过氧化值最低,与脱色油相比降低了37.8%,这与GTP具有强大的抗氧化剂和螯合能力,可防止鱼肝油氧化有关。活性黏土与硅藻土处理的鱼肝油过氧化值略高,可能是由于制备过程处于开放条件且温度略高,引起了鱼肝油的氧化,导致了过氧化值上升。
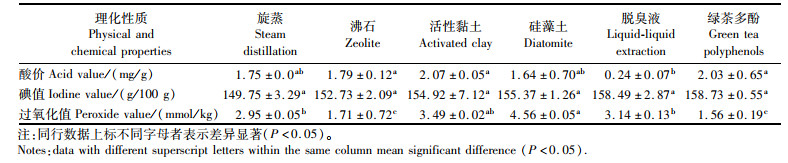
|
表 3 不同脱臭方法制备大黄鱼肝油的理化性质 Tab.3 Physicochemical properties of large yellow croaker liver oil prepared by different deodorization methods |
由表 4可知:饱和脂肪酸中,精制油较粗油增加1.2倍。单不饱和脂肪酸中C16∶ 1(棕榈油酸)、C18∶ 1(油酸)为主要成分,相对含量平均达21.73%与40.04%,鱼肝油经精制后单不饱和脂肪酸含量略有下降。在多不饱和脂肪酸中,C18∶ 2 (亚油酸)最为丰富,且随着精制进程的不断推进,其含量不断增加。精制油中EPA与DHA的相对含量比粗油增加了1.84倍。此外,粗油中出现少量反式脂肪酸是由酶解时间略长导致的。反式脂肪酸摄入会引起全身性炎症,并可能增加胰岛素的抗性[10],世界卫生组织建议将反式脂肪的摄入量限制在总能量摄入量的1%以下,测定结果均符合标准。不同的脱臭方法对鱼肝油脂肪酸的影响明显。在饱和脂肪酸中,旋蒸、沸石、硅藻土、碱性稀醇处理组的含量都明显增加,以棕榈酸(C16∶ 0)含量增加最明显,脱臭液处理组比脱色油含量增加1.13倍,比活性黏土组增加1.45倍; 而活性黏土、GTP处理组则含量降低,其中C16∶ 0明显降低,且GTP处理组的C18∶ 0也明显降低。在单不饱和脂肪酸中,棕榈油酸、油酸含量相对较多,棕榈油酸在旋蒸处理组的含量较脱色油略有增加,但在沸石、活性黏土、硅藻土、脱臭液、GTP处理组含量均下降,其中脱臭液处理组下降最多,为22.13%。油酸在脱臭液处理组最多,较脱色油增加1.12倍; 其余处理组均减少。在多不饱和脂肪酸中,亚油酸含量最为丰富,但有一定差异。脱臭液处理组亚油酸相对含量最低,仅为4.79%,沸石处理组亚油酸含量最高,为14.60%。EPA和DHA中,各脱臭鱼肝油较脱色油均有明显提高,其中活性黏土组含量最高,为16.39%。旋蒸和沸石法均使C18∶ 3明显降低,而其脱臭方法对C18∶ 3几乎无影响。。在EPA和DHA中,各脱臭法处理的鱼肝油较脱色油均有明显提高,其中活性黏土法含量最高,为16.39%,比三脱精制后的增加了1倍; 各脱臭方法均能明显提高DHA的含量。总体来看,经不同脱臭方法制备,其脂肪酸组成及含量略有差异,但总体品质较为优质,均可保证其营养成分并提高功能特性。
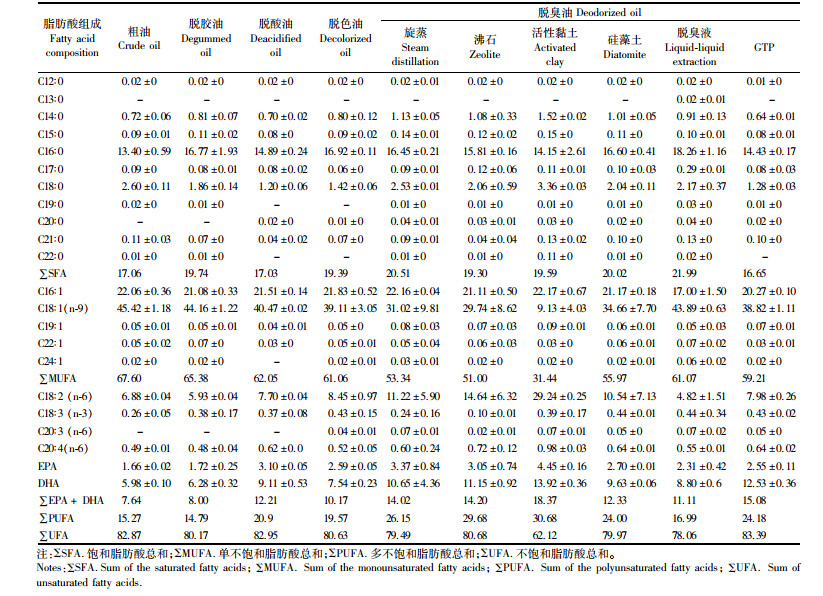
|
表 4 精制与脱臭工艺对大黄鱼肝油脂肪酸的影响 Tab.4 Effect of refining and deodorizing process on fatty acids of large yellow croaker liver oil |
在鱼肝油中,感官特性与特定香味化合物有一定关联,它不仅可以提供一些有关鱼肝油整体质量的判定标准,还可能反映出鱼肝油本身的氧化状态。大黄鱼肝油4个精制阶段与不同脱臭方法的代表性鱼肝油风味如图 2所示。鱼肝油经精制后变为澄清透明的淡黄色,同时对脱去油脂味、鱼腥味和酸味也有一定效果。
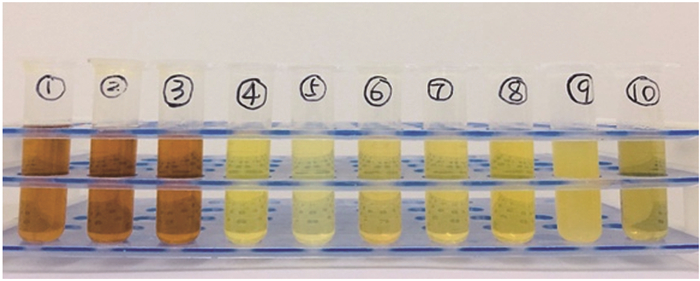
|
(1)粗油; (2)脱胶油; (3)脱酸油; (4)脱色油; (5)活性黏土固相吸附脱臭油; (6)硅藻土固相吸附脱臭油; (7)沸石固相吸附脱臭油; (8)旋蒸脱臭油; (9)脱臭液吸附脱臭油; (10)绿茶多酚脱臭油。 (1) Crude oil; (2) Degummed oil; (3)Deacidified oil; (4) Decolorized oil; (5) Deodorized oil by activated clay solid phase adsorption; (6) Deodorized oil by diatomite solid phase adsorption; (7) Deodorized oil by zeolite solid phase adsorption; (8) Deodorized oil by steam distillation; (9) Deodorized oil by liquid-liquid extraction; (10) Deodorized oil by GTP treatment. 图 1 精制和脱臭工艺鱼肝油 Fig. 1 Refining and deodorization of large yellow croaker liver oil |
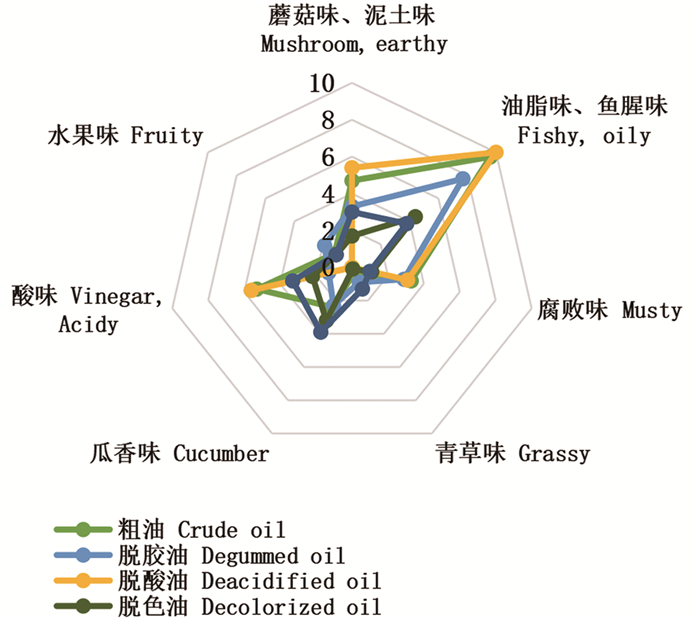
|
图 2 四个精制阶段大黄鱼肝油的风味雷达图 Fig. 2 Flavor radar map of large yellow croaker liver oil prepared by four refining stages |
鱼肝油脱臭后,其风味因脱臭方法的不同而不同。活性黏土吸附脱臭后色泽较脱色油更浅,与其他鱼肝油有显著差异,然而,产生了一种青草味,并与一种轻微的油脂味、鱼腥味混合在一起,带来了一种不愉快的味道。经沸石和硅藻土和脱臭液处理的样品颜色无明显变化与脱色油相近,味道也略有改善。GTP脱臭油颜色呈淡绿色,油脂味、鱼腥味较低,还有一定清香味。同时脱臭液也可以有效去除油脂味、鱼腥味等不良风味并产生有清香味。
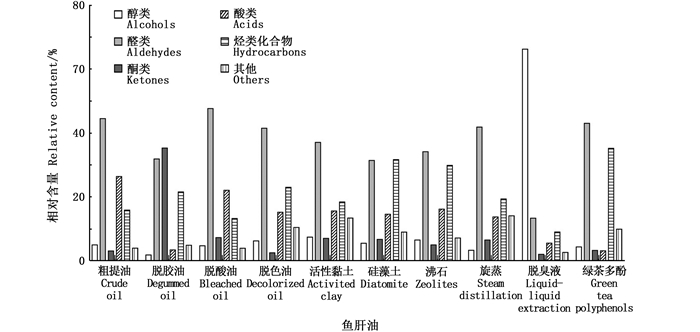
2.4 精制与脱臭工艺对大黄鱼肝油挥发性化合物的影响由大黄鱼肝油在精制过程以及不同脱臭方法的挥发性成分的热图(图 4)和相对含量(图 5),可见大黄鱼肝油在各处理阶段中醛类化合物为主要的化合物。
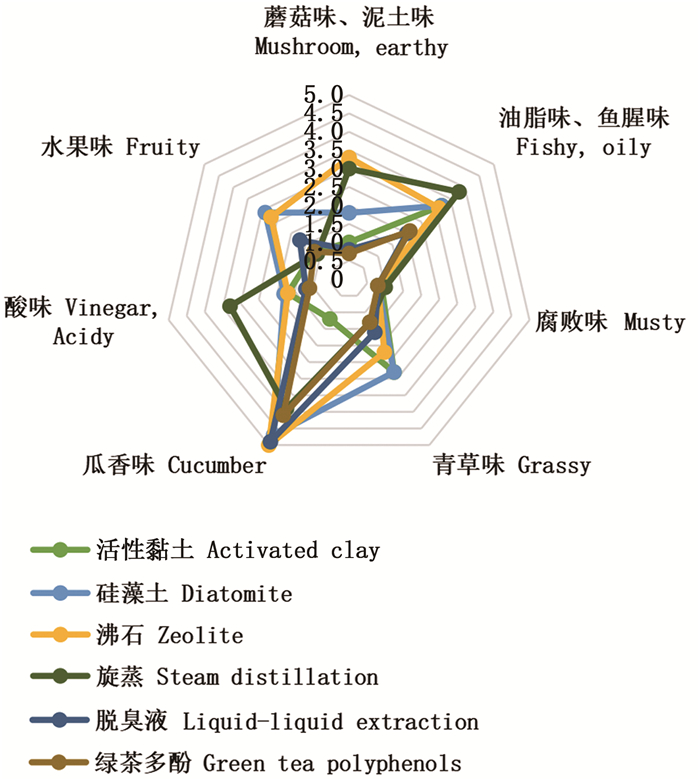
|
图 3 不同脱臭方法制备大黄鱼肝油的风味雷达图 Fig. 3 Flavor radar map of large yellow croaker liver oil prepared by different deodorization methods |
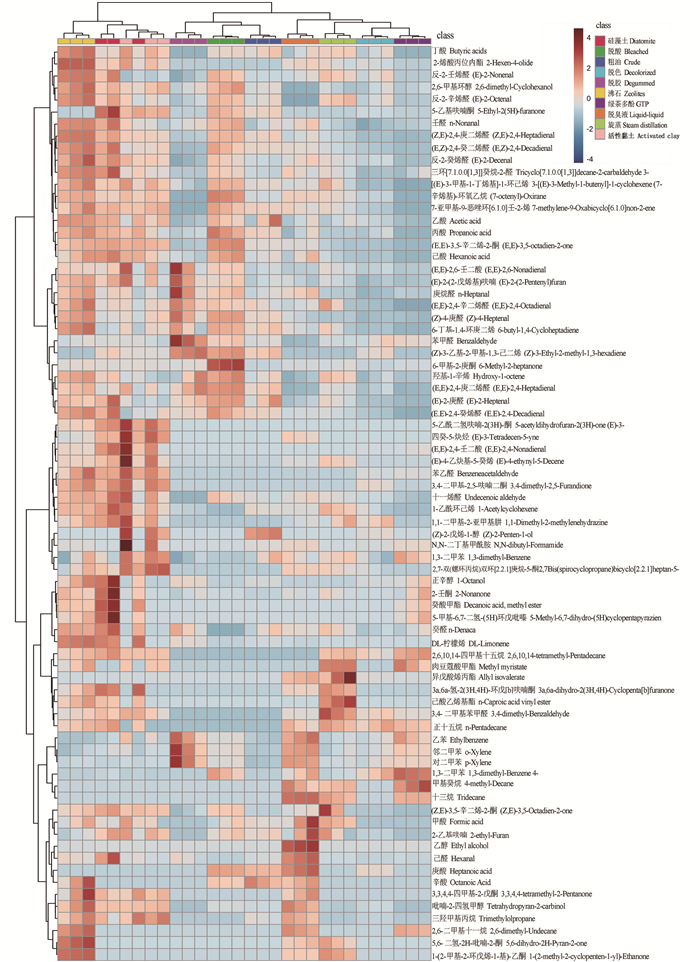
|
图 4 各阶段鱼肝油热图 Fig. 4 Heatmap of fish liver oil in different stages |
|
图 5 各阶段鱼肝油中各类挥发性成分相对含量 Fig. 5 Relative contents of volatile components in fish liver oil at different stages |
醛类化合物是鱼肝油风味的主要来源,也是脂质氧化的主要产物[16]。由图 4和图 5可见,含量最高的挥发性化合物为2, 4-庚二烯醛,其次是2, 4-癸二烯醛,而其他醛类化合物如庚醛、壬醛也有相对较多的含量。醛类被认为是氧化过程中的重要指标,同时也是产生油性气味的原因[17],鱼肝油经精制后,醛类化合物含量有明显降低。
酮通常由脂肪酸的脂质自氧化或不饱和脂肪酸通过氢过氧化物的自氧化产生,阈值通常很低,对油脂整体风味影响显著[18]。酮类化合物中3, 5-辛二烯酮含量最高,经脱酸后含量较大,较粗鱼肝油增加了2.88倍。其原因应为沸水洗涤导致其氧化,但随着精制的不断深入其含量也显著降低。2-壬酮的含量在精制过程中没有明显的变化。
醇也可通过脂肪酸氢过氧化物的二次分解形成,且测定的醇类化合物中1-辛烯-3-醇具有较低阈值,其他醇类化合物对鱼肝油的风味贡献不大[19]。醇类化合物中1-辛烯-3-醇具有蘑菇味[20],其含量的变化也可以反映产品的酸败程度。在鱼肝油精制的过程中,脱酸鱼肝油的1-辛烯-3-醇含量略增加,但经脱臭和脱色后,其含量下降。
2.4.2 不同脱臭方法对鱼肝油挥发性成分的影响由图 4和图 5可见,醛类化合物中,2, 4-庚二烯醛、2, 4-癸二烯醛对各鱼肝油风味影响较大,具有鱼腥味、青草味,是主要呈味物质。活性黏土、沸石、硅藻土处理组均高于脱色油的2倍以上,其数值过高的原因为固相吸附过程与氧气接触较多,且温度相对较高,使亚油酸和亚麻酸等多不饱和脂肪酸发生了氧化反应,使其含量上升。其他脱臭方法的工艺条件的氧化程度较小,尤其是GTP处理组2, 4-庚二烯醛、2, 4-癸二烯醛等醛类化合物降低明显,分别减少了31.25%与56.88%, 且具有青草味的己醛、壬醛略有增加,应为风味改善的主要原因。
酮类化合物中,3, 5-辛二烯酮为含量最高的酮类化合物,其阈值极低,极具代表性。GTP处理组脱去3, 5-辛二烯酮多达81.84%,GTP具有抗氧化性,使挥发性成分改善效果显著。旋蒸虽然温度较高,但水蒸气溶解了一部分挥发性成分,并被排气带走,所以增量较少,脱臭液可溶解大部分醛酮也并未有明显增加,而3种固相吸附脱臭的酮类含量不减反增,并没有起到很好的脱臭作用。
醇类化合物中,GTP处理组的1-辛烯-3-醇含量最低,降低了52.76%,这极大的改善了鱼肝油的风味。随后活性黏土和脱臭液处理组也有明显的减少,与粗鱼肝油相比分别下降了25.27%与24.44%。但硅藻土和旋蒸脱臭鱼肝油变化不明显,沸石吸附脱臭不减反增,没有起到很好的脱臭效果。
此外,鱼肝油中如碳氢化合物、酸类化合物、脂类化合物及其他化合物虽占有一定比例,由于其具有高气味阈值,这些化合物对其的整体香气影响不大。
3 结论本文全面分析了大黄鱼肝油在4个精制阶段和不同脱臭方法的理化性质、脂肪酸含量与挥发性成分的变化。粗制大黄鱼肝油经脱胶、脱酸、脱色和脱臭精制之后,可明显降低酸价和过氧化值,提高碘值,鱼肝油色泽澄清为明黄色,精制过程单不饱和脂肪酸略有降低,但EPA与DHA增加了1.84倍,精制过程使醛类化合物含量有明显降低,3, 5-辛二烯酮、1-辛烯-3-醇均是先增大后降低。
不同脱臭方法对鱼肝油的品质影响显著,其中GTP对酸价影响不明显,但碘值提高了1.12倍,过氧化值降低了37.8%。不同脱臭方法对脂肪酸均有影响,GTP使饱和脂肪酸略有下降,不饱和脂肪酸略有增加,而高不饱和脂肪酸如EPA和DHA含量明显增加,比粗油增加了1倍,比三脱后的精制鱼油增加了48%,而活性黏土法则是饱和脂肪酸、不饱和脂肪酸含量明显增加,EPA和DHA含量比三脱精制后的增加了1倍。脱臭方法对鱼肝油色泽影响不明显,但可均降低鱼肝油的腥臭味,GTP对鱼肝油色泽颜色呈淡绿色,油脂味、鱼腥味较低,还有一定清香味。脱臭方法对挥发性成分的影响显著,其中活性黏土、沸石、硅藻土处理使鱼肝油中2, 4-庚二烯醛、2, 4-癸二烯醛等醛类化合物含量增加,但GTP处理组使醛类物质如2, 4-庚二烯醛、2, 4-癸二烯醛减少了31.25%与56.88%,脱去3, 5-辛二烯酮多达81.84%,1-辛烯-3-醇降低了52.76%,增加了具有青草味的己醛、壬醛,极大的改善了大黄鱼肝油的风味。
该研究为大黄鱼肝油的精制及脱臭提供技术依据,也为大黄鱼加工下脚料的高值化零废弃利用提供技术支撑,这对于大黄鱼产业的绿色发展具有较好的指导意义。
| [1] |
DU Y N, XUE S, HAN J R, et al. Simultaneous extraction by acidic and saline solutions and characteristics of the lipids and proteins from large yellow croaker (Pseudosciaena crocea) roes[J]. Food Chemistry, 2020, 310: 125928. DOI:10.1016/j.foodchem.2019.125928 |
| [2] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴-2020[M]. 北京: 中国农业出版社, 2020. Fishery Administration Bureau of Ministry of Agriculture and Rural Areas, National Aquatic Technology Promotion Center, China Fisheries Society. China fishery statistical yearbook-2020[M]. Beijing: China Agricultural Press, 2020. |
| [3] |
MENEGAZZO M L, PETENUCI M E, FONSECA G G. Production and characterization of crude and refined oils obtained from the co-products of Nile tilapia and hybrid sorubim processing[J]. Food Chemistry, 2014, 157: 100-104. DOI:10.1016/j.foodchem.2014.01.121 |
| [4] |
吴燕燕, 陶文斌, 李来好, 等. 宁德地区养殖大黄鱼形态组织结构与品质特性[J]. 水产学报, 2019, 43(6): 1472-1482. WU Y Y, TAO W B, LI L H, et al. Morphological structure and quality characteristics of cultured Larimichthys crocea in Ningde[J]. Journal of Fisheries of China, 2019, 43(6): 1472-1482. |
| [5] |
DOU X, WANG Y Q, WU Y Y, et al. Analysis and evaluation of nutritional components in liver of large yellow croaker (Pseudosciaena crocea)[J]. CyTA-Journal of Food, 2020, 18(1): 551-560. DOI:10.1080/19476337.2020.1800824 |
| [6] |
LIANG P, LI R F, SUN H, et al. Phospholipids composition and molecular species of large yellow croaker (Pseudosciaena crocea) roe[J]. Food Chemistry, 2018, 245: 806-811. DOI:10.1016/j.foodchem.2017.11.108 |
| [7] |
ELTWERI A M, THOMAS A L, METCALFE M, et al. Potential applications of fish oils rich in omega-3 polyunsaturated fatty acids in the management of gastrointestinal cancer[J]. Clinical Nutrition, 2017, 36(1): 65-78. DOI:10.1016/j.clnu.2016.01.007 |
| [8] |
ENDO J, ARITA M. Cardioprotective mechanism of omega-3 polyunsaturated fatty acids[J]. Journal of Cardiology, 2016, 67(1): 22-27. DOI:10.1016/j.jjcc.2015.08.002 |
| [9] |
窦鑫, 吴燕燕, 杨贤庆, 等. 大黄鱼肝油提取工艺优化及品质分析[J]. 食品与机械, 2020, 36(7): 187-193. DOU X, WU Y Y, YANG X Q, et al. Optimization of extraction process and quality analysis of Pseudosciaena crocea liver oil by response surface methodology[J]. Food & Machinery, 2020, 36(7): 187-193. |
| [10] |
SONG G S, ZHANG M N, PENG X, et al. Effect of deodorization method on the chemical and nutritional properties of fish oil during refining[J]. LWT, 2018, 96: 560-567. DOI:10.1016/j.lwt.2018.06.004 |
| [11] |
杨斌, 黄威, 陈峰. 绿茶提取物的研究开发现状[J]. 肉类研究, 2009(12): 88-91. YANG B, HUANG W, CHEN F. The present research and exploiture situation of green tea extract[J]. Meat Research, 2009(12): 88-91. |
| [12] |
马双, 郝淑贤, 李来好, 等. 几种鱼卵营养成分对比分析[J]. 南方水产科学, 2019, 15(4): 113-121. MA S, HAO S X, LI L H, et al. Comparative analysis of nutritional components of several roes[J]. South China Fisheries Science, 2019, 15(4): 113-121. |
| [13] |
MAHMOUD M A A, BUETTNER A. Characterisation of aroma-active and off-odour compounds in German rainbow trout (Oncorhynchus mykiss). Part Ⅱ: Case of fish meat and skin from earthen-ponds farming[J]. Food Chemistry, 2017, 232: 841-849. DOI:10.1016/j.foodchem.2016.09.172 |
| [14] |
CREXI V T, MONTE M L, SOARES L A D S, et al. Production and refinement of oil from carp (Cyprinus carpio) viscera[J]. Food Chemistry, 2010, 119(3): 945-950. DOI:10.1016/j.foodchem.2009.07.050 |
| [15] |
中华人民共和国农业部. SC/T 3502—2016鱼油[S]. 北京: 中国农业出版社, 2017. Ministry of Agriculture of the People's Republic of China. SC/T 3502-2016 Fish oil[S]. Beijing: China Agricultural Publishing House, 2017. |
| [16] |
ZHANG Q, DING Y C, GU S Q, et al. Identification of changes in volatile compounds in dry-cured fish during storage using HS-GC-IMS[J]. Food Research International, 2020, 137: 109339. DOI:10.1016/j.foodres.2020.109339 |
| [17] |
ŠIMAT V, VLAHOVIĆ J, SOLDO B, et al. Production and refinement of omega-3 rich oils from processing by-products of farmed fish species[J]. Foods, 2019, 8(4): 125. DOI:10.3390/foods8040125 |
| [18] |
HAN G, ZHANG L, LI Q X, et al. Impacts of different altitudes and natural drying times on lipolysis, lipid oxidation and flavour profile of traditional Tibetan yak jerky[J]. Meat Science, 2020, 162: 108030. DOI:10.1016/j.meatsci.2019.108030 |
| [19] |
GIRI A, OSAKO K, OHSHIMA T. Identification and characterisation of headspace volatiles of fish miso, a Japanese fish meat based fermented paste, with special emphasis on effect of fish species and meat washing[J]. Food Chemistry, 2010, 120(2): 621-631. DOI:10.1016/j.foodchem.2009.10.036 |
| [20] |
ZHANG J J, XU D L, ZHAO X H, et al. Effect of Zanthoxylum bungeanum maxim on the lipid oxidation and fatty acid composition of dry-cured fish during processing[J]. Journal of Food Processing and Preservation, 2017, 41(3): e12894. DOI:10.1111/jfpp.12894 |
2. Key Lab of Aquatic Product Processing, Ministry of Agriculture and Rural Affairs, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, Guangdong, China
 2022,
Vol. 31
2022,
Vol. 31


