2. 上海海洋大学 海洋科学研究院, 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
大型海藻是海洋生态系统中的初级生产者,可吸收氮磷等营养物质,降低富营养化程度,抑制赤潮发生,常被应用于海域生态修复工程,在生物地球化学循环过程中发挥了重要作用[1-5]。大型海藻对水体营养盐及微生物群落影响的研究较多,如:有研究表[1-2]明针叶蕨藻(Caulerpa sertularioides)对磷吸收效率最高,且对铵态氮(NH4+-N)的吸收优于硝态氮(NO3--N);条斑紫菜(Pyropia yezoensis)被认为有利于降低海域的NH4+-N水平和DIN/P值、提高微生物群落结构稳定性及物种多样性[3];龙须菜(Gracilaria lemaneiformis)栽培可降低表层水体氮、磷浓度[4],且龙须菜对若干海洋微藻特别是藻华藻类具明显生长抑制作用[5]。当前我国水族产业蓬勃发展[7-10],一些具有观赏价值的大型海藻对大、中、小型海水生态水族箱也具有创建生境、净化水质的效果。目前海水生态水族箱配置常见的观赏大型海藻主要是针叶蕨藻、杉叶蕨藻、长茎葡萄蕨藻、石莼等[11],这些海藻具有较强的吸收营养盐、释放氧气等生态功能,同时又具有很好的观赏价值。
微宇宙[12](Microcosm),一般也包括中宇宙(Mesocosm),即人为设计和构建的、具有一定生态系统水平的小生态系统或实验室模拟生态系统,作为一种模拟研究方法,在生态学领域已得到广泛的应用。代威等[13]利用了人工微宇宙模拟黏细菌捕食,从而测试黏细菌捕食对微生物群落结构的影响;孙健等[14]通过室内标准微宇宙试验系统检验了三唑酮对浮游动物的效应;黄伟等[15]采用微宇宙实验方法研究了不同氮磷比条件对东海近岸浮游植物群落生长的影响;李霞等[16]以景观湖泊为研究对象设计微宇宙试验系统,以此研究水体富营养化的机理。
过去对海洋生态系统的研究一般基于开放或半开放海区,主要集中在自然海域及养殖海区,对服务于观赏体系的微宇宙系统研究甚少。本研究选用角蝾螺(Turbo cornutus)活化底砂并依靠舐食清理缸体,以副金翅雀鲷(Chrysiptera parasema)为观赏主体构建水族体系,然后利用净化水质效果优于长茎葡萄蕨藻(Caulerpa lentillifera)和细齿麒麟菜(Eucheuma denticulatum)的针叶蕨藻(Caulerpa sertularioides)[17]作为生产者完善多营养层级系统,探究大型海藻对生态水族箱中微宇宙结构及稳定性的影响,以期为构建生境合理且稳定的水族景观海洋微宇宙系统奠定基础。
1 材料与方法 1.1 生物体来源及暂养条件实验用针叶蕨藻(Caulerpa sertularioides)采集于海南文昌近岸,使用消毒海水清洗并去除藻体上的杂藻和附着物,清洗后的藻体培养在盐度25~30、温度(26±1) ℃及光照强度25.00 μmol/(m2·s)条件下备用。角蝾螺(Turbo cornutus)与副金翅雀鲷(Chrysiptera parasema)购自上海岚灵花鸟市场,运回实验室经适应性暂养后,于盐度25~30、温度(26±1) ℃及光照强度25.00 μmol/(m2·s)条件下饲养。
1.2 微宇宙系统的构建生态水族箱为具备独立微型循环系统的300 L水体,设备设置如图 2所示。透明亚克力悬挂式藻盒五面均匀布设直径4 mm孔洞,保证内外水体交换通畅;光源为12 W的LED灯(120颗灯珠),藻盒内针叶蕨藻所受光照强度控制在25.00 μmol/(m2·s)左右,光照周期为12∶12,以维持其正常生长。箭头为循环水流向,流量3 000 L/h,水体盐度为27.5±1.0、温度为(26±1) ℃。
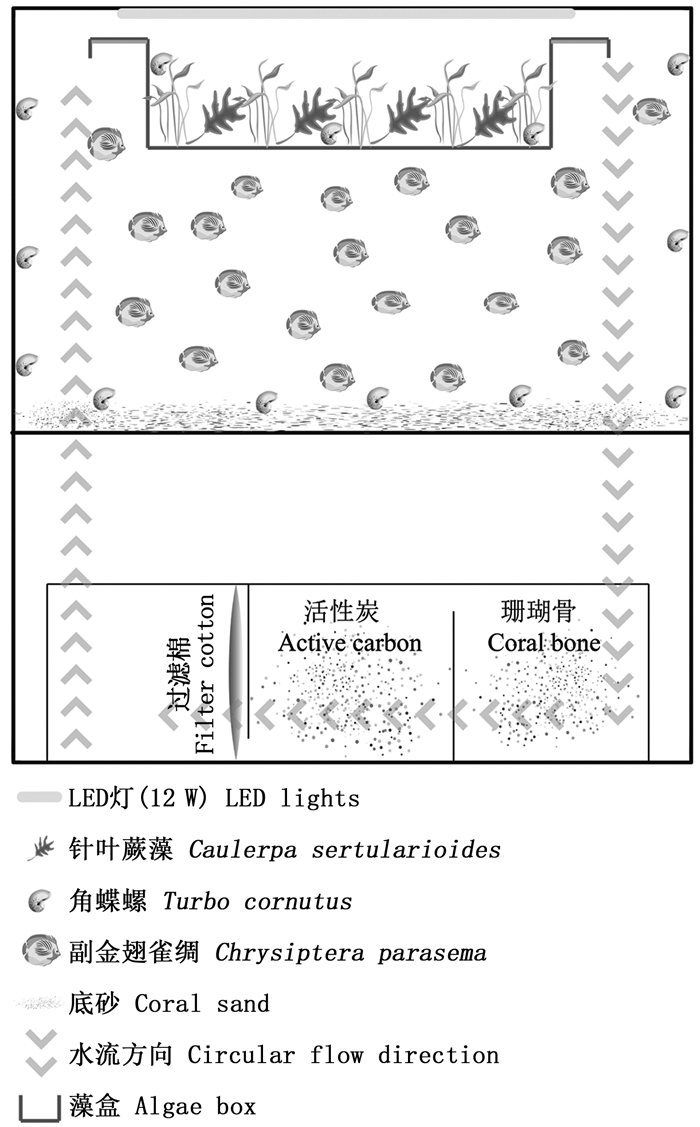
|
图 1 微宇宙系统的构建 Fig. 1 Construction of the microcosm system |
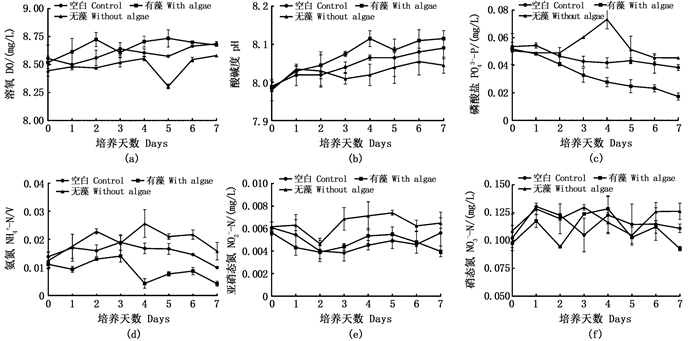
|
图 2 水环境因子变化趋势 Fig. 2 Change trend of water environment factors |
共设立3组实验组,分别为无生物组、无藻组及有藻组(有生物组),每组设立3个平行。通过预实验得出不同生物的大致适宜比例,设立各组生物配置如表 1所示。实验共进行7 d,每日定时定量向副金翅雀鲷投喂饵料1次。

|
表 1 实验组生物配置 Tab.1 Biological configuration of experimental group |
实验期间每天进行水样采集,以完成水体各项理化指标分析。水体中营养盐使用水质流动分析仪(Skalar 3000,Hollend)测定,溶解氧(DO)与pH使用多参数水质检测仪(Hach HQd,USA)测定。第7天采集生态水族箱上、中、下3层水样,每个平行组各采集两组5 L样品,分别用于细菌及浮游生物检测。在低温状态下,迅速将采集的18个样品进行0.22 μm滤膜真空抽滤,在-80 ℃条件下保存,留待DNA提取。
1.4 DNA提取及PCR扩增将1.3节中滤膜剪碎后,参照DNA试剂盒(TruSeqTM DNA Sample Prep Kit,上海赛百盛公司)步骤提取基因组DNA,再以2.0%琼脂糖凝胶电泳分析样本DNA的完整性。引物设计如表 2所示,由上海美吉生物公司合成。PCR体系(20 μL):5×Fast Pfu Buffer 4 μL、dNTPs 2 μL(终浓度2.5 mmol/L)、正反向引物各0.8 μL(终浓度5 μmol/L)、Fast Pfu聚合酶0.4 μL、DNA模板1 μL、BSA 0.2 μL,补灭菌双蒸水至20 μL。PCR反应参数:1×(95 ℃ 3 min);循环数(27,35)×(95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s);72 ℃ 10 min,10 ℃直至结束。产物使用DNA凝胶回收试剂盒(Axy Prep,AXYGE公司)回收纯化,采用蓝色荧光定量系统(QuantiFluorTM-ST,Promeg公司)进行定量检测,并作相应调整。PCR最终产物委托上海美吉生物公司进行高通量测序。

|
表 2 引物设计 Tab.2 Primer design |
水质数据使用GraphPad Prism 7.04处理并绘制图形;微生物群落丰度分析及典范对应分析(CCA)均使用R 4.0.3完成;使用SPSS 23.0进行单因素方差分析(One-Way ANOVA),P < 0.05表示差异显著。
微生物群落多样性及均匀度指数使用Mothur 1.30.1软件计算得出,并使用Student t检验法(Student’s t-test)进行两组间差异检验,相关公式如下, Shannon指数:
 (1)
(1)
式中:Sobs为实际观测到的OTU数目;ni为第i个OTU所含的序列数;N为所有的序列数。
Shannon even指数:
 (2)
(2)
式中:Hshamnon为物种多样性指数;S为样品中的种类总数。
Coverge指数:
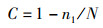 (3)
(3)
式中:n1为只含有一条序列的OTU数目;N为抽样中出现的总序列数目。
2 结果 2.1 水环境因子实验期间,各实验组水体各项理化指标呈现不同的变化趋势(图 2)。水体溶解氧(DO)含量和pH的总体变化趋势为波动上升,由高到低依次为有藻组、无生物组、无藻组[图 2(a)、图 2(b)]。有藻组水体磷酸盐(PO43--P)、铵态氮(NH4+-N)含量下降最快,第7天时显著低于无藻组(P < 0.05);无藻组在第4天达到最高值,其后缓慢下降[图 2(c)、图 2(d)]。有藻组水体亚硝态氮(NO2--N)含量在实验期内维持较低水平,基本与无生物组持平;无藻组在第3~5天中水体NO2--N含量有上升趋势[图 2(e)]。各处理组水体硝态氮(NO3--N)含量均有一定程度的波动,但第7天时,有藻组水体NO3--N含量显著低于无藻组(P < 0.05)[图 2(f)]。
2.2 系统中微生物多样性分析 2.2.1 细菌多样性各处理组水体样品细菌群落的多样性指数结果见表 3,并使用Student’s t检验法进行两组间差异检验。所有样品的覆盖度(Coverage)均超过97%,表明微生物测序深度较高,所得数据可靠。有藻组的细菌群落多样性及均匀度指数显著低于无藻组(P < 0.05),可能是由于在微宇宙中栽培大型海藻为细菌提供了良好的附着表面,从而导致水中悬浮细菌群落多样性下降。总体来说,水体细菌多样性及均匀度由高到低为无藻组>无生物组>有藻组。

|
表 3 细菌多样性指数 Tab.3 Bacterial diversity index |
各处理组水体样品浮游生物群落的多样性指数结果见表 4,并使用Student’s t检验法进行两组间差异检验。所有样品的覆盖度均超过99%,表明微生物测序深度较高,所得数据可靠。无生物组与有生物组浮游生物群落均匀度具有显著差异(P < 0.05),且无藻组浮游生物群落均匀度显著高于有藻组(P < 0.05)。总体来说,水体浮游生物多样性及均匀度由高到低为无生物组>无藻组>有藻组。

|
表 4 浮游生物多样性指数 Tab.4 Plankton diversity Index |
如图 3所示,根据分类学分析结果,各实验组样品中的细菌序列主要分布于11个菌门,分别为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、Patescibacteria、达达菌门(Dadabacteria)、蓝藻菌门(Cyanobacteria)、绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobia)、酸杆菌门(Acidobacteria)以及浮霉菌门(Planctomycetes)。无生物组中变形菌门与厚壁菌门分别为第一、二优势门,其次为放线菌门和拟杆菌门;在无藻组中第一、二优势门为变形菌门和放线菌门,且两者丰度之和在细菌群落中占60%以上;在有藻组中第一、二优势门也为变形菌门与放线菌门,且所占比例在65%以上。在无藻及有藻处理组中,变形菌门与放线菌门所占比例大,但厚壁菌门和蓝藻菌门所占比例较小。
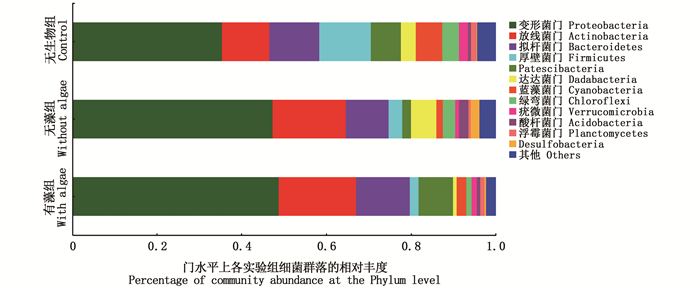
|
图 3 门水平上细菌群落的相对丰度 Fig. 3 Percentage of bacterial community abundance at the Phylum level |
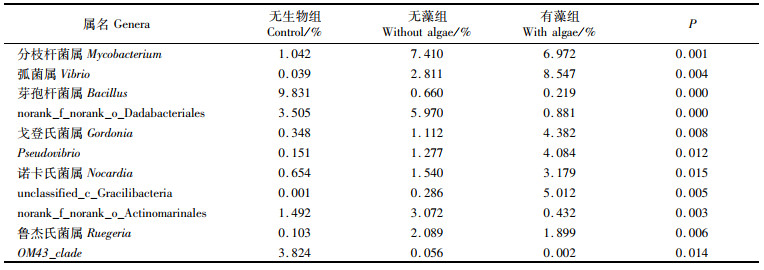
在属水平分类上,各处理组细菌群落结构差异明显,且细菌群落组成也有所不同(图 4)。Enterovibrio在有藻组中为第二优势属,在无藻组含量较低,在无生物组中未检出;Gilvibacter在无生物组中为第二优势属,但在无藻组中未检出;Pseudovibrio在无藻组中含量较低,在有藻组中含量较高;希瓦氏菌属(Shewanella)、发光杆菌属(Photobacterium)、Vogesella、Halodesulfovibrio及Sediminitomix在无生物组中未检出。由表 5可知:分枝杆菌属(Mycobacterium)、弧菌属(Vibrio)及戈登氏菌属(Gordonia)等细菌群落在无生物组中含量低,与无藻组和有藻组组间差异极显著(P < 0.01);芽孢杆菌属(Bacillus)及OM43_clade在无藻组及有藻组中含量较低,与无生物组间差异显著(P < 0.05)。

|
图 4 属水平上丰度前50的细菌群落丰度热图 Fig. 4 Heatmap of bacterial community abundance at the Genus level(Top 50) |
|
表 5 差异较大的主要菌属 Tab.5 The main genera of bacteria with great difference |
如图 5所示,根据分类学分析结果,各实验组样品中的浮游生物序列主要分布于8个门,分别为硅藻门(Bacillariophyta)、未分类的真菌、子囊菌门(Ascomycota)、未分类的真核生物、纤毛门(Ciliophora)、绿藻门(Chlorophyta)、有孔虫门(Foraminifera)以及裸藻门(Euglenophyta)。所有实验组的第一优势门均为硅藻门,至少占样品中浮游生物群落丰度的40%以上。但各组中第二优势门则有所不同,无生物组为未分类的真菌,无藻组为未分类的真核生物,有藻组为子囊菌门。在无生物组中子囊菌门含量极少,且未检出有孔虫;在无藻组中绿藻门含量不足1%,但有孔虫含量较多;在无藻组及有藻处理组中,子囊菌门与未分类的真核生物所占比例大,但未分类的真菌所占比例较小。

|
图 5 门水平上浮游生物群落的相对丰度 Fig. 5 Percentage of plankton community abundance at the Phylum level |
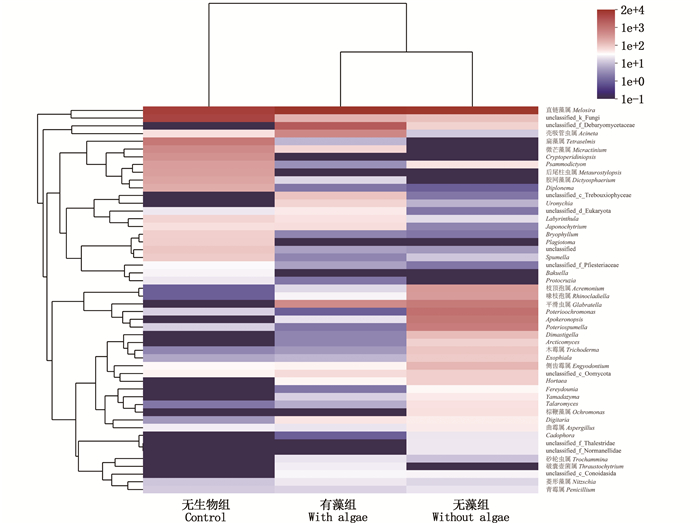
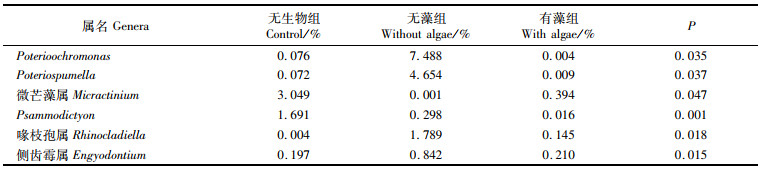
在属水平分类上,各处理组浮游生物群落结构差异明显,且群落组成也有所不同(图 6)。各实验组中第一优势属均为直链藻属(Melosira),但第二、第三优势属有所不同,且有生物组的群落结构更相似。Glabratella和偏角毛虫属(Apokeronopsis)在无生物组中未检出,扁藻属(Tetraselmis)、Cryptoperidiniopsis和后尾柱虫属(Metaurostylopsis)在无藻组中未检出,Cryptoperidiniopsis和后尾柱虫属在有藻组中也未检出。并且由表 6可知:Poterioochromonas、Poteriospumella、Engyodontium和Rhinocladiella在无藻组中占优势,与无生物组和有藻组组间差异显著(P < 0.05);微芒藻属(Micractinium)和Psammodictyon在无生物组中占优势,与无藻组和有藻组组间差异显著(P < 0.05)。
|
图 6 属水平上丰度前50的浮游生物群落丰度热图 Fig. 6 Heatmap of plankton community abundance at the Genus level(Top 50) |
|
表 6 差异较大的主要浮游生物属 Tab.6 Main genera of plankton with great difference |
选择样本间在总群落丰度中占据1~15位序的细菌及浮游生物优势种(属)群落,对2.1节中6个环境因子进行典范对应分析(CCA),第一、二轴解释度之和为73.28%(图 7)。

|
M1~15:Mycobacterium; Vibrio; Bacillus; (Order)Dadabacteriales; Enterovibrio; (Order)Chloroplast; Photobacterium; Sediminitomix; Gordonia; ;Nocardia; (Class)Gracilibacteria; (Class)Gammaproteobacteria; (Order)Actinomarinales; (Family)Rhodobacteraceae; Ruegeria. P1~15:Melosira; (Kingdom)Fungi; (Family)Debaryomycetaceae; Glabratella; Poterioochromonas; Apokeronopsis; Tetraselmis; Poteriospumella; Acineta; Micractinium; Cryptoperidiniopsis; Psammodictyon; Acremonium; Rhinocladiella; Metaurostylopsis. 图 7 群落丰度前15的优势种(属)微生物群落与环境因子CCA三序图 Fig. 7 CCA triplot of the environmental factors and dominant microorganism species (genus)(Top 15) |
CCA结果显示:有生物组优势种群落在第一轴上远离无生物组,且有藻组及无藻组优势种群落在第二轴上分开。无藻组微生物优势种群落丰度与营养盐含量呈正相关关系,与溶解氧(DO)及pH负相关,表明水体环境较差,动物活动使水体DO和pH显著低于其他两组(P < 0.05),且水体氮磷含量显著高于其他处理组(P < 0.05);有藻组则相反,微生物优势种群落丰度与DO及pH呈正相关关系,与营养盐含量负相关。从细菌水平上看,营养盐含量对优势种芽孢杆菌属(Bacillus)及肠弧菌属(Enterovibrio)群落影响较大,与pH呈正相关关系的优势种群落较多;从浮游生物水平上看,优势种Poteriospumella及undenfied Funji受pH与DO的影响较大,优势种群落多与营养盐含量呈正相关关系。
3 讨论 3.1 大型海藻对水质的净化作用大型海藻光合作用能释放O2,降低海水中的二氧化碳(CO2)和氢离子(H+)浓度,从而提高pH和DO[18-19]。并且,大型海藻能够吸收动物排放到水体中的代谢产物以及残饵分解所释放的营养盐[20],从而达到净化水体、稳定生境的作用。水体DO含量和pH由高到低依次为有藻组、对照组、无藻组,表明针叶蕨藻有助于提高微宇宙中水体DO及pH;有藻组水体NO2--N含量在实验期内能够维持较低水平,且PO43--P、NH4+-N含量下降最快,与TANAKA等[1]和IMCHEN等[2]的研究成果相符;并且在第7天时,无藻组各项水质指标均显著高于有藻组及无生物组(P < 0.05)。研究结果表明,大型海藻能够有效提升DO和pH、去除营养盐,从而维持生态水族箱中微宇宙系统生境稳定。
3.2 微宇宙中微生物群落多样性及均匀度特征Shannon多样性指数是反映多样性的综合指标,既包括物种丰富度又包括均匀度[21]。各处理组的微生物群落多样性及均匀度指数结果表明:在循环水体中引入预设生物会显著改变系统中微生物群落结构,且在微宇宙中栽培针叶蕨藻对微生物群落多样性及均匀度具有显著影响。有研究[22]表明,大型海藻一方面能够以其细胞的胞外物质为细菌提供营养,吸引细菌附着;另一方面,其代谢产物和释放的抑菌物质在一定程度上会抑制细菌生长[23]。通过此类调控作用,最终有可能降低水体中的细菌群落多样性。并且,在系统中培养大型海藻会对某些浮游生物群落产生抑制效应[4, 24]。
3.3 微宇宙中微生物群落结构分析由细菌群落结构分析,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)是微宇宙中的主要优势菌门,与其他研究海洋细菌群落结构的文献相似[25-26],但不同处理组的菌门分布不同,表明大型海藻具有影响微宇宙中细菌群落结构的能力。在属水平上,各实验组细菌群落结构也具有明显差异。分枝杆菌属(Mycobacterium)是鱼类常见的病原菌[27],在无生物组中群落生物量显著低于有生物组(P < 0.05),或由受试动物带入微宇宙系统;有藻组弧菌属(Vibrio)群落生物量显著高于其他两组(P < 0.05),表明大型海藻或可能携带致病菌进入微宇宙系统,虽然本试验中并未有试验动物染病,但为避免染病情况,投放海藻前须作消毒清洗。芽孢杆菌属(Bacillus)及戈登氏菌属(Gordonia)均具有净化水质和吸附污染物等功效[28-29],但它们在各处理组中群落丰度分布相反,芽孢杆菌属在有藻组中生物量最低,戈登氏菌属在有藻组中的含量显著高于其它两组,可能是由于营养和生态位的竞争而导致这一现象。
由浮游生物群落结构分析,各处理组的第一优势门均为硅藻门(Bacillariophyta)[30]。营腐生、寄生和共生的子囊菌门(Ascomycota)在有藻组中含量较高,针叶蕨藻凋落物为其提供了养分来源[31];浮游植物是海洋生态系统中重要的初级生产者[32],但在一定条件下会形成水华,对水体生态系统稳定性构成威胁,本研究中,浮游植物生物量在有藻组中含量低于无藻组,表明培养大型海藻能控制其生物量,不至形成水华;无藻组中浮游动物数量高于有藻组,表明大型海藻对微宇宙中浮游生物群落结构具有一定影响。
试验发现无生物与有生物组间微生物群落结构具有显著差异,表明不同营养层次所构建的微宇宙微生物群落不同,与前人[25, 33]研究成果一致。无藻组与有藻组微生物群落结构差异显著,表明在微宇宙中培养大型海藻会显著改变生态水族箱中微宇宙结构。并且,大型海藻能够影响系统中微生物优势种群落结构,对系统中大部分浮游生物优势种具有抑制效应,与多样性研究结果一致。
3.4 微宇宙中微生物群落结构与环境因子间的关系微生物群落结构及物种多样性对水质环境非常敏感,能够直观反映水体环境质量及健康状况,是海洋生态系统的关键特征之一[6]。基于CCA结果及水质分析结果发现,无生物组、无藻组及有藻组微生物优势种群落结构有显著差异。无藻组和无生物组微生物群落点分布较散,表明系统或会随环境因子的改变而发生剧烈变化。无藻组样点位于DO和pH的反向延长线上,动物活动使水体DO和pH显著低于其他两组(P < 0.05),且动物排泄及食物残渣分解所释放的营养盐无法被微生物完全代谢,导致水体营养盐含量较高,水体酸化可能性较大,生态系统自净能力弱,较不稳定;而在本试验微宇宙中,有藻组样点均位于氮磷营养盐的反向延长线上,表明有藻组水体生态系统缓冲能力较强,培养针叶蕨藻能有效改善水质,有益于水生动物良好的生活环境构建。肠弧菌属(Enterovibrio)也是海洋弧菌的一类,营养盐含量对细菌优势种芽孢杆菌属(Bacillus)及肠弧菌属群落影响较大,在CCA中分别聚集在无生物组、无藻组一侧,表明细菌群落结构会对营养盐含量的高低作出响应,且营养盐含量高不利于水生动物健康;戈登氏菌属(Gordonia)是一种可用于低污染水体修复的微生物菌群,在本试验中作为优势属聚集在有藻组一侧,对维持系统生境稳定能够发挥一定效用。浮游生物优势种群落多聚集在与营养盐含量正相关的一侧,表明水质优劣将显著影响微宇宙中浮游生物群落结构,当水体营养盐含量升高时,浮游植物优势种丰度也随之增加,具有引发水华的风险。
4 结论(1) 在生态水族箱中培养大型海藻能有效去除营养盐,提升水体DO及pH,从而维持生境稳定。
(2) 不同营养层级所构建的微宇宙中微生物群落结构不同,培养大型海藻能够显著影响系统中微生物群落结构,并且抑制某些微生物群落,有助于提高水族景观海洋微宇宙系统的稳定性。
| [1] |
TANAKA Y, ASHAARI A, MOHAMAD F S, et al. Bioremediation potential of tropical seaweeds in aquaculture: low-salinity tolerance, phosphorus content, and production of UV-absorbing compounds[J]. Aquaculture, 2020, 518: 734853. DOI:10.1016/j.aquaculture.2019.734853 |
| [2] |
IMCHEN T, EZAZ W. Time course nutrient uptake study of some intertidal rocky shore macroalgae and the limiting effect due to synergistic interaction[J]. Indian Journal of Geo-Marine Sciences, 2020, 49(2): 287-292. |
| [3] |
梁洲瑞, 孙藤芹, 汪文俊, 等. 日照紫菜养殖海域营养盐的时空分布特征及其与浮游植物群落结构的相关性分析[J]. 渔业科学进展, 2019, 40(5): 78-88. LIANG Z R, SUN T Q, WANG W J, et al. The temporal and spatial distribution characteristics of the nutrients and community structures of phytoplankton and their relationships in the Pyropia culture areas of Rizhao, China[J]. Progress in Fishery Sciences, 2019, 40(5): 78-88. |
| [4] |
解欣斐, 龚映雪, 胡晓娟, 等. 外伶仃海域龙须菜栽培对水质及浮游细菌数量的影响[J]. 暨南大学学报(自然科学与医学版), 2016, 37(3): 185-192. XIE X F, GONG Y X, HU X J, et al. Effect of Gracilaria lemaneiformis cultivation on water quality and bacterioplankton abundance of Wailingding Island coastal waters[J]. Journal of Jinan University (Natural Science & Medicine Edition), 2016, 37(3): 185-192. |
| [5] |
柴召阳. 龙须菜规模栽培对真核浮游生物群落结构的影响及其对微藻藻华的抑制作用[D]. 广州: 暨南大学, 2016. CHAI Z Y. Effects of the massive cultivation of Gracilaria lemaneiformis onplankton community structure and its inhibition on microalgal bloom[D]. Guangzhou: Ji'nan University, 2016. |
| [6] |
刘书荣, 周曦杰, 崔潇, 等. 贻贝筏式养殖区海藻群落对两类代表性藻栖端足目种群特征的影响[J]. 水产学报, 2020, 44(3): 461-468. LIU S R, ZHOU X J, CUI X, et al. Effects of seaweeds community on two representative seaweed-associated Amphipod population characteristics in mussel rant culture area[J]. Journal of Fisheries, 2020, 44(3): 461-468. |
| [7] |
刘颖, 李丽, 孙大川. 上海观赏水族市场调查及发展前景分析[J]. 安徽农业科学, 2015, 43(12): 347-351. LIU Y, LI L, SUN D C. Development prospect and the current situation of ornamental fish market in Shanghai[J]. Journal of Anhui Agricultural Sciences, 2015, 43(12): 347-351. DOI:10.3969/j.issn.0517-6611.2015.12.118 |
| [8] |
张希, 杨宁, 黄海. 海南省观赏水族行业的发展前景及对策[J]. 热带农业科学, 2012, 32(8): 83-86. ZHANG X, YANG N, HUANG H. Current situation of decorative fishery in Hainan and development suggestions[J]. Chinese Journal of Tropical Agriculture, 2012, 32(8): 83-86. DOI:10.3969/j.issn.1009-2196.2012.08.019 |
| [9] |
黄之旸. 全球观赏水族市场发展趋势[J]. 水族世界, 2011(6): 52-63. HUANG Z Y. Development trend of global ornamental aquarium market[J]. World of Aquarium, 2011(6): 52-63. |
| [10] |
郝博浪. 浅析上海水族市场的发展[J]. 水族世界, 2010(3): 164-169. HAO B L. Analysis on the development of Shanghai aquarium Market[J]. Aquarium World, 2010(3): 164-169. |
| [11] |
丁兰平, 王展, 黄冰心. 杉叶蕨藻: 一种较好的海水观赏藻[J]. 科学养鱼, 2014(6): 80. DING L P, WANG Z, HUANG B X. Fern leaf Ferns: a kind of good ornamental Marine algae[J]. Scientific Fish Farming, 2014(6): 80. |
| [12] |
CONGER G P. Theories of macrocosms and microcosms in the history of philosophy[M]. New York: Columbia University Press, 1922.
|
| [13] |
代威, 纠敏, 王文辉, 等. 人工微宇宙下粘细菌捕食对微生物群落结构的影响[J]. 微生物学报, 2020, 60(3): 452-463. DAI W, JIU M, WANG W H, et al. Effects of myxobacteria predation on microbial community structure of artificial microcosm[J]. Acta Microbiologica Sinica, 2020, 60(3): 452-463. |
| [14] |
孙健, 肖鹏飞, 刘毅华, 等. 利用室内微宇宙系统研究三唑酮对淡水浮游动物群落的影响[J]. 生态毒理学报, 2020, 15(4): 139-148. SUN J, XIAO P F, LIU Y H, et al. Study on the effect of triadimefon on freshwater zooplankton community using indoor microcosm system[J]. Asian Journal of Ecotoxicology, 2020, 15(4): 139-148. |
| [15] |
黄伟, 朱旭宇, 曾江宁, 等. 氮磷比对东海浮游植物群落生长影响的微宇宙实验[J]. 环境科学, 2012, 33(6): 1832-1838. HUANG W, ZHU X Y, ZENG J N, et al. Microcosm experiments on the influence of different N/P ratios on phytoplankton community growth in the East China Sea[J]. Environmental Science, 2012, 33(6): 1832-1838. |
| [16] |
李霞, 于淼, 林欣, 等. 基于微宇宙试验的不同营养级景观湖泊营养盐变化的研究[J]. 西南民族大学学报(自然科学版), 2018, 44(1): 40-51. LI X, YU M, LIN X, et al. Study on the nutrient changes of landscape lakes based on microcosm experiment[J]. Journal of Southwest University for Nationalities (Natural Science Edition), 2018, 44(1): 40-51. |
| [17] |
程芬, 李乐, 殷小龙, 等. 3种海藻对无机盐和有机物水体中氨态盐净化效果比较[J]. 基因组学与应用生物学, 2017, 36(3): 1084-1089. CHENG F, LI L, YIN X L, et al. Comparison on purification effect of three macroalgae species on Ammonia salt in inorganic and organic water[J]. Genomics and Applied Biology, 2017, 36(3): 1084-1089. |
| [18] |
王首吉, 杜虹, 梅志平, 等. 春季深澳湾龙须菜固碳量及其影响因素[J]. 海洋环境科学, 2016, 35(3): 343-348. WANG S J, DU H, MEI Z P, et al. Carbon fixation of Gracilaria lemaneiformis and its environmental regulation in Shen'ao bay in spring[J]. Marine Environmental Science, 2016, 35(3): 343-348. |
| [19] |
韦章良, 韩红宾, 胡明, 等. 三沙湾盐田港海水养殖海域海-气界面CO2交换通量的时空变化[J]. 上海海洋大学学报, 2016, 25(1): 106-115. WEI Z L, HAN H B, HU M, et al. Seasonal variation of sea-air CO2 flux in mariculture area in Yantian Harbor, Sansha Bay[J]. Journal of Shanghai Ocean University, 2016, 25(1): 106-115. |
| [20] |
丁平真, 韦章良, 陶燕东, 等. 围隔海域水质评价及底栖曲浒苔对水质修复能力评估研究[J]. 上海海洋大学学报, 2017, 26(4): 519-527. DING P Z, WEI Z L, TAO Y D, et al. The evaluation of water quality in enclosed mariculture bay and assessment of bioremediation abilities of Ulva flexuosa[J]. Journal of Shanghai Ocean University, 2017, 26(4): 519-527. |
| [21] |
任丽娟, 何聃, 邢鹏, 等. 湖泊水体细菌多样性及其生态功能研究进展[J]. 生物多样性, 2013, 21(4): 421-432. REN L J, HE D, XING P, et al. Bacterial diversity and ecological function in lake water bodies[J]. Biodiversity Science, 2013, 21(4): 421-432. |
| [22] |
BELL W, MITCHELL R. Chemotactic and growth responses of marine bacteria to algal extracellular products[J]. The Biological Bulletin, 1972, 143(2): 265-277. DOI:10.2307/1540052 |
| [23] |
BRUNBERG A K. Contribution of bacteria in the mucilage of Microcystis spp. (Cyanobacteria) to benthic and pelagic bacterial production in a hypereutrophic lake[J]. FEMS Microbiology Ecology, 1999, 29(1): 13-22. DOI:10.1111/j.1574-6941.1999.tb00594.x |
| [24] |
刘之威, 罗洪添, 武宇辉, 等. 汕头南澳龙须菜规模栽培对水质和浮游植物的影响[J]. 中国水产科学, 2019, 26(1): 99-107. LIU Z W, LUO H T, WU Y H, et al. Large-scale cultivation of Gracilaria lemaneiformis in Nan'ao Island of Shantou and its effects on the aquatic environment and phytoplankton[J]. Journal of Fishery Sciences of China, 2019, 26(1): 99-107. |
| [25] |
关晓燕, 王摆, 蒋经伟, 等. 仿刺参-中国明对虾-斑节对虾混养下水体微生物组成和多样性[J]. 水产科学, 2020, 39(6): 796-803. GUAN X Y, WANG Z, JIANG J W, et al. Bacterial community and diversity analysis in a polyculture system of sea cucumber Apostichopus japonicus with Chinese Shrimp Fenneropenaeus chinensis, and tiger shrimp Penaeus monodon[J]. Fisheries Science, 2020, 39(6): 796-803. |
| [26] |
庄康, 胡晓娟, 曹煜成, 等. 不同寡营养培养条件下南海水体细菌群落结构及其对碳源的利用特征[J]. 微生物学通报, 2020, 47(9): 2697-2710. ZHUANG K, HU X J, CAO Y C, et al. Bacterial community structure and its utilization characteristics of carbon sources in water of South China Sea under different low-nutrient culture conditions[J]. Microbiology China, 2020, 47(9): 2697-2710. |
| [27] |
张书环, 聂品, 舒少武, 等. 子二代中华鲟分枝杆菌感染及血液生理生化指标的变化[J]. 中国水产科学, 2017, 24(1): 136-145. ZHANG S H, NIE P, SHU S W, et al. Mycobacteriosis in cultured F2 generation Chinese sturgeon (Acipenser sinensis) and relevant blood physiological and biochemical indices[J]. Journal of Fishery Sciences of China, 2017, 24(1): 136-145. |
| [28] |
李雪, 刘述凤, 鄢雨朦, 等. 复合芽孢杆菌对鲫鱼养殖水体水质及细菌群落结构的影响[J]. 生态与农村环境学报, 2020, 36(4): 522-530. LI X, LIU S F, YAN Y M, et al. Effect of bacillus complex on water quality and bacterial community structure of Carassius aumtus culture water[J]. Journal of Ecology and Rural Environment, 2020, 36(4): 522-530. |
| [29] |
谭琦慧, 齐东升, 彭俊杰. 一种黑臭水体生态修复治理方法: 中国, CN111252904A[P]. 2020-06-09. TAN Q H, QI D S, PENG J J. Black and odorous water body ecological restoration treatment method: CN, 111252904A[P]. 2020-06-09. |
| [30] |
李亚军, 王先明, 程贤松, 等. 海南岛海尾湾浮游植物群落结构及水质的调查[J]. 热带生物学报, 2020, 11(3): 257-265. LI Y J, WANG X M, CHENG X S, et al. A survey of phytoplankton community structure and seawater quality in the seawaters near Haiwei Bay, Hainan province[J]. Journal of Tropical Biology, 2020, 11(3): 257-265. |
| [31] |
戴晓娟, 胡韧, 罗洪添, 等. 大型海藻龙须菜凋落物分解对水质的影响[J]. 热带海洋学报, 2021, 40(1): 91-98. DAI X J, HU R, LUO H T, et al. Effects of the decomposition of Gracilaria lemaneiformis on seawater quality[J]. Journal of Tropical Oceanography, 2021, 40(1): 91-98. |
| [32] |
孙军. 海洋浮游植物与生物碳汇[J]. 生态学报, 2011, 31(18): 5372-5378. SUN J. Marine phytoplankton and biological carbon sink[J]. Acta Ecologica Sinica, 2011, 31(18): 5372-5378. |
| [33] |
林国荣, 王春忠, 孙富林, 等. 海水混养池塘虾蛤肠道与养殖环境的微生物多样性[J]. 微生物学通报, 2018, 45(9): 1989-1999. LIN G R, WANG C Z, SUN F L, et al. Microbial community diversity in seawater polyculture pond of shrimp and clam[J]. Microbiology China, 2018, 45(9): 1989-1999. |
2. Institute of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China;
3. National Experimental Teaching Demonstration Center of Fishery Science, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


