2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306;
3. 国家淡水水产品加工技术研发分中心, 上海 201306
近年来,糖尿病病例呈逐年递增的趋势,世界卫生组织预计2050年患病人数将达6.42亿人。由于对人体有着严重危害,其被称为第三种慢性疾病[1]。在糖尿病患者中,Ⅱ型糖尿病所占比例最大,占患者总数的85%~95%[2]。这种疾病给社会带来了巨大的负担,为开发有效的降血糖产品创造了根本的需要[2]。
糖尿病产生的主要原因是人体吸收过多糖分以及胰岛素分泌失衡导致的身体中糖分代谢紊乱[3-4]。人类饮食摄入的碳水化合物(低聚糖、二糖等)通过小肠黏膜上的关键消化酶(α-葡萄糖苷酶)水解成葡萄糖单体,被人体吸收进入血液提高血糖浓度[5]。因此,可通过抑制α-葡萄糖苷酶活性来降低血糖[3]。目前用于治疗Ⅱ型糖尿病的方法主要是口服人工合成的酶抑制剂(如阿卡波糖),然而,这些酶抑制剂经常导致腹胀、腹泻等胃肠道症状的副作用[5]。因此,从天然产物提取对人体无毒的α-葡萄糖苷酶抑制剂成了重要途径,目前对动植物蛋白α-葡萄糖苷酶抑制剂的研究是热点,张灿等[6]利用木瓜蛋白酶酶解银杏蛋白制得了α-葡萄糖苷酶抑制肽,张玉等[7]利用酸性蛋白酶酶解蚕蛹蛋白得到了α-葡萄糖苷酶抑制剂。
目前南极磷虾(Euphausia superba)的蕴藏量据《南大洋生物资源储量调查》保守估计6~10亿t[8]。它含有丰富的蛋白质,可作为制备生物活性肽的重要来源,例如,WANG等[9]分离纯化抗骨质疏松肽,李芙蓉等[10]制备出抗氧化活性肽。南极磷虾蛋白酶解产物中氨基酸种类丰富,据文献[11]报道α-葡萄糖苷酶的抑制活性与氨基酸的疏水性相关,南极磷虾中含有丰富的疏水性氨基酸[12],故南极磷虾可作为制备α-葡萄糖苷酶抑制肽的来源。但目前还很少有关于从南极磷虾粉中分离纯化出α-葡萄糖苷酶抑制肽的报道。本研究为南极磷虾的综合利用提供科学依据。
1 材料与方法 1.1 材料与仪器脱脂南极磷虾粉(水分含量为13.66%,蛋白含量为72%,脂肪含量为1.20%,灰分含量12.44%,总糖含量0.64%)由青岛康境海洋生物科技有限公司提供。风味蛋白酶(22 200 U/g)和动物蛋白质水解酶(72 177.78 U/g)购于南宁东恒华道生物科技有限责任公司; 碱性蛋白酶(71 155.56 U/g)、中性蛋白酶(69 733.3 U/g)和复合蛋白酶(62 222.2 U/g)购于天津市诺奥科技发展有限公司; α-葡萄糖苷酶、Sephadex G-25购于北京索莱宝科技有限公司; PNPG购于上海源叶生物科技有限公司。
紫外分光光度计UV-2000型,北京普析通用仪器有限责任公司; 雷磁PHS-3C pH计,上海仪电科学仪器股份有限公司; 超滤杯、超滤膜,上海摩速科学器材有限公司; CBS-A程控多功能全自动部分收集器、核酸蛋白检测仪HDB-7L,上海沪西分析仪器有限公司; TSK凝胶色谱柱(G2000 SWXL, 7.8 mm×300 mm),北京金欧亚科技发展有限公司; Alliance e2695高效液相色谱仪,上海硅仪生化科技有限公司。
1.2 实验方法 1.2.1 α-葡萄糖苷酶抑制率测定参考文献[13]并略作修改,将2 mL的0.2 mol/L(pH为6.8)磷酸盐缓冲溶液、0.3 mL的0.2 U/mL α-葡萄糖苷酶和0.5 mL的样品溶液加入试管,37 ℃恒温水浴中保温15 min; 然后向试管中加入0.4 mL的2.5 mmol/L的PNPG溶液,37 ℃恒温水浴中保温15 min; 最后向试管内加入0.8 mL的0.2 mol/L的Na2CO3溶液终止反应。用蒸馏水调零点,在波长为405 nm处,测定吸光值为Ai,用缓冲液代替样品溶液测得吸光度Ao,缓冲液代替酶测得Aj。测定结果以α-葡萄糖苷酶抑制率T表示:
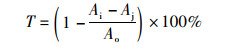 (1)
(1)
式中:Ao为空白对照管; Ai为样品测定管; Aj为样品对照管。
1.2.2 蛋白酶活力测定蛋白酶活力单位定义为1 min内分解出1 μg酪氨酸的酶量为1单位,操作步骤参照陈安和[14]。
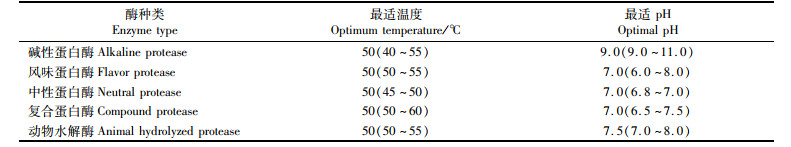
1.2.3 蛋白酶的选择以脱脂南极磷虾粉为原材料,选取中性蛋白酶、复合蛋白酶、碱性蛋白酶、风味蛋白酶、动物水解蛋白酶5种生物酶,在表 1中各自最适条件(磷酸缓冲溶液调pH),按酶添加量0.023 g/g(原料)、酶解时间4.5 h和料液比10∶ 1(mL/g)进行酶解,酶解液于90 ℃下灭酶15 min,10 000 r/min 4 ℃离心20 min,收集上清液,以α-葡萄糖苷酶抑制率为指标比较各种酶酶解效果。
|
表 1 蛋白酶的酶解条件 Tab.1 Enzymolysis conditions of protease |
以筛选出来的蛋白酶对脱脂南极磷虾粉进行酶解,酶解条件:脱脂南极磷虾粉5.0 g,料液比8∶ 1(mL/g),酶添加量0.25 g,温度50 ℃,pH 7.0,酶解时间4.0 h。单因素条件时间:4.0 h、5.0 h、6.0 h、7.0 h、8.0 h; 酶添加量:0.20 g、0.25 g、0.30 g、0.35 g、0.40 g; 料液比:2∶ 1、4∶ 1、6∶ 1、8∶ 1、10∶ 1。反应结束,将烧杯置于90 ℃沸水中15 min,然后离心20 min(10 000 r/min)。测其α-葡萄糖苷酶抑制率。
1.2.5 响应面试验根据中心组合试验设计原理,以α-葡萄糖苷酶抑制率(Y)为响应值,选择酶解时间(A)、酶添加量(B)、料液比(C)为影响因素,设计3因素3水平实验。因素和编码水平见表 2。

|
表 2 响应面试验因素水平与编码 Tab.2 Response surface test factor level and coding |
采用凝胶色谱法测定分子量分布[15]。以细胞色素C(相对分子质量12 384 u),抑肽酶(相对分子质量6 511 u),杆菌肽(相对分子质量1 450 u),Gly-Gly-Tyr-Arg(相对分子质量451 u),Gly-Gly-Gly(相对分子质量189 u)为标准品,以各标准品的分子量与洗脱体积作标准曲线,通过比较样品的洗脱体积计算样品的分子量分布。色谱条件:色谱柱TSKgel G2000 SWXL (7.8 mm×300 mm),进样量10 μL,检测波长220 nm,温度30 ℃,流动相为乙腈∶水∶三氟乙酸=45∶ 55∶ 0.1(体积比),流速0.5 mL/min。样品经0.22 μm微孔滤膜处理后注入仪器进行测定。
1.2.7 超滤酶解产物依次通过10 ku、5 ku、3 ku的超滤膜,获得MW≥10 ku、5 ku≤MW<10 ku、3 ku≤MW<5 ku和 < 3 ku 4个组分,冷冻干燥,测各组分对α-葡萄糖苷酶抑制率的IC50。
1.2.8 凝胶过滤层析操作步骤参考石杰方法并略作修改[16],Sephadex G-25凝胶预处理之后装柱(80 cm×1.6 cm),去离子水平衡、洗脱,将上述超滤中抑制效果最好的组分用去离子水配成质量浓度30 mg/mL,上样5 mL,流速0.5 mL/min,在280 nm下用核酸蛋白检测仪检测,自动收集器每6 min收集一管,测各组分对α-葡萄糖苷酶抑制率的IC50。
1.3 统计分析所得数据运用Design-Expert 8.0.6.0软件进行响应曲面分析,Origin 9软件作图,SPSS 9.0软件进行数据统计分析,以α= 0.05作为差异显著水平。IC50为抑制率达50%时样品浓度,IC50的计算采用SPSS 9.0软件拟合样品浓度与抑制活性之间的线性关系得到。
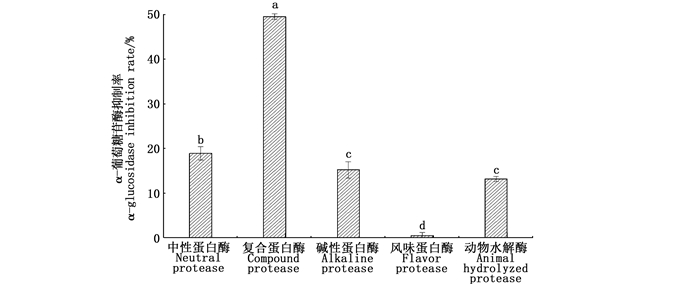
2 结果与分析 2.1 酶解脱脂南极磷虾粉的蛋白酶选择分析脱脂南极磷虾粉分别经5种蛋白酶酶解后,在质量浓度30 mg/mL下测α-葡萄糖苷酶抑制率,由图 1可知,5种酶解产物均有一定的抑制活性但差别很大,其中复合蛋白酶酶解产物对α-葡萄糖糖苷酶抑制活性最高,抑制率为49.53%,远远高于其他4种酶解产物。由于酶的专一性,每种酶的酶切位点特定,酶解同一原料所得到的多肽,在肽序列、空间结构和分子量大小等方面具有很大差异,导致不同的蛋白酶酶解产生的多肽对α-葡萄糖苷酶的抑制活性也不相同[17-18]。在利用酶法制备多肽的过程中,对蛋白酶的选择至关重要。复合蛋白酶内含内切酶和外切酶,多种酶共同作用能够把肽链的内部结构和末端切碎,释放更多不同结构的具有特异功能的多肽。胡春芹等[19]利用复合蛋白酶(内切与外切蛋白酶)酶解条斑紫菜制备α-葡萄糖苷酶抑制肽; 延海莹等[20]采用复合蛋白酶酶解扇贝裙边制备降血糖活性肽; 林海生等[21]通过复合酶酶解华贵栉孔扇贝制备α-葡萄糖苷酶抑制肽。
|
图中标有不同字母表示组间有显著性差异(P < 0.05)。 Different letters in the figure indicate significant differences between groups (P < 0.05). 图 1 不同蛋白酶对α-葡萄糖苷酶的抑制率 Fig. 1 Different proteases on α-glucosidase inhibition rate |
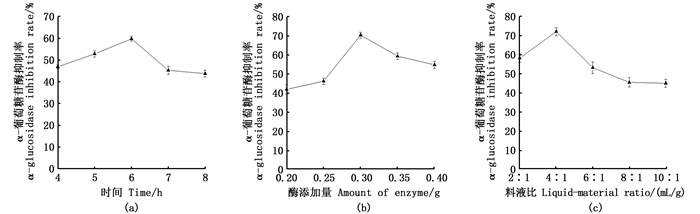
由图 2(a)可知,酶解时间为4~6 h时,α-葡萄糖苷酶抑制率线性递增,且在6 h时α-葡萄糖苷酶抑制率达到最大值59.39%,酶解时间为6~8 h时,抑制率随酶解时间增加逐渐降低。这可能是因为随酶解时间的增加,底物被酶解的越彻底,生产的活性肽增多,而酶解时间过长,使得活性肽被进一步水解,导致酶解产物对α-葡萄糖苷酶的抑制能力下降。如图 2(b),随着酶量的增加,酶解产物对α-葡萄糖苷酶的抑制率先增加后降低,在酶用量为0.3 g时,抑制率达最大值为70.21%。这是因为相同酶解时间下,酶量的增加使得底物分解速率加快,得到更多的活性肽,而酶过量时,活性肽被进一步酶解,对α-葡萄糖苷酶的抑制能力下降。由图 2(c)可知,料液比在2∶ 1~4∶ 1时,酶解产物的α-葡萄糖苷酶抑制率逐渐增大,且在4∶ 1时α-葡萄糖苷酶抑制率达到最大值72.33%,料液比在4∶ 1~10∶ 1时,α-葡萄糖苷酶抑制率逐渐降低。其原因是在料液比为4∶ 1时,酶充分与底物作用,因而抑制率最大,但随酶解体系中溶剂的添加过量降低了酶的含量,从而破坏了酶与底物的充分结合,故抑制率下降。
|
图 2 脱脂南极磷虾粉酶解单因素试验 Fig. 2 Single factor test of enzymatic hydrolysis of Defatted Antarctic Krill powder |
以抑制率为响应值,利用Expert 8.0.6.0软件对响应结果进行回归拟合,得到如下回归方程:Y=+84.26-1.24A+1.47B-1.35C+0.47AB+0.040AC-0.065BC-6.55A2-6.01B2-5.48C2。从实验结果(表 3)和方差分析(表 4)可以看出:所建立的模型显著性极高(P < 0.000 1),失拟项不显著(P=0.130 1>0.05),表明模型比较稳定。CV < 10%,表明可信度比较高; RAdj2=0.982 7、R2=0.992 4,说明模型拟合较好,试验误差小。根据回归方程中各因素的系数值可知各因素对α-葡萄糖苷酶抑制率的影响顺序为酶添加量>料液比>时间。
|
表 3 响应面设计与结果 Tab.3 Response surface design and results |
|
表 4 方差分析 Tab.4 Table of variance analysis |
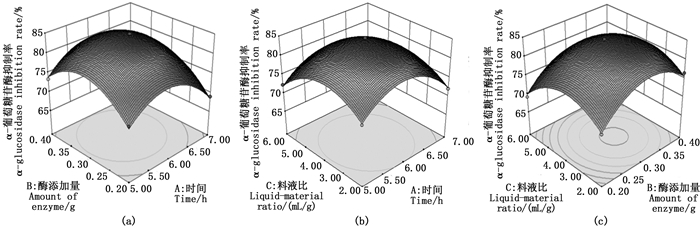
从图 3(a)可以看出,固定酶量,随时间增加抑制率先缓慢增加后逐渐减小,酶解时间固定,酶添加量对α-葡萄糖苷酶抑制率的变化趋于一致,两者交互作用显著,抑制率的极大值在5.5~6.0 h和0.3~0.35 g。图 3(b)与图 3(a)相似,固定时间因素,随料液比增大,抑制率先增加后缓慢减少,固定料液比因素,酶解时间对α-葡萄糖苷酶抑制率的变化先缓慢增加后逐渐减少,抑制率的极大值在5.5~6.0 h和3∶ 1~4∶ 1。图 3(c)可以看出酶添加量与料液比交互作用不明显。
|
图 3 三因素交互作用对α-葡萄糖苷酶抑制率的影响 Fig. 3 Effect of three-factor interaction on the inhibition rate of α-glucosidase |
根据实验数据,利用Design-Expert 8.0.6.0处理,计算出最佳条件为:酶解时间5.91 h、酶添加量0.31 g、料液比3.75∶ 1,此条件下预测值为84.49%。考虑实际操作,最终取优化条件:酶解时间5.9 h、酶添加量0.31 g、料液比3.75∶ 1,通过3组重复实验得到的实验值为83.96%,与预测值相比误差在±1%以内,说明响应面优化得到的酶解条件可靠,具有实际意义。
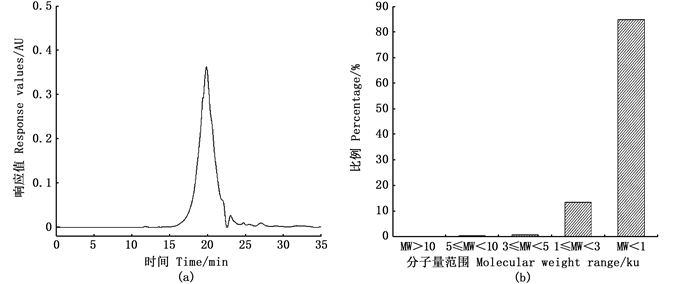
2.4 复合蛋白酶酶解产物的分子量分布不同分子量的肽在凝胶色谱中的保留时间不同,故可以利用分子量与洗脱体积作标准曲线,计算不同分子量的肽分布[22]。标准线性拟合曲线为log2n=4.88x3-1.28x2+10.5x-23.3,R2为0.990。复合蛋白酶在上述响应面优化得到的最优条件下,对脱脂南极磷虾粉进行酶解得到酶解产物,然后利用凝胶色谱法测其分子量分布。由图 4(a)可知酶解产物出峰时间大多数集中在15至23 min之间,结合标准曲线拟合方程算出酶解产物分子量分布,如图 4(b)大部分多肽分子量范围为 < 3 000 u,占98.63%。这表明脱脂南极磷虾粉中的大分子蛋白质被复合蛋白酶酶解基本上为小分子的多肽、寡肽及游离氨基酸。这为接下来的超滤选择超滤膜提供了试验数据支撑。
|
图 4 酶解产物的GPC谱及分子量分布 Fig. 4 GPC spectrum and molecular weight distribution diagram of the hydrolysate |
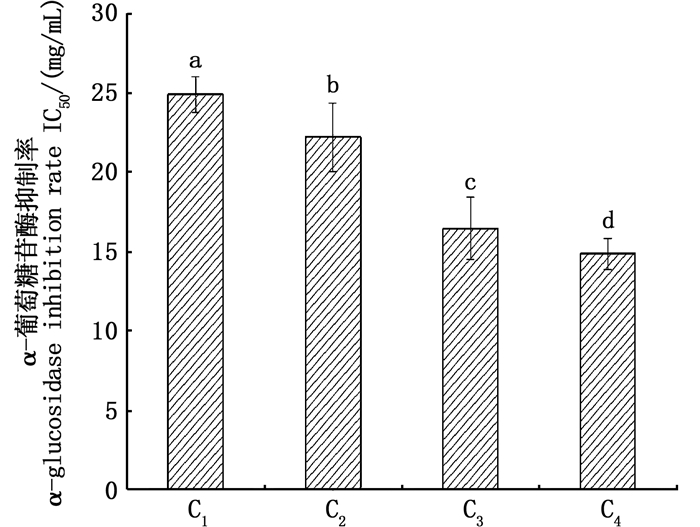
根据脱脂南极磷虾粉酶解液中分子量分布结果,利用10 ku、5 ku和3 ku的超滤膜将酶解液分成C1(MW≥10 ku)、C2(5 ku≤MW < 10 ku)、C3(3 ku≤MW < 5 ku)和C4(MW < 3 ku)等4个组分,每个组分对α-葡萄糖苷酶抑制的IC50值如图 5所示。其中C4[(14.89±2.15) mg/mL]的IC50值明显低于C1[(24.95±1.12) mg/mL]、C2[(22.25±1.96) mg/mL]和C3[(16.48±0.98) mg/mL]。有文献[23]报道酶解产物的分子量大小可以影响其生物活性,通过超滤得到的组分分子量越小其抑制活性越高。顾欣等[24]利用碱性蛋白酶酶解山杏仁制备α-葡萄糖苷酶抑制肽经超滤分离得到分子量 < 5 ku组分抑制效果最好; 李昱菲[3]以鹰嘴豆为原料利用碱性蛋白酶酶解制备α- 葡萄糖苷酶抑制肽经超滤得到 < 3 ku组分抑制效果最好。故选择C4组分进行下一步纯化。
|
图 5 不同分子量段多肽对α-葡萄糖苷酶抑制率的影响 Fig. 5 Effects of different molecular weight peptides on inhibition rate of α-glucosidase |
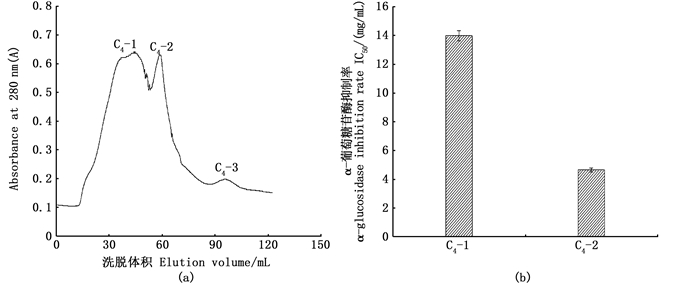
用SephadexG-25分离C4,得到3个洗脱峰(C4-1,C4-2,C4-3)如图 6(a)。由于C4-3组分含量较低,无法收集进行后续研究,所以仅研究前两个组分对α-葡萄糖苷酶抑制的IC50值。由图 6(b)可知C4-2[(4.64±0.14) mg/mL]对α-葡萄糖苷酶抑制活性远高于C4-1[(13.97±0.35) mg/mL],与之前文献[25]研究结果一致。黄钦钦等[26]利用G-10分离纯化条斑紫菜α-葡萄糖苷酶抑制肽分成2个组分,其中后一个组分抑制率最高。由图 6(a)可知,制备的多肽含有丰富的芳香族侧链氨基酸,间接证实制备的物质中含有疏水性氨基酸,这符合文献报道的具有α-葡萄糖苷酶抑制活性物质的特点。
经超滤和G-25纯化后的产物(C4-2)对α-葡萄糖苷酶抑制活性远高于胡建恩等[27]利用Sephadex LH-20纯化牡蛎蛋白水解物得到的α-葡萄糖苷酶抑制组分(IC50为40 mg/mL)和梁凯[28]通过纯化汉麻籽粕酶解产物得到的α-葡萄糖苷酶抑制活性物质(IC50值为6.77 mg/mL)。
|
图 6 SephadexG-25凝胶色谱和各组分(C4-1、C4-2)对α-葡萄糖苷酶抑制IC50 Fig. 6 SephadexG-25 gel chromatography and the inhibition rate of α-glucosidase of each fraction (C4-1, C4-2) |
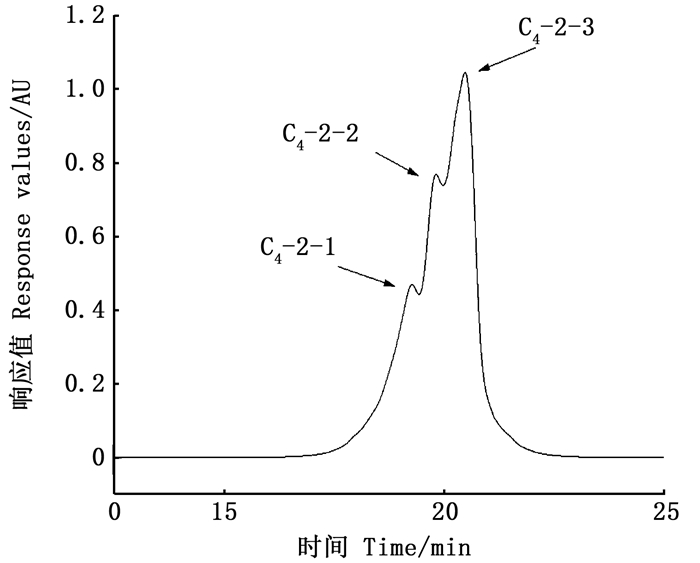
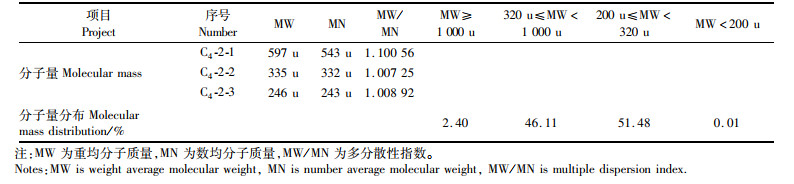
利用凝胶色谱法测C4-2分子质量及分布,如图 7和表 5所示C4-2中多为寡肽,其中分子质量为200~1 000 u的占97.59%。经计算C4-2-1、C4-2-2和C4-2-3的分子量分别为597 u、335 u和246 u,基本上为3~6肽。这与胡宇航等[29]利用玉米制备α-葡萄糖苷酶抑制肽的分子质量基本吻合。准确地测定C4-2的分子质量及分布,为后续α-葡萄糖苷酶抑制肽的进一步鉴定提供基础。
|
图 7 C4-2的GPC谱图 Fig. 7 The GPC spectrum of C4-2 |
|
表 5 C4-2的分子质量以及分子质量分布 Tab.5 Molecular weight and molecular mass distribution of C4-2 |
本研究以脱脂南极磷虾为原料,以抑制率为指标筛选出复合蛋白酶为最佳用酶; 基于单因素结果结合响应面优化确定最优工艺参数:酶解时间5.9 h、料液比3.75∶ 1、酶添加量0.062 g/g(原料)。在此基础上得到的酶解液,其分子质量集中分布在3 000 u以下,占98.63%。经超滤和G-25分离纯化提高了酶解产物的α-葡萄糖苷酶抑制活性。本试验证明了通过复合蛋白酶酶解脱脂南极磷虾粉再经分离纯化得到的物质是具有α-葡萄糖苷酶抑制活性的,也证明了脱脂南极磷虾粉是制备α-葡萄糖苷酶抑制肽的一个很有前途的来源。
这种利用天然产物酶解制备出来的肽往往对人体没有副作用,吸收快,必将成为未来食品工业制造抑制剂的发展趋势[31]。但本研究还需进一步纯化鉴定肽的结构,探究肽的作用机制。
| [1] |
KUMAR T V, LAKSHMANASENTHIL S, GEETHARAMANI D, et al. Fucoidan-α-D-glucosidase inhibitor from Sargassum wightii with relevance to type 2 diabetes mellitus therapy[J]. International Journal of Biological Macromolecules, 2015, 72: 1044-1047. DOI:10.1016/j.ijbiomac.2014.10.013 |
| [2] |
KIM K T, RIOUX L E, TURGEON S L. α-amylase and α-glucosidase inhibition is differentially modulated by fucoidan obtained from Fucus vesiculosus and Ascophyllum nodosum[J]. Phytochemistry, 2014, 98: 27-33. DOI:10.1016/j.phytochem.2013.12.003 |
| [3] |
李昱菲. 鹰嘴豆α-葡萄糖苷酶抑制肽的酶法制备及其稳定性初探[D]. 石河子: 石河子大学, 2016. LI Y F. Preparation of α-glucosidase inhibitory peptides by enzymatic hydrolysis from Chickpea protein and its stability research[D]. Shihezi: Shihezi University, 2011. |
| [4] |
WEI M K, CHAI W M, WANG R, et al. Quinazolinone derivatives: Synthesis and comparison of inhibitory mechanisms on α-glucosidase[J]. Bioorganic & Medicinal Chemistry, 2017, 25(4): 1303-1308. |
| [5] |
范莉, 王业玲, 唐丽. 天然来源α-葡萄糖苷酶抑制剂筛选方法的研究进展[J]. 天然产物研究与开发, 2016, 28(2): 313-321, 306. FAN L, WANG Y L, TANG L. Review on screening methods for α-glucosidase inhibitors from natural resources[J]. Natural Product Research and Development, 2016, 28(2): 313-321, 306. |
| [6] |
张灿, 吴彩娥, 范龚健, 等. 酶解银杏蛋白制备α-葡萄糖苷酶抑制肽的研究[J]. 食品与机械, 2016, 32(11): 137-141. ZHANG C, WU C E, FAN G J, et al. Preparation of α-glucosidase inhibitory peptides derived from Ginkgo biloba by enzymatic method[J]. Food & Machinery, 2016, 32(11): 137-141. |
| [7] |
张玉, 王伟, 张一帆, 等. 响应面法优化蚕蛹蛋白源α-葡萄糖苷酶抑制肽酶解条件[J]. 中国食品学报, 2016, 16(4): 137-144. ZHANG Y, WANG W, ZHANG Y F, et al. The enzymatic hydrolysis condition optimization of α-glucosidase inhibitory peptides of silkworm pupa protein by response surface methodology[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(4): 137-144. |
| [8] |
PUTLAND J, SUTTON T. Survey of larval Euphausia superba lipid content along the western Antarctic Peninsula during late autumn 2006[J]. Polar Science, 2011, 5(3): 383-389. DOI:10.1016/j.polar.2011.01.001 |
| [9] |
WANG Y C, WANG S S, WANG J F, et al. Preparation and anti-osteoporotic activities in vivo of phosphorylated peptides from Antarctic krill (Euphausia superba)[J]. Peptides, 2015, 68: 239-245. DOI:10.1016/j.peptides.2014.10.004 |
| [10] |
李芙蓉, 施文正, 李燕. 高速逆流色谱法分离制备南极磷虾虾粉抗氧化肽[J]. 上海海洋大学学报, 2019, 28(2): 305-312. LI F R, SHI W Z, LI Y. Separation and preparation of Euphausia superba antioxidant peptides by high speed countercurrent chromatography[J]. Journal of Shanghai Ocean University, 2019, 28(2): 305-312. |
| [11] |
赵红星. 降血糖活性肽制备及抑制α-葡萄糖苷酶活性肽纯化与鉴定[D]. 哈尔滨: 哈尔滨工业大学, 2018. ZHAO H X. Preparation of hypoglycemic active peptides and purification and identification of α-glucosidase inhibitory peptides[D]. Harbin: Harbin Institute of Technology, 2018. |
| [12] |
全沁果, 段伟文, 曾雪鸽, 等. 南极磷虾粉成分分析及营养学评价[J]. 食品与机械, 2018, 34(9): 68-72, 76. QUAN Q G, DUAN W W, ZENG X G, et al. Valuable components analysis and nutritional evaluation on antarctic krill (Euphausia superba) meals[J]. Food & Machinery, 2018, 34(9): 68-72, 76. |
| [13] |
秦英英. 燕麦β-葡聚糖的化学改性及其生理活性研究[D]. 上海: 上海海洋大学, 2019. QIN Y Y. Chemical modification and physiological activity of oat β-glucan[D]. Shanghai: Shanghai Ocean University, 2019. |
| [14] |
陈安和. 几种蛋白酶活力测定新方法[J]. 生命的化学(中国生物化学会通讯), 1997, 17(6): 41-43. CHEN A H. Several new methods for the determination of protease activity[J]. Chemistry of Life (Communication of Chinese Society of Biochemistry), 1997, 17(6): 41-43. |
| [15] |
中华人民共和国国家发展和改革委员会. QB/T 2879-2007海洋鱼低聚肽粉[S]. 北京: 中华人民共和国国家质量监督检验检疫总局, 2008. National Development and Reform Commission. QB/T 2879-2007 Marine fish oligopeptides powder[S]. Beijing: General Administration of Quality Supervision, Inspection, and Quarantine of the People's Republic of China, 2008. |
| [16] |
石杰, 宿瑞奇, 张文婷, 等. 三斑海马蛋白ACE抑制肽的制备及其二级结构的研究[J]. 食品研究与开发, 2020, 41(9): 38-44. SHI J, SU R Q, ZHANG W T, et al. Preparation and the secondary structure of angiotensin I-converting enzyme (ACE) inhibitory peptide from the seahorse protein[J]. Food Research and Development, 2020, 41(9): 38-44. |
| [17] |
李艳敏, 郁书怀, 仝艳军, 等. 裙带菜α-葡萄糖苷酶抑制活性肽的制备[J]. 食品工业科技, 2020, 41(20): 127-134. LI Y M, YU S H, TONG Y J, et al. Preparation of α-glucosidase inhibitory peptides derived from Sea Mustard[J]. Science and Technology of Food Industry, 2020, 41(20): 127-134. |
| [18] |
KLOMPONG V, BENJAKUL S, KANTACHOTE D, et al. Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally (Selaroides leptolepis) as influenced by the degree of hydrolysis and enzyme type[J]. Food Chemistry, 2007, 102(4): 1317-1327. DOI:10.1016/j.foodchem.2006.07.016 |
| [19] |
胡春芹, 龙婧, 周楠迪, 等. 紫菜酶解产物锌螯合-α-葡萄糖苷酶抑制剂活性肽的研究[J]. 食品与生物技术学报, 2019, 38(4): 143-149. HU C Q, LONG J, ZHOU N D, et al. Research of α-glucosidase inhibitor from proteolytic product of Porphyra yezoensis chelated with zinc[J]. Journal of Food Science and Biotechnology, 2019, 38(4): 143-149. |
| [20] |
延海莹, 刘盟梦, 乔乐克, 等. 扇贝裙边活性肽的制备及其降血糖活性研究[J]. 食品工业, 2018, 39(3): 117-121. YAN H Y, LIU M M, QIAO L K, et al. Study on scallop skirt active peptide and glucose tolerance activity[J]. The Food Industry, 2018, 39(3): 117-121. |
| [21] |
林海生, 廖津, 章超桦, 等. 华贵栉孔扇贝酶法制备α-葡萄糖苷酶抑制肽的工艺优化[J]. 广东海洋大学学报, 2020, 40(5): 97-104. LIN H S, LIAO J, ZHANG C H, et al. Optimization of enzymatic preparation of α-glucosidase inhibitory peptides from Chlamys nobilis[J]. Journal of Guangdong Ocean University, 2020, 40(5): 97-104. |
| [22] |
刘志彤, 郑淋, 王晨阳, 等. 海参二肽基肽酶IV抑制肽的酶解制备及结构鉴定[J]. 现代食品科技, 2020, 36(8): 166-174. LIU Z T, ZHENG L, WANG C Y, et al. Preparation and structure identification of dipeptidyl-peptidase Ⅳ (DPP-Ⅳ) inhibitory peptides from Holotharia tubulosa by enzymatic hydrolysis[J]. Modern Food Science & Technology, 2020, 36(8): 166-174. |
| [23] |
HYUN C K, SHIN H K. Utilization of bovine blood plasma proteins for the production of angiotensin I converting enzyme inhibitory peptides[J]. Process Biochemistry, 2000, 36(1/2): 65-71. |
| [24] |
顾欣, 崔洁, 李迪, 等. 山杏仁蛋白源α-葡萄糖苷酶抑制肽的分离、纯化及鉴定[J]. 中国粮油学报, 2016, 31(8): 116-121. GU X, CUI J, LI D, et al. Separation, purification, and identification of α-glucosidase inhibitory peptides from apricot kernel proteins[J]. Journal of the Chinese Cereals and Oils Association, 2016, 31(8): 116-121. |
| [25] |
JIN R T, TENG X Y, SHANG J Q, et al. Identification of novel DPP-IV inhibitory peptides from Atlantic salmon (Salmo salar) skin[J]. Food Research International, 2020, 133: 109161. |
| [26] |
黄钦钦, 田亚平. 条斑紫菜蛋白酶解液α-葡萄糖苷酶和DPP-IV抑制活性的表征及肽成分解析[J]. 食品科学, 2020, 41(24): 110-116. HUANG Q Q, TIAN Y P. α-Glucosidase and dipeptidyl peptidase Ⅳ inhibitory activity and peptide composition of Porphyra yezoensis protein hydrolysate[J]. Food Science, 2020, 41(24): 110-116. |
| [27] |
胡建恩, 马驰宇, 王刚, 等. 牡蛎蛋白水解产物中α-葡萄糖苷酶活性抑制组分的分离与纯化[J]. 大连水产学院学报, 2009, 24(5): 449-452. HU J E, MA C Y, WANG G, et al. Isolation and purification of α-glucosidase inhibiting components from oyster protein hydrolysate[J]. Journal of Dalian Fisheries University, 2009, 24(5): 449-452. |
| [28] |
梁凯. 汉麻籽粕降血糖肽的酶法制备及其分离纯化[D]. 广州: 华南理工大学, 2014. LIANG K. Enzymatic preparation and purification hypoglycemic peptide from hemp seed meal[D]. Guangzhou: South China University of Technology, 2014. |
| [29] |
胡宇航, 戴军, 陈尚卫, 等. 玉米降血糖活性肽制备分离及其氨基酸序列分析[J]. 食品与机械, 2017, 33(6): 147-152. HU Y H, DAI J, CHEN S W, et al. Preparation, separation and amino acid sequence analysis of corn peptides with hypoglycemic activity[J]. Food & Machinery, 2017, 33(6): 147-152. |
| [30] |
张姣姣. 天然产物中α葡萄糖苷酶抑制剂的研究进展[J]. 青海畜牧兽医杂志, 2019, 49(3): 62-65, 9. ZHANG J J. Research progress of alpha-glucosidase inhibitors in natural products[J]. Chinese Qinghai Journal of Animal and Veterinary Sciences, 2019, 49(3): 62-65, 9. |
| [31] |
苏建辉, 张玉, 刘成祥, 等. 牡丹籽油及植物提取物的降血糖降血脂活性[J]. 食品与生物技术学报, 2018, 37(7): 739-746. SU J H, ZHANG Y, LIU C X, et al. Antidiabetic and hypolipidemic activity of plant extracts including peony seed oil[J]. Journal of Food Science and Biotechnology, 2018, 37(7): 739-746. |
2. Engineering Research Center for Processing and Storage of Shanghai Seawater Products, Shanghai 201306, China;
3. National Freshwater Aquatic Products Processing Technology R&D Center, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


