2. 中国水产科学研究院黄海水产研究所 海洋渔业科学与食品产出过程功能实验室, 山东 青岛 266071
对虾养殖是水产养殖中的重要支柱性产业,为中国乃至世界水产养殖业的发展做出了巨大贡献。从2001年至今,中国养殖对虾的年产量一直稳居世界首位。2018年世界对虾养殖产量为571.7万t,中国对虾养殖产量205.2万t,占世界养殖总产量的35.9%[1-2]。然而,随着对虾大规模集约化养殖的不断发展,病害问题逐渐成为限制对虾养殖业发展的重要因素。目前,关于对虾病原检测、微生态制剂施用,水产消毒剂、中草药和抗生素的应用以及病害防控技术的研究报道屡见不鲜[3-5]。其中,在中国对虾养殖实践中,泼洒过硫酸氢钾(2KHSO5·K2SO4·KHSO4,简称PMS)进行水质调控和疾病预防的管理手段十分普遍。
PMS是一种由单过硫酸氢钾(KHSO5,PMPS)、硫酸氢钾(KHSO4)和硫酸钾(K2SO4)等组成的酸性复合盐[6]。与含氯消毒剂相比,PMS易溶于水,其水溶液无刺激性气味,分解产物为无机盐,具有杀菌谱广、安全性高、环境友好等优点,是一种高效、绿色安全的氧化剂和消毒剂[7]。PMS可在水体中产生高活性的小分子自由基和活性氧等衍生物,通过氧化作用杀灭各类病毒、细菌、支原体、霉菌等病原微生物[8]。同时,PMS可有效地降解水产养殖池水体中的总氮、总磷,提高池塘溶解氧,降低水体pH,并能分解污泥颗粒促进水解及酸化过程,进而实现改善水质、底质的目的[9]。现有报道[10-11]表明,PMS在水产养殖防疫、畜牧养殖防疫、污水处理、医疗环境消杀、外来病原防御(COVID-19)等领域得到广泛应用。然而,现阶段关于PMS在水产养殖生产应用中的水域环境生态变化规律及其作用效果持续性缺乏系统性分析,有关PMS对池塘养殖环境下的水质、可培养细菌和弧菌及微生物群落变化规律的研究也鲜有报道。
通过比较分析PMS泼洒前后对虾池塘养殖系统中水质理化因子、虾体和水体中可培养细菌和弧菌及水体菌群结构变化情况,系统解析PMS对池塘养殖模式下的水体环境和菌群结构的影响,探究PMS在池塘养殖凡纳滨对虾系统中的水质调控和疾病防控的应用效果,相关研究结果可为评判PMS在水产养殖过程中的防控作用及科学使用提供数据支撑。
1 材料与方法 1.1 样品来源2020年7月,河北省沧州市某凡纳滨对虾养殖场养殖的对虾患病,患病池塘养殖面积为3.33 hm2,水深1.5 m,患病对虾表现为活力降低、肝胰腺模糊呈褐红色、有白便等症状。随后,对患病池塘泼洒PMS,泼洒水体质量浓度约为0.2 g/L。分别从该发病池塘(试验组)及其相邻的同等规模未发病养殖池塘(对照组)采集虾样和水样,并对养殖池塘主要水质理化因子进行检测分析,取虾的肝胰腺和水样进行微生物分离培养和分析。试验池塘与对照池塘的水源一致、投放同批次虾苗、养殖管理条件相同。
1.2 样品采集与环境因子检测为了检测PMS泼洒前后水体菌群结构的变化,在PMS泼洒前第1天(标记为PB1)和第3天(标记为PB3)及泼洒后第1天(标记为PA1)和第3天(标记为PA3)分别采集患病池塘样品,同时为了减少池塘环境自身变化所产生的影响,同步采集相同日期的未泼洒PMS池塘的样品进行比较分析(对应样品编号分别为CB1、CB3、CA1、CA3)。每日清晨6:00对试验池塘和对照池塘进行样品采集和环境因子测定。从每个池塘各选3个不同位点分别取2 L中上层水样,采用无菌纱绢过滤去除水体中较大的颗粒性杂质,随后采用0.22 μm无菌纤维素滤膜对每份水样进行真空抽滤,抽滤体积为1 L,抽滤后的滤膜(含细菌)放入5 mL无菌离心管中,标记后用液氮速冻,暂存于-80 ℃超低温冰箱内用于DNA提取。同步使用便携式YSI测定各采样点的水温、盐度、pH和溶解氧,并使用WTW 6600分光光度仪及氨氮和亚硝酸盐检测试剂盒(Supelco,欧标ISO7150、ISO6777)测定水体的氨氮和亚硝酸盐含量,每组水样平行检测3次。
1.3 虾体和水体可培养细菌含量分析从试验和对照池塘随机捞取10尾对虾,利用消毒后的解剖工具剪取约0.2 g的对虾肝胰腺组织,称重后加入数滴无菌1.5% NaCl溶液进行研磨,将研磨后的肝胰腺组织匀浆洗脱至10 mL无菌离心管中,并用无菌1.5% NaCl溶液进行定量。使用无菌1.5% NaCl溶液通过10倍梯度稀释至10-2和10-3。同步使用无菌1.5% NaCl溶液将不同采样点的水样稀释10倍。分别吸取100 μL肝胰腺组织匀浆稀释液和水样稀释液,涂布于胰蛋白胨大豆肉汤培养基(TSB)和硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(TCBS)上,每个样品平行3组试验,于28 ℃培养24 h后记录TSB和TCBS上可培养细菌和弧菌总量。依据样品稀释浓度,推算两个池塘内水体和对虾肝胰腺内可培养细菌以及弧菌含量。
1.4 高通量测序采用水体样本DNA提取纯化试剂盒(FastDNA? Spin Kit for Soil,MP Biomedicals)对两个池塘内采集到的8份水样滤膜进行总DNA提取,使用1%的琼脂糖凝胶电泳检测DNA提取质量,并对DNA浓度和纯度进行测定。用16S rDNA基因的V3-V4可变区特异性引物进行扩增,每份样品设立3个平行检测,PCR扩增产物使用2%琼脂糖凝胶电泳进行产物回收,委托上海美吉生物医药科技有限公司使用Miseq PE300/NovaSeq PE250平台对检测合格的纯化回收产物进行建库测序分析。
1.5 数据分析通过Excel 2016对原始数据进行初步整理,并使用SPSS 13.0通过单因素方差分析(one-way ANOVA)对数据进行分析,P < 0.05表示差异显著。使用QIIME计算每个样本物种的α多样性指数并绘制门属水平的相对丰度图,基于Bray-Curtis非相似性进行主坐标分析(principal coordinates analysis,PCoA)。
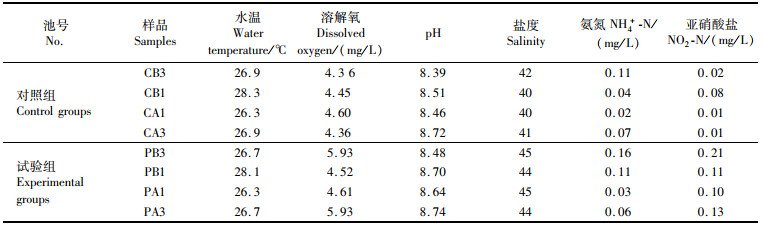
2 结果 2.1 泼洒PMS对池塘水质理化因子的影响对2个池塘环境因子测定结果进行分析,结果表明:试验组和对照组池塘水质理化因子波动趋势相似,水温、DO和pH波动范围分别为26.3~28.3 ℃、4.36~5.93 mg/L、8.39~8.74;盐度、氨氮、亚硝酸盐变化幅度较小,波动范围分别为40~45、0.02~0.16 mg/L、0.01~0.21 mg/L,但PMS泼洒后水体氨氮含量由0.11 mg/L快速降至0.03 mg/L,表明施用0.2 g/L PMS对对虾养殖水体中低含量氨氮也具有一定改善作用,泼洒PMS 24 h和72 h后的水温、溶解氧、pH、盐度、亚硝酸盐无显著差异。
|
表 1 PMS泼洒前后池塘水质理化因子检测信息表 Tab.1 Physicochemical information of water before and after PMS spray |
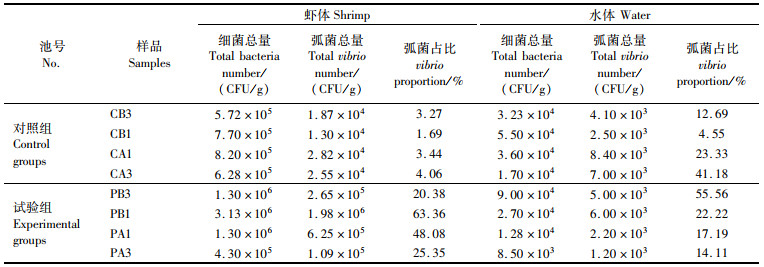
对虾体和水体中可培养细菌数量进行检测分析,结果表明:对照组对虾肝胰腺内可培养细菌和弧菌含量为5.72×105~8.20×105 CFU/g和1.30×105~2.82×104 CFU/g,弧菌占比1.69%~4.06%,弧菌占比处于较低水平;水体可培养细菌和弧菌含量为1.70×105~5.50×104 CFU/mL和2.50×105~8.40×103 CFU/mL,弧菌占比4.55%~41.18%且呈持续升高趋势。与对照组相比,试验组池塘对虾肝胰腺内可培养细菌和弧菌含量普遍较高,PMS泼洒前(PB3 Vs PB1),对虾肝胰腺内可培养细菌和弧菌数量分别由1.30×106 CFU/g(PB3)和2.65×105 CFU/g(PB3)升高到3.13×106 CFU/g(PB1)和1.98×106 CFU/g(PB1),弧菌占比由20.38%(PB3)升高到63.36%(PB1),水体中弧菌数量也呈升高趋势,且试验组池塘发病程度与弧菌的增值呈正相关性。
PMS泼洒后试验组对虾肝胰腺和水体中可培养细菌/弧菌数量和弧菌占比均呈持续下降趋势。肝胰腺内可培养细菌/弧菌数量分别由3.13×106 CFU/g和1.98×106 CFU/g降低至4.30×105 CFU/g和1.09×105 CFU/g,弧菌占比由63.36%降低至25.35%;水体中可培养细菌/弧菌数量分别由2.70×104 CFU/mL和6.00×103 CFU/m降低至8.50×103 CFU/mL和1.20×103 CFU/mL,弧菌占比由22.22%降低至14.11%。对照组中对虾肝胰腺和水体中可培养细菌数量变幅较小。表明PMS可显著降低虾体和水体中可培养细菌数量及弧菌占比,对可培养细菌具有一定的消杀作用。
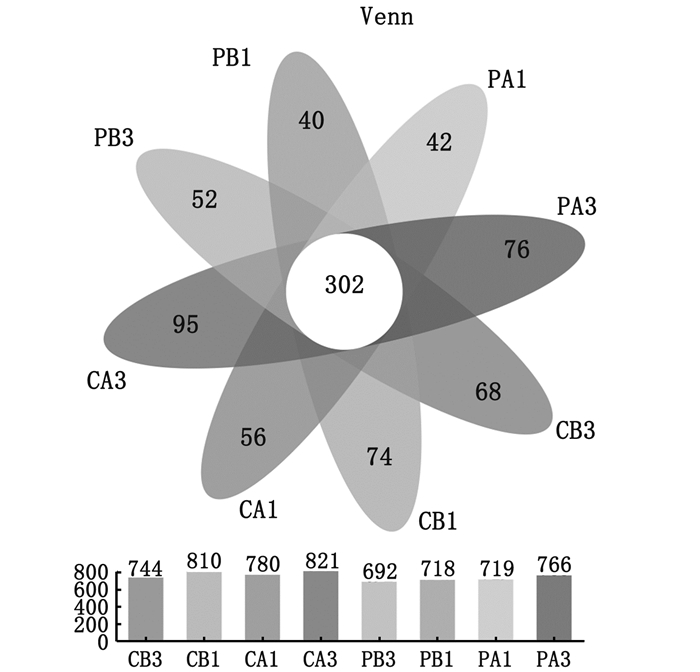
2.3 高通量测序数据分析对CB3/CB1/CA1/CA3,PB3/PB1/PA1/PA3共8组24个池水样品进行高通量测序分析表明,每个样品的平均序列数为54 118条,97%相似度水平下聚类获得1 742个OTU,不同样品的OTU数量在692~821个,8组共有OUT为302个,独有OTU数量分别为68、74、56、95、52、40、42和76个(图 1),各样品中物种覆盖度大于99.26%(99.26%~99.43%)(表 3),表明本次测序信息可信度较高,足够支撑样品中微生物的相关分析结果。
|
图 1 对虾养殖池塘水体微生物在OTU水平检出数的Venn图 Fig. 1 Venn diagram of microorganisms detected in water at OTU level |
|
表 2 PMS泼洒前后水体和对虾肝胰腺中可培养细菌检测信息表 Tab.2 Culturable microorganism information in water and hepatopancreas before and after PMS spray |
|
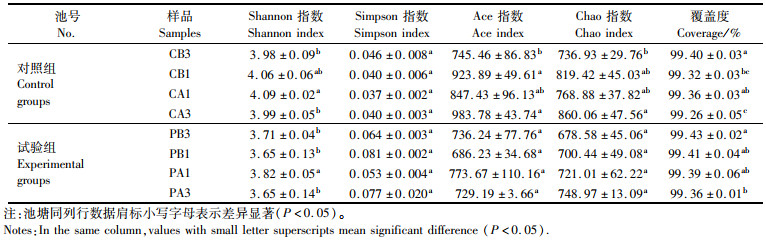
表 3 α多样性指数分析 Tab.3 α diversity indexes |
根据聚类分析结果,进行α多样性分析,其中菌群丰度可由ACE指数、Chao指数进行评估,其数值越高表明群落物种丰富度越高, 菌群多样性由Shannon指数、Simpson指数进行评估,群落多样性与Shannon指数呈正相关,与Simpson指数呈负相关[12]。
α多样性指数分析表明:在同一测序深度下,试验组池塘和对照组池塘水体中有关群落丰富度的Ace指数分别为686.23~773.67和745.46~983.78,Chao指数分别为678.58~748.97和736.93~860.06, 有关群落多样性的Shannon指数分别为3.65~3.82和3.98~4.09,Simpson指数为0.053~0.081和0.037~0.046。对照组池塘水体中微生物群落丰富度指数Ace和Chao整体呈现显著升高的趋势(P < 0.05),试验组池塘水体中群落丰富度Ace和Chao指数无显著变化。泼洒和未泼洒PMS对试验组和对照组池塘水体中群落Simpson指数均无显著差异。
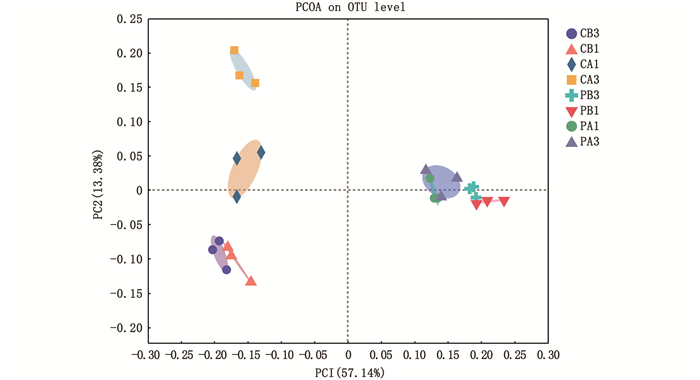
基于Bray Curtis法在OTU水平上对样品间的差异进行主成分分析(PCoA)。结果表明,PC1轴的可信度为57.14%,PC2轴的可信度为13.38%。试验池塘和对照池塘在PC1水平上可将其分为两个独立的微生物群落组成系统,未泼洒PMS前试验池塘PB3和PB1组间以及对照池塘CB3和CB1组间样品均相距较近,出现症状后试验组和对照组样品均与之前有所偏离(PB1与PA1、CB1与CA1、),但泼洒PMS 3天后,试验组样品相距较近(PA1与PA3),对照组样品相距较远(CA1与CA3)。
2.5 菌群结构特征分析通过对Miseq PE300/NovaSeq PE250平台所得有效序列进行归纳整理,将池水各样本在不同分类水平上进行物种注释和统计分析,所得有效数据共注释到34门和542个属。
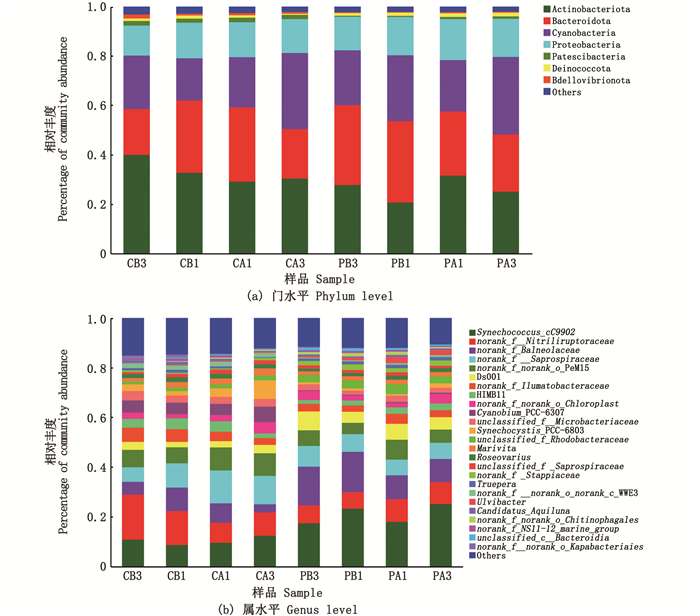
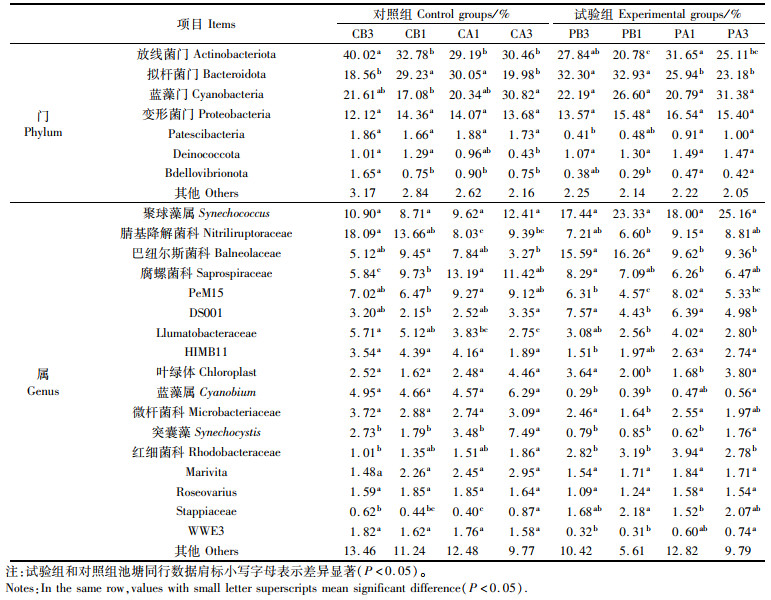
在门水平上相对丰度大于0.1%的菌门中,放线菌门(Actinobacteriota)、拟杆菌门(Bacteroidota)、蓝藻门(Cyanobacteria)和变形菌门(Proteobacteria)为8组内的优势菌门,优势度分别为20.78%~40.02%、18.56%~32.93%、17.08%~31.38%和12.12%~16.54%。试验组泼洒PMS前后(PB1/PA1),放线菌门(Actinobacteriota)和(Bdellovibrionota)相对丰度显著升高(P < 0.05),拟杆菌门(Bacteroidota)相对丰度显著降低(P < 0.05),其他门类无显著性变化。对照组中,CB1和CA1组菌群结构在门水平相对丰度均未有显著差异(P>0.05)。
|
图 2 OTU水平上的样品间PCoA分析 Fig. 2 Principal component analysis at OTU level |
在属水平上,8组中排名较高的优势菌群为聚球藻属(Synechococcus)、腈基降解菌科(Nitriliruptoraceae)、巴纽尔斯菌科(Balneolaceae)、Saprospiraceae、PeM15。试验组泼洒PMS前后(PB1/PA1),腈基降解菌科、PeM15、DS001、Llumatobacteraceae、微杆菌科、Rhodobacteraceae相对丰度显著升高(P < 0.05);巴纽尔斯菌科、Saprospiraceae、Stappiaceae相对丰度显著降低(P < 0.05)。对照组池水中,CB1和CA1组腈基降解菌科、Llumatobacteraceae相对丰度显著降低(P < 0.05),Saprospiraceae、PeM15、Synechocystis相对丰度显著升高(P < 0.05)。
对比泼洒PMS前后3天的变化趋势,结果表明,在门水平上,对照组中放线菌门、蓝藻门的相对丰度逐渐升高,Deinococcota和Bdellovibrionota的相对丰度逐渐降低;试验组泼洒PMS后,Patescibacteria和Bdellovibrionota相对丰度逐渐升高,拟杆菌门相对丰度逐渐降低。在属水平上,对照组中Saprospiraceae、PeM15、Synechocystis、Rhodobacteraceae的相对丰度显著升高,腈基降解菌科、Llumatobacteracea的相对丰度显著降低;试验组中巴纽尔斯菌科和Saprospiraceae的相对丰度显著降低,腈基降解菌科、HIMB11、蓝藻属、Synechocystis、WWE3的相对丰度显著升高。
|
图 3 基于门水平(a)和属水平(b)细菌物种相对丰度分析 Fig. 3 Histogram of bacterial species relative abundance at phylum (a) and genus (b) level |
PMS作为一种安全、高效的消毒剂和氧化剂已经在水产养殖领域得到广泛使用[7]。PMS与水发生氧化反应后生成不稳定的臭氧,臭氧瞬间分解成氧气和氧原子,即所谓的新生态氧,从而提高水体溶解氧,加快水体物质循环,降解水体中总氮和总磷以及降低COD、pH及亚硝酸盐等,进而实现改善水质和底质的目的[8, 13]。该研究发现,虽然试验池塘水体的氨氮和亚硝酸盐的含量一直处于低值水平,但泼洒PMS后3 d内的氨氮较泼洒前显著降低,表明PMS对低含量氨氮也有良好的改善作用。但是PMS泼洒24 h和72 h对池塘内的溶解氧、pH无显著差异影响,分析其原因可能为:大水面池塘养殖环境条件下,水体溶解氧主要受潮汐、气候、风力等因素影响较大,PMS的使用可能在一定程度改变水体溶解氧含量,但并未达到显著水平;pH的改变受多种因子影响,PMS可能使得水体瞬时pH发生显著变化,但随着池塘水质在风力、温差、饵料投喂及水生生物活动等影响下,由PMS导致的水体pH降低效应被弱化。
|
表 4 PMS对池塘水体微生物门水平和属水平相对丰度的影响 Tab.4 Effect of PMS on bacterial relative abundance at phylum and genus levels of pond water |
PMS的灭菌作用机理为在水中经过链式反应,产生次氯酸、新生态氧和有机酸等成分,依此杀灭病原微生物[9]。其对水体中的大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、假单胞菌(Pseudomonas)、链球菌(Streptococcus)、爱德华氏菌(Edwardsiella)、嗜水气单胞菌(Aeromonas hydrophila)、副溶血弧菌(Vibrio parahemolyticus)、灿烂弧菌(V. splendidus)等多种病原菌均有较强的杀灭效果,且对革兰氏阴性菌的消杀效果优于革兰氏阳性菌[14-16]。另有研究[17-18]表明,弧菌是对虾养殖中最常见的病原菌,在对虾病害暴发期间,对虾体内和养殖水体的细菌变化主要以弧菌丰度的增加为主。该研究的对虾养殖系统中,发病池塘对虾肝胰腺内可培养细菌和弧菌含量与对照组相比高出1~2个数量级,尤其是弧菌数量大量扩增,该结果与对虾发病病原菌特征相符。通过对对虾肝胰腺和水体中可培养细菌和弧菌数量进行检测分析表明,PMS泼洒能显著降低池塘水体和对虾肝胰腺内的病原菌数量。该研究结果进一步证明PMS对环境微生物具有一定消杀作用且PMS对水体内的弧菌或非弧菌的消杀作用无选择性。
水环境的稳定性与微生物的多样性密切相关。多样性指数是评判微生物群落多样性的重要指数,水体微生物多样性指数下降会增大养殖动物患病风险[19-20]。该研究通过高通量测序分析表明,各实验组的物种覆盖度均大于99.26%,符合MAO等[21]描述的取样充分测序样品覆盖度需高于97%的要求。因此,该测序结果能充分反映对虾池塘养殖水体微生物群落种类和结构。试验池塘水体菌群的Ace、Chao和Shannon指数均比对照组低,且PMS泼洒并未显著改变水体菌群的细菌群落丰富度和α多样性。PCOA分析表明泼洒PMS试验组样品相距较近,未泼洒PMS对照组样品较泼洒前偏离较远。结果表明适当使用PMS无法在短期内增加水体微生物群落的丰度和多样性。
对海洋微生物群落的研究表明,拟杆菌门和变形菌门是世界各地不同季节海水中的主要微生物群体[22]。拟杆菌门对于降解养殖水体中可溶性有机物具有重要作用,水体中残饵及粪便沉积可导致拟杆菌门含量增加[23-24]。该研究中泼洒PMS试验组中拟杆菌门相对丰度显著降低,可能是PMS对拟杆菌门的增殖有一定抑制作用。PMS泼洒后患病对虾症状缓解,并显著降低系统内可培养细菌数量,变形菌门相对丰度略高于对照组且呈现波动上升趋势,该结果与ZHENG等[25]关于患病对虾池水中变形菌门丰度显著高于对照池的研究结果相似。黄雪敏等[26]与薛明等[27]均研究表明,对虾养殖池中放线菌门为优势菌门,其相对丰度对照池显著高于发病池。该研究发现,放线菌门在两个池塘中均是优势菌门,其相对丰度在对照组中呈显著降低趋势,在试验组中泼洒PMS后显著升高,表明PMS对放线菌门的增值作用无显著抑制作用。蓝藻门在水体碳氮循环中扮演着重要的角色,而蓝细菌的过度生长会导致水生生物的患病死亡[28]。该研究发现,试验组中泼洒PMS 24 h后蓝藻门相对丰度有所下降,对照组中上升,可能是PMS对水体内蓝藻的增值有一定的抑制作用。由于肝胰腺内脂质和微量元素的干扰,未能成功测得肝胰腺内菌群结构变化情况,而在水体微生物群落分析中,泼洒PMS后弧菌占比处于较低水平(< 0.1%)(相关结果未列出)。结果表明泼洒PMS前后水体内微生物菌群结构呈现一定程度的波动变化,并影响水体中微生物群落的丰度和多样性,进而实现对水体中微生物群落起到全方位调控作用。
综上所述,该研究结果表明:与对照组相比,发病池塘对虾肝胰腺内可培养细菌和弧菌含量普遍较高,尤其是弧菌数量大量增殖,说明这是对虾发病的主要因素。虽然可培养微生物在整个水体菌群结构中体现不大,但是泼洒PMS后水体和虾体内可培养细菌和弧菌数量及弧菌占比均呈现显著降低趋势,PMS对水体内微生物群落也起到一定调控作用,且PMS泼洒对水体中低含量的氨氮也有显著的降低作用,说明PMS泼洒对凡纳滨对虾养殖水体水质理化因子具有一定的改善作用。建议在生产实践中定期使用PMS进行水质改良和有害菌的抑制。相关研究结果为评判PMS在水产养殖过程中的防控作用及其科学使用提供数据支撑。
| [1] |
FAO (Food and Agriculture Organization of the United Nations). FAO yearbook 2020, Fishery and Aquaculture Statistics[M]. Rome: FAO, 2020.
|
| [2] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴2020[M]. 北京: 中国农业出版社, 2020. Ministry of Agriculture and Rural Affairs of the People's Republic of China, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistical yearbook 2020[M]. Beijing: China Agriculture Press, 2020. |
| [3] |
曲木, 暴丽梅, 赵子续, 等. 微生态制剂在水产养殖中的应用[J]. 生物化工, 2019, 5(6): 102-106, 119. QU M, BAO L M, ZHAO Z X, et al. Application of microecological preparations in aquaculture[J]. Biological Chemical Engineering, 2019, 5(6): 102-106, 119. DOI:10.3969/j.issn.2096-0387.2019.06.030 |
| [4] |
张星, 姚吉伦, 徐文思, 等. 过硫酸氢钾在水处理中的应用研究进展[J]. 化学与生物工程, 2018, 35(2): 8-14. ZHANG X, YAO J L, XU W S, et al. Research progress in applications of peroxymonosulfate in water treatment[J]. Chemistry & Bioengineering, 2018, 35(2): 8-14. DOI:10.3969/j.issn.1672-5425.2018.02.002 |
| [5] |
曾泳钦, 林晓璇, 刘国光, 等. 臭氧联合过硫酸氢钾复合盐氧化降解水中酮洛芬的研究[J]. 环境科学学报, 2017, 37(6): 2158-2163. ZENG Y Q, LIN X X, LIU G G, et al. Enhanced ozonation of ketoprofen by peroxymonosulfate[J]. Acta Scientiae Circumstantiae, 2017, 37(6): 2158-2163. |
| [6] |
冯秀, 王爱玲, 张振仓, 等. 过硫酸氢钾复合物最佳杀菌条件的研究[J]. 动物医学进展, 2017, 38(8): 39-42. FENG X, WANG A L, ZHANG Z C, et al. Study on optimum sterilization conditions of potassium monopersulfate compound[J]. Progress in Veterinary Medicine, 2017, 38(8): 39-42. DOI:10.3969/j.issn.1007-5038.2017.08.008 |
| [7] |
JIN B D, NIU J T, DAI J W, et al. New insights into the enhancement of biochemical degradation potential from waste activated sludge with low organic content by Potassium Monopersulfate treatment[J]. Bioresource Technology, 2018, 265: 8-16. DOI:10.1016/j.biortech.2018.05.032 |
| [8] |
NIU T H, ZHOU Z, REN W C, et al. Effects of potassium peroxymonosulfate on disintegration of waste sludge and properties of extracellular polymeric substances[J]. International Biodeterioration & Biodegradation, 2016, 106: 170-177. |
| [9] |
唐兴刚, 魏文康, 罗胜军, 等. 过硫酸氢钾复合物在畜牧水产中的应用研究进展[J]. 中国兽药杂志, 2020, 54(8): 73-79. TANG X G, WEI W K, LUO S J, et al. Advances in research of potassium peroxomonosulfate compound on animal husbandry and aquatic[J]. Chinese Journal of Veterinary Drug, 2020, 54(8): 73-79. |
| [10] |
SONTHIPET S, RUENPHET S, TAKEHARA K. Bactericidal and virucidal efficacies of potassium monopersulfate and its application for inactivating avian influenza virus on virus-spiked clothes[J]. Journal of Veterinary Medical Science, 2018, 80(4): 568-573. DOI:10.1292/jvms.17-0599 |
| [11] |
HASHIZUME M, AOKI K, OHNO S, et al. Disinfectant potential in inactivation of epidemic keratoconjunctivitis-related adenoviruses by potassium peroxymonosulfate[J]. European Journal of Ophthalmology, 2021, 31(2): 379-384. DOI:10.1177/1120672119891408 |
| [12] |
李成, 孔晓雪, 余炬波, 等. 基于高通量测序分析蟹糊微生物菌群多样性[J]. 食品科学, 2020, 41(4): 134-139. LI C, KONG X X, YU J B, et al. Analysis of microbial community diversity of crab paste by high-throughput sequencing[J]. Food Science, 2020, 41(4): 134-139. |
| [13] |
周冬仁, 罗毅志, 叶雪平, 等. 几种常用水质改良剂处理中华鳖养殖废水效果比较试验[J]. 现代农业科技, 2016(2): 268-270. ZHOU D R, LUO Y Z, YE X P, et al. Comparative test of several common water quality improvers in treating turtle culture wastewater[J]. Modern Agricultural Science and Technology, 2016(2): 268-270. DOI:10.3969/j.issn.1007-5739.2016.02.159 |
| [14] |
谈智, 孙巍, 唐晨晨, 等. 单过硫酸氢钾复合盐杀菌效果与影响因素研究[J]. 中国消毒学杂志, 2017, 34(1): 5-8. TAN Z, SUN W, TANG C C, et al. Study on the bactericidal efficacy and influence factor of potassium hydrogen peroxy-monosulfate disinfectant[J]. Chinese Journal of Disinfection, 2017, 34(1): 5-8. |
| [15] |
MAINOUS M E, SMITH S A, KUHN D D. Effect of common aquaculture chemicals against Edwardsiella ictaluri and E. tarda[J]. Journal of Aquatic Animal Health, 2010, 22(4): 224-228. DOI:10.1577/H10-020.1 |
| [16] |
王欣舒, 吴明松, 刘宇鹤, 等. 单过硫酸氢钾复合盐的消毒研究与应用进展[J]. 无机盐工业, 2021, 53(4): 32-37. WANG X S, WU M S, LIU Y H, et al. Research and application progress of potassium monopersulfate compound for disinfection[J]. Inorganic Chemicals Industry, 2021, 53(4): 32-37. |
| [17] |
SULLAM K E, ESSINGER S D, LOZUPONE C A, et al. Environmental and ecological factors that shape the gut bacterial communities of fish: a meta-analysis[J]. Molecular Ecology, 2012, 21(13): 3363-3378. DOI:10.1111/j.1365-294X.2012.05552.x |
| [18] |
XIONG J B, ZHU J L, WANG K, et al. The temporal scaling of bacterioplankton composition: high turnover and predictability during shrimp cultivation[J]. Microbial Ecology, 2014, 67(2): 256-264. DOI:10.1007/s00248-013-0336-7 |
| [19] |
周洪玉, 韩梅琳, 仇天雷, 等. 不同生物过滤系统铵态氮转化速率及生物膜特性分析[J]. 环境科学, 2017, 38(6): 2444-2452. ZHOU H Y, HAN M L, QIU T L, et al. Ammonia removal rate and microbial community structures in different biofilters for treating aquaculture wastewater[J]. Environmental Science, 2017, 38(6): 2444-2452. |
| [20] |
YING C, CHANG M J, CHANG Y T, et al. Photosynthetic bacteria enhanced water quality and integrity of microbial community composition of integrated multitrophic aquaculture system of milkfish Chanos chanos coastal farming[J]. Fisheries Science, 2020, 86(2): 329-338. DOI:10.1007/s12562-019-01387-z |
| [21] |
MAO S Y, ZHANG M L, LIU J H, et al. Characterising the bacterial microbiota across the gastrointestinal tracts of dairy cattle: membership and potential function[J]. Scientific Reports, 2015, 5(1): 16116. DOI:10.1038/srep16116 |
| [22] |
TINTA T, VOJVODA J, MOZETICˇ P, et al. Bacterial community shift is induced by dynamic environmental parameters in a changing coastal ecosystem (northern Adriatic, northeastern Mediterranean Sea) – a 2-year time-series study[J]. Environmental Microbiology, 2015, 17(10): 3581-3596. DOI:10.1111/1462-2920.12519 |
| [23] |
COTTRELL M T, KIRCHMAN D L. Natural assemblages of marine proteobacteria and members of the Cytophaga-flavobacter cluster consuming low- and high-molecular-weight dissolved organic matter[J]. Applied and Environmental Microbiology, 2000, 66(4): 1692-1697. DOI:10.1128/AEM.66.4.1692-1697.2000 |
| [24] |
邱楚雯, 施永海, 王韩信. 暗纹东方鲀不同养殖模式下的微生物群落结构[J]. 水产学报, 2021, 45(2): 209-220. QIU C W, SHI Y H, WANG H X. Microbial community structure in different cultural patterns of Takifugu obscures[J]. Journal of Fisheries of China, 2021, 45(2): 209-220. |
| [25] |
ZHENG Y F, YU M, LIU J W, et al. Bacterial community associated with healthy and diseased pacific white shrimp (Litopenaeus vannamei) larvae and rearing water across different growth stages[J]. Frontiers in Microbiology, 2017, 8: 1362. DOI:10.3389/fmicb.2017.01362 |
| [26] |
黄雪敏, 温崇庆, 梁华芳, 等. 健康和发病凡纳滨对虾糠虾期育苗池水体的菌群结构比较[J]. 广东海洋大学学报, 2018, 38(4): 27-34. HUANG X M, WEN C Q, LIANG H F, et al. Comparison of bacterial community structure in larval rearing water between healthy and diseased Litopenaeus vannamei mysis[J]. Journal of Guangdong Ocean University, 2018, 38(4): 27-34. DOI:10.3969/j.issn.1673-9159.2018.04.004 |
| [27] |
薛明, 何瑶瑶, 邱孟德, 等. 高通量测序分析凡纳滨对虾育苗期水体菌群结构特征[J]. 水产学报, 2017, 41(5): 785-794. XUE M, HE Y Y, QIU M D, et al. Characterization of aquatic bacterial community of Litopenaeus vannamei larvae during hatchery period with high-throughput sequencing[J]. Journal of Fisheries of China, 2017, 41(5): 785-794. |
| [28] |
范立民, 吴伟, 裘丽萍, 等. 罗非鱼养殖池塘水和表层沉积物中蓝藻的群落结构及影响因素研究[J]. 上海海洋大学学报, 2017, 26(6): 844-852. FAN L M, WU W, QIU L P, et al. Community structure of cyanobacteria in water and surface sediment of tilapia ponds and the influencing factors[J]. Journal of Shanghai Ocean University, 2017, 26(6): 844-852. |
2. Laboratory for Marine Fisheries Science and Food Production Processes, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, Shandong, China
 2022,
Vol. 31
2022,
Vol. 31


