2. 国家远洋渔业工程技术研究中心, 上海 201306;
3. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
4. 农业农村部大洋渔业开发重点实验室, 上海 201306;
5. 农业农村部大洋渔业资源环境科学观测实验站, 上海 201306;
6. 浙江省海洋水产研究所, 浙江 舟山 316021
阿根廷滑柔鱼(Illex argentinus)是西南大西洋海域重要的经济头足类种类,生长速度快,寿命短,广泛分布在22°S~54°S的西南大西洋大陆架和大陆坡海域,是我国鱿钓渔业的重要捕捞对象[1-4]。FAO渔业统计数据显示,阿根廷滑柔鱼产量年间波动大,规律不明确[5]。已有研究[6-8]表明,海洋环境和气候变化等因素对阿根廷滑柔鱼的渔场形成和资源量变化具有很强的影响。特别是海表面温度[6, 9-11]、叶绿素a质量浓度[12-13]和垂直水层温度[14]等环境因素对阿根廷滑柔鱼渔场产生不同程度的影响。除海洋环境因素的影响外,阿根廷滑柔鱼渔场资源分布与气候环境有关[15]。目前针对阿根廷滑柔鱼渔场形成和资源变动的研究主要集中在探究海表环境因子的影响,且关于大尺度气候变化对阿根廷滑柔鱼资源分布的研究较少。
南极海冰变化作为全球范围的大尺度气候变化会对全球海洋水温以及鱼类的种群分布产生显著影响[16-17]。南极海冰覆盖范围是指南极地区海冰密集程度(sea ice concentration)超过15%的区域面积。在阿根廷-乌拉圭共同渔业区内(Argentine-Uruguayan common fishing zone, AUCFZ),阿根廷滑柔鱼具有垂直洄游的习性且主要栖息在50~200 m水深范围内[18]。南极海冰覆盖范围变化可能会引起阿根廷滑柔鱼渔场内不同水层的水温发生变化,并进一步影响阿根廷滑柔鱼栖息地的分布[19]。因此,为深入研究南极海冰覆盖范围变化对阿根廷滑柔鱼栖息地的影响,本文基于西南大西洋不同水层水深温度构建的栖息地适宜性指数(habitat suitability index, HSI)模型,探究不同深度海水温度和阿根廷滑柔鱼栖息地对南极海冰覆盖范围变化的响应,以理清未来南极海冰融化不同程度情况下西南大西洋阿根廷滑柔鱼栖息地的变化规律,为渔业生产和管理政策制定提供科学依据。
1 材料与方法 1.1 渔业和环境数据阿根廷滑柔鱼捕捞数据来自上海海洋大学鱿钓技术组,数据时间范围为2013—2017年的1—4月,渔场主要范围为41°S~49°S和55°W~61°W的阿根廷公海海域。渔业数据包括作业经纬度、作业时间、捕捞努力量和产量。利用Matlab软件将渔业数据时间分辨率转化为月,空间分辨率转化为0.5°×0.5°。
依据阿根廷滑柔鱼的生活史习性,垂直水温水层选择54、96和193 m。垂直水温数据来自亚太数据研究中心(http://apdrc.soest.hawaii.edu/las_ofes/v6/dataset?catitem=71),时间尺度为月,空间分辨率为0.5°×0.5°。利用Matlab将渔业与环境数据进行匹配并建模。
南极海冰覆盖范围数据来自美国国家冰雪数据中心(https://nsidc.org/data/seaice_index/),时间尺度为天。
1.2 分析方法计算2013—2017年1—4月西南大西洋阿根廷滑柔鱼渔场54、96和193 m水深海水温度的月平均值,将其与海冰覆盖范围月平均值进行对比分析,分析海冰覆盖范围与不同水层海水温度之间的关系。
栖息地适宜性指数(HSI)模型最初被用于描述野生动物对周围栖息地环境的适应情况,现已普遍应用在渔业资源变动研究方面[20-21]。构建基于不同水层海水温度的西南大西洋阿根廷滑柔鱼综合HSI模型[19],利用综合HSI模型计算2013—2017年1—4月西南大西洋阿根廷滑柔鱼公海渔场的平均HSI,选取海冰覆盖范围最高和最低的两年,对比两年1—4月各月西南大西洋阿根廷滑柔鱼栖息地适宜性变化情况。其中,基于捕捞努力量与不同水层水温的频次分布关联构建不同水层的单环境因子曲线,其拟合公式[22]为
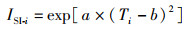 (1)
(1)
式中:a、b为应用最小二乘法估计的模型参数,使观测值与预测值的残差最小;i为不同水深,m;Ti为不同深度的海水水温, ℃;ISI-i为水深i的单水温因子SI值。基于不同权重的分配方案来构建综合HSI模型,HSI计算公式[22]为
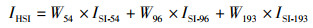 (2)
(2)
式中:IHSI为基于不同水层温度的综合栖息地适宜性指数;W54、W96、W193为54、96和193 m水深水温SI值的权重,权重方案分别为(1,0,0)、(0, 1, 0)、(0, 0, 1)、(0.8、0.1、0.1)、(0.1, 0.8, 0.1)、(0.1, 0.1, 0.8)、(0.5, 0.25, 0.25)、(0.25, 0.5, 0.25)、(0.25, 0.25, 0.5)、(0.333, 0.333, 0.333);ISI-54、ISI-96、ISI-193为54、96和193 m水深水温SI值。通过分析捕捞努力量分布与适宜栖息地分布的重合程度,即计算捕捞努力量在适宜栖息海域内的占比来比较不同权重方案下的模型性能并筛选最优性能的HSI模型,预测阿根廷滑柔鱼栖息地适宜性。认为HSI≥0.6和HSI≤0.2的海域分别为阿根廷滑柔鱼的适宜栖息地和不适宜栖息地[22]。
有研究[23]表明,南极海冰融化会引起周边海域水温降低,在一般情况下每10年下降0.1 ℃,而近几十年来,气候变暖引致的南极海冰融化严重,对周边海域水温及其生态系统产生严重的影响。西南大西洋海域离南极海域较近,加上海流的作用会将南极融化的冷水团通过不同水层输送至阿根廷外海海域,因此必然会引起该海域内垂向水温的降低[19]。但前人研究并未量化水温会降低至何种程度。因此,本文假设南极海冰融化引起阿根廷滑柔鱼渔场内不同水层的海水温度分别降低0.1、0.3、0.5和1.0 ℃,分析西南大西洋阿根廷滑柔鱼HSI的时空分布在垂向水温下降不同水平情况下的变化规律,进一步估算阿根廷滑柔鱼不同作业区域内(公海、阿根廷EEZ、福克兰群岛EEZ)适宜栖息地时空分布的变化情况。其中适宜栖息地的经纬度重心位置计算公式[24]为
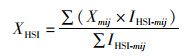 (3)
(3)
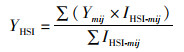 (4)
(4)
式中: XHSI是适宜HSI的经度重心;YHSI是适宜HSI的纬度重心;Xmij为对应m月份渔区i的经度;Ymi是对应m月份渔区i的纬度;IHSI-mij为m月份对渔区i的HSI值。
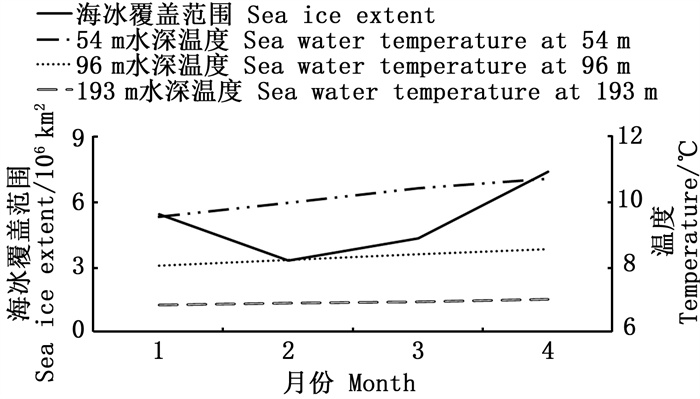
2 结果 2.1 南极海冰覆盖范围与不同水层海水温度的关系南极海冰覆盖范围和不同水层海水温度均存在明显的月间变化(图 1)。1—4月海冰覆盖范围呈现先降低后升高的趋势,具体表现为1—2月下降,2月海冰覆盖范围最低,为3.312×106 km2;2—4月逐月升高,4月海冰覆盖范围达到最高,为7.398×106 km2。水温与南极海冰覆盖范围的整体变化趋势较为一致。1—4月54、96和193 m的水温都呈现明显的线性增长趋势,但不同水深的水温差异较大,水深越深,水温越低。水深54 m时,水温最低9.55 ℃,最高10.71 ℃;水深96 m时,水温最低8.04 ℃,最高8.55 ℃;水深193 m时,水温最低6.84 ℃,最高7.02 ℃。将2013—2017年1—4月各月南极海冰覆盖范围和不同水层水温进行相关分析,均呈显著相关(P < 0.05)。
|
图 1 2013—2017年1—4月海冰覆盖范围与不同水层海水温度月间平均值变化对比 Fig. 1 Comparison of variations in monthly average sea ice extent and sea water temperature at different water layers from January to April during 2013-2017 |
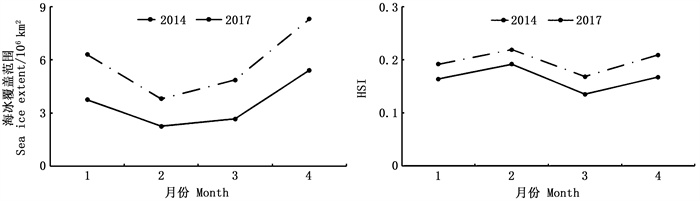
如图 2所示,2014年(南极海冰覆盖范围最高)和2017年(南极海冰覆盖范围最低)1—4月南极海冰覆盖范围都呈现明显的先降低后升高的趋势:1—2月下降,2月海冰覆盖范围最低,2014年为3.84×106 km2,2017年为2.29×106 km2;2—4月逐月升高,4月海冰覆盖范围达到最高,2014年为8.34×106 km2,2017年为5.44×106 km2。且2014年各月海冰覆盖范围明显高于2017年各月。对比两年HSI变化可以发现,2014年月均HSI要显著高于2017年。两年渔场内的HSI都呈现先升高后降低再升高的趋势。
|
图 2 海冰覆盖范围和HSI月间变化 Fig. 2 Comparison of variations in monthly sea ice extent and habitat suitability index (HSI) of I. argentinus |
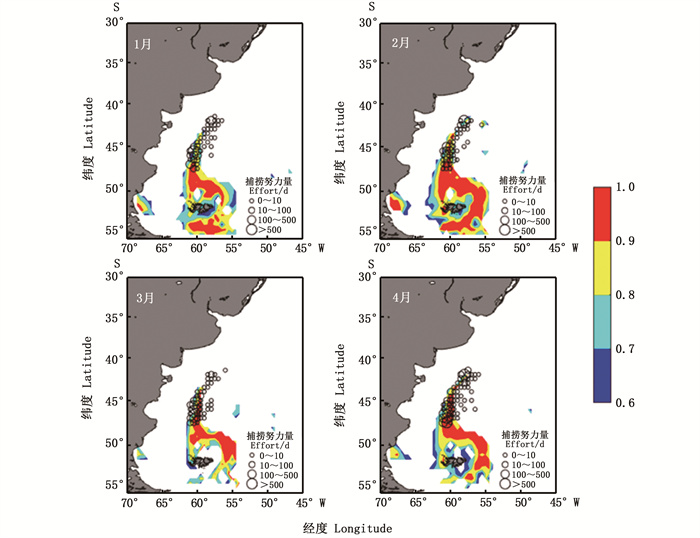
2013—2017年1—4月各月的阿根廷滑柔鱼捕捞努力量分布与最适宜栖息地(HSI≥0.6)分布高度重合(图 3),1—4月分别有86.2%、99.5%、78.2%和92.4%的捕捞努力量处于适宜栖息地范围内,证明该HSI模型模拟效果较好,对阿根廷滑柔鱼栖息地情况的判断较为准确。
|
图 3 2013—2017年1—4月最适宜栖息地与捕捞努力量的空间分布图 Fig. 3 Spatial distribution of suitable habitat overlaid with fishing effort from January to April |
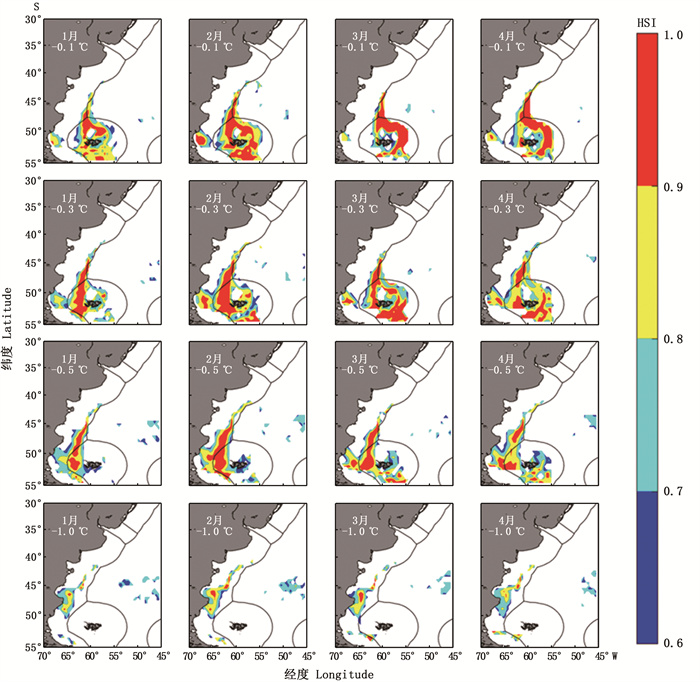
图 4结果显示,1—4月各月随着水温降低,最适宜栖息地空间覆盖范围整体均呈现向阿根廷EEZ线内移动的趋势,并且在水温降低1.0 ℃时,整体适宜栖息地范围显著变少。
|
图 4 垂向温度降低不同水平时阿根廷滑柔鱼适宜栖息地的时空分布 Fig. 4 Spatio-temporal distribution of suitable habitat of Illex argentinus under the scenarios of vertical water temperature decreasing by 0.1, 0.3, 0.5 and 1.0 ℃, respectively |
阿根廷滑柔鱼适宜栖息地面积随垂向温度降低而呈现不同变化(图 5)。1—4月随着水温降低,最适宜栖息地整体均呈现先升高后降低的趋势,特别在降温1 ℃时发现适宜栖息地呈现大幅下降势态,各月适宜栖息地比例在降温1 ℃时的占比均最低。1—4月随着水温降低,不适宜栖息地整体呈现先降低后升高的趋势,在降温1 ℃时不适宜栖息地比例大幅升高。1、2、4月最适宜栖息地占比最高在降温0.3 ℃时出现,对应比例分别为18.27%、22.11%、21.39%;3月最适宜栖息地占比最高在降温0.5 ℃时出现,为18.87%。
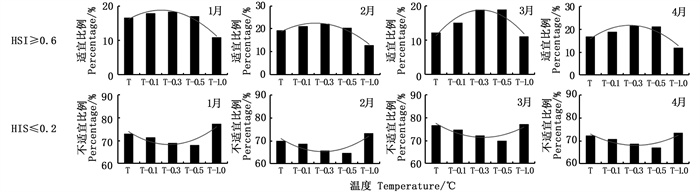
|
图 5 垂向温度降低不同水平时阿根廷滑柔鱼适宜和不适宜栖息地面积比例 Fig. 5 Comparison in the percentages of suitable habitat and poor habitat of I.argentinus under the scenarios of vertical water temperature decreasing by 0.1, 0.3, 0.5 and 1.0 ℃, respectively |
由图 6可清晰发现,1—4月随着垂向水温的降低,阿根廷滑柔鱼适宜栖息地经纬度重心发生显著变化。1—4月在垂向水温降低0.1、0.3、0.5 ℃时,适宜栖息地向西北方向移动且移动距离较短;而垂向水温降低1.0 ℃时,适宜栖息地经纬度重心向东北方向作长距离移动。
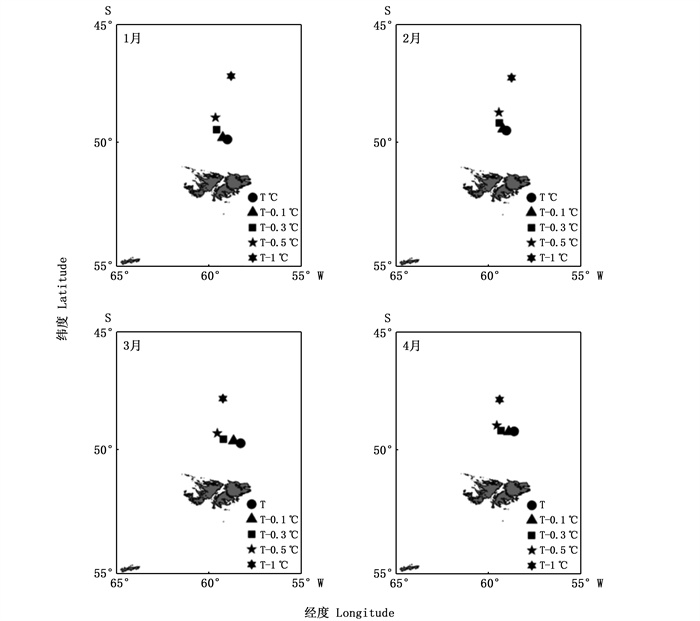
|
图 6 垂向温度降低不同水平时阿根廷滑柔鱼适宜栖息地经纬度重心空间变化图 Fig. 6 Spatial variations of longitudinal and latitudinal gravity centers of suitable habitat of I.argentinus under the scenarios of vertical water temperature decreasing by 0.1, 0.3, 0.5 and 1.0 ℃, respectively |
阿根廷滑柔鱼适宜栖息地在不同经纬度上出现的频次变化如图 7和图 8所示。2013—2017年1—4月在水温降低0.1 ℃、0.3 ℃、0.5 ℃和1.0 ℃时,适宜栖息地在经度上均呈现向西移动且频次增加。纬度方向上,水温降低幅度从0.1 ℃到0.5 ℃过程中适宜栖息地均缓慢向北移动,且适宜栖息地出现的频次变化不大;当水温降低1.0 ℃时,可以发现适宜栖息地呈现明显的向北移动,且北部海域适宜栖息地的频次增多,该结果与适宜栖息地经纬度重心变化一致。
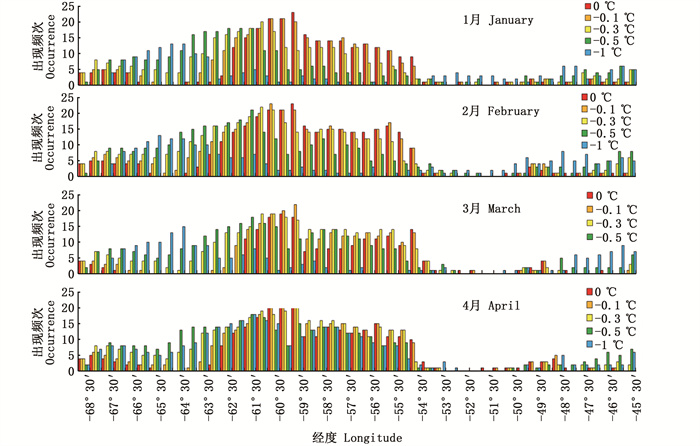
|
图 7 垂向温度降低不同水平时阿根廷滑柔鱼适宜栖息地在经度上的出现频次 Fig. 7 Occurrence frequency of suitable habitat of I.argentinus in the longitude direction under the scenarios of vertical water temperature decreasing by 0.1, 0.3, 0.5 and 1.0 ℃, respectively |
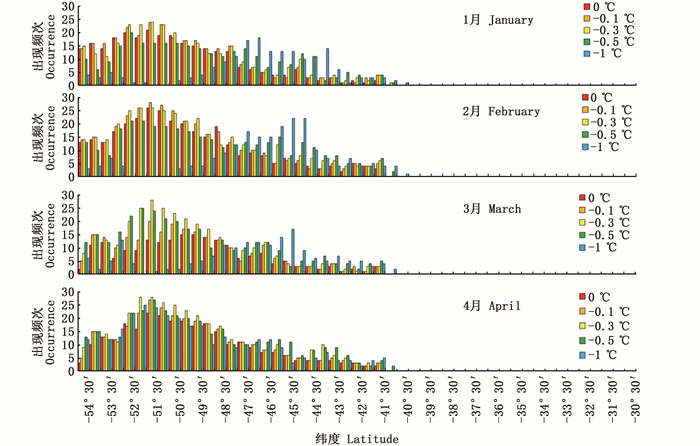
|
图 8 垂向温度降低不同水平时阿根廷滑柔鱼适宜栖息地在纬度上的出现频次 Fig. 8 Occurrence frequency of suitable habitat of I.argentinus in the latitude direction under the scenarios of vertical water temperature decreasing by 0.1, 0.3, 0.5 and 1.0 ℃, respectively |
按大西洋公海、阿根廷EEZ和福克兰群岛EEZ进行划分,对不同作业区域内的适宜栖息地占比进行分析(表 1)。结果显示,2013—2017年1—4月各月在正常水温情况下,公海和阿根廷EEZ区域的适宜栖息地占比在3%左右,而福克兰群岛EEZ区域的适宜栖息地占比远高于公海和阿根廷EEZ区域,最低为3月的8.20%,最高为2月的12.69%,整体平均达到10.87%。
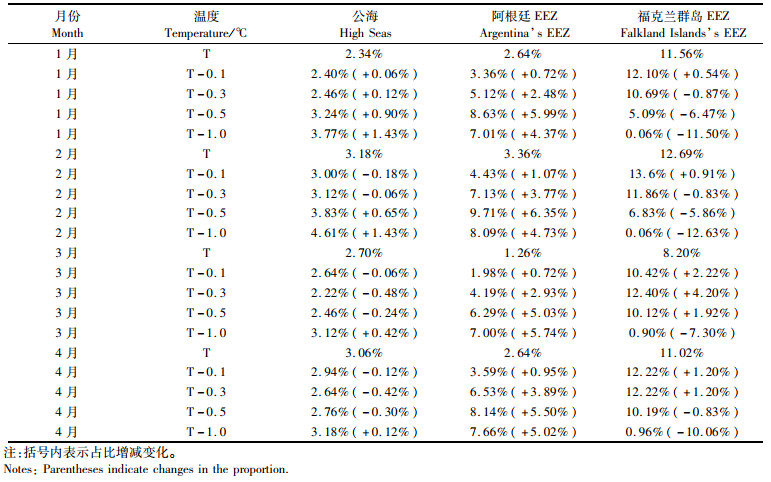
|
表 1 垂向温度降低不同水平时阿根廷滑柔鱼适宜栖息地在不同作业区域的占比变化 Tab.1 Variations in the percentage of the suitable habitat of I. argentinus in different fishing areas under the scenarios of vertical water temperature decreasing by 0.1, 0.3, 0.5 and 1.0 ℃, respectively |
大西洋公海、阿根廷EEZ、福克兰群岛EEZ适宜栖息地占比随着垂向水温的降低均出现了较大变化(表 1)。在公海区域,各月份随着水温降低,适宜栖息地占比除1月均略有升高外,其余各月均有升高和降低,增幅最高+1.43%,降幅最高-0.48%,整体受影响较小。但由图 4可知,传统公海渔场内的适宜栖息地已经消失,公海区域的适宜栖息地出现在东方向离岸较远的大洋区域。对于阿根廷EEZ,各月份随着水温降低,适宜栖息地占比全部升高。水温降低0.1 ℃时各月增幅在1%左右;水温降低0.5 ℃时,平均增幅都超过5.7%。3月份适宜栖息地占比达到最高为9.71%。不同水层温度的降低使阿根廷EEZ区域内的适宜栖息地面积整体升高。对于福克兰群岛EEZ,1—4月除了部分适宜栖息地占比出现略微增加外,水温降幅较大时适宜栖息地面积比例均出现大幅降低,降幅最高达-12.63%。可以看出在福克兰群岛EEZ海域内垂向水温降低整体不利于形成阿根廷滑柔鱼适宜栖息地。
3 讨论 3.1 南极海冰对海洋环境的影响研究[16-17]表明,南极海冰覆盖范围的变化将影响全球海洋温度的变化。对2013—2017年1—4月南极海冰覆盖范围的变化和西南大西洋阿根廷滑柔鱼渔场附近不同水层水温变化进行分析发现,各水层水温整体随着海冰覆盖范围的扩大,呈现升高趋势。该结果与刘赫威等[9]的研究结果相一致,也印证了前人对两者的关系研究结论。南极海冰覆盖范围变化会导致南半球大气环流产生显著变化[25-26],特别是南极海冰在南极绕极波动(Antarctic circumpolar wave, ACW)对全球气候调节中发挥重要作用[27]。大气与海洋间的海气交换过程,通过二氧化碳的交换影响海洋的酸性状况[28],而海洋酸化会对海洋生物产生较大影响[29]。
有研究[30]指出,南极海冰的变化使得南大洋海水含盐量降低;同时通过多年数据分析发现,海冰在不同季节覆盖范围的变化也影响着南大洋区域叶绿素a质量浓度的变化[31]。海冰变化对相关环境因子的影响,可能进一步对该区域生物的生存产生影响。有学者[32]指出,海冰为南极磷虾提供了重要的食物来源和庇护所,尤其是在生命早期阶段,海冰与环极地海洋环流的相互作用会对南极磷虾的种群分布产生重要影响;另外海冰覆盖范围变化对南极顶级掠食者雪鹱和海豹的存活率和性别特异性变化产生影响[33]。海冰除了对南大洋有直接影响外,也通过对温盐环流的控制[34]、深层水中水体混合与分离的控制[35]等影响大西洋的海洋环境和生物生存。通过南极海冰与海洋环境的相关性可知,在后续探究海洋生物的生物学特性、渔场分布、资源变动等与海洋环境关系时,可以将南极海冰的变化情况作为关键环境因子之一。
3.2 南极海冰变动对阿根廷滑柔鱼栖息地的影响海洋环境因素对大洋性头足类的资源丰度和空间分布影响显著[8, 36]。有研究[37-38]认为亲潮和黑潮交汇对西北太平洋柔鱼渔场形成具有重要影响,厄尔尼诺和拉尼娜现象[39]、海表面温度和叶绿素a质量浓度[40]是影响西北太平洋柔鱼资源丰度的关键因素;海表面温度[41]、叶绿素a质量浓度[42]、冷暖水团[43]等是影响秘鲁外海茎柔鱼的资源丰度的重要环境因子。国内外研究者对阿根廷滑柔鱼资源与环境关系的研究也集中上述因素,但阿根廷滑柔鱼的洄游范围非常广泛[44],且在生命周期的不同阶段和不同季节栖息在不同区域的不同水层[45]。因此,探究阿根廷滑柔鱼资源受海洋环境影响的机理时,还需要考虑将南极海冰变化与不同水层水温相结合,可以提高栖息地预测模型对该资源的预测精度。
阿根廷滑柔鱼的生长、分布、运动和个体大小变化在很大程度上取决于西南大西洋海水温度的变化[46]。阿根廷滑柔鱼的分布又与不同水层温度存在显著联系[14]。南极海冰覆盖范围变化引发的各水层水温变化与西南大西洋阿根廷滑柔鱼HSI存在相关性,影响着适宜栖息地的分布范围和在各作业区的占比。随着水温的降低,适宜栖息地空间覆盖范围整体移向阿根廷EEZ内,阿根廷EEZ作业渔区适宜栖息地占比升高,福克兰群岛EEZ适宜栖息地占比明显降低,因此阿根廷EEZ线内随着水温降低更适宜阿根廷滑柔鱼的生存:当水温降低0.3或0.5 ℃时,适宜栖息地占比最高;当水温降低1.0 ℃时,适宜栖息地占比最低。因此,水温过低将使得整个西南大西洋内阿根廷滑柔鱼渔区最适范围减少,从而根本上影响阿根廷滑柔鱼的资源丰度。
本文在采用综合HSI模型计算和假设不同水层温度降低时,没有探索不同水层温度降低的差异性,可能会对结论产生一定偏差;另外,在探讨南极海冰覆盖范围对阿根廷滑柔鱼HSI的影响时,只考虑了海冰变化作为单一大尺度环境因子对其影响,没有考虑海冰变化对西南大西洋阿根廷滑柔鱼渔场内海表面温度、叶绿素a质量浓度、海表面高度等其他环境因子的影响, 也未评估海冰变化对西南大西洋其他海洋生物的影响,这些生物可能与阿根廷滑柔鱼存在生存竞争关系。未来将充分考虑影响阿根廷滑柔鱼资源丰度的气候和环境因子,建立综合模型来更精确地评估阿根廷滑柔鱼资源状况及其对气候和海洋环境的响应规律,为合理开发利用该资源提供科学依据。
| [1] |
王尧耕, 陈新军. 世界大洋性经济柔鱼类资源及其渔业[M]. 北京: 海洋出版社, 2005: 240-264. WANG Y G, CHEN X J. The resource and biology of economic oceanic squid in the world[M]. Beijing: Ocean Press, 2005: 240-264. |
| [2] |
BRUNETTI N E, ELENA B, ROSSI G R, et al. Summer distribution, abundance and population structure of Illex argentinus on the Argentine shelf in relation to environmental features[J]. South African Journal of Marine Science, 1998, 20(1): 175-186. DOI:10.2989/025776198784126386 |
| [3] |
BRUNETTI N E. The evolution of the Illex argentinus (Castellanos, 1960) fishery[J]. Informes Tecnicos De Investigacion Pesquera, 1990(155): 3-19. |
| [4] |
CHEN X J, LIU B L, CHEN Y. A review of the development of Chinese distant-water squid jigging fisheries[J]. Fisheries Research, 2008, 89(3): 211-221. DOI:10.1016/j.fishres.2007.10.012 |
| [5] |
FAO. Food and Agriculture Organization of the United Nations' Fisheries Database: Global Production Statistics 1950-2019[DB/OL]. http://www.fao.org/fishery/statistics/global-production/query/en
|
| [6] |
WALUDA C M, TRATHAN P N, RODHOUSE P G. Influence of oceanographic variability on recruitment in Illex argentinus (Cephalopoda: Ommastrephidae) fishery in the South Atlantic[J]. Marine Ecology Progress Series, 1999, 183: 159-167. DOI:10.3354/meps183159 |
| [7] |
CHEN C S, CHIU T S, HAUNG W B. The spatial and temporal distribution patterns of the Argentine short-finned squid, Illex argentinus, abundances in the southwest Atlantic and the effects of environmental influences[J]. Zoological Studies, 2007, 46(1): 111-122. |
| [8] |
刘赫威, 余为, 陈新军. 西南大西洋阿根廷滑柔鱼资源及其对环境响应的研究进展[J]. 中国水产科学, 2020, 27(10): 1254-1265. LIU H W, YU W, CHEN X J. A review of Illex argentinus resources and the responses to environmental variability in the southwest Atlantic Ocean[J]. Journal of Fishery Sciences of China, 2020, 27(10): 1254-1265. |
| [9] |
WALUDA C, RODHOUSE P, PODESTÁ G, et al. Surface oceanography of the inferred hatching grounds of Illex argentinus (Cephalopoda: Ommastrephidae) and influences on recruitment variability[J]. Marine Biology, 2001, 139: 671-679. DOI:10.1007/s002270100615 |
| [10] |
陈新军, 刘必林, 王跃中. 2000年西南大西洋阿根廷滑柔鱼产量分布及其与表温关系的初步研究[J]. 湛江海洋大学学报, 2005, 25(1): 29-34. CHEN X J, LIU B L, WANG Y Z. Study on the distribution of production of Illex argentinus and its relationship with sea surface temperature in the southwest Atlantic Ocean in 2000[J]. Journal of ZhanjiangOcean University, 2005, 25(1): 29-34. DOI:10.3969/j.issn.1673-9159.2005.01.008 |
| [11] |
刘必林, 陈新军. 2001年西南大西洋阿根廷滑柔鱼产量分布与表温关系的初步研究[J]. 海洋渔业, 2004, 26(4): 326-330. LIU B L, CHEN X J. Preliminary study on the relationship between the distribution of production of Illex argentinus and SST in the southwest Atlantic Ocean in 2001[J]. Marine Fisheries, 2004, 26(4): 326-330. DOI:10.3969/j.issn.1004-2490.2004.04.016 |
| [12] |
张炜, 张健. 西南大西洋阿根廷滑柔鱼渔场与主要海洋环境因子关系探讨[J]. 上海水产大学学报, 2008, 17(4): 471-475. ZHANG W, ZHANG J. A discussion about relationship between the distribution of production of Illex argentinus and marine environmental factors in the southwest Atlantic Ocean[J]. Journal of Shanghai Fisheries University, 2008, 17(4): 471-475. |
| [13] |
郑丽丽, 伍玉梅, 樊伟, 等. 西南大西洋阿根廷滑柔鱼渔场叶绿素a分布及其与渔场的关系[J]. 海洋湖沼通报, 2011(1): 63-70. ZHENG L L, WU Y M, FAN W, et al. The distribution of chlorophyll-a and its relationship with the Illex argentinus fishing ground of southwest Atlantic Ocean[J]. Transactions of Oceanology and Limnology, 2011(1): 63-70. DOI:10.3969/j.issn.1003-6482.2011.01.009 |
| [14] |
李娜, 陈新军, 金岳. 基于复合种群的阿根廷滑柔鱼资源评估和管理策略评价[J]. 上海海洋大学学报, 2019, 28(3): 471-482. LI N, CHEN X J, JIN Y. Stock assessment and management for metapopulation of Illex argentinus[J]. Journal of Shanghai Ocean University, 2019, 28(3): 471-482. |
| [15] |
林东明, 韩飞, 朱凯, 等. 孵化季节对阿根廷滑柔鱼生长发育的影响[J]. 上海海洋大学学报, 2020, 29(3): 374-384. LIN D M, HAN F, ZHU K, et al. Effects of hatching season on the growth and development in Illex argentinus[J]. 2020, 29(3): 374-384. |
| [16] |
JACKA T H, BUDD W F. Detection of temperature and sea-ice-extent changes in the Antarctic and Southern Ocean, 1949-96[J]. Annals of Glaciology, 1998, 27: 553-559. DOI:10.3189/1998AoG27-1-553-559 |
| [17] |
KUSAHARA K, WILLIAMS G D, MASSOM R, et al. Roles of wind stress and thermodynamic forcing in recent trends in Antarctic sea ice and Southern Ocean SST: An ocean-sea ice model study[J]. Global and Planetary Change, 2017, 158: 103-118. DOI:10.1016/j.gloplacha.2017.09.012 |
| [18] |
BAZZINO G, QUIÑONES R A, NORBIS W. Environmental associations of shortfin squid Illex argentinus (Cephalopoda: Ommastrephidae) in the northern Patagonian Shelf[J]. Fisheries Research, 2005, 76(3): 401-416. DOI:10.1016/j.fishres.2005.07.005 |
| [19] |
刘赫威, 余为, 陈新军, 等. 南极海冰变动对西南大西洋阿根廷滑柔鱼资源丰度及空间分布的影响[J]. 水产学报, 2021, 45(2): 187-199. LIU H W, YU W, CHEN X J, et al. Influence of Antarctic sea ice variation on abundance and spatial distribution of Argentine shortfin squid Illex argentinus in the southwest Atlantic Ocean[J]. Journal of Fisheries of China, 2021, 45(2): 187-199. |
| [20] |
USFWS. 101ESM habitat as a base for environmental assessment[R]. Washington, D. C: Division of Ecological Services U.S. Fish and Wildlife Service Department of the Interior, 1980: 4-80.
|
| [21] |
易倩, 余为, 陈新军. 西北太平洋柔鱼栖息地适宜性变动研究[J]. 海洋渔业, 2019, 41(3): 257-265. YI Q, YU W, CHEN X J. Habitat suitability variations of Ommastrephes bartramii in the northwest Pacific[J]. Marine Fisheries, 2019, 41(3): 257-265. DOI:10.3969/j.issn.1004-2490.2019.03.001 |
| [22] |
YU W, GUO A, ZHANG Y, et al. Climate-induced habitat suitability variations of chub mackerel Scomber japonicus in the East China Sea[J]. Fisheries Research, 2018, 207: 63-73. DOI:10.1016/j.fishres.2018.06.007 |
| [23] |
HAUMANN F A, GRUBER N, MNNICH M. Sea-ice induced southern ocean subsurface warming and surface cooling in a warming climate[J]. AGU Advances, 2020, 1(2): e2019AV000132. |
| [24] |
YU W, CHEN X J, ZHANG Y. Seasonal habitat patterns of jumbo flying squid Dosidicus gigas off Peruvian waters[J]. Journal of Marine Systems, 2019, 194: 41-51. DOI:10.1016/j.jmarsys.2019.02.011 |
| [25] |
RAPHAEL M N, HOBBS W, WAINER I. The effect of Antarctic sea ice on the southern hemisphere atmosphere during the southern summer[J]. Climate Dynamics, 2011, 36(7/8): 1403-1417. |
| [26] |
BUKATOV A E, BUKATOV A A, BABⅡ M V. Regional variability of Antarctic sea ice extent[J]. Russian Meteorology and Hydrology, 2016, 41(6): 404-409. DOI:10.3103/S1068373916060042 |
| [27] |
WHITE W B, PETERSON R G. An Antarctic circumpolar wave in surface pressure, wind, temperature and sea-ice extent[J]. Nature, 1996, 380(6576): 699-702. DOI:10.1038/380699a0 |
| [28] |
STEPHENS B B, KEELING R F. The influence of Antarctic sea ice on glacial–interglacial CO2 variations[J]. Nature, 2000, 404(6774): 171-174. DOI:10.1038/35004556 |
| [29] |
FABRY V J, SEIBEL B A, FEELY R A, et al. Impacts of ocean acidification on marine fauna and ecosystem processes[J]. ICES Journal of Marine Science, 2008, 65(3): 414-432. DOI:10.1093/icesjms/fsn048 |
| [30] |
MAKSYM T. Southern Ocean freshened by sea ice[J]. Nature, 2016, 537(7618): 40-41. DOI:10.1038/537040a |
| [31] |
BEHERA N, SWAIN D, SIL S. Effect of Antarctic sea ice on chlorophyll concentration in the Southern Ocean[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2020, 178: 104853. DOI:10.1016/j.dsr2.2020.104853 |
| [32] |
THORPESE, MURPHYEJ, WATKINSJL. Circumpolar connections between Antarctic krill (Euphausia superba Dana) populations: Investigating the roles of ocean and sea ice transport[J]. Deep Sea Research Part I: Oceanographic Research Papers, 2007, 54(5): 792-810. DOI:10.1016/j.dsr.2007.01.008 |
| [33] |
BARBRAUD C, WEIMERSKIRCH H, GUINET C, et al. Effect of sea-ice extent on adult survival of an Antarctic top predator: the snow petrel Pagodroma nivea[J]. Oecologia, 2000, 125(4): 483-488. DOI:10.1007/s004420000481 |
| [34] |
SHIN S I, LIU Z Y, OTTO-BLIESNER B L, et al. Southern Ocean sea-ice control of the glacial north Atlantic thermohaline circulation[J]. Geophysical Research Letters, 2003, 30(2): 1096. |
| [35] |
NADEAULP, FERRARIR, JJANSENM F. Antarctic sea ice control on the depth of north Atlantic deep water[J]. Journal of Climate, 2019, 32(9): 2537-2551. DOI:10.1175/JCLI-D-18-0519.1 |
| [36] |
曹杰, 陈新军, 刘必林, 等. 鱿鱼类资源量变化与海洋环境关系的研究进展[J]. 上海海洋大学学报, 2010, 19(2): 232-239. CAO J, CHEN X J, LIU B L, et al. Review on the relationship between stock recruitment of squid and oceanographic environment[J]. Journal of Shanghai Ocean University, 2010, 19(2): 232-239. |
| [37] |
陈新军. 关于西北太平洋的柔鱼渔场形成的海洋环境因子的分析[J]. 上海水产大学学报, 1997, 6(4): 263-267. CEHN X J. An analysis on marine environment factors of fishing ground of Ommastrephes bartrami in Northwestern Pacific[J]. Journal of Shanghai Fisheries University, 1997, 6(4): 263-267. |
| [38] |
CHEN X J, CAO J, CHEN Y, et al. Effect of the Kuroshio on the spatial distribution of the red flying squid Ommastrephes bartramii in the northwest Pacific Ocean[J]. Bulletin of Marine Science, 2012, 88(1): 63-71. DOI:10.5343/bms.2010.1098 |
| [39] |
余为, 陈新军, 易倩, 等. 北太平洋柔鱼早期生活史研究进展[J]. 上海海洋大学学报, 2013, 22(5): 755-762. YU W, CHEN X J, YI Q, et al. Review on the early life history of neon flying squid Ommastrephes bartramii in the north Pacific[J]. Journal of Shanghai Ocean University, 2013, 22(5): 755-762. |
| [40] |
余为, 陈新军. 西北太平洋柔鱼栖息地环境因子分析及其对资源丰度的影响[J]. 生态学报, 2015, 35(15): 5032-5039. YU W, CHEN X J. Analysis of environmental conditions and their influence on the abundance of neon flying squid in the Northwest Pacific Ocean[J]. Acta Ecologica Sinica, 2015, 35(15): 5032-5039. |
| [41] |
徐冰, 陈新军, 陆化杰, 等. 秘鲁外海茎柔鱼资源丰度和补充量与海表温度的相关关系[J]. 海洋渔业, 2013, 35(3): 296-302. XU B, CHEN X J, LU H J, et al. Relationship between sea surface temperature and abundance index, recruitment of Dosidicus gigas in the waters off Peru[J]. Marine Fisheries, 2013, 35(3): 296-302. DOI:10.3969/j.issn.1004-2490.2013.03.006 |
| [42] |
ROBINSON C J, GÓMEZ-GUTIÉRREZ J, SALAS DE LEÓN DA. Jumbo squid (Dosidicus gigas) landings in the Gulf of California related to remotely sensed SST and concentrations of chlorophyll a (1998-2012)[J]. Fisheries Research, 2013, 137: 97-103. DOI:10.1016/j.fishres.2012.09.006 |
| [43] |
胡振明, 陈新军, 周应祺, 等. 利用栖息地适宜指数分析秘鲁外海茎柔鱼渔场分布[J]. 海洋学报, 2010, 32(5): 67-75. HU Z M, CHEN X J, ZHOU Y Q, et al. Forecasting fishing ground of Dosidicus gigas based on habitat suitability index off Peru[J]. Acta Oceanologica Sinica, 2010, 32(5): 67-75. |
| [44] |
方舟, 陆化杰, 陈新军, 等. 西南大西洋阿根廷滑柔鱼生物学年间比较[J]. 生态学报, 2012, 32(2): 371-379. FANG Z, LU H J, CHEN X J, et al. Annual variability in biological characteristics of Illex argentinus in the southwest Atlantic Ocean[J]. Acta Ecologica Sinica, 2012, 32(2): 371-379. |
| [45] |
KORONKIEWICZ A. Growth and life cycle of squid Illex argentinus from (the) Patagonian and Falkland shelf and Polish fishery of squid for this region: 1978-1985[C]. ICES Council Meeting Papers, 1986, 27: 1-16.
|
| [46] |
CHEN C S, HAUNG W B, CHIU T S. Different spatiotemporal distribution of Argentine short-finned squid (Illex argentinus) in the southwest Atlantic during high-abundance year and its relationship to sea water temperature changes[J]. Zoological Studies, 2007, 46(3): 362-374. |
2. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
3. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
5. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
6. Zhejiang Marine Fisheries Research Institute, Zhoushan 316021, Zhejiang, China
 2021,
Vol. 30
2021,
Vol. 30


