2. 山东省海洋生态环境与防灾减灾重点实验室, 山东 青岛 266061;
3. 厦门大学 近海海洋环境科学国家重点实验室, 福建 厦门 361102
日照市位于山东南部,海域面积约6 000 km2,海岸线长168.5 km,东、南两面临海。潮汐西南-东北向,主要为西南向涨潮流,潮流与海岸线基本平行[1]。近岸海域沉积物由北向南转移,主要来源于河流入海和沿岸冲刷[2]。由于受到河流径流、沿岸流、波浪和潮汐等综合作用的影响,日照近海水动力条件复杂,沉积物类型多样,对大型底栖动物群落结构影响明显[3]。20世纪90年代起,山东省提出“海上山东”的发展战略,《山东半岛蓝色经济区发展规划》《日照市城市总体规划》等文件相继出台,受沿海海洋开发的影响,近海水域和底栖生态环境发生巨变,部分海域出现污染,底栖动物群落结构发生重大变化[4]。大型底栖动物是海洋生态系统物质循环和能量流动的重要环节,其活动能力弱,对环境变化逃避能力差,因此对栖息环境变化灵敏度高,底栖动物群落结构和多样性等变化可以较为准确地反映出所在海域环境的时空变化[5]。目前,日照沿岸海域大型底栖动物群落相关研究少见报道[4, 6-7],本文以2018年至2019年对日照近海大型底栖动物现状调查结果为依据,分析大型底栖动物的物种组成、优势种、群落结构、多样性和季节变化规律,旨在为日照海域大型底栖动物生态学长期调查、海洋工程对海洋环境的影响和底栖动物资源可持续发展提供数据支持。
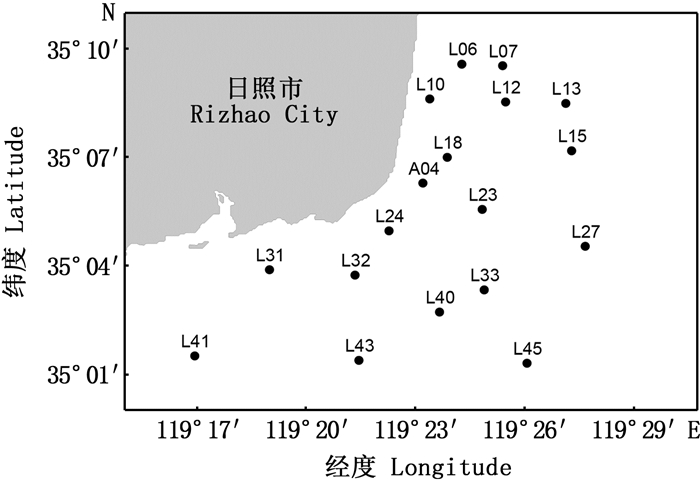
1 材料与方法 1.1 野外采样于2018年7月(夏季)、10月(秋季)、12月(冬季)和2019年4月(春季)对日照近海18个站位进行了大型底栖动物调查采样,地理范围为119°16′57.66″~119°27′40.5″E、35°1′18.00″~35°9′33.72″N(图 1)。在每站使用面积为0.05 m2的抓斗采泥器重复采样4次合为1个样品,采得沉积物用孔径为0.5 mm的网筛冲洗分选,留在网筛上的样品全部收集装瓶,并用体积分数为10%的甲醛溶液固定。
|
图 1 日照近海大型底栖动物取样站位 Fig. 1 Sampling sites of macrobenthos in coastal waters of Rizhao |
样品带回实验室在体视显微镜下进行分类、鉴定、计数,使用感量为0.000 1 g的电子天平进行称量,最后换算成单位面积的生物量(g/m2)和丰度(ind./m2)。物种标准名称来源于WoRMS官网。以上所有样品的采集、处理、保存、计数和称量均参照《海洋调查规范》[8]进行。
1.3 数据处理使用相对重要性指数(IRI)来确定大型底栖动物优势种,计算公式:
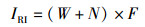 (1)
(1)
式中: IRI为相对重要性指数;W为某一种的生物量占大型底栖动物总生物量的百分比;N为该种的丰度占大型底栖动物总丰度的百分比;F为该种出现的频率[9]。多样性分析采用Margalef物种丰富度指数(d)、Shannon-Wiener多样性指数(H′)以及Pielou物种均匀度指数(J)[10], 公式如下:
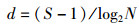 (2)
(2)
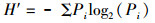 (3)
(3)
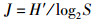 (4)
(4)
式中: S为总种数;N为总个体数;Pi为样品中第i种的个体数与总个体数的比值。使用PRIMER 6.0进行大型底栖动物群落结构和丰度/生物量比较曲线分析。各季度大型底栖动物丰度数据取平方根后经Bray-Curtis相似性等级聚类(Hierarchical cluster analysis)、非度量多维标度(Non-metric Multi-Dimensional Scaling)及相似性(Similarity/distance percentages、Similarity profile)分析,比较群组间的相似性并筛选各季度表征群落特征的物种[11]。
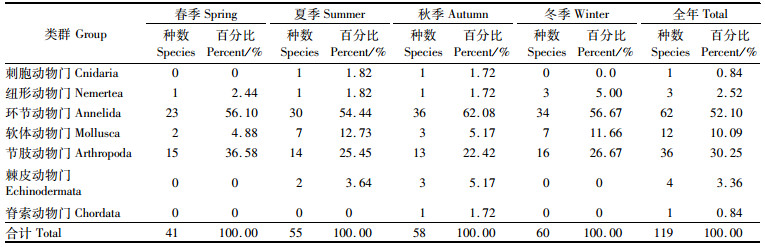
2 结果与分析 2.1 种类组成共鉴定出大型底栖动物72科119种(表 1),包括刺胞动物、纽形动物、环节动物、软体动物、节肢动物、棘皮动物和头索动物7大门类, 其中: 多毛类28科62种,占总种数的52.10%;软体动物10科12种,占总种数的10.09%;甲壳类26科36种,占总种数的30.25%;棘皮动物4科4种,占总种数的3.36%;纽形动物2科3种,占总种数的2.52%;刺胞和头索动物各1种,占总种数的1.68%。4个季度大型底栖动物种类分别为春季4门41种、夏季6门55种、秋季7门58种、冬季4门60种,物种数排序为冬>秋>夏>春。所有季度中环节动物和节肢动物种类数均排在前两位,这两类各自占比之和在每个季度均超过80%,环节动物所占比例排序为秋>冬>春>夏,节肢动物所占比例排序为春>冬>夏>秋。
|
表 1 日照近海大型底栖动物各类群物种数 Tab.1 Species number of each macrobenthic taxoa in the coastal waters of Rizhao |
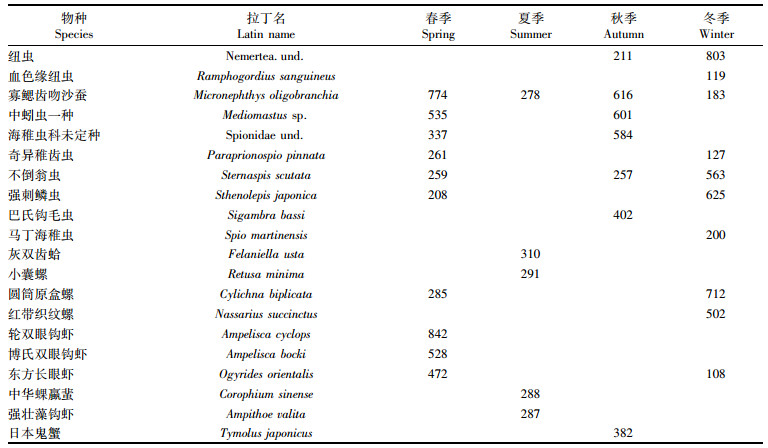
寡鳃齿吻沙蚕(Micronephthys oligobranchia)为4个季度的共有优势种(表 2)。不倒翁虫(Sternaspis scutata)是春、秋、冬季的优势种,中蚓虫一种(Mediomastus sp.)、圆筒原盒螺(Cylichna biplicata)、海稚虫科未定种(Spionidae und.)、纽虫(Nemertea und.)、奇异稚齿虫(Paraprionospio pinnata)、强刺鳞虫(Sthenolepis japonica)、东方长眼虾(Ogyrides orientalis)在两个季度中占优势。总体而言,日照近海大型底栖动物优势种在不同季节存在一定差异,但均以多毛类为主。
|
表 2 日照海域大型底栖动物各季节优势种相对重要性指数 Tab.2 The IRI of seasonal dominant species of macrobenthos in the coastal waters of Rizhao |
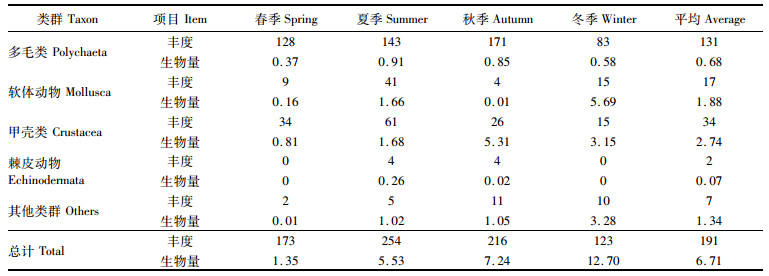
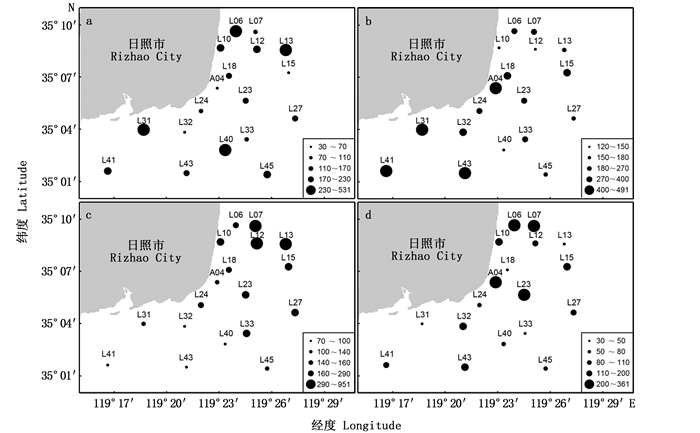
由表 3和图 2可知:4个季度大型底栖动物平均丰度为191 ind./m2。春季平均丰度为173 ind./m2,其中: 多毛类占优势,为128 ind./m2,占73.99%;其次为甲壳类34 ind./m2,占19.65%;软体动物为9 ind./m2,占5.20%;其他类群平均丰度仅为2 ind./m2,占1.16%。丰度最高的站位是L31站,达530 ind./m2,最低的站位为A04站仅30 ind./m2。夏季平均丰度为254 ind./m2: 多毛类为优势类群,丰度143 ind./m2,占56.30%,其次为甲壳类61 ind./m2,占24.02%;软体动物41 ind./m2,占16.14%;棘皮动物4 ind./m2,占1.57%;其他类群的平均丰度为5 ind./m2,占1.97%。丰度最高的是L43站,达490 ind./m2,最低的是L12站,为120 ind./m2。秋季平均丰度为216 ind./m2,其中: 多毛类平均丰度171 ind./m2,占79.17%;其次为甲壳动物26 ind./m2,占12.04%;软体动物和棘皮动物均为4 ind./m2,各占1.85%;其他类群为11 ind./m2,占5.09%。丰度最高的站是L07站,达950 ind./m2,最低的为L43站,为70 ind./m2。冬季平均丰度为123 ind./m2,其中: 多毛类动物平均丰度最高为83 ind./m2,占67.47%;软体动物和甲壳类次之,均为15 ind./m2,各占12.20%;其他类群为10 ind./m2,占8.13%。从站位来看,丰度最高的站是L06站,达360 ind./m2,最低的为L13站,为30 ind./m2。不同季节的平均丰度呈现夏季>秋季>春季>冬季的特点,各季节均以多毛类占优势。
|
表 3 大型底栖动物主要类群丰度和生物量的季节变化 Tab.3 Seasonal abundance (ind./m2) and biomass (g/m2) of benthic macrofauna main groups |
|
图 2 大型底栖动物在春(a)、夏(b)、秋(c)、冬(d)季丰度的空间分布 Fig. 2 Spatial distribution of macrobenthic abundance (ind./m2)in spring (a), summer (b), autumn (c) and winter (d) |
4个季度大型底栖动物平均生物量为6.71 g/m2。春季平均生物量为1.35 g/m2: 甲壳类占优势(60.00%),为0.81 g/m2; 其他类群平均生物量最小为0.01 g/m2。生物量最高的站为L18站,达3.31g/m2,L12站最低,仅为0.40 g/m2。夏季平均生物量为5.53 g/m2,其中: 甲壳类占优势,为1.68 g/m2,占30.38%;其次为软体动物,平均生物量为1.66 g/m2,占30.02%;棘皮动物最少,为0.26 g/m2,占4.70%。从站位来看,生物量最高的站为L18站(37.33 g/m2),最低为L12、L13站,均为0.30 g/m2。秋季平均生物量为7.24 g/m2: 甲壳类依然是优势类群,占73.34%;软体动物生物量最低,仅为0.01 g/m2,占0.14%。生物量最高的站为L07站,高达94.56 g/m2,该站出现了大个体甲壳类日本鬼蟹(T. japonicus),最低的为L41站,仅为0.08 g/m2。冬季平均生物量为12.70 g/m2: 软体动物最高为5.69 g/m2,占44.80%;多毛类最低为0.58 g/m2。L09站生物量最大,达60.66 g/m2,L31站最低,为0.06 g/m2。平均生物量呈现冬季>秋季>夏季>春季的特点,甲壳类和软体动物在不同季节占优势。

|
图 3 大型底栖动物在春(a)、夏(b)、秋(c)、冬(d)季生物量的空间分布 Fig. 3 Spatial distribution of macrobenthic biomass(g/m2) in spring (a), summer (b), autumn (c) and winter (d) |
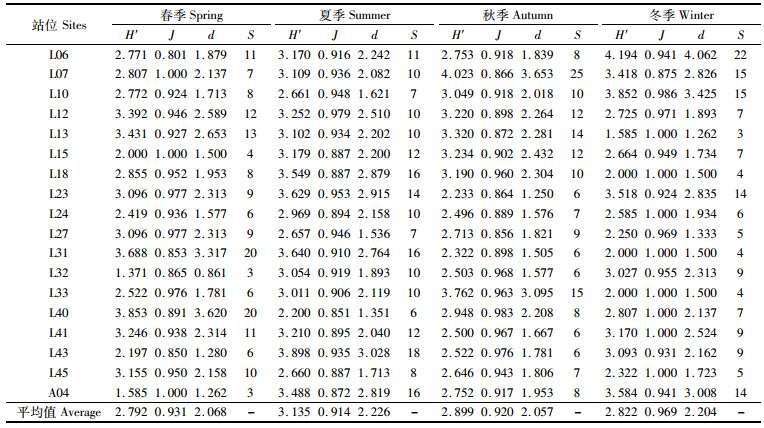
各站位的多样性指数没有明显的季节变化规律,夏季的平均多样性指数最高,为3.135,其余3个季度均小于3(表 4)。均匀度指数各季度的平均值差异不明显,依次为冬季(0.969)>春季(0.931)>秋季(0.920)>夏季(0.914),平均丰富度指数夏季最高(2.226),秋季最低(2.057)。
|
表 4 各站位大型底栖动物多样性指数 Tab.4 The diversity indices of macrobenthos in each site |
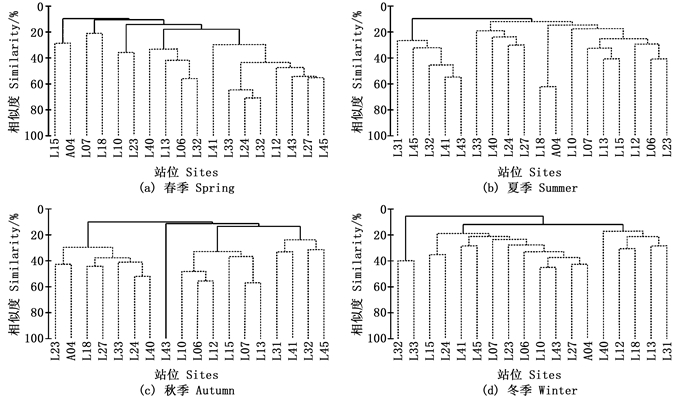
大型底栖动物群落CLUSTER聚类分析结果见图 4,各季节不同站组间相似性较低。结合SIMPROF分析,4月可划分为5个站组。SIMPER分析结果:群落1为东方长眼虾群落,包括L15、A04站位;群落2为足刺拟单指虫-小头弹钩虾群落,包括L07、L18站位;群落3为双壳类幼体巧言虫群落,包括L10、L23站位;群落4为中蚓虫一种不倒翁虫群落,包括L06、L13、L31、L40站位;其他站位属于群落5,为寡鳃齿吻沙蚕-轮双眼钩虾-博氏双眼钩虾群落。
|
图 4 大型底栖动物春(a)、夏(b)、秋(c)、冬(d)季的群落结构聚类分析图 Fig. 4 CLUSTER results based on square-root transformed abundance data in spring (a), summer (b), autumn (c) and winter (d) |
7月可划分为2个站组。SIMPER分析结果:群落1为内卷原盒螺-树蛰虫-昆士兰稚齿虫群落,包括L31、L32、L41、L43、L45站位,靠近调查海域南部;其他站位属于群落2,为寡鳃齿吻沙蚕-中华蜾蠃蜚-日本角吻沙蚕-三崎双眼钩虾群落,位于调查海域北部。
10月可划分为4个站组。SIMPER分析结果:群落1为海稚虫科未定种-蜾蠃蜚群落,包括L18、L23、L24、L27、L33、L40、A04,位于调查海域中部;群落2为独指虫群落,为L43站位;群落3为中蚓虫一种-巴氏钩毛虫群落,包括L06、L07、L10、L12、L13、L15站位,靠近调查海域北部;其他站位属于群落4,为寡鳃齿吻沙蚕群落,位于调查海域南部。
12月可划分为3个站组。SIMPER分析结果:群落1为寡鳃齿吻沙蚕昆士兰稚齿虫群落,包括L32、L33站位;群落2为强刺鳞虫不倒翁虫群落,包括L06、L07、L10、L15、L23、L24、L27、L41、L43、L45、A04站位;其他站位属于群落3,为纽虫群落。
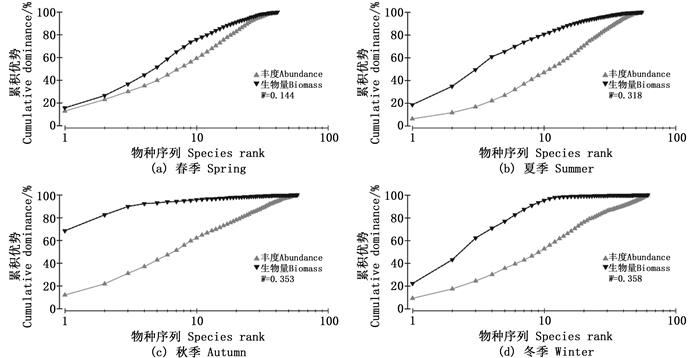
2.6 丰度/生物量比较曲线(ABC曲线)4个季度大型底栖动物ABC曲线见图 5。可以看出4个季度生物量曲线始终位于丰度曲线上方,其中4月生物量曲线虽高于丰度曲线,但生物量曲线起点较低,且起点处与丰度曲线相距较近,丰度和生物量曲线接近重合,说明4月调查海域可能存在一定程度的扰动。
|
图 5 大型底栖动物春(a)、夏(b)、秋(c)、冬(d)季的ABC曲线 Fig. 5 ABC curves of macrobenthos in spring (a), summer (b), autumn (c) and winter (d) |
底栖生物对不同类型的自然因素十分敏感,一些细微的环境变化,如沉积类型、水温、水深、水动力等,都可能使其群落的物种组成发生变化[12],而物种组成的变化会直接影响大型底栖动物的丰度和生物量。春夏季大型底栖动物进入繁殖期,个体较小的种群如多毛类数量上升,但较高的水温也会增加捕食动物活跃度,从而控制小个体生物的数量[13],一般来说大型底栖动物的丰度呈现春夏秋季高于冬季的特点;而由于大部分多毛类的生活周期较短,秋冬季小个体数量有所下降,其他类群如软体动物、甲壳类个体逐渐发育成熟,生物量明显增大,因此秋冬季大型底栖动物的生物量普遍高于春夏季。总体而言,自然条件、人类活动和动物自身生活史特点均会影响大型底栖动物的群落结构,使其种类、丰度和生物量出现季节变化。
物种数量和种类组成是群落的基本组成成分,通过不同年度物种数的变化,可以对该区域群落变化趋势有一定的了解。本研究与日照近岸海域历史资料的对比见表 5,可以看出2007—2019年间日照近海采集到的大型底栖动物种数略有下降并存在年际波动:2014年养殖区种数较少,各生物类群在总种数上的比例基本保持稳定,均以多毛类占优势,但少数耐污种如奇异稚齿虫(Pa. pinnata)在2015年以后逐渐成为群落优势种,原来排名前几位的优势种优势程度降低;大型底栖动物丰度和生物量发生较大变化,平均丰度从2007年的1 885 ind./m2下降至191 ind./m2,生物量则从39.82 g/m2下降至6.71 g/m2,物种多样性指数也呈现逐年下降的趋势。一般来说,一段时间内,特定海域中大型底栖动物丰度和生物量的变化可反映其群落的变化,进而可推断生境的变化[13-14]。调查海域丰度和生物量水平下降,说明近年来日照近海的底栖生境不稳定,环境扰动导致生物个体由大个体变为小个体占优势。21世纪初随着日照市大力推进海岸开发,岚山港、石臼港在原有煤码头的基础上扩建大型集装箱码头,万平口附近围海造地,奎山嘴北岸修建发电厂,使日照的岸线和滩涂宽度发生较大的变化,自然岸线和海域面积减少[4]。海岸开发和海洋工程建设与运营使底栖动物的栖息地范围变小,航道疏浚和土石方倾倒造成严重的底质搅动和翻耕,导致沉积环境不稳定,大型底栖动物的丰度、生物量和多样性降低,海域生态功能逐渐衰退[15]。根据2006—2019年《山东省海洋生态环境状况公报》,2014年之前日照近海海水水质符合一类水质标准,2015年夏季岚山区近岸海水由一类变为二类水质,2018、2019全年为二类水质,无机氮、活性磷酸盐等要素呈现上升趋势。岚山区围海造地、港口码头、航道运输等对底栖环境的持续扰动和龙王河、绣针河径流入海可能是造成调查海域大型底栖动物群落丰度、生物量和多样性持续下降的主要因素。

|
表 5 本研究结果与历史资料的对比 Tab.5 Comparison with historical data |
大型底栖动物群落3种多样性指数(J、H′、d)的季节变化均不明显,除物种均匀度指数(J)全年基本保持较高的水准外,物种多样性指数(H′)与物种丰富度指数(d)都呈现夏季高于其他季节的特征。其中,年平均物种多样性指数(H′)水平分布呈现出南北两侧站位较高,调查海域中部站位相对较低的空间分布特征,可能与向陆一侧为岚山港海洋工程有关,调查海域中部站位多位于进出港航道附近,受港池内部围填海和外部船舶通行的双重影响,相较于南北两侧港区边缘站位受人为扰动程度大,导致站位种类数和物种个数均较小。在通常情况下,清洁的水域环境中生物种类数较多,生境恶化或水体受到污染都会使敏感生物被淘汰,少数物种数量大增,通过物种多样性指数(H′)可在一定程度上反映出环境质量的变化[16]。蔡立哲等[17]提出多样性指数5级污染评价法:无底栖动物为严重污染,H′值< 1为重度污染,1≤H′ < 2为中度污染,2≤H′ < 3为轻度污染,H′≥>3为清洁。日照近海历史资料显示,2007—2015年间大型底栖动物物种多样性指数均大于3[6-7, 14, 17],而本次调查中仅夏季的H’值大于3,物种多样性指数年平均值为2.912,属轻度污染。罗民波等[18]对洋山岛周围海域生态研究发现,海洋工程可使海域水文条件发生较大变化,外源营养物质和污染物的增加使底栖环境受到胁迫,大型底栖动物群落结构会发生相应的改变,表现为物种多样性指数下降,单纯度上升。2015年后日照港多个海洋工程项目开工建设并投入运营,港口与航道工程可能在一定程度上影响了近海的底栖生境,致使大型底栖动物多样性发生变化。
WARWICK[19]提出运用ABC曲线来监测环境污染造成的大型底栖动物群落扰动。一种或几种个体较大的物种生物量占优势,且每个种多于一个个体,整条生物量曲线位于丰度曲线上方;当群落受到扰动时,个体较大的物种消失,小个体的机会种在数量上占优势,中度污染时生物量和丰度曲线或相互交叉或重叠在一起,严重污染时整条丰度曲线位于生物量曲线上方。本研究中ABC曲线没有出现生物量和丰度曲线相互交叉或丰度曲线位于生物量曲线之上的情况,其中春季虽然生物量曲线高于丰度曲线,但生物量曲线起点处与丰度曲线相距较近,大型底栖动物群落可能受到轻微扰动。一般来说,由于气候变化、地形变化、人类活动等引发外部环境改变或污染进而引起的生物演替为异源演替,如果异源演替过程超过了群落内部生物学过程所引发的演替,则群落的发展趋势就会发生变化,生态系统较难维持稳定状态,甚至可能导致该生态系统的崩溃[16]。由于海洋工程围填海和航道运营的影响,近十年来日照近海大型底栖动物群落丰度、生物量和多样性指数逐年下降,群落出现轻中度扰动情况,且种类组成有小型化趋势,多毛类占比由2007年的38.30%上升至52.10%,底栖动物趋向于采取r-选择对策来适应不稳定的栖息环境,一些耐污种和机会种出现,甚至成为群落优势种[20-24]。为防治海域生态环境恶化和物种资源持续衰退,促进日照近海海洋生态系统的健康持续发展,应进一步提高对海岸开发和海洋工程的管理力度,制定有效的海洋生态综合治理措施,并开展长期持续的调查监测。
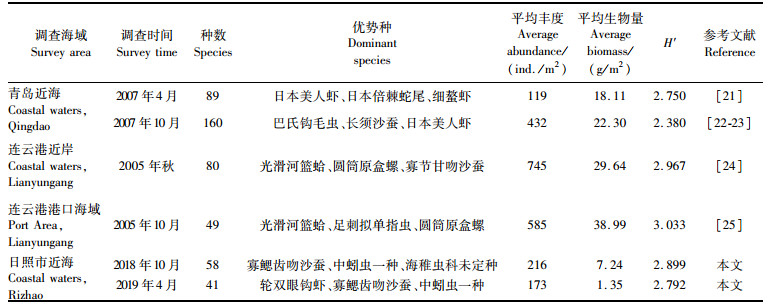
3.3 与邻近海域对比调查区以北为青岛周边海域,以南与连云港相邻,为排除季节因素影响,选取本研究春秋两季结果与邻近海域历史资料的对比,见表 6。贺心然等[25]在2005年秋季对连云港港口海域的调查中获大型底栖动物49种,与本海域调查结果相近,但优势种的组成则有较大的差别。连云港港口海域主要优势种为光滑河篮蛤(Potamocorbula laevis)、足刺拟单指虫(Cossurella aciculata)和圆筒原盒螺(C. biplicata),且软体动物光滑河篮蛤(P. laevis)在丰度和生物量上均为第一优势种。本调查海域秋季的优势种以个体更小的多毛类为主,软体动物未作为优势种出现,4个季节的共有优势种寡鳃齿吻沙蚕(M. oligobranchia)仅在连云港港口优势种中排第四位。一般来说,沉积物在搬运、沉积过程中由于不断受到水动力及生物等外力作用,其粒度参数可以反映所在海域沉积物理化性质的变化[26]。连云港港口位于海州湾顶部,海域地势较平坦,水深较浅,加之西大堤的建设使当地的水动力作用明显减弱,沉积动力能量低,有利于泥沙扩散堆积,底质以黏土质粉砂为主;调查海域位于海州湾北岸,是山东省基岩砂质海岸发育区,沿岸有由北向南颗粒较粗的泥沙流,且南北两侧均有河流汇入,水动力和沉积动力较强,底质以含砾泥质砂为主[3, 27],沉积环境的不同使大型底栖动物群落结构发生变化。此外,生境的复杂性是决定底栖动物多样性的关键因子,一般来说空间异质性程度高,小生境更加多样化,能允许更多的物种共存,从而具有更高的物种多样性[28]。青岛海域大型底栖动物种数高于其他海域的原因可能与青岛近海沉积环境多样、空间异质性程度高有关[29]。
|
表 6 本研究结果与邻近海域的对比 Tab.6 Comparison with adjacent waters |
日照近海春秋季大型底栖动物的平均生物量明显低于邻近海域的平均生物量。虽然物种组成上各海域均以多毛类占优势,其他类群次之,但日照近海多毛类比重最高,且其他类群如甲壳类多为端足目个体较小的物种,鲜少出现大个体生物。青岛海域生物量以节肢动物和棘皮动物贡献最高,连云港港口海域水流较小,生态环境良好(H′>3),物种资源远较日照海域丰富,且个体较大的软体动物较多,群落结构的不同影响了生物量的数值。分季节看,本研究和邻近海域平均生物量均呈现秋季大于春季的特征,两者的季节变化规律相同。时空尺度上,海域水动力状况与底质类型均会影响大型底栖动物的分布,日照近岸与连云港海域同位于海西湾,两者物种数相近,主要贡献类群均为多毛类,但本研究海域丰度明显小于连云港海域。吴海燕等[30]在对福建省主要海湾的研究中提出水动力强的海域沉积物环境不稳定,表层淤泥容易搅动悬浮,不利于生活史长的附着型大型底栖动物生长。此外,沉积物粒径大小也对大型底栖动物丰度产生影响,日照近海海域水动力和沉积动力均强于连云港,且沉积物颗粒较大,生物资源不如连云港丰富,大型底栖动物丰度值偏低。
| [1] |
国家海洋局北海分局. 日照港海域海洋水文气象资料汇编[R]. 青岛: 国家海洋局北海分局, 1997. North Sea Branch of the State Oceanic Administration. Compilation of hydrometeorological data of Rizhao Port sea area[R]. Qingdao: Branch of the State Oceanic Administration, 1997. |
| [2] |
王琦, 吕亚男, 张建华. 山东省日照县近岸沉积物的物质来源及扩散方向[J]. 山东海洋学院学报, 1978(2): 41-50. WANG Q, LYU Y N, ZHANG J H. The material source and diffusion direction of coastal sediments in Rizhao County, Shandong Province[J]. Journal of Shandong Ocean University, 1978(2): 41-50. |
| [3] |
宋红瑛, 刘金庆, 印萍, 等. 日照近海表层沉积物粒度特征与沉积环境[J]. 中国海洋大学学报, 2016, 46(3): 96-104. SONG H Y, LIU J Q, YIN P, et al. Grain size characteristics of the surface sediment and sedimentary environment in Rizhao offshore[J]. Periodical of Ocean University of China, 2016, 46(3): 96-104. |
| [4] |
高翔, 徐敬明. 日照沿海开发对潮间带生境及底栖动物群落的影响[J]. 海洋科学集刊, 2002(44): 61-65. GAO X, XU J M. Impact of Rizhao coastal area exploitation on inter-tidai habitats and zoo-benthic communities[J]. Studia Marina Sinica, 2002(44): 61-65. |
| [5] |
李新正. 我国海洋大型底栖生物多样性研究及展望: 以黄海为例[J]. 生物多样性, 2011, 19(6): 676-684. LI X Z. An overview of studies on marine macrobenthic biodiversity from Chinese waters: principally from the Yellow Sea[J]. Biodiversity Science, 2011, 19(6): 676-684. |
| [6] |
齐磊磊, 王其翔, 官曙光, 等. 日照近海大型底栖动物群落结构[J]. 渔业科学进展, 2013, 34(1): 97-102. QI L L, WANG Q X, GUAN S G, et al. Community structure of macrobenthos in coastal waters of Rizhao[J]. Progress in Fishery Sciences, 2013, 34(1): 97-102. |
| [7] |
辛荣, 孟娜. 日照市养殖海域秋季底栖动物的群落特征分析[J]. 安徽农业科学, 2014, 42(5): 1393-1394. XIN R, MENG N. Community features of macrobenthos in autumn in Rizhao sea area of Shandong province[J]. Journal of Anhui Agricultural Sciences, 2014, 42(5): 1393-1394. |
| [8] |
中华人民共和国国家质量监督检疫总局, 中国国家标准化管理委员会. 海洋调查规范[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration. Specifications for oceanographic survey[S]. Beijing: China Standard Press, 2007. |
| [9] |
PINKAS L, OLIPHANT M S, IVERSON I L K. Food habits of albacore, Bluefin tuna, and bonito in California waters[J]. Fish Bulletin, 1971, 152: 1-105. |
| [10] |
张华伟, 彭欣, 刘俊峰, 等. 南麂列岛冬夏季潮间带大型底栖生物群落结构[J]. 上海海洋大学学报, 2018, 27(1): 133-140. ZHANG H W, PENG X, LIU J F, et al. Community structure of macrobenthos in the intertidal zones of Nanji Islands in winter and summer[J]. Journal of Shanghai Ocean University, 2018, 27(1): 133-140. |
| [11] |
CLARKE K R, WARWICK R M. Change in marine communities: an approach to statistical analysis and interpretation[M]. 2nd ed. Plymouth: PRIMER-E Ltd., 2001.
|
| [12] |
董鹏, 张海波, 叶仙森, 等. 象山港中部海域大型底栖动物群落组成及多样性特征[J]. 上海海洋大学学报, 2015, 24(3): 430-440. DONG P, ZHANG H B, YE X S, et al. Community structure and biodiversity characteristics of macrobenthos in the middle of Xiangshan Bay[J]. Journal of Shanghai Ocean University, 2015, 24(3): 430-440. |
| [13] |
杨梅, 李新正, 徐勇, 等. 胶州湾潮下带大型底栖动物群落的季节变化[J]. 生物多样性, 2016, 24(7): 820-830. YANG M, LI X Z, XU Y, et al. Seasonal variations in macrobenthic communities in the subtidal zones of Jiaozhou Bay[J]. Biodiversity Science, 2016, 24(7): 820-830. |
| [14] |
纪莹璐, 王尽文, 张亮, 等. 日照岚山港邻近海域大型底栖动物群落结构及季节变化[J]. 生态科学, 2020, 39(5): 151-160. JI Y L, WANG J W, ZHANG L, et al. Community structure and seasonal changes of macrobenthos in the adjacent waters of Lanshan Harbour[J]. Ecological Science, 2020, 39(5): 151-160. |
| [15] |
沈国英, 施并章. 海洋生态学[M]. 2版. 北京: 科学出版社, 2002. SHEN G Y, SHI B Z. Marine ecology[M]. 2nd ed. Beijing: Science Press, 2002. |
| [16] |
邓玉娟, 董树刚, 刘晓收. 福建兴化湾大型底栖动物种类组成和生物多样性[J]. 海洋科学, 2016, 40(1): 54-63. DENG Y J, DONG S G, LIU X S. Species composition and biodiversity of macrofauna in Xinghua Bay, Fujian[J]. Marine Sciences, 2016, 40(1): 54-63. |
| [17] |
蔡立哲, 马丽, 高阳, 等. 海洋底栖动物多样性指数污染程度评价标准的分析[J]. 厦门大学学报(自然科学版), 2002, 41(5): 641-646. CAI L Z, MA L, GAO Y, et al. Analysis on assessing criterion for polluted situation using species diversity index of marine macrofauna[J]. Journal of Xiamen University(Natural Science), 2002, 41(5): 641-646. |
| [18] |
罗民波, 陆健健, 沈新强, 等. 大型海洋工程对洋山岛周围海域大型底栖动物生态分布的影响[J]. 农业环境科学学报, 2007, 26(1): 97-102. LUO M B, LU J J, SHEN X Q, et al. Impact of huge ocean engineering on distribution characteristics of macrobenthos in waters around Yangshan Islands in Hangzhou Bay[J]. Journal of Agro-Environment Science, 2007, 26(1): 97-102. |
| [19] |
WARWICK R M. A new method for detecting pollution effects on marine macrobenthic communities[J]. Marine Biology, 1986, 92(4): 557-562. DOI:10.1007/BF00392515 |
| [20] |
王航俊, 邹清, 刘亚林, 等. 乐清湾大型底栖动物种类和数量组成特征及变化[J]. 海洋科学, 2018, 42(6): 78-87. WANG HJ, ZOU Q, LIU YL, et al. The characteristics and changes of the species and quantity of macrobenthos in Yueqing Bay[J]. Marine Sciences, 2018, 42(6): 78-87. |
| [21] |
王宗兴, 范士亮, 徐勤增, 等. 青岛近海春季大型底栖动物群落特征[J]. 海洋科学进展, 2010, 28(1): 50-56. WANG Z X, FAN S L, XU Q Z, et al. Characteristics of macrobenthic community in spring in the coastal waters of Qingdao[J]. Advances in Marine Science, 2010, 28(1): 50-56. |
| [22] |
王宗兴, 范士亮, 徐勤增, 等. 青岛近海秋季大型底栖动物群落特征[J]. 海洋湖沼通报, 2010(1): 59-64. WANG Z X, FAN S L, XU Q Z, et al. Characters of macrobenthic community in autumn in the coastal water of Qingdao[J]. Transactions of Oceanology and Limnology, 2010(1): 59-64. |
| [23] |
王宗兴, 范士亮, 韦钦胜, 等. 青岛近海大型底栖动物生物多样性现状[J]. 海洋通报, 2010, 29(1): 1-5. WANG Z X, FAN S L, WEI Q S, et al. Study on species diversity of macrobenthic fauna in the coastal waters of Qingdao[J]. Marine Science Bulletin, 2010, 29(1): 1-5. |
| [24] |
陈斌林, 方涛, 李道季. 连云港近岸海域底栖动物群落组成及多样性特征[J]. 华东师范大学学报(自然科学版), 2007(2): 1-10. CHEN B L, FANG T, LI D J. Community structure and biodiversity characteristics of macrobenthos in the costal area of Lianyungang[J]. Journal of East China Normal University(Natural Science), 2007(2): 1-10. |
| [25] |
贺心然, 陈斌林, 王淑军. 连云港港口海域秋季底栖动物群落组成及多样性研究[J]. 淮海工学院学报(自然科学版), 2009, 18(3): 78-81. HE X R, CHEN B L, WANG S J. Community structure and biodiversity of macrobenthos in the autumn of Lianyungang Port area[J]. Journal of Huaihai Institute of Technology(Natural Science Edition), 2009, 18(3): 78-81. |
| [26] |
彭俊, 陈沈良. 连云港近岸海域沉积物特征与沉积环境分析[J]. 海洋科学进展, 2010, 28(4): 445-454. PENG J, CHEN S L. Analysis on sedimentary characteristics and environments in nearshore of Lianyungang[J]. Advances in Marine Science, 2010, 28(4): 445-454. |
| [27] |
张存勇, 冯秀丽. 连云港近岸海域沉积物粒度空间分布特征及其分析[J]. 海洋学报, 2009, 31(4): 120-127. ZHANG C Y, FENG X L. The spatial distribution and analysis about the grain-size of sediments in the Lianyungang nearshore sea area[J]. Acta Oceanologica Sinica, 2009, 31(4): 120-127. |
| [28] |
冷宇, 刘一霆, 赵升, 等. 养马岛后海区域秋季大型底栖动物群落特征[J]. 环境监测管理与技术, 2013, 25(3): 17-20, 46. LENG Y, LIU Y T, ZHAO S, et al. Analysis on the characteristics of macrobenthos community during autumn in the Yangma Island[J]. The Administration and Technique of Environmental Monitoring, 2013, 25(3): 17-20, 46. |
| [29] |
陈正新, 董贺平, 赵德志, 等. 青岛前海沉积物运移特征[J]. 海洋地质与第四纪地质, 2006, 26(5): 45-53. CHEN Z X, DONG H P, ZHAO D Z, et al. Movements of sediments in the Qingdao city coast[J]. Marine Geology & Quaternary Geology, 2006, 26(5): 45-53. |
| [30] |
吴海燕, 傅世锋, 蔡晓琼, 等. 福建省主要海湾潮下带大型底栖无脊椎动物组成与分布特征[J]. 应用生态学报, 2019, 30(12): 4240-4248. WU H Y, FU S F, CAI X Q, et al. Composition and distribution characteristics of macroinvertebrates in subtidal zone of the main marine bays in Fujian Province, China[J]. Chinese Journal of Applied Ecology, 2019, 30(12): 4240-4248. |
2. Shandong Provincial Key Laboratory of Marine Ecology and Environment & Disaster Prevention and Mitigation, Qingdao 266061, Shandong, China;
3. State Key Laboratory of Marine Environmental Science, Xiamen University, Xiamen 361102, Fujian, China
 2022,
Vol. 31
2022,
Vol. 31


