2. 浙江省淡水水产研究所 农业农村部淡水渔业健康养殖重点实验室, 浙江省淡水水产遗传育种重点实验室, 浙江 湖州 313001;
3. 上海海洋大学 水产科学国家级实验教学示范中心 上海 201306
红螯螯虾(Cherax quadricariratus)又名澳洲淡水龙虾,隶属于甲壳纲(Malacostraca)十足目(Decapoda)拟螯虾总科(Parastacoidea)拟螯虾科(Parastacidae),该虾食性杂、生长快、养成规格大、可食比例高、肉质鲜美,是一种具有较高养殖潜力的世界性淡水经济虾类。随着国民收入的持续增长,消费者对虾类等较高端水产品的需求也在不断上涨,但由于凡纳滨对虾(Litopenaeus vannamei)等大众虾类病害频发、养殖效益下滑,中国虾类养殖业亟需新产品、新爆点来填补不断扩大的市场缺口。近几年,克氏原螯虾(Procambarus clarkii)产业兴起,带动了其他淡水螯虾类的同步发展,特别是作为大型淡水螯虾类代表的红螯螯虾,业内对其关注度越来越高。我国自20世纪90年代引进该虾后,已形成了一定的养殖规模,并在养殖模式、繁育方式上取得了部分阶段性成果[1-2]。目前红螯螯虾的繁育方式主要有温室水泥池繁育、室外土塘繁育等[3-4]。在非热带地区更趋向于温室水泥池繁育,因为该方式的孵化效率更高,有利于规模化育苗,且环境可控,集约化程度高,特别是对于红螯螯虾这一热带性品种更适用[5-6]。但采用该方式,红螯螯虾在温室越冬过程中由于水体区域较小,水质指标易变,会造成其体质下降、生长受限、病害发生甚至死亡,影响其繁殖能力,从而造成虾苗批量化供应能力的不足,导致虾苗价格过高,制约红螯螯虾产业化发展。翌年作为亲本的红螯螯虾在越冬期间的水质管理是解决上述难题的关键之一。
亚硝酸盐不仅是虾类养殖过程中重要的污染成分,也是制约虾类生长与生存的主要因子之一[7]。高浓度(超过其安全浓度)的亚硝酸盐急性胁迫会引起虾类中毒,甚至窒息死亡。如罗氏沼虾(Macrobrachium rosenbergii)受到高浓度亚硝酸盐胁迫后会表现为血液载氧能力降低,进而造成组织缺氧、神经麻痹、骚动不安等状况,随着胁迫时间的延长,将出现昏迷,直至死亡[8]。低浓度(低于其安全浓度,但高于渔业水质标准规定的0.2mg/L)亚硝酸盐慢性胁迫则可能会导致虾类生长发育抑制[9]、组织器官损伤[10]、生理代谢紊乱[11]以及免疫功能下降[12-14],长期胁迫将造成虾类得病甚至死亡。钟君伟等[15]对克氏原螯虾的研究表明,亚硝酸盐对其成虾的安全浓度为12.32 mg/L,是水质标准的61.6倍,说明克氏原螯虾在较高浓度的亚硝酸盐中不会很快死亡,但在长期慢性胁迫过程中,免疫功能会出现失调,生存与生长指标均会下降。
目前亚硝酸盐胁迫对虾类的影响已有较多研究报道。如:潘训彬等[16]研究了亚硝酸盐对红螯螯虾幼虾和亚成虾的急性毒性,结果表明亚硝酸盐对幼虾的96 h半致死浓度为22.81 mg/L,安全浓度为2.28 mg/L;对亚成虾的96 h半致死浓度为37.48 mg/L,安全浓度为3.75 mg/L。吕晓燕等[17]应用透射电镜技术,结合生物酶测定方法,研究了水体中不同浓度亚硝酸盐胁迫下红螯螯虾肝胰腺、鳃和肌肉组织中免疫相关酶的活性变化以及对肝胰腺和鳃的形态学影响。后续的研究有必要在探讨亚硝酸盐致死浓度的同时,分析亚硝酸盐对组织器官的损伤及对抗氧化指标、免疫相关指标、能量代谢指标等的影响,并探讨其对肠道菌群的影响,以便更加全面地指导实际越冬生产中的水质管理,改善亲本在越冬期间的生长状况。
一般红螯螯虾从外塘入温室的初期,亚硝酸盐会达到0.5 mg/L以上,需要经过一段时间才能降低并稳定在较低范围(渔业水质标准规定的0.2 mg/L以内),但当水质管理不善、投喂量过多等情况下亚硝酸盐又将升高。因此,本实验在确定亚硝酸盐胁迫的96 h半致死浓度和安全浓度后,分别设置4组不同亚硝酸盐浓度组,通过生理生化指标及肠道菌群比较分析,对比各实验组肝胰腺组织的特征变化,为红螯螯虾越冬过程中的水质管理提供科学依据。
1 材料与方法 1.1 实验设计实验用虾均采自浙江省淡水水产研究所综合试验基地,选取越冬期间体质健壮、四肢齐全、规格相近的红螯螯虾[体质量为(55.02±3.35)g,体长为(10.58±0.22)cm)],实验前调控各组亚硝酸盐浓度,各组水温等环境条件一致。采用常规生物急性毒性试验法,研究0~30 mg/L亚硝酸盐浓度对虾的急性毒性,得到24~96 h的死亡率,并通过概率单位法计算半致死浓度以及安全浓度。然后分别设置4组不同亚硝酸盐质量浓度组(A组:对照组0 mg/L;B组:低质量浓度组0.5 mg/L;C组:中质量浓度组2.3 mg/L;D组,高质量浓度组5.0 mg/L),每组3平行,每个水槽(容积为200 L)随机移入虾各10尾,测量其初始体长、初始体质量,胁迫6周后测量最终体质量、最终体长、肝胰腺质量,计算存活率(SR)、肥满度(CF)、肝体指数(HI)、体重增加率(WG)、体长增加率(LB),并取样进行后续检测。计算公式如下:
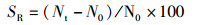 (1)
(1)
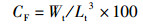 (2)
(2)
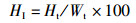 (3)
(3)
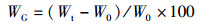 (4)
(4)
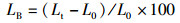 (5)
(5)
式中:SR为存活率,%;CF为肥满度,g/cm3;HI为肝体指数,%;WG为体重增加率,%;LB为体长增加率,%;N0为初始虾数,尾;Nt为终末虾数,尾;W0为初始体质量,g;Wt为终末体质量,g;L0为初始体长,cm;Lt为终末体长,cm;Ht为终末肝重,g。
用NaNO2(分析纯)试剂配制实验组亚硝酸盐质量浓度。试验期间每日傍晚投喂人工配合饲料,各组投喂量一致,每日上午进行吸污、换水及亚硝酸盐质量浓度监测,保证亚硝酸盐质量浓度的稳定,水温(20.0±0.5) ℃,24 h连续微充气以保证溶氧。
1.2 样品采集与分析从各组水槽中随机取3尾虾,解剖后取肝胰腺。肝胰腺分成两部分:一部分肝胰腺保存于波恩氏液,波恩氏液保存的样品采用常规石蜡包埋,连续横切,切片厚度为6 μm,H.E染色,显微镜观察并拍照;另一部分肝胰腺与各组的肌肉和血清保存于液氮中进行抗氧化指标(超氧化物歧化酶SOD、丙二醛MDA)、免疫相关指标(酸性磷酸酶ACP、碱性磷酸酶AKP、溶菌酶UL)、能量代谢指标(甘油三酯TG)的检测。液氮保存之后的样品转移至-80 ℃超低温冰箱保存。按每克待测样组织加入9 mL生理盐水的比例配制组织匀浆,研磨后转移至2 mL离心管中,4 ℃下3 000 r/min离心10 min,取上清液分装后放入4 ℃冰箱暂存后用于检测,酶活指标均采用南京建成生物工程研究所试剂盒测定。取肠道分析肠道菌群结构,肠道样品为从各组水槽中随机取3尾虾,解剖后用无菌剪刀将肠道组织剪开,并用解剖刀轻轻刮取内溶物,然后将样品放置于液氮内,随后转移至-80 ℃冰箱备用。提取各组菌群总DNA,以肠道细菌DNA为模板,采用细菌通用引物扩增细菌序列,比较各组肠道菌群变化[18]。
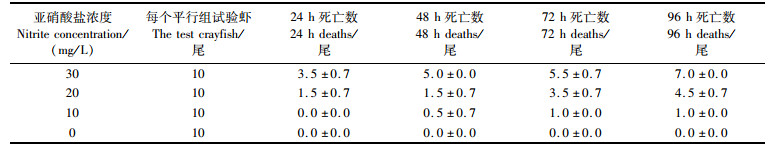
2 结果 2.1 急性毒性试验首先采用常规生物急性毒性试验法研究亚硝酸盐对红螯螯虾96 h的半致死浓度以及安全浓度,每组3平行(表 1)。结果可见红螯螯虾的死亡率随亚硝酸盐浓度及胁迫时间的增加而增加,同时,通过直线内插法计算得到亚硝酸盐对红螯螯虾96 h的半致死浓度为22.0 mg/L,安全浓度SC为2.2 mg/L。
|
表 1 亚硝酸盐急性毒性试验 Tab.1 Preliminary test of nitrite stress |
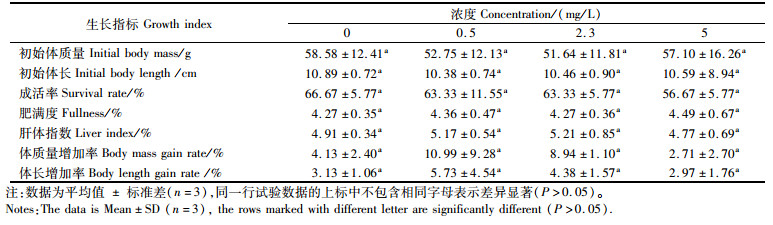
胁迫6周后测量4组不同亚硝酸盐浓度组(0、0.5、2.3、5.0 mg/L)红螯螯虾的体质量、体长、肝胰腺质量,计算成活率、肥满度、肝体指数、体质量增加率、体长增加率等指标(表 2)。结果表明,这4组的成活率、肥满度、肝体指数、体质量增加率与体长增加率均无显著性差异(P>0.05),但高浓度组的成活率、体质量增加率、体长增加率最低。
|
表 2 各组的生长指标 Tab.2 Growth index of each group |
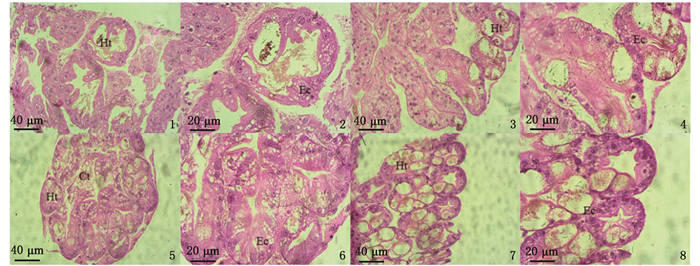
组织切片观察发现,对照组上皮细胞无断裂,排列较为整齐,分支管状腺之间的结缔组织较多而互相联系(图版-1, 2);低浓度组(0.5 mg/L)与对照组形态一致,未出现形态学的改变(图版-3, 4);中浓度组(2.3 mg/L)的肝小管排列开始混乱,各肝小管大小出现差异,但总体上变化不明显(图版-5, 6);高浓度组(5 mg/L)上皮细胞层溶解,肝小管排列混乱,各肝小管大小出现差异,基膜不整齐,肝小管间的结缔组织减少,细胞出现裂解,空泡化加剧(图版-7, 8)。总体上随着亚硝酸盐浓度的增加,肝小管排列趋于混乱,大小出现差异,肝小管间的结缔组织随之减少,产生空泡化,特别是在高浓度组(5 mg/L)中的变化相对明显。
|
1、2. 对照组;3、4. 低浓度组(0.5 mg/L);5、6. 中浓度组(2.3 mg/L);7、8. 高浓度组(5 mg/L); Ec. 单层柱状上皮细胞;Ht. 肝小管;Ct.结缔组织。 1, 2. Control group; 3, 4. Low concentration group(0.5 mg/L); 5, 6. Medium concentration group (2.3 mg/L); 7, 8. High concentration group (5 mg/L); Ec. Simple columnar epithelium; Ht. Liver tubes; Ct. Connective tissue. 图版 肝胰腺组织学观察 Plate Observation of the histology of hepatopancreas |
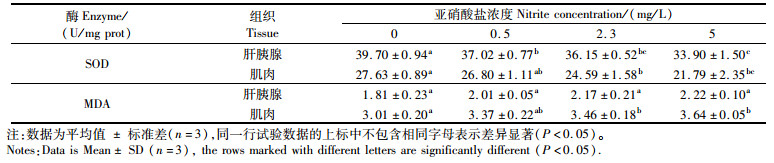
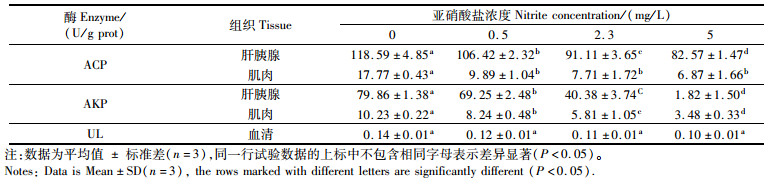
检测结果表明,在亚硝酸盐浓度为0~5 mg/L范围内,抗氧化指标SOD活性在肝胰腺中为39.70~33.90 U/mg prot,在肌肉中为27.63~21.79 U/mg prot,且均随亚硝酸盐浓度的升高而降低。其中在肝胰腺中,对照组SOD活性显著高于其他3组(P < 0.05),高浓度组SOD活性显著低于其他3组(P < 0.05);在肌肉中,对照组SOD活性显著高于中、高浓度组(P < 0.05),高浓度组SOD活性显著低于对照组和低浓度组(P < 0.05)(表 3)。MDA活性在肝胰腺中为1.81~2.22 U/mg prot,在肌肉中为3.01~3.64 U/mg prot,且均随亚硝酸盐浓度的升高而升高。其中在肝胰腺中,4组的MDA活性无显著性差异(P>0.05);在肌肉中,对照组MDA活性显著低于中、高浓度组(P < 0.05),且抗氧化指标具有组织特异性,肝胰腺内测得的SOD活性大于肌肉,MDA活性则小于肌肉(表 3)。免疫相关指标ACP、AKP活性在肝胰腺中分别为118.59~82.57、79.86~18.82 U/g prot,在肌肉中分别为17.77~6.87、10.23~3.48 U/g prot,免疫相关指标UL活性在血清中为0.14~0.10 U/g prot,且均随亚硝酸盐浓度的升高而降低。其中在肝胰腺中,4组ACP、AKP活性均存在显著性差异(P < 0.05),对照组最高,高浓度组最低;在肌肉中,对照组ACP活性显著高于其他3组(P < 0.05),4组AKP活性均存在显著性差异(P < 0.05),对照组最高,高浓度组最低;血清中4组的UL活性则无显著差异(P>0.05),且免疫相关指标也具有组织特异性,肝胰腺内测得到的ACP、AKP活性均大于肌肉(表 4)。能量代谢指标TG活性为0.26~0.17 mmol/g prot,且随亚硝酸盐浓度的升高而降低,对照组TG活性显著高于高浓度组(P < 0.05),见表 5。总体上,高浓度的亚硝酸盐含量对抗氧化指标、免疫相关指标、能量代谢指标具有影响。
|
表 3 抗氧化相关指标检测 Tab.3 Antioxidant-related indicator detection |
|
表 4 免疫相关指标检测 Tab.4 Immune-related indicator detection |

|
表 5 能量代谢相关指标检测 Tab.5 Energy metabolism-related indicator detection |
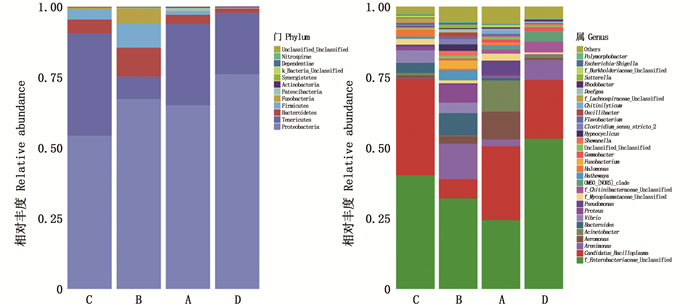
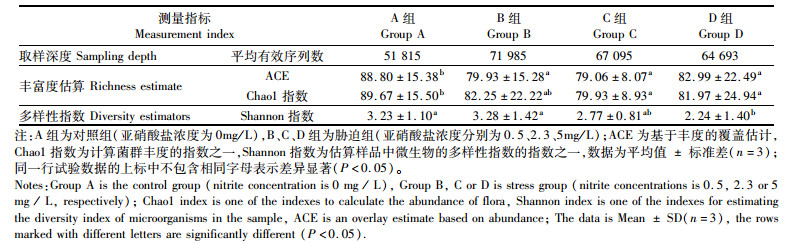
每组各随机取3个肠道样品分析肠道菌群结构,结果表明,12个样品共有766 764个高质量序列,平均一个样品序列数为63 897。4个组的优势种所属门均为Proteobacteria(变形菌门),其次为Tenericutes(软壁菌门);对照组A组Candidatus_Bacilloplasma和Enterobacteriaceae为主要优势菌属,胁迫组B、C、D 3组主要优势菌属为Enterobacteriaceae,其次为Candidatus_Bacilloplasma,亚硝酸盐胁迫在一定程度上提高了Enterobacteriaceae的比例,这在B、D组表现得尤为明显(图 1)。在丰富度估算中,B、C、D组的ACE指标显著低于A组(P < 0.05),C、D组的Chao 1指标显著低于A组(P < 0.05);在多样性估算中,D组的Shannon指标均显著低于A、B组(P < 0.05)。因此,总体上D组(高浓度组)的肠道菌群多样性最低,A组(对照组)的肠道菌群多样性最高(表 6)。
|
左图为分类上门的水平肠道菌群组成,右图为分类上属的水平肠道菌群组成。 The left figure shows the composition of the intestinal flora at the phylum level, and the right figure shows the composition of the intestinal flora at the genus level. 图 1 不同亚硝酸盐浓度胁迫下肠道菌群组成 Fig. 1 Composition of intestinal microflora at different nitrite concentrations |
|
表 6 不同亚硝酸盐浓度胁迫下肠道菌群丰富度估算(Chao1& ACE)和多样性指数(Shannon) Tab.6 Estimates of Intestinal Bacterial Richness (Chao1 and ACE) and Diversity Index (Shannon) under different Nitrite Concentrations |
渔业水质标准规定养殖水体中亚硝酸盐含量应不高于0.2 mg/L[15],而本研究得到的红螯螯虾亚硝酸盐的安全浓度为2.2 mg/L,是水质标准11倍,说明红螯螯虾有一定的亚硝酸盐耐受性。但在越冬过程中,亚硝酸盐浓度的异常升高依旧会造成不良的影响及不容忽视的毒性作用[19],包括生长、蜕壳、摄食、繁殖、体质等方面都会受到影响。推测造成这些影响的原因可能与亚硝酸盐达到一定浓度时其生长、组织器官、生理生化指标及肠道菌群等的变化有关。因此,我们在亚硝酸盐浓度为0~5 mg/L范围内进行了生长指标、肝胰腺组织切片、生理生化指标及肠道菌群的检测。
3.1 亚硝酸盐对红螯螯虾生存与生长的影响在亚硝酸盐过高的环境中虾的抵抗力和免疫力往往较弱,进而影响其生存与生长[20]。本次研究表明,在亚硝酸盐浓度为0~5 mg/L范围内,各组的成活率、肥满度、肝体指数均无显著差异(P>0.05),但高浓度组(5 mg/L)的成活率、体质量增加率、体长增加率最低。推测较长时间的高浓度亚硝酸盐胁迫对生存与生长速度具有一定的影响,但影响不一定造成成活率与生长速度的显著降低。
3.2 亚硝酸盐对肝胰腺组织学影响肝胰腺是虾类进行合成和分泌消化酶、吸收营养物质、排泄、蜕皮等生命活动的重要器官[21]。有研究[22]表明,亚硝酸盐中毒致组织病变最严重的器官是肝胰腺。李霞等[23]也认为,肝胰腺的病变会导致虾合成、吸收功能的紊乱或丧失,进而破坏整个机体的新陈代谢,降低成活率。本次研究结果显示,高浓度亚硝酸盐导致的肝胰腺生理功能受损是使虾生命力降低的重要原因。组织切片观察发现,随着亚硝酸盐浓度的增加,肝小管排列趋于混乱,大小出现差异,肝小管间的结缔组织随之减少,产生空泡化,这在高浓度组中尤为明显。这证明了亚硝酸盐对肝胰腺的组织结构有损害,若长期处于此环境条件下,将影响其生理功能而致肝胰腺病变,使其合成、吸收功能紊乱或丧失,进而影响其越冬期间的抗病力、生长及繁殖性能。因此,在越冬过程中应避免亚硝酸盐的升高对肝胰腺等脏器的影响。
3.3 亚硝酸盐对生理生化指标的影响研究[24]证明,亚硝酸盐浓度的升高可导致机体活性氧的增加,抗氧化酶则是甲壳动物机体非特异性免疫的一个重要方面,可在一定程度上反映机体的健康状况[25]。本实验结果显示,总体上SOD活性随亚硝酸盐浓度的升高而降低,MDA活性随亚硝酸盐浓度的升高而升高。吕晓燕等[17]对红螯螯虾的研究也表明,SOD等抗氧化酶活性总体上与亚硝酸盐浓度呈负相关,且高浓度组酶活性降低更明显,导致机体清除超氧阴离子的能力下降,机体抗氧化防御系统损伤。因此,推测抗氧化酶活性的下降是造成红螯螯虾器官损伤的重要原因。
在甲壳动物的免疫体系中,ACP和AKP均为磷酸单酯酶,主要分布在肝胰腺、血淋巴中,其活性变化可指示体内免疫系统的受损情况,在免疫应答中起重要的作用[15]。吕晓燕等[17]的研究表明,在3~6 mg/L亚硝酸盐浓度范围内,亚硝酸盐对红螯螯虾的ACP和AKP活性影响极其显著,且ACP和AKP具有组织特异性,在肝胰腺内测得的ACP和AKP的活性大于肌肉,这与肝胰腺和肌肉在代谢过程中的特点有关。本研究得到了类似的结论,即总体上ACP和AKP活性随亚硝酸盐浓度的升高而降低,且肝胰腺内测得的ACP、AKP活性均大于肌肉。但亚硝酸盐对红螯螯虾肝胰腺、肌肉等组织器官中ACP、AKP活性影响的具体作用机制仍需进一步探索。溶菌酶是广泛存在于水生动物血清、吞噬细胞中的一种碱性蛋白,能在一定程度上能够反映环境因素改变对水生动物免疫水平的影响[26]。研究[27-29]表明,亚硝酸盐胁迫的危害程度与墨吉明对虾(Fenneropenaeus merguiensis)、凡纳滨对虾、中国对虾(Penaeus chinensis)体内的溶菌酶含量相关,因为高含量的溶菌酶有助于增强虾的抗病能力,降低致病菌的易感性,提高存活率。本研究中,4个实验组血清中溶菌酶活性无显著差异(P>0.05),但溶菌酶含量仍然随着亚硝酸盐浓度的升高降低,表明较高的亚硝酸盐仍然存在降低溶菌酶含量的可能性,迫使越冬虾抵抗病菌能力下降。
本次酶活检测结果表明,即使在0.5 mg/L的较低亚硝酸盐浓度下,能提高红螯螯虾免疫能力的SOD、ACP、AKP以及UL活力均下降,能造成机体损伤的MDA活力均升高,这说明在室内水泥池越冬过程中,长期低浓度亚硝酸盐胁迫对红螯螯虾的毒害作用也是不容忽视的。
3.4 亚硝酸盐对红螯螯虾肠道菌群的影响虾肠道内的细菌在维持宿主健康中发挥着重要作用,如促进消化、减少有毒微生物的代谢活动、抑制病原菌生长等[30-32]。FRANK等[33]通过比较健康和发病对虾的肠道细菌组成,发现肠道细菌的失衡可引起肠炎。DUBOURG等[34]认为菌群丰度、多样性以及功能发生的变化会影响肠道黏膜的完整性甚至引发疾病。张皓[35]研究表明,水质指标的变化会影响养殖水体细菌种群结构,同时也影响养殖动物健康及其肠道细菌组成。XIONG等[36]与吴金凤等[37]对虾类的研究表明,发病组肠道中细菌多样性相对于健康组有较大幅度的下降。本研究样本虽然没有出现发病情况,但本次肠道菌群分析结果表明,高浓度亚硝酸盐造成了虾体内肠道菌群多样性的降低,这是一种应激预警,可能导致肠炎等细菌性或病毒性疾病的发生。同时本研究发现亚硝酸盐胁迫在一定程度上提高了肠杆菌科(Enterobacteriaceae)的比例,该科的部分种类是肠道疾病的重要病原菌,如大肠埃希氏菌(Escherichia coli)等。因此,推测亚硝酸盐胁迫打破了红螯螯虾肠道内微生态系统的平衡,造成某些致病菌比例的提高,从而降低了机体的抵抗力[38]。建议红螯螯虾室内越冬期间在水中加入EM菌等进行调水并改善肠道菌群环境,并对水质进行定期监测,避免亚硝酸盐浓度过高,影响虾的健康。
| [1] |
CHENG S, JIA Y Y, CHI M L, et al. Culture model of Cherax quadricarinatus: Temporary shelter in shed and pond culture[J]. Aquaculture, 2020, 526: 1-8. |
| [2] |
CHENG S, JIA Y Y, CHI M L, et al. The exploration of artificial incubation of Cherax quadricarinatus eggs[J]. Aquaculture, 2020, 529: 1-6. |
| [3] |
陈奕彬, 李色东. 红螯螯虾繁育关键技术[J]. 科学养鱼, 2018, 2: 6-7. CHEN Y B, LI S D. Key techniques for breeding Cherax quadricarinatus[J]. Scientific Fish Farming, 2018, 2: 6-7. |
| [4] |
李卫芳. 红螯螯虾规模化育苗技术报告[J]. 水产养殖, 2013, 2: 20-22. LI W F. Technical report on the large-scale seedling of Cherax quadricarinatus[J]. Journal of Aquaculture, 2013, 2: 20-22. |
| [5] |
顾志敏, 许谷星, 黄鲜明, 等. 红螯螯虾的室内人工育苗[J]. 水产学报, 2003, 27(1): 32-37. GU Z M, XU G X, HUANG X M, et al. Indoor artificial breeding and juvenile nursing of Cherax quadricarinatus[J]. Journal of Fisheries of China, 2003, 27(1): 32-37. |
| [6] |
王在文. 红螯螯虾土池人工育苗与养殖技术[J]. 科学养鱼, 2017, 2: 33-34. WANG Z W. Artificial seedling and breeding techniques in the Cherax quadricarinatus soil pond[J]. Sientific fish farming, 2017, 2: 33-34. |
| [7] |
WANG W N, WANG A L, ZHANG Y J, et al. Effects of nitrite on lethal and immune response of Macrobrachium nipponense[J]. Aquaculture, 2004, 232(1-4): 679-686. DOI:10.1016/j.aquaculture.2003.08.018 |
| [8] |
王龙, 郝志敏, 王晶. 两种溶氧条件下亚硝酸盐和氨氮对罗氏沼虾毒性比较的研究[J]. 饲料与畜牧, 2011, 8: 12-16. WANG L, HAO Z M, WANG J. A comparative study of the toxicity of nitrites and ammonia nitrogen to Macrobrachium rosenbergii under two dissolved oxygen conditions[J]. Feed and animal husbandry, 2011, 8: 12-16. |
| [9] |
MALLlASEN M, VALENTI W C. Effect of nitrite on larval development of giant river prawn Macrobrachium rosenbergii[J]. Aquaculture, 2006, 261(4): 1292-1298. DOI:10.1016/j.aquaculture.2006.07.048 |
| [10] |
胡义波, 王玥, 姜乃澄. 氨态氮、亚硝态氮对罗氏沼虾血细胞及超微结构的影响[J]. 浙江大学学报(理学版), 2005, 32(6): 691-697. HU Y B, WANG Y, JIANG N C. Effects of ammonia-N and nitrite-N on the hemocyte count and ultrastructure of Macrobrachium rosenbergii[J]. Journal of Zhejiang University(Science Edition), 2005, 32(6): 691-697. DOI:10.3321/j.issn:1008-9497.2005.06.021 |
| [11] |
LEE W C, CHEN J C. Nitrogenous excretion and arginase specific activity of kuruma shrimp Marsupenaeus japonicus exposed to elevated ambient nitrite[J]. Journal of Experimental Marine Biology and Ecology, 2004, 308(1): 103-111. DOI:10.1016/j.jembe.2004.02.014 |
| [12] |
CHND R K, SAHOO P K. Effect of nitrite on the immune response of freshwater prawn Macrobrachium malcolmsonii and its susceptibility to Aeromonas hydrophila[J]. Aquaculture, 2006, 258(1-4): 150-156. DOI:10.1016/j.aquaculture.2006.05.001 |
| [13] |
XIAN J A, WANG A L, CHEN X D, et al. Cytotoxicity of nitrite on haemocytes of the tiger shrimp, Penaeus monodon, using flow cytometric analysis[J]. Aquaculture, 2011, 317: 240-244. DOI:10.1016/j.aquaculture.2011.03.026 |
| [14] |
冼健安, 张秀霞, 郭慧, 等. 亚硝酸盐胁迫对罗氏沼虾血细胞及其抗氧化酶活力的影响[J]. 生物安全学报, 2016, 25(4): 300-307. XIAN J A, ZHANG X X, GUO H, et al. Effects of nitrite on haemocyte and antioxidant enzyme activity in Macrobrachium rosenbergii[J]. Journal of Biosafety, 2016, 25(4): 300-307. DOI:10.3969/j.issn.2095-1787.2016.04.012 |
| [15] |
钟君伟, 朱永安, 付佩胜, 等. 亚硝酸盐氮对克氏原螯虾成虾的毒性及其抗病因子的影响[J]. 长江大学学报(自然科学版), 2014, 11(5): 36-40. ZHONG J W, ZHU Y A, FU P S, et al. Toxicity of nitrite nitrogen on Procambarus clarkii and effects of nitrite nitrogen on immune-related factor[J]. Journal of Yangtze University (Natural Science Edition), 2014, 11(5): 36-40. |
| [16] |
潘训彬, 张秀霞, 鲁耀鹏, 等. 氨氮和亚硝酸盐对红螯螯虾幼虾和亚成虾的急性毒力[J]. 生物安全学报, 2017, 26(4): 316-322. PAN X B, ZHANG X X, LU Y P, et al. Acute toxicity of ammonia and nitrite on juvenile and subadult redclaw crayfish (Cherax quadricarinatus)[J]. Journal of Biosafety, 2017, 26(4): 316-322. DOI:10.3969/j.issn.2095-1787.2017.04.011 |
| [17] |
吕晓燕, 李嘉尧, 方燕, 等. 亚硝酸盐对红螯光壳螯虾不同组织免疫相关酶活性及超微结构的影响[J]. 水产学报, 2010, 34(12): 1812-1820. LYU X Y, LI J R, FANG Y, et al. Nitrite stress on immune-related enzymes and the ultrastructure in different tissue of redclaw crayfish (Cherax quadricarinatus)[J]. Journal of Fisheries of China, 2010, 34(12): 1812-1820. |
| [18] |
SUO Y T, LI E C, LI T Y, et al. Response of gut health and microbiota to sulfide exposure in Pacific white shrimp Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 2017, 63: 87-96. |
| [19] |
曾红, 林能锋, 张文焕, 等. 亚硝酸氮对日本对虾(Penaeus japonicus)幼虾的急性毒性试验[J]. 福建畜牧兽医, 2006, 28(5): 13-14. ZENG H, LIN N F, ZHANG W H, et al. Acute toxicity test of nitrite nitrogen to Penaeus japonicus prawns[J]. Fujian Journal of Animal Husbandry and Veterinary Medicine, 2006, 28(5): 13-14. DOI:10.3969/j.issn.1003-4331.2006.05.006 |
| [20] |
唐红日, 唐新民, 江辉, 等. 池塘养殖南美白对虾如何降解过高的亚硝酸盐[J]. 中国水产, 2008(11): 81-82. TANG H R, TANG X M, JIANG H, et al. How to degrade the high nitrite produced in the process of pond culture of Litopenaeus vannamei[J]. China Fisheries, 2008(11): 81-82. DOI:10.3969/j.issn.1002-6681.2008.11.041 |
| [21] |
颜素芬, 姜永华, 陈昌生. 中国龙虾早期叶状幼体肝胰腺的显微与超微结构[J]. 水产学报, 2005, 29(6): 737-744. YAN S F, JIANG Y H, CHEN C S. Micro-ultrastructure of hepatopancreas of phyllosoma larvae in Panulirus stimpsoni[J]. Journal of Fisheries of China, 2005, 29(6): 737-744. |
| [22] |
吴中华, 刘昌彬. 中国对虾慢性亚硝酸盐和氨中毒的组织病理学研究[J]. 华中师范大学学报(自然科学版), 1999, 33(1): 119-122. WU Z H, LIU C B. Histopathological research on chronic poisoning of Penaeus chinensis by nitrite and ammonia[J]. Journal of Central China normal University (Na t. Sci.), 1999, 33(1): 119-122. |
| [23] |
李霞, 何幽峰, 李华, 等. 正常和患红腿黄鳃病的中国对虾肝胰脏组织学研究[J]. 大连水产学院学报, 1992, 7(1): 11-15. LI X, HE Y F, LI H, et al. The histopathological study on the hepatopancreas with redlegs andyellow gill disease of Penaeus Chinenesis[J]. Journal of Dalian Fisheries College, 1992, 7(1): 11-15. |
| [24] |
LACKNE R. Fish ecotoxicology[M]. Basel: Birkhauser Publishers, 1998: 203-224.
|
| [25] |
陈萍, 李健, 李吉涛, 等. 不同地理群体三疣梭子蟹非特异性免疫功能的比较[J]. 中国农学通报, 2008, 24(11): 496-498. CHEN P, LI J, LI J T, et al. Comparison on the functions of nonspecific immunity in different populations of Portunus trituberculatus[J]. Chinese Agricultural Science Bulletin, 2008, 24(11): 496. |
| [26] |
陈家长, 臧学磊, 孟顺龙, 等. 亚硝酸盐氮胁迫对罗非鱼血清非特异性免疫酶活力的影响[J]. 生态环境学报, 2012, 21(5): 897-901. CHENG J C, ZANG X L, MENG S L, et al. Effect of nitrite nitrogen stress on the activities of nonspecific immune enzymes in serum of tilapia (GIFT Oreochromis niloticus)[J]. Ecology and Environmental Sciences, 2012, 21(5): 897-901. |
| [27] |
栗志民, 钱佳慧, 刘建勇, 等. 亚硝酸盐对墨吉明对虾的毒性及其免疫因子的影响[J]. 安徽农业科学, 2015, 43(21): 160-163. LI Z M, QIAN J H, LIU J Y, et al. Effects of Nitrite on the Toxicity and Immmune Parameters of Fenneropenaeus merguiensis[J]. Journal of Anhui Agri, 2015, 43(21): 160-163. DOI:10.3969/j.issn.0517-6611.2015.21.060 |
| [28] |
黄翔鹄, 李长玲, 郑莲, 等. 亚硝酸盐氮对凡纳滨对虾毒性和抗病相关因子影响[J]. 水生生物学报, 2006, 30(4): 466-471. HUANG X H, LI C L, ZHENG L, et al. The toxicity of NO2-N on Litopenaeus vannamei and effects of NO2-N on facters relating to the anti-disease ability[J]. Acta Hydrobiologica Sinica, 2006, 30(4): 466-471. DOI:10.3321/j.issn:1000-3207.2006.04.016 |
| [29] |
丁美丽, 林林, 李光友, 等. 有机污染对中国对虾体内外环境影响的研究[J]. 海洋与湖沼, 1997, 28(1): 7-12. DINNG M L, LIN L, LI G Y, et al. Effects of organic pollution on Penaeus chinensis body's intra-environment and external-environment[J]. Oceanologia et Limnologia Sinaca, 1997, 28(1): 7-12. DOI:10.3321/j.issn:0029-814X.1997.01.002 |
| [30] |
ClEMENTE J C, URSELLl L K, PARFREY L W, et al. The impact of the gut microbiota on human health: An integrative view[J]. Cell, 2012, 148: 1258-1270. DOI:10.1016/j.cell.2012.01.035 |
| [31] |
ROUND J L, MAZMANIAN S K. The gut microbiota shapes intestinal immune responses during health and disease[J]. Nature Reviews Immunology, 2009, 9: 313-323. DOI:10.1038/nri2515 |
| [32] |
RING E, OLSEN R E, MAYHEW T M, et al. Electron microscopy of the intestinal microflora of fish[J]. Aquaculture, 2003, 227: 395-415. DOI:10.1016/j.aquaculture.2003.05.001 |
| [33] |
FRANK D N, AMAND A L, FELDMAN R A, et al. Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104: 13780-13785. DOI:10.1073/pnas.0706625104 |
| [34] |
DUBOURG G, SURENAUD M, LEVY Y, et al. Microbiome of HIV-infected people[J]. Microbial pathogenesis, 2016, 106: 85-93. |
| [35] |
张皓. 养殖环境微生物群落的动态变化及与水环境的互作[D]. 苏州: 苏州大学, 2015. ZHANG H. The dynamic changes of microbial communities in aquaculture environment and interactions with water environment[D]. Suzhou: Suzhou University, 2015. |
| [36] |
XIONG J B, WANG K, WU J F, et al. Changes in intestinal bacterial communities are closely associated with shrimp disease severity[J]. Applied Microbiology and Biotechnology, 2015, 99(16): 6911-6919. DOI:10.1007/s00253-015-6632-z |
| [37] |
吴金凤, 熊金波, 王欣, 等. 肠道菌群对凡纳滨对虾健康的指示作用[J]. 应用生态学报, 2016, 27(2): 611-621. WU J F, XIONG J B, WANG X, et al. Intestinal bacterial community is indicative for the healthy status of Litopenaeus vannamei[J]. Chinese Journal of Applied Ecology, 2016, 27(2): 611-621. |
| [38] |
张家松, 段亚飞, 张真真, 等. 对虾肠道微生物菌群的研究进展[J]. 南方水产科学, 2015, 11(6): 114-119. ZHANG J S, DUAN Y F, ZHANG Z Z, et al. Research progress of shrimp intestinal microflora[J]. Southern Fisheries Science, 2015, 11(6): 114-119. |
2. Key Laboratory of Healthy Freshwater Aquaculture Ministry of Agriculture Rural Affairs, Key Laboratory of Freshwater Aquatic Animal Genetic and Breeding of Zhejiang Province, Zhejiang Institute of Freshwater Fisheries, Huzhou 313001, Zhejiang China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


