2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306;
3. 农业农村部水产品贮藏保鲜质量安全风险评估实验室, 上海 201306
黄曲霉毒素(aflatoxin, AF)是一类主要由黄曲霉(Aspergillus flavus)和寄生曲霉(A. parasiticus)产生的具有二氢呋喃环结构的次级代谢物,其中,黄曲霉毒素B1(aflatoxin B1, AFB1)的毒性最强。已经证实AFB1是诱导肝细胞性肝癌(hepatocellular carcinoma, HCC)的诱发因子,AFB1的摄入与乙型肝炎病毒(hepatitis B virus, HBV)和丙型肝炎病毒(hepatitis C virus, HCV)具有协同作用,可通过遗传和表观遗传修饰促进HCC的发展[1]。AFB1除了具有致癌、致畸、致突变的特性外,还会导致营养不良、生长迟缓和免疫抑制[2-4],已被国际癌症研究机构(International Agency for Research on Cancer, IARC)列为Ⅰ类致癌物[5]。尽管AFB1主要毒性作用器官是肝脏,但摄入AFB1对其他器官如肾脏[6]、心脏[7]、睾丸[8]、附睾[9]、卵巢[10]和大脑[11]等也有不良反应。ZHENG等[12]研究发现,4 μg/mL AFB1分别作用于Caco-2、HEK、Hep-G2和SK-N-SH细胞,均可显著抑制细胞生长、提高乳酸脱氢酶(lactate dehydrogenase, LDH)水平、降低细胞抗氧化水平和诱导遗传损伤。AFB1的摄入总是伴随着肝损伤和氧化应激,LI等[13]研究发现AFB1会导致肉鸡的肝脏损伤,包括肝组织学病变、血清酶活性增加、肝脏内抗氧化酶活性下降以及活性氧(reactive oxygen species, ROS)和8-羟基脱氧鸟苷(8-hydroxy-2′ -deoxyguanosine, 8-OHdG)水平的升高。
壳寡糖(chitooligosaccharides, COS)是甲壳素通过酶或化学脱乙酰作用生成的衍生物壳聚糖进一步水解得来的,其聚合度小于20,平均分子量小于3.2 ku,商业生产COS的原料丰富,主要是海洋甲壳类动物废弃物,如虾壳、蟹壳等。COS具有抗氧化、抗炎、调节免疫、抗肿瘤、抗菌、抗凝血、保护神经等多种生物活性[14-18]。QU等[19]研究了在高脂饮食小鼠模型中体内和体外COS的自由基清除能力,在高脂肪饮食小鼠的饲料中加入COS会导致小鼠的胃、肝和血清中的超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)活性显着增加,显示出COS具有一定的抗氧化活性,并且可以恢复受高脂饮食影响的小鼠体内的抗氧化酶的活性。HUANG等[20]研究发现,COS预处理可以降低Cu2+诱导的SH-SY5Y细胞活力的降低和LDH释放水平的增加,同时COS下调了Cu2+诱导的细胞氧化应激和Caspase-3基因活化水平,并通过激活核因子红系-2-相关因子-2(nuclear factor erythroid-2-related factor-2, Nrf2)信号通路来缓解Cu2+诱导的细胞氧化损伤。
因此,基于以上研究基础,本文以大鼠肝细胞(BRA 3A细胞)为研究对象,通过设计体外实验来研究COS对AFB1诱导大鼠肝细胞毒性损伤的干预作用,以期为利用具有生物活性的天然产物降低真菌毒素对肝脏的毒性损伤作用提供理论基础。
1 材料与方法 1.1 实验材料与仪器大鼠肝细胞(BRL 3A细胞),中国科学院上海生命科学研究院细胞库;COS(分子量为1 220 u),山东卫康生物医药技术有限公司;DMEM高糖培养基,HyClone公司;胎牛血清(FBS),BI公司(以色列);二甲基亚砜(DMSO)、磷酸缓冲溶液(PBS),生工生物(上海)股份有限公司;青链霉素混合液(100×)、胰蛋白酶、BCA蛋白浓度测定试剂盒,北京索莱宝科技有限公司;CCK-8试剂盒,DOJINDO公司(日本);Western及IP裂解液、ROS检测试剂盒、脂质氧化(MDA)检测试剂盒、超氧化物歧化酶(SOD)活性检测试剂盒,碧云天生物技术公司;谷胱甘肽-S转移酶(GST)测定试剂盒,南京建成生物工程研究所;TRIzoL试剂,赛默飞世尔科技(中国)有限公司;HiScript III RT SuperMix for qPCR、AceQ qPCR SYBR Green Master Mix,南京诺唯赞生物有限公司;96微孔板、6孔板、细胞培养皿、细胞培养瓶,Corning公司(美国);0.22 μm针头式滤器,PALL公司(美国)。
主要仪器:BB150二氧化碳恒温培养箱和NANODROP 2000分光光度计,购自赛默飞世尔科技(中国)有限公司;OptiMairTM垂直流超净工作台,购自新加坡艺思高科技有限公司;AE2000T倒置生物显微镜,购自麦克奥迪实业集团有限公司;TD3低速离心机,购自湖南湘仪实验室仪器开发有限公司;SYNERGY2多功能酶标仪,购自伯腾仪器有限公司(美国);CT14RD高速冷冻离心机,购自上海天美生化仪器设备工程有限公司;BD FACSVerse流式细胞仪,购自Becton Dickison(美国);QL-902涡旋振荡仪,购自海门市其林贝尔仪器制造有限公司;ABI7900荧光定量PCR仪,购自Applied Biosystems;G2965A Agilent 2200生物分析仪,购自安捷伦生物科技有限公司。
1.2 细胞培养大鼠肝细胞(BRL 3A细胞)在加有体积分数为10%的胎牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM培养基中,置于恒湿的37 ℃和5%二氧化碳的培养箱中培养。AFB1和COS分别溶解在DMSO和超纯水中制备AFB1和COS工作液(1 000×),工作液使用前均需用0.22 μm针头式滤器过滤。细胞接种在细胞培养皿或培养瓶中培养,在用AFB1和COS处理前,取对数期的细胞计数后制备一定浓度的细胞悬液接种在96孔板、6孔板或培养皿中,将种板细胞培养24 h,其中DMSO的终体积分数为0.1%。
1.3 细胞活力的测定AFB1对细胞的半数抑制浓度(half inhibitory concentration, IC50)是指AFB1能将细胞生长抑制50%所需的作用浓度。用CCK-8法分别测定AFB1对细胞的IC50和COS对细胞的无损害作用浓度,取对数期细胞接种于96孔板中(5×103个/孔),置于培养箱中培养24 h后吸出培养基,分别更换不同浓度的AFB1工作液(0.4、2、10、50、250 μmol/L)和COS工作液(7.81、31.25、125、500、2 000 μmol/L)继续培养24 h。培养结束后按照CCK-8试剂盒说明书向每孔加入10 μL CCK-8溶液,37 ℃孵育1 h后立即用酶标仪测定在450 nm处的吸光度值,按照公式(1)分别计算各浓度组的AFB1和COS对细胞的增殖抑制率,然后再根据公式(2)计算的到AFB1对细胞的IC50。
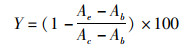 (1)
(1)
式中:Y为增殖抑制率,%;Ab为空白组(只含细胞工作液,无细胞)的吸光度值;Ae为试验组的吸光度值;Ac为对照组(无药物处理,有细胞)的吸光度值。
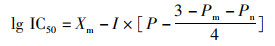 (2)
(2)
式中:Xm为lg(最大剂量);I为lg(最大剂量/相临剂量);P为增殖抑制率之和;Pm为最大增殖抑制率;Pn为最小增殖抑制率。
1.4 COS和AFB1作用于细胞存活率的测定根据1.3节的结果得到AFB1的IC50和COS对细胞的无损害作用浓度,重新设置AFB1和COS作用浓度,测定它们对细胞存活率的影响。取对数期的细胞制备密度为5×103个/mL的细胞悬液,接种于96孔板中(100 μL /孔),培养24 h后加入重新设定的各浓度组的COS工作液(0、10、20、40 μmol/L)预处理细胞6 h后,去除原培养液,加入AFB1工作液(0、2.5、5、10 μmol/L)继续培养24 h。培养结束后每孔加入10 μL CCK-8溶液,37 ℃孵育1 h后立即用酶标仪测定450 nm处的吸光度值,各实验组的细胞存活率按照公式(3)进行计算。
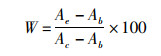 (3)
(3)
式中:W为细胞存活率,%;Ab为空白组(只含细胞工作液,无细胞)的吸光度;Ae为实验组的吸光度;Ac为对照组(无药物处理,有细胞)的吸光度。
1.5 细胞内ROS的测定试验组的设置:对照组、COS单独处理组(10、20、40 μmol/L),AFB1单独处理组(0、2.5、5、10 μmol/L)、COS预处理+AFB1处理组。将对数期的细胞密度调整为2.5×105个/mL,接种于96孔板中,200 μL /孔,培养24 h,然后加入各试验组后继续培养。培养结束后按照试剂盒说明书操作,PBS清洗1次细胞,每孔加入200 μL预热的DCFH-DA探针,培养箱中避光孵育30 min,用不含血清的DMEM培养基清洗3次去掉未结合的探针后,立即用酶标仪检测激发波长和发射波长分别为488 nm和525 nm处的DCF荧光强度值,结果用相对DCF荧光强度表示,即试验组/对照组。
1.6 细胞内氧化还原水平的测定试验组的设置:对照组、COS单独处理组(10、20、40 μmol/L),AFB1单独处理组(0、2.5、5、10 μmol/L)、COS预处理+AFB1处理组。取对数期的细胞计数后配制成密度为5×105个/mL的细胞悬液,以2 mL/孔接种于6孔板中,培养24 h后按照试验组设置加药继续培养。培养结束后在冰上进行裂解细胞的操作:用预冷的PBS清洗1次后每孔加入300 μL细胞裂解液,静置30 s,细胞刮刮下细胞,将细胞裂解悬液移至离心管中,然后4 ℃,8 000 r/min离心5 min,取上清液分装在新离心管中,置于冰槽中备用或者-80 ℃冰箱保存。在进行氧化还原指标测定前,需要测定样品的蛋白浓度。根据BCA蛋白浓度试剂盒说明书进行操作:配制标准品溶液并将样品适当稀释后,分别取20 μL置于96孔板中,每孔加入200 μL配置好的BCA工作液,混匀后置于培养箱中孵育30 min,酶标仪测定562 nm处的吸光度值,根据标准曲线,计算样品的蛋白浓度。
1.6.1 细胞内MDA含量的测定按照丙二醛(Malondialdehyde, MDA)检测试剂盒说明书进行操作,样品处理后取200 μL上清液至96孔板中,随即用酶标仪测定532 nm处的吸光度值,绘制MDA标准曲线,根据标准曲线可以计算样品MDA的含量,结果用相对MDA含量表示,即试验组/对照组。
1.6.2 细胞内SOD、GST活性的测定分别按照SOD、GST检测试剂盒说明书步骤进行操作,结果用相对SOD、GST活性表示,即试验组/对照组。
1.7 细胞凋亡率的检测试验组的设置:对照组、20 μmol/L COS单独处理组、AFB1单独处理组(5、10 μmol/L)、COS预处理+AFB1处理组。流式检测还需要设置用于调电压的阴性对照(无药物处理)、单阳1(FITC Annexin V染色)、单阳2(PI染色),收集细胞后先分别对单阳1和单阳2进行诱导凋亡处理后再进行染色。取对数期的细胞,计数后配制成密度为5×104个/mL的细胞悬液,接种于6孔板中,2 mL/孔,培养24 h后按照试验组设置加药继续培养。培养结束后按照FITC Annexin V试剂盒说明书步骤进行操作,分别收集清洗细胞后进行染色,避光分别加入5 μL FITC Annexin V和5 μL PI,室温避光孵育15 min,孵育结束后,立即用流式细胞仪检测,每个样品收集10 000个细胞进行检测分析。
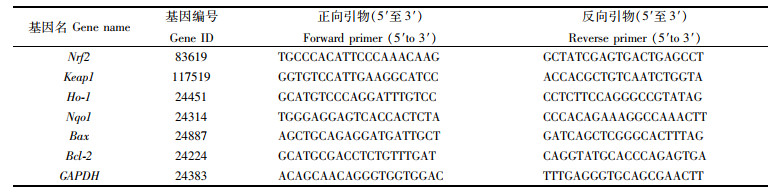
1.8 RNA的提取与实时荧光定量Real-time quantitative PCR (RT-qPCR)根据1.4~1.7节的试验结果,最终选择20 μmol/L COS和10 μmol/L AFB1处理细胞,试验组分为对照组、AFB1单独处理组、COS预处理+AFB1处理组。取对数期的细胞,计数后配制成密度为2.5×104个/mL的细胞悬液,接种于细胞培养皿中,10 mL/皿,培养24 h后按照试验组设置加药继续培养。培养结束后按照说明书步骤,全程在冰上操作,采用TRIzol法提取样本总RNA,NanoDrop® Nanodrop-2000(thermal)系统测定RNA浓度和纯度,每个RNA样品的A260/A280大于1.8,A260/A230大于2.2,再通过Bioanalyzer 2200对RNA进行质量检测,用过RNA的完整值(RIN)来判断RNA完整性。质检和完整性均合格之后,开始逆转录合成cDNA:取1~2 μg Total RNA加入离心管中,然后加4× gDNA wiper Mix(4 μL),再加RNase-free ddH2O补充至16 μL混匀后置于42 ℃孵育2 min,随后再加5× HiScript Ⅲ qRT SuperMix(4 μL),混匀后37 ℃下孵育15 min,85 ℃孵育5 s终止反应。再根据cDNA样品分别配置qPCR反应体系:取PCR管,依次加入2×Master Mix(5 μL)、Forward Primer(0.2 μL)、Reverse Primer(0.2 μL)、ROX(0.2 μL),再加水至总体积为9 μL,混匀后将该混合液加到384-PCR板对应的每个孔中,接着加入对应的cDNA(1 μL),置于PCR仪上进行qPCR反应。采用以下热循环程序进行PCR扩增:在50 ℃下孵育2 min,94 ℃预变性5 min,95 ℃解链15 s,60 ℃退火1 min,40个循环,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s,95 ℃ 15 s,并从60 ℃缓慢加热到99 ℃。引物由苏州金唯智公司完成序列的合成,引物序列如表 1所示,采用RT-qPCR检测表 1中的基因表达量,按2-ΔΔCt方法计算结果。
|
表 1 引物序列 Tab.1 The primer sequences |
试验组的设置:对照组、10 μmol/L AFB1单独处理组、COS预处理+AFB1处理组。取对数期的细胞,计数后配制成密度为2.5×104个/mL的细胞悬液,接种于细胞培养皿中,10 mL/皿,培养24 h后按照试验组设置加药继续培养。培养结束后快速用TRIzol试剂裂解并收集细胞,-80 ℃速冻后利用干冰运送,委托苏州金唯智生物科技公司进行RNA-Seq全基因组测序。
1.10 数据处理用IBM SPSS Statistic 25软件进行分析,所有数据以平均值±标准差(Mean±SD)表示,试验数据分析采用单因素ANOVA检验和Duncan氏检验进行多重比较和差异显著性检验。试验设定3~5个平行组,每个试验重复不少于3次,以P < 0.05表示存在显著性差异且具有统计学意义。
2 结果 2.1 AFB1对BRL 3A细胞的IC50由图 1可知:在浓度为0.4~250 μmol/L时,AFB1对细胞的增殖抑制呈现剂量-效应关系趋势。根据公式2计算得到AFB1对BRL 3A细胞的IC50为15.86 μmol/L。
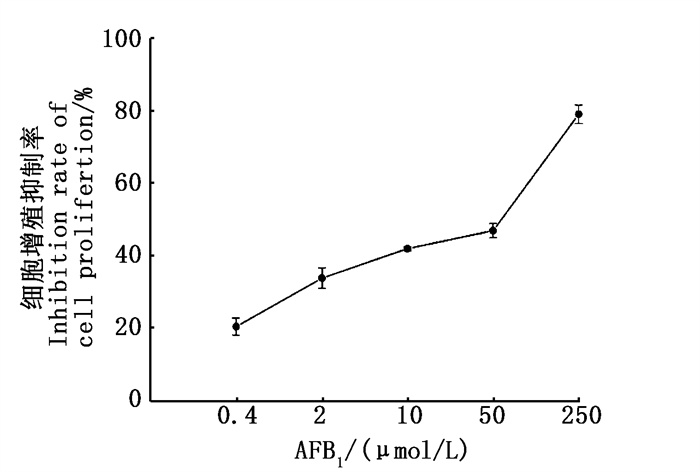
|
图 1 AFB1处理24 h对BRL 3A细胞增殖的影响 Fig. 1 Effect of AFB1 treatment for 24 h on proliferation of BRL 3A cells |
由图 2可知,COS浓度≤125 μmol/L时对细胞没有明显损伤,而COS浓度>125 μmol/L时才对细胞的增殖有抑制作用。
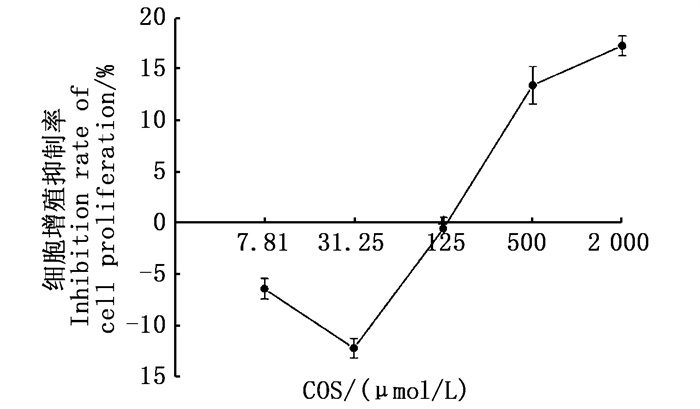
|
图 2 COS处理24 h对BRL 3A细胞增殖的影响 Fig. 2 Effect of COS treatment for 24 h on proliferation of BRL 3A cells |
如图 3所示:与无处理的对照组相比,AFB1单独处理组(2.5、5、10 μmol/L)的细胞存活率显著降低;而COS单独处理组(10、20、40 μmol/L)中除了20 μmol/L COS显著提高细胞的存活率以外(P < 0.05),其余浓度组对细胞的存活率均无显著改变。而在COS预处理+AFB1处理中,与对照组相比,COS预处理后的AFB1各浓度组的细胞存活率均显著提高(P < 0.05),且在COS预处理浓度为20 μmol/L时,产生的干预效果最好,可将被2.5、5、10 μmol/L AFB1处理的细胞存活率分别从83.89%±3.60%、79.05%±2.34%、67.96%±3.53%显著提高到102.56%±2.77%、102.24%±4.67%、95.04%±2.92%(P < 0.05);且在COS预处理浓度为20 μmol/L时,各AFB1浓度处理与无AFB1处理的细胞存活率相比没有显著性变化。因此,初步判断可以得出COS预处理对AFB1诱导的BRL 3A细胞毒性损伤有一定的缓解作用。
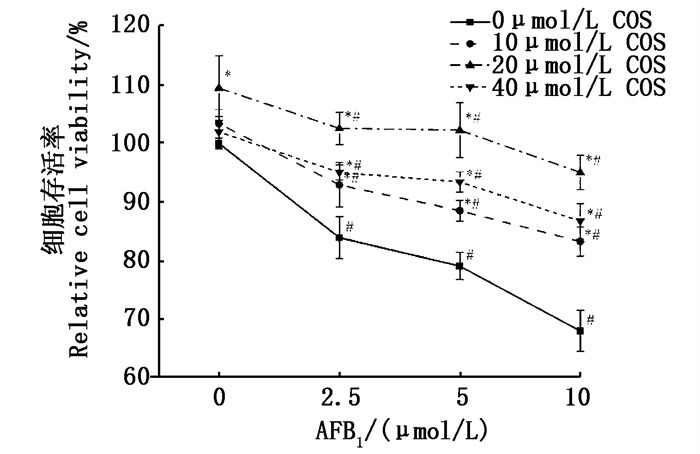
|
*表示AFB1一定浓度时,COS处理组与无COS处理组相比差异显著,P < 0.05;#表示COS一定浓度时,AFB1处理组与无AFB1处理组相比差异显著,P < 0.05。 * indicates that at a certain concentration of AFB1, the difference between the COS treatment group and the group without COS is significant, P < 0.05; # indicates that at a certain concentration of COS, the difference between the AFB1 treatment group and the group without AFB1 is significant, P < 0.05. 图 3 COS预处理对AFB1诱导BRL 3A细胞存活率的影响 Fig. 3 Effect of COS pretreatment on the survival rate of BRL 3A cells induced by AFB1 |
如图 4所示,与无药物处理对照组相比,细胞内ROS水平随AFB1浓度的增加而显著升高(P < 0.05),可分别升高到113.03%±0.28%、128.02%±4.19%、140.01%±5.20%,且COS单独处理组的ROS相对水平无显著变化。在COS预处理+AFB1处理组中,AFB1浓度为5、10 μmol/L时,10、20、40 μmol/L COS均可显著降低细胞内ROS水平(P < 0.05),其中,20 μmol/L COS预处理可将各AFB1浓度组诱导引起的ROS水平升高降至102.98%±0.25%、108.67%±3.08%、106.92%±4.33%,且20 μmol/L COS预处理可将2.5 μmol/L AFB1组诱导引起的BRL 3A细胞内升高的ROS水平恢复到正常水平。
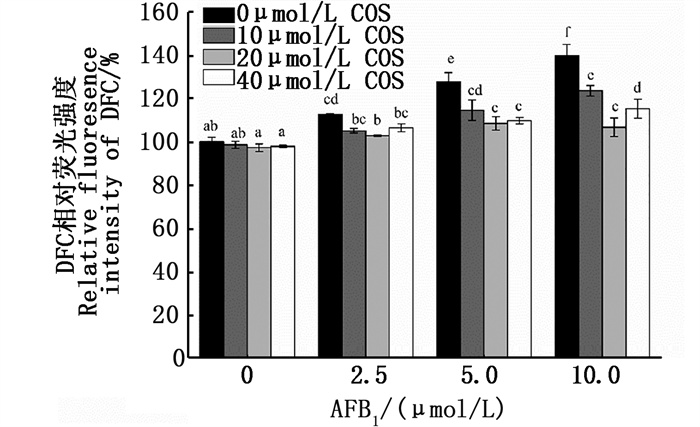
|
小写字母不同,表示具有显著差异(P < 0.05)。 Different lowercase letters indicate significant differences(P < 0.05). 图 4 COS预处理对AFB1诱导BRL-3A细胞ROS含量的影响 Fig. 4 Effect of COS pretreatment on AFB1-induced intracellular ROS production in BRL 3A cells |
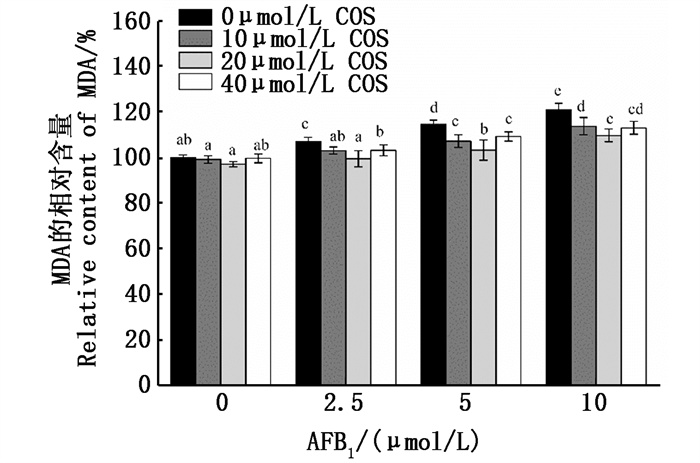
如图 5所示,与对照组相比,AFB1单独处理组可以使MDA的相对含量显著升高(P < 0.05),而COS单独处理组中MDA的相对含量与无药物处理对照组相比差异不显著。在COS预处理+AFB1处理组中,与无COS处理的对照组相比,各COS预处理组均可显著降低各AFB1诱导后细胞内的MDA含量(P < 0.05),其中20 μmol/L COS预处理效果最好,可将2.5、5、10 μmol/L AFB1处理的MDA的相对含量由107.09%±1.80%、114.62%±1.86%、121.11%±2.68%分别显著降低到99.53%±3.61%、103.30%±4.39%、109.73%±2.78 %(P < 0.05),并且在AFB1处理的浓度为2.5、5 μmol/L时,20 μmol/L COS预处理与无药物处理的对照组相比无显著差异。
|
小写字母不同,表示具有显著差异(P < 0.05)。 Different lowercase letters indicate significant differences(P < 0.05). 图 5 COS预处理对AFB1诱导BRL 3A细胞脂质过氧化的影响 Fig. 5 Effect of COS pretreatment on AFB1-induced lipid peroxidation in BRL 3A cells |
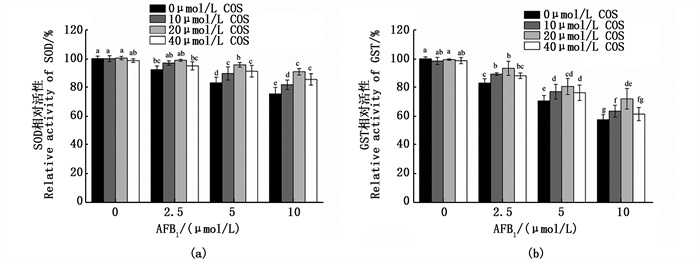
如图 6a所示,与对照组相比,随着AFB1单独处理的浓度升高,SOD的活性显著降低(P < 0.05),COS单独处理组对SOD的活力无显著改变。而在COS预处理+AFB1处理组中,当AFB1浓度为5、10 μmol/L时,各浓度COS预处理均可显著提高SOD的活性(P < 0.05),20 μmol/L COS预处理组的效果最好,可将SOD的相对活性分别由83.20%±3.87%、75.47%±4.46%显著提高到95.69%±1.60%、90.88%±2.27%(P < 0.05)。由图 6b可知:与对照组相比,AFB1单独处理组可显著降低GST的活力(P < 0.05),COS单独处理组对GST的相对活力无显著改变。在COS预处理+AFB1处理组中,当AFB1处理浓度为5 μmol/L时,各浓度的COS预处理均能显著提高GST活性(P < 0.05);与无COS对照组相比,20 μmol/L COS预处理组可显著提高各浓度AFB1处理细胞后的GST相对活性,可分别由83.14%±2.99%、70.71%±3.75%、57.72%±3.52%显著提高到93.40%±4.94%、80.75%±5.56%、72.18%±7.14%(P < 0.05)。
|
小写字母不同,表示具有显著差异(P < 0.05)。 Different lowercase letters indicate significant differences(P < 0.05). 图 6 COS预处理对AFB1诱导BRL 3A细胞SOD和GST活性的影响 Fig. 6 Effect of COS pretreatment on the activities of SOD and GST in BRL 3A cells induced by AFB1 |
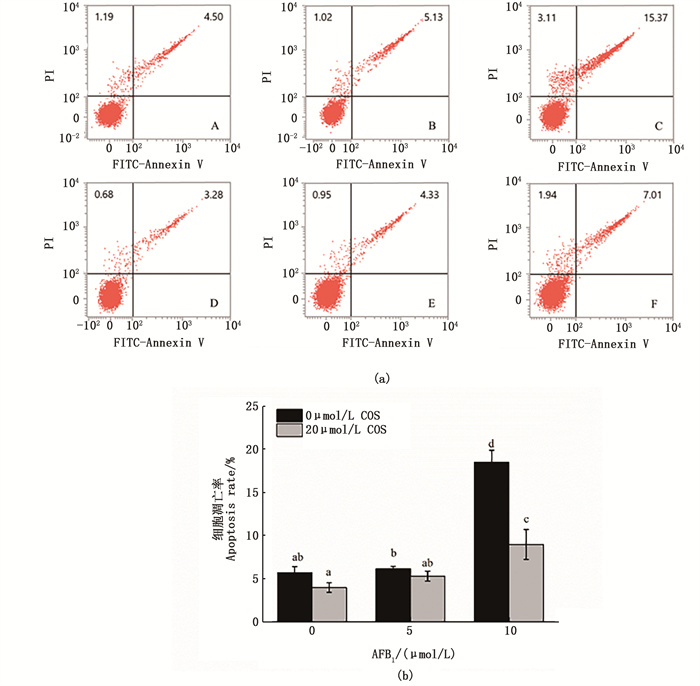
如图 7所示,从结果可以看出,20 μmol/L COS单独处理的细胞凋亡率与无处理对照组相比无显著变化,10 μmol/L AFB1单独处理组的细胞凋亡率相比于无处理对照组显著升高,而经过20 μmol/L COS预处理后显著降低了细胞的凋亡率,可以将10 μmol/L AFB1诱导BRL 3A细胞的凋亡率从18.48%±1.40%显著降低到8.95%±1.75%。
|
A. 对照组; B. 5 μmol/L AFB1单独处理组; C. 10 μmol/L AFB1单独处理组;D. 20 μmol/L COS单独处理组; E. 20 μmol/L COS预处理+5 μmol/L AFB1处理组; F. 20 μmol/L COS预处理+5 μmol/L AFB1处理组。 A. control group; B. 5 μmol/L AFB1 single treatment group; C. 10 μmol/L AFB1 single treatment group; D. 20 μmol/L COS single treatment group; E. 20 μmol/L COS Pretreatment + 5 μmol/L AFB1 treatment group; F. 20 μmol/L COS pretreatment + 5 μmol/L AFB1 treatment group. 图 7 COS预处理对AFB1诱导BRL 3A细胞凋亡的影响 Fig. 7 Effect of COS pretreatment on apoptosis of BRL 3A cells induced by AFB1 |
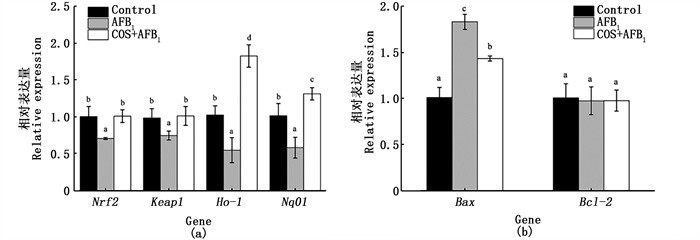
基于以上研究结果,为了研究COS预处理干预AFB1诱导细胞凋亡和氧化应激的可能机制,通过RT-qPCR检测了氧化应激和细胞凋亡相关基因mRNA的表达情况。Keap1-Nrf2通路是细胞最重要的内源性抗氧化通路,Nrf2作为细胞对抗氧化应激的关键转录因子,其作用机制是在胞质中与Keap1(Kelch-like ECH-associated protein 1)蛋白解离,转移到细胞核与抗氧化应答元件ARE(Antioxidant Response Element)结合,然后启动下游Ⅱ相代谢酶的高效表达,如NAD(P)H: (醌受体)氧化还原酶1(NAD(P)H: quinone acceptor oxidoreductase 1, NQO1)、酶血红素加氧酶-1(heme oxygenase-1, HO-1)、SOD、CAT等。Keap1和Nrf2是Nrf2信号通路的核心基因,Nrf2转录调节Nqo1和Ho-1基因;Bax和Bcl-2基因分别参与促进细胞凋亡和抑制细胞凋亡。如图 8a所示,结果表明AFB1显著降低了Nrf2信号通路和细胞凋亡相关基因mRNA的表达(P < 0.05),而COS预处理能够将基因Keap1和Nrf2的mRNA相对表达水平恢复至正常水平,并显著促进下游基因Nqo1和Ho-1的mRNA表达;此外,如图 8b,COS预处理还可以显著降低AFB1诱导引起的促凋亡基因Bax的mRNA相对表达量的升高。基于以上试验结果,推测COS可能通过激活Nrf2信号通路来启动通路下游的Ⅱ相代谢酶的表达,从而提高细胞自身的抗氧化能力来缓解AFB1诱导引起的细胞氧化损伤,同时可能调节Bax基因的表达来缓解AFB1诱导引起的细胞凋亡。
|
小写字母不同,表示具有显著差异(P < 0.05)。 Different lowercase letters indicate significant differences(P < 0.05). 图 8 COS预处理对AFB1诱导BRL 3A细胞氧化应激和凋亡相关基因表达的影响 Fig. 8 Effects of COS pretreatment on gene expression of oxidative stress and apoptosis in BRL 3A cells induced by AFB1 |
细胞内维持正常生理功能和稳态通常与多种代谢途径、信号通路和基因表达有关,为进一步研究COS预处理对AFB1诱导细胞毒性损伤干预作用的可能机制,通过RNA-seq测序来研究COS和AFB1处理细胞后基因的差异表达情况和富集情况,研究可能参与了COS干预作用的信号通路。
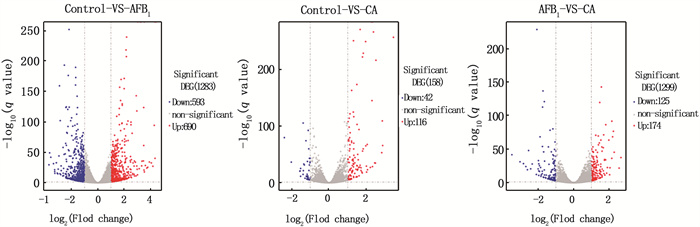
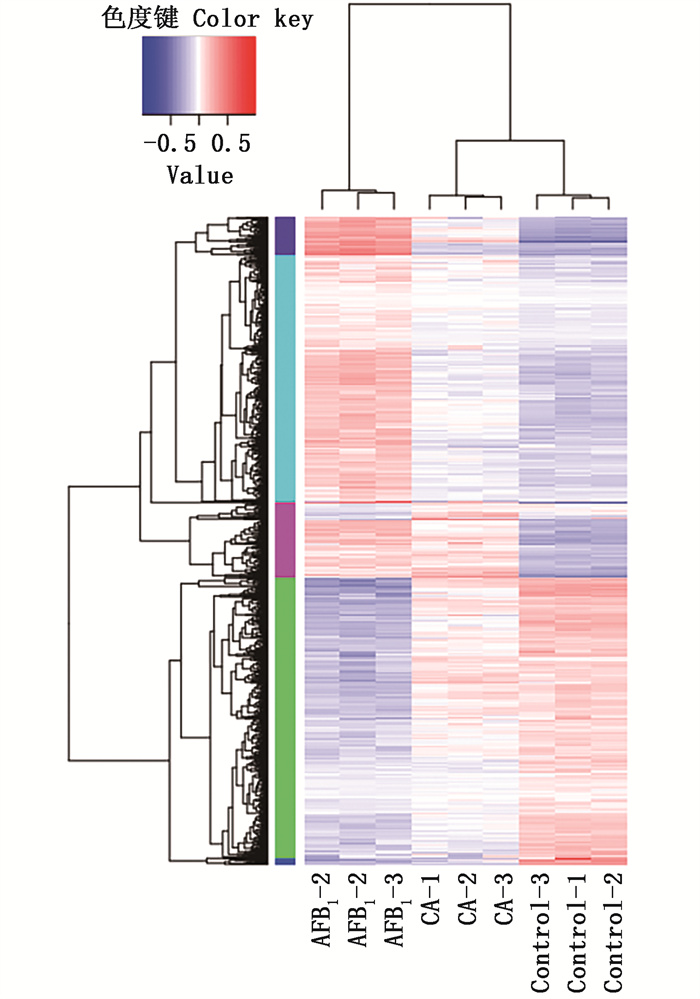
2.9.1 差异基因表达的筛选及其聚类分析通过RNA-seq测序,进行了3组样品的对比分析,使用FPKM(Fragments Per Kilo bases per Million reads)方法计算每组比对样品中的基因表达量,通过比较每组样本之间的基因表达量从而筛选出差异表达的基因,其中组间差异基因表达如图 9所示。与对照组(Control组)相比,AFB1单独处理组(AFB1组)中有690个基因表达上调,593个基因表达下调;COS预处理+AFB1处理组(CA组)中有116个基因表达上调,42个基因表达下调;与AFB1组处理组相比,CA组有174个基因表达上调,125个基因表达下调。差异基因表达聚类图如图 10,颜色从蓝到红,表示基因表达量越高,从整体图可以看出,COS可以缓解由AFB1诱导引起的基因表达差异性的上下调。
|
图 9 3组比较样本差异基因表达统计分析 Fig. 9 Statistical analysis of differential gene expression among 3 groups of comparative samples |
|
图 10 3组样本的差异基因表达层次聚类分析 Fig. 10 Hierarchical cluster analysis of differential gene expression in 3 groups of samples |
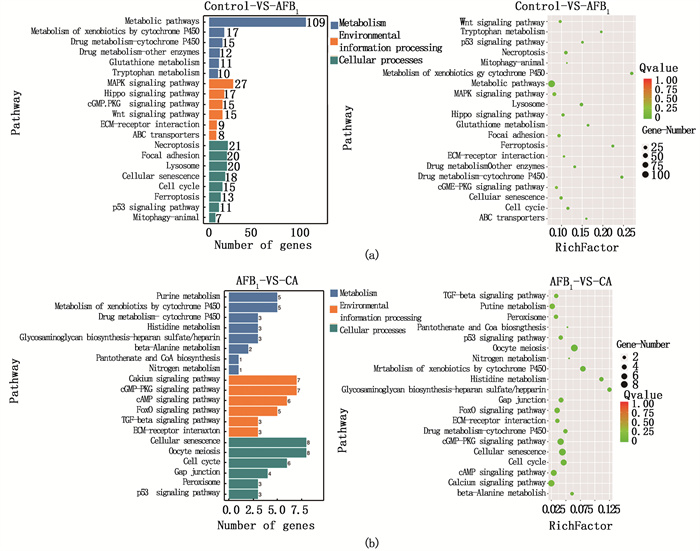
通过Pathway显著性富集能确定差异表达基因参与的最主要生化代谢途径和信号转导途径,使用KEGG(Kyoto Encyclopedia of Genes and Genomes)公共数据库对富集出的差异表达基因做Pathway富集分析,以KEGG Pathway为单位,应用超几何检验,找出与整个基因组背景相比,在差异表达基因中显著性富集的Pathway。结果显示,AFB1诱导细胞可以引起细胞多个通路途径的基因差异表达,特别是代谢作用的相关通路,为了有针对性地研究COS发挥干预作用的可能途径,主要分析差异表达基因富集到代谢作用、细胞过程和环境信息传递通路的具体情况,结果如图 11所示。发现AFB1刺激细胞后,差异表达基因较多的富集到代谢途径(Metabolic pathways),其中差异极显著的有细胞色素P450对外源物质的代谢作用(Metabolism of xenobiotics by cytochrome P450)、药物代谢-细胞色素P450(Drug metabolism-cytochrome P450)和谷胱甘肽代谢(Glutathione metabolism)(P < 0.01),其次是p53、MAPK和Hippo信号通路(P < 0.05),这些通路的差异表达基因可能参与了AFB1诱导的细胞生长抑制和凋亡。图 12b中,CA组相比于AFB1组的差异表达基因显著富集到细胞色素P450对外源物质的代谢作用(P < 0.01)、药物代谢-细胞色素P450(P < 0.01)、和p53信号通路(P < 0.05),这些Pathway可能与COS预处理对细胞的保护作用有关。
|
图 11 差异表达基因的KEGG富集分析 Fig. 11 KEGG enrichment analysis of differentially expressed genes |
曲霉菌属可以在适当的自然条件下生长并产毒,增加了控制AFB1污染食品和粮食的难度,人和动物也不可避免的通过饮食摄入AFB1进而造成肝脏损伤。AFB1在没有经过代谢活化之前无致癌毒性,其主要是通过肝脏中细胞色素P450酶系统(CYP450)生物转化形成致癌的活性中间体AFB1-8, 9-环氧化物(AFB1-8, 9-epoxide, AFBO)来发挥毒性作用[21]。
AFB1诱导的大鼠肝细胞毒性损伤可能与其刺激细胞生化代谢和氧化应激有关,AFB1通过细胞的CYP450生物转化为毒性中间体AFBO,再进一步刺激细胞内各种代谢途径和信号通路,同时抑制细胞自身的抗氧化防御系统来诱导大鼠肝细胞的氧化应激,进而诱导细胞凋亡。COS预处理能在一定程度上缓解AFB1对细胞的毒性损伤,其可能激活了Nrf2信号通路来提升内源性抗氧化剂的生成能力,进而缓解AFB1诱导细胞引起的氧化应激。Nrf2信号通路是最重要的内源性抗氧化应激通路之一,对调节机体氧化应激方面有着重要作用,早期的研究中,LUO等[22]通过敲除Nrf2基因发现COS的抗氧化能力与Nrf2的转录激活诱导的Ho-1、Nqo1和Sod等抗氧化基因有关,同时COS还抑制了p38mapk、JNK和ERK的磷酸化,其研究表明COS通过Nrf2活化和MAPK磷酸化的降低来保护乙醇诱导L02细胞的氧化应激。试验进一步的RNA-seq研究结果显示:AFB1可能激活p53、MAPK和Hippo信号通路来帮助其抑制细胞的生长和促进细胞凋亡;而COS也可能通过细胞色素P450对外源物质的代谢作用途径、药物代谢-细胞色素P450途径和p53信号通路来帮助其干预AFB1的毒性损伤。以上结果表明COS预处理可以缓解AFB1诱导大鼠肝细胞的毒性损伤,然而,该研究尚处于初始阶段,需要更进一步研究COS发挥干预作用的作用靶点和具体机制;此外,体外试验的结果还需要设计相关体内试验进行验证,并研究COS在动物模型中干预作用的具体情况及相关机制。
| [1] |
JEANNOT E, BOORMAN G A, KOSYK O, et al. Increased incidence of aflatoxin B1-induced liver tumors in hepatitis virus C transgenic mice[J]. International Journal of Cancer, 2012, 130(6): 1347-1356. DOI:10.1002/ijc.26140 |
| [2] |
RODA E, COCCINI T, ACERB D, et al. Comparative in vitro and ex-vivo myelotoxicity of aflatoxins B1 and M1 on haematopoietic progenitors (BFU-E, CFU-E, and CFU-GM): species-related susceptibility[J]. Toxicology in Vitro, 2010, 24(1): 217-223. DOI:10.1016/j.tiv.2009.09.005 |
| [3] |
GOLLI-BENNOUR E E, KOUIDHI B, BOUSLIMI A, et al. Cytotoxicity and genotoxicity induced by aflatoxin B1, ochratoxin A, and their combination in cultured Vero cells[J]. Journal of Biochemical and Molecular Toxicology, 2010, 24(1): 42-50. DOI:10.1002/jbt.20310 |
| [4] |
CORCUERA L A, ARBILLAGA L, VETTORAZZI A, et al. Ochratoxin A reduces aflatoxin B1 induced DNA damage detected by the comet assay in Hep G2 cells[J]. Food and Chemical Toxicology, 2011, 49(11): 2883-2889. DOI:10.1016/j.fct.2011.07.029 |
| [5] |
NONE. IARC monographs on the evaluation of carcinogenic risk to humans, Vol. 56, some naturally occurring substances: Food items and constituents, heterocyclic aromatic amines and mycotoxins: IARC, Lyon, 1993 (ISBN 92-832-1256-8). 599 pp. Price SF 95.00[J]. Analytica Chimica Acta, 1994, 294(3): 341.
|
| [6] |
ABDEL-HAMID A A M, FIRGANY A E D L. Vitamin E supplementation ameliorates aflatoxin B1-induced nephrotoxicity in rats[J]. Acta Histochemica, 2015, 117(8): 767-779. DOI:10.1016/j.acthis.2015.08.002 |
| [7] |
MANNAA F A, ABDEL-WAHHAB K G, ABDEL-WAHHAB M A. Prevention of cardiotoxicity of aflatoxin B1 via dietary supplementation of papaya fruit extracts in rats[J]. Cytotechnology, 2014, 66(2): 327-334. DOI:10.1007/s10616-013-9579-x |
| [8] |
SUPRIYA C, REDDY P S. Prenatal exposure to aflatoxin B1: developmental, behavioral, and reproductive alterations in male rats[J]. The Science of Nature, 2015, 102(5/6): 26. |
| [9] |
MURAD A F, AHMED S, ABEAD S. Toxicity effect of aflatoxin B1 on reproductive system of albino male rats[J]. Pakistan Journal of Biological Sciences, 2015, 18(3): 107-114. DOI:10.3923/pjbs.2015.107.114 |
| [10] |
CHENG L H, QIN Y S, HU X, et al. Melatonin protects in vitro matured porcine oocytes from toxicity of Aflatoxin B1[J]. Journal of Pineal Research, 2019, 66(4): e12543. DOI:10.1111/jpi.12543 |
| [11] |
BAHEY N G, ABD ELAZIZ H O, GADALLA K K S. Toxic effect of aflatoxin B1 and the role of recovery on the rat cerebral cortex and hippocampus[J]. Tissue and Cell, 2015, 47(6): 559-566. DOI:10.1016/j.tice.2015.09.001 |
| [12] |
ZHENG N, ZHANG H, LI S L, et al. Lactoferrin inhibits aflatoxin B1-and aflatoxin M1-induced cytotoxicity and DNA damage in Caco-2, HEK, Hep-G2, and SK-N-SH cells[J]. Toxicon, 2018, 150: 77-85. DOI:10.1016/j.toxicon.2018.04.017 |
| [13] |
LI S H, MUHAMMAD I, YU H X, et al. Detection of Aflatoxin adducts as potential markers and the role of curcumin in alleviating AFB1-induced liver damage in chickens[J]. Ecotoxicology and Environmental Safety, 2019, 176: 137-145. DOI:10.1016/j.ecoenv.2019.03.089 |
| [14] |
NGO D H, VO T S, NGO D N, et al. Biological effects of chitosan and its derivatives[J]. Food Hydrocolloids, 2015, 51: 200-216. DOI:10.1016/j.foodhyd.2015.05.023 |
| [15] |
ISMAIL S A. Microbial valorization of shrimp byproducts via the production of thermostable chitosanase and antioxidant chitooligosaccharides[J]. Biocatalysis and Agricultural Biotechnology, 2019, 20: 101269. DOI:10.1016/j.bcab.2019.101269 |
| [16] |
XIE C Y, WU X, LONG C M, et al. Chitosan oligosaccharide affects antioxidant defense capacity and placental amino acids transport of sows[J]. BMC Veterinary Research, 2016, 12: 243. DOI:10.1186/s12917-016-0872-8 |
| [17] |
JIANG Z W, HAN B Q, LI H, et al. Preparation and anti-tumor metastasis of carboxymethyl chitosan[J]. Carbohydrate Polymers, 2015, 125: 53-60. DOI:10.1016/j.carbpol.2015.02.039 |
| [18] |
JU Y Y, HUANG Y Y, XIAO M T, et al. Hypolipidaemic and antioxidant activities of chito-oligosaccharides in hyperlipidaemic rats induced by high-fat diet[J]. Maejo International Journal of Science and Technology, 2019, 13(1): 72-81. |
| [19] |
QU D F, HAN J Z. Investigation of the antioxidant activity of chitooligosaccharides on mice with high-fat diet[J]. Revista Brasileira de Zootecnia, 2016, 45(11): 661-666. DOI:10.1590/s1806-92902016001100004 |
| [20] |
HUANG H C, HONG L, CHANG P, et al. Chitooligosaccharides attenuate Cu2+-induced cellular oxidative damage and cell apoptosis involving Nrf2 activation[J]. Neurotoxicity Research, 2015, 27(4): 411-420. DOI:10.1007/s12640-014-9512-x |
| [21] |
RUSHING B R, SELIM M I. Aflatoxin B1: a review on metabolism, toxicity, occurrence in food, occupational exposure, and detoxification methods[J]. Food and Chemical Toxicology, 2019, 124: 81-100. DOI:10.1016/j.fct.2018.11.047 |
| [22] |
LUO Z G, DONG X X, KE Q, et al. Chitooligosaccharides inhibit ethanol-induced oxidative stress via activation of Nrf2 and reduction of MAPK phosphorylation[J]. Oncology Reports, 2014, 32(5): 2215-2222. DOI:10.3892/or.2014.3463 |
2. Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China;
3. Laboratory of Quality & Safety Risk Assessment for Aquatic Product on Storage and Preservation, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


