虾青素(Astaxanthin) 即3, 3′-二羟基-4, 4′-二酮基-β, β′-胡萝卜素, 是一种含有酮基的脂溶性含氧类胡萝卜素[1],具有抗癌、降血压、增强免疫力及促进水产动物生长繁殖的作用,而且着色效果显著[2-4]。虾青素极易与自由基反应,可有效清除体内的活性氧,具有极强的抗氧化活性,其淬灭活性氧和清除自由基的能力均显著高于β-胡萝卜素和VE[5]。因此,在食品、保健品等多领域有着较大的应用价值和广阔的开发前景。
藻类、菌类及甲壳类动物是虾青素的主要来源。很多甲壳类动物体内均含有数量可观的虾青素,如虾体的黄色、蓝色或紫色都是源自虾青素与蛋白质的复合物,而这种复合物主要存在于虾壳中。全球每年产生600万~800万t甲壳类废弃物,相当于捕捞贝类总质量的20%~50%[6]。然而占虾青素原料70%~85%的虾壳或蟹壳一般作为废弃物丢弃,回收利用较少,造成对资源的浪费。因此,亟需探索简单方便且有效提取虾壳中虾青素的方法,以提高虾壳资源的综合利用率。
虾青素常见的提取方法包括碱提法[7]、酶解法[8]、有机溶剂浸提法[9]、超临界CO2法[10]等。杜云建等[11]采用低温稀碱浸提法,从虾壳中浸提天然虾青素的提取率为9.31%。这种方法,操作工艺简单,但是在实验过程中消耗了大量的酸碱,其废水对环境污染严重。此外,虾青素的提取过程中酸碱的使用造成了部分虾青素的氧化降解。因此,近几年来,酸碱法提取虾青素正被其他方法取代。酶法常用在藻类和鲜虾中虾青素的提取,张晔等[12]采用纤维素酶、果胶酶以及复合酶对雨生红球藻进行破壁,用甲醇浸提虾青素,虾青素提取率达到71.08%。谈俊晓等[13]以冷冻南极磷虾为原料,采用Alcalase碱性蛋白酶和木瓜蛋白酶复合酶解方法,以无水乙醇为提取剂提取虾青素,在优化条件下虾青素提取率为90.42%。酶法提取虽然操作简单,污染小,但生物酶制剂价格较高,且酶解耗费时间长。超临界CO2法是一种绿色安全的萃取分离方法,主要适用于非极性和分子质量小于500的化合物的提取,若将其应用于极性或者分子量较大的化合物时,则需要加入夹带剂来增加化合物在CO2中的溶解度,夹带剂一般选择醇类、酮类等有机溶剂。虾青素分子质量为596.84,因此在使用超临界CO2法浸提时,需要使用大量有机溶剂作为夹带剂,并且整个提取过程在高压及密封环境中进行。同时,在浸提结束后,原料的一些残留物会附着在反应釜内部,造成清洁困难及仪器损伤,并且仪器后期维护费用较高,故使得仪器设备投资资金成本高昂,因此产业化尚有一段距离。
本文利用有机溶剂浸提法提取罗氏沼虾、南极磷虾和凡纳滨对虾虾壳中虾青素,比较3种虾类在不同工艺条件下的虾青素提取率,并通过正交试验优化南极磷虾虾壳中虾青素提取的最佳工艺。同时,对3种虾类虾壳中虾青素的抗氧化性也进行分析,以期为虾壳废弃物的综合利用提供理论依据。
1 材料与方法 1.1 材料与仪器罗氏沼虾和凡纳滨对虾,购于上海市浦东新区新芦苑集贸市场;南极磷虾由辽宁省大连海洋渔业集团公司提供,冷冻方式运到实验室并在-50 ℃冰柜中贮藏;虾青素标准品(纯度≥98%),购于上海源叶生物有限公司;二氯甲烷、无水乙醇、乙酸乙酯等,均为分析纯,购于国药集团。
主要仪器:ME104E型电子天平,上海梅特勒-托利多仪器有限公司;UV-1800PC紫外可见分光光度计,上海美谱达仪器有限公司;DHG-9023型电热恒温鼓风干燥箱,上海三发科学仪器有限公司;W2-100SP型旋转蒸发仪,上海申生科技有限公司;HWS-24型恒温水浴锅,上海慧泰仪器制造有限公司;FTIR-650型傅里叶红外光谱仪,天津港东科技发展股份有限公司。
1.2 标准曲线的绘制准确称取2.5 mg虾青素标准样品,用二氯甲烷溶解并配成浓度分别为2、4、6、8和10 μg/mL的虾青素标准溶液,编号1~5备用。以二氯甲烷为空白,取1号对照品溶液在200 ~ 800 nm处测其吸光度,确定最大吸收波长为486 nm。在最大吸收波长下,分别测量各个对照品溶液的吸光度(A值)。以虾青素的浓度为横坐标、A值为纵坐标,制作标准曲线。
1.3 不同因素对虾青素提取率的影响将罗氏沼虾、南极磷虾及凡纳滨对虾虾壳剥离去肉清洗干净并沥干后,放入50 ℃的烘箱中烘干,称量;将干虾壳放入万能粉碎机中粉碎,并过100目筛网,得到粗细均匀的粉末,于-20 ℃下贮藏备用。
1.3.1 有机溶剂种类对虾青素提取率的影响分别称取0.5 g罗氏沼虾、南极磷虾及凡纳滨对虾虾壳粉于50 mL离心管中,向其中分别加入10 mL丙酮、无水乙醇、石油醚,二氯甲烷及甲醇于30 ℃水浴条件下浸提3 h后旋转蒸发,二氯甲烷定容到50 mL后在486 nm处测定吸光度值,计算虾壳中虾青素的提取率,实验设计3组平行。
1.3.2 料液比对虾青素提取率的影响分别称取0.5 g罗氏沼虾、南极磷虾及凡纳滨对虾虾壳粉15份于50 mL离心管中,按照1∶10、1∶20、1∶30、1∶40、1∶50的料液比(g/mL)分别加入二氯甲烷溶液,于30 ℃水浴条件下浸提3 h后旋转蒸发,二氯甲烷定容到50 mL后在486 nm处测定吸光度值,计算虾壳中虾青素的提取率。
1.3.3 提取温度对虾青素提取率的影响分别称取0.5 g罗氏沼虾、南极磷虾及凡纳滨对虾虾壳粉15份于50 m L离心管中,加入10 mL二氯甲烷后分别置于10、20、30、40、50 ℃水浴中浸提3 h后二氯甲烷定容到50 mL后于486 nm处测定吸光度值,计算虾壳中虾青素的提取率。
1.3.4 提取时间对虾青素提取率的影响取样和前处理同上,加入10 mL二氯甲烷后置于30 ℃水浴中,分别在1.5、2.0、2.5、3.0、3.5 h后各取出3组并测定,计算虾青素提取率。
1.4 含量计算方法虾青素含量参考张晓燕等[14]的计算方法:
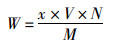 (1)
(1)
式中:W为虾青素提取率,μg/g;x为虾青素质量浓度,μg/mL;V为虾青素粗提液体积,mL;N为稀释的倍数,本试验中为10;M为虾壳干质量,g。
1.5 正交试验优化根据单因素试验的结果,以南极磷虾虾青素提取率为考察指标,进行三因素三水平正交优化试验。选取料液比(1∶20、1∶30、1∶40),提取时间(1.5、2.0、2.5 h)以及提取温度(25、30、35 ℃)确定南极磷虾虾青素提取的最佳工艺参数并验证。
1.6 虾青素红外吸收光谱的测定参考吴娇等[15]的方法,取少量KBr粉末于研钵中充分研磨,均匀铺平于压片模具中,压片40 s左右,制成溴化钾片。取少量配置好的0.1 mg/mL的虾青素标准品溶液均匀滴加在溴化钾片上,置于红外光谱仪中检测。虾青素样品的检测方法同上,将虾青素样品与标准品的红外光谱图进行对比与分析。
1.7 虾青素抗氧化性的研究将虾青素提取单因素实验的结果作为3种虾壳的有机溶剂提取的工艺条件。在此工艺条件下浸提得到虾青素二氯甲烷提取液,经旋转蒸发,并用无水乙醇溶液复溶,制得浓度分别为10、20、40、60、80 μg/mL虾青素无水乙醇溶液,备用。
1.7.1 清除DPPH自由基能力的测定实验采用比色法[16]测定虾青素清除DPPH自由基的能力。分别移取1 mL不同浓度的虾青素溶液于20 mL试管中,加入1 mL 0.2 mmol/L的DPPH溶液,充分振荡摇匀,室温下避光反应30 min 后倒入比色皿中,在波长为517 nm下测定吸光度并记录吸光值为A2。移取1 mL无水乙醇于20 mL试管中代替虾青素溶液,测定吸光度值为A1。以1 mL无水乙醇代替DPPH溶液,测定吸光度值为A0。实验设计3组平行,清除率按照下式进行计算:
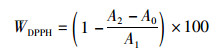 (2)
(2)
式中:WDPPH为DPPH的清除率,%;A0为无水乙醇与虾青素在517 nm处的吸光度;A1为无水乙醇与DPPH溶液在517 nm处的吸光度;A2为虾青素与DPPH溶液在517 nm处的吸光度。
1.7.2 羟基自由基清除能力的测定根据袁磊等[17]的方法略作修改。分别取10、20、40、60、80 μg / mL虾青素乙醇溶液1 mL于试管中,在其中依次加入1 mL 9 mmol/L的硫酸亚铁溶液,1 mL 9 mmol/L的水杨酸-乙醇溶液,最后加入8.8 mmol/L的H2O2,充分混匀后于避光37 ℃恒温水浴反应20 min,在510 nm波长处测定吸光度(A2); 用去离子水代替虾青素溶液测定吸光度(A1); 用去离子水代替过氧化氢溶液测定吸光度(A0)。实验设置3组平行,计算公式:
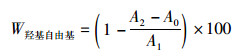 (3)
(3)
式中:W羟基自由基为羟基自由基清除率,%;A0为去离子水代替过氧化氢溶液测定吸光度;A1为去离子水代替虾青素溶液测定吸光度;A2为虾青素与硫酸亚铁、水杨酸、过氧化氢在510 nm处的吸光度。
1.7.3 铁离子还原能力的测定采用碧云天总抗氧化能力检测试剂盒(FRAR法)进行铁离子还原能力的测定实验。实验设计3组平行,样品的铁离子还原能力(FRAP值)以达到同样吸光度所需要的FeSO4的浓度(mmol/L)表示。FRAP值越大则铁还原能力越强。
1.8 数据分析采用SPSS 24.0软件设计正交表并进行正交试验,在单因素方差分析(ANOVA)的基础上采用Duncan氏多重比较,取P < 0.05为差异显著,运用Origin 9.1软件作图。
2 结果与分析 2.1 虾青素标准曲线图在二氯甲烷最大吸收波长486 nm处测得虾青素各梯度标准溶液的吸光值,得标准曲线方程为
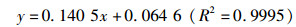 (4)
(4)
式中:x为虾青素质量浓度,μg/mL;y为溶液吸光度A。线性回归相关系数显著,表明虾青素在0~10 μg/mL质量浓度范围内具有线性关系。
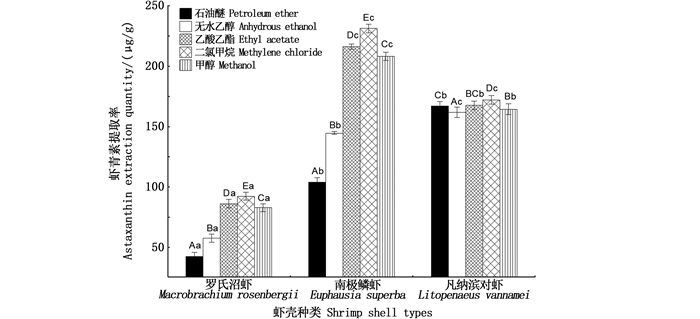
2.2 虾青素提取单因素实验结果 2.2.1 有机溶剂种类对虾青素提取率的影响由图 1可知,不同有机溶剂对3种虾壳中虾青素的提取效果存在差异,而不同溶剂对凡纳滨对虾虾青素提取率的影响最为稳定。使用石油醚浸提虾壳中虾青素时,凡纳滨对虾的虾青素提取率显著高于南极磷虾和罗氏沼虾,分别为172.21、103.96、42.40 μg/g。在不同有机溶剂中,二氯甲烷浸提南极磷虾和罗氏沼虾虾壳得到的虾青素提取率明显高于无水乙醇、甲醇、乙酸乙酯和石油醚。另外,由图 1可知,南极磷虾及凡纳滨对虾虾壳中的虾青素的提取率显著高于罗氏沼虾中虾青素的提取率。
|
柱状图上方含不同小写字母代表组内差异显著,不同大写字母代表组间差异显著。 Different lowercase letters on the top of the bar represent significant differences within groups, while different uppercase letters represent significant differences between groups. 图 1 有机溶剂种类对虾青素提取率的影响 Fig. 1 Influence of organic solvent types on extraction yield of astaxanthin |
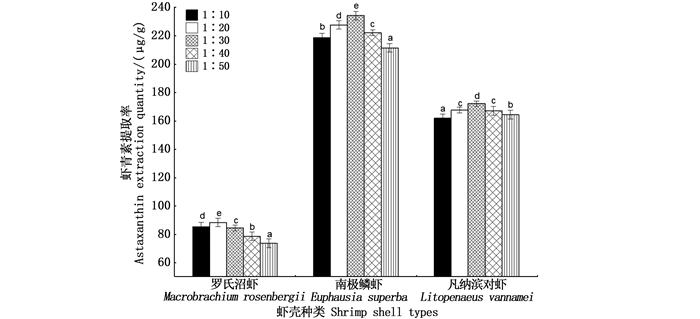
由图 2可看出,不同比例的料液比对虾青素提取效果均有显著影响。当料液比为1∶30 g/mL时南极磷虾和凡纳滨对虾的提取率达到了最大值,分别为234.72和172.21 μg/g;而当料液比为1∶20 g/mL时罗氏沼虾虾青素的提取率达到最大值88.69 μg/g。因此,确定1∶30 g/mL为南极磷虾及凡纳滨对虾的最适料液比,1∶20 g/mL为罗氏沼虾的最适料液比。
|
柱状图上方含不同字母代表差异显著(P < 0.05)。 Different letters above the bars indicate significant differences(P < 0.05). 图 2 料液比对虾青素提取率的影响 Fig. 2 Effect of material to liquid ratio on extraction yield of astaxanthin |
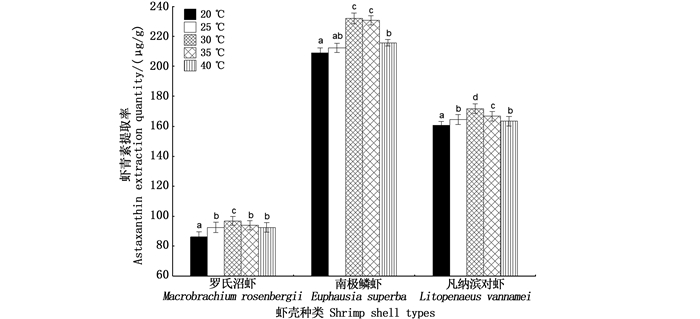
由图 3可知,不同提取温度对3种虾壳虾青素提取率均表现出显著影响。随着提取温度的升高,3种虾壳虾青素提取率均呈现先上升后下降的趋势,且均在提取温度为30 ℃条件下,达到最高提取率,分别为97.01、232.28和172.07 μg/g。因此,确定30 ℃为罗氏沼虾、南极磷虾及凡纳滨对虾的最适虾青素提取温度。
|
柱状图上方含不同字母代表差异显著(P < 0.05)。 Different letters above the bars indicate significant differences(P < 0.05). 图 3 提取温度对虾青素提取率的影响 Fig. 3 Influence of extraction temperature on the extraction yield of astaxanthin |
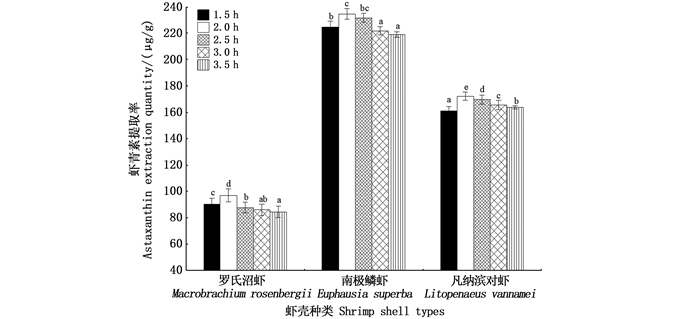
由图 4可知,浸提时间对3种虾壳中虾青素的提取率均有显著影响。当浸提时间低于2 h时,虾壳中的虾青素与有机溶剂接触时间较短,未能达到较好的溶出效率,因此虾青素提取率较低。随着提取时间的延长,虾壳中虾青素提取率随之增高,在2 h时虾青素提取率达到最高,罗氏沼虾、南极磷虾、凡纳滨对虾分别为97.01、234.48和172.21 μg/g。之后,随着浸提时间的增加,虾青素含量呈明显下降的趋势,这是因为虾青素的不稳定性决定了提取时间不宜过长。
|
柱状图上方含不同字母代表差异显著(P < 0.05)。 Different letters above the bars indicate significant differences(P < 0.05). 图 4 提取时间对虾青素提取率的影响 Fig. 4 Influence of extraction time on extraction yield of astaxanthin |
通过正交试验以南极磷虾的虾青素提取率为参考指标作方差分析,由表 1可知,料液比、提取温度和提取时间对南极磷虾的虾青素提取率具有显著影响(P<0.05),各因素影响不同参考指标的主次关系:C(提取时间)>A(料液比)>B(提取温度),最佳水平为A2B2C3,即料液比为1∶30、提取温度为30 ℃、提取时间为2.5 h。
|
表 1 南极磷虾提取虾青素正交试验结果 Tab.1 Orthogonal test results of astaxanthin extraction from Antarctic krill |
对正交试验结果进行验证,在料液比为1∶30(g/mL)、提取温度为30 ℃、提取时间为2.5 h的条件下用二氯甲烷提取南极磷虾虾壳中虾青素提取率为245.01 μg/g。因此,该优化条件为最佳选择。
|
表 2 方差分析表(因变量:虾青素提取率) Tab.2 ANOVA table(dependent variable: extraction yield) |
每一个化合物都有其特定的红外吸收光谱,因而可以通过红外光谱对化合物进行定性分析。由图 5可知,从提取的虾青素红外检测谱图与标准品谱图进行比较可看出,二者的官能团振动吸收峰极为相似。在波长3 400~3 600 cm-1处出现强伸缩振动吸收峰,说明提取物中含有羟基O-H;3 000~3 100 cm-1内为C=C双键结构中的C-H伸缩振动的吸收峰;2 800~3 000 cm-1间出现亚甲基的特征吸收峰,说明提取物中含有大量不饱和烃;在波长1 700 ~1 760 cm-1内出现羰基C=O强振动吸收峰,与虾青素六元环上的结构相一致;1 400 ~1 600 cm-1间出现强吸收峰,说明其为六元环不饱和C=C双键结构的伸缩振动峰;1 200 ~1 400 cm-1内出现甲基的面内弯曲振动峰;1 000~1 100 cm-1间出现C-O强特征吸收峰,说明提取物中存在虾青素酯类物质;在900 ~1 000 cm-1处出现C-H键面外弯曲振动峰,这与虾青素的共轭双键结构相符。在虾青素的提取过程中,提取条件会造成虾青素轻微氧化的发生,可导致虾青素部分吸收峰发生位移[18]。
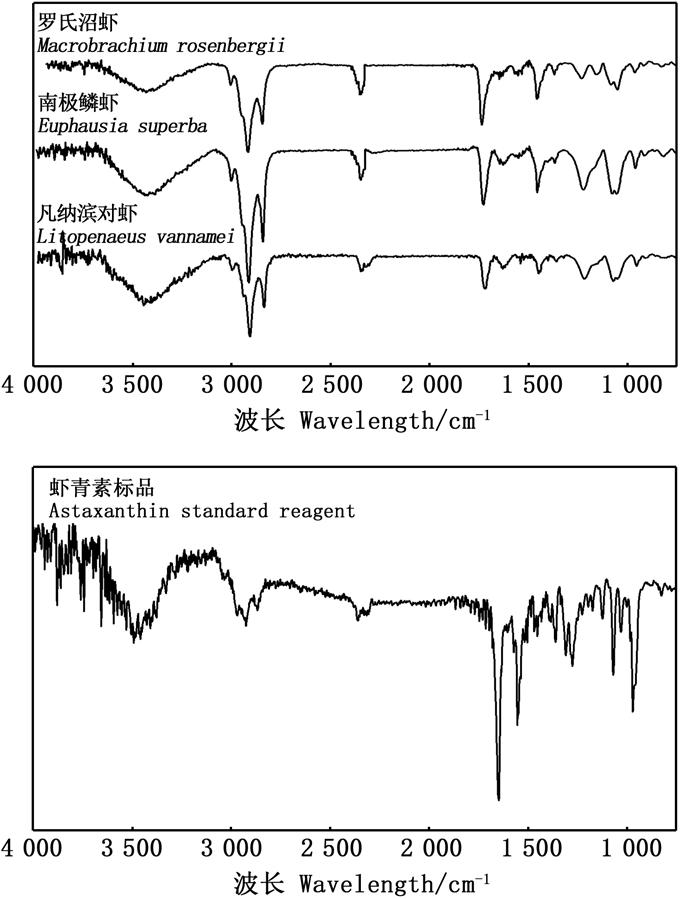
|
图 5 虾青素样品红外扫描图谱 Fig. 5 Infrared scanning spectra of astaxanthin samples |
本实验以VC为对照,对不同浓度的虾青素和VC清除DPPH自由基能力进行了比较研究。研究结果如图 6所示,随着VC和虾青素浓度的升高,其对DPPH自由基的清除能力逐渐增强。在10~80 μg/mL的浓度范围中,罗氏沼虾、南极磷虾、凡纳滨对虾及VC对DPPH的清除率分别从23.5%、15.2%、23.4%、26.6%升高到95.30%、90.00%、92.67%、95.90%。各浓度梯度下VC的自由基清除率均略高于虾青素,这个结果与尹蔷[19]等研究结果一致。由图 6还可看出,罗氏沼虾所提取的虾青素的DPPH清除率略优于凡纳滨对虾,但是没有显著差异,而两者均显著高于南极磷虾中虾青素的DPPH清除力。
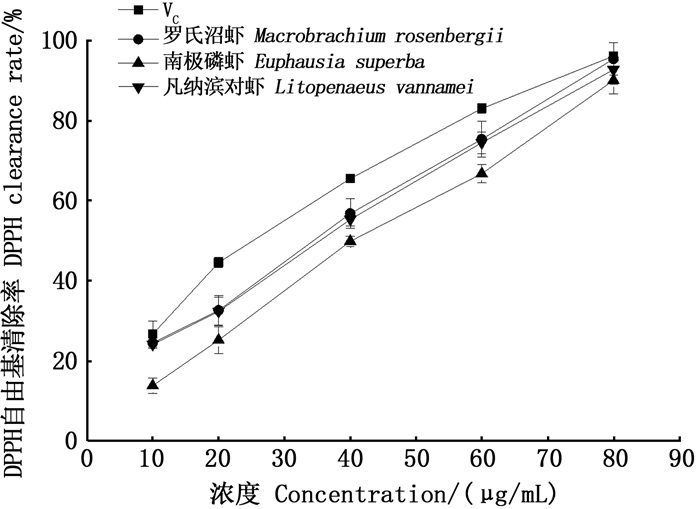
|
图 6 不同虾壳虾青素与VC对DPPH自由基的清除效果 Fig. 6 DPPH free radical scavenging effects of astaxanthin and VC in different shrimp shells |
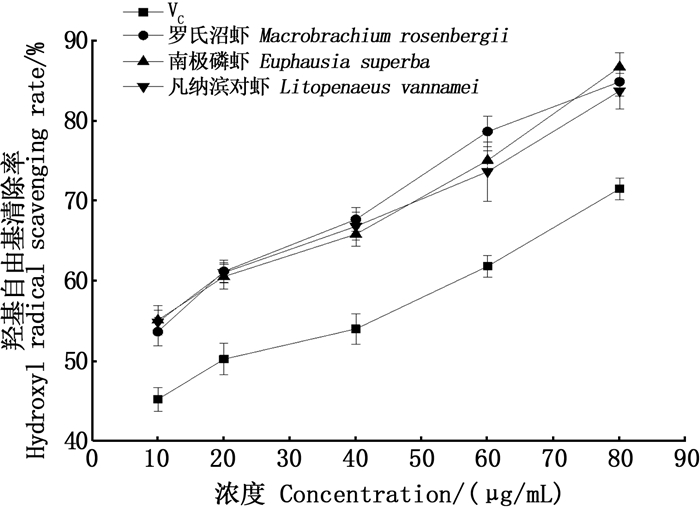
由图 7可知,3种虾壳中的虾青素对羟基自由基均具有很好的清除效果,其清除能力与添加浓度遵循剂量-效应关系。在各个浓度条件下,虾青素的羟基自由基的清除能力均显著优于VC。随着抗氧化剂浓度的提高,罗氏沼虾、南极磷虾、凡纳滨对虾虾壳中的虾青素及VC的羟基自由基清除率分别从53.62%、55.08%、54.84%、45.15%增加到84.88%、86.75%、83.73%、71.50%。由此可见,3种虾壳中的虾青素较VC均能够更有效的达到清除羟基自由基的目的。通过计算虾青素及VC的半抑制浓度(IC50)可知:3种虾壳虾青素的半抑制浓度值分别为9.41、9.12、8.21 μg/mL,VC的IC50值为18.53 μg/mL。可以看出,3种虾壳虾青素的羟基自由基清除率分别是VC的1.96、2.03、2.25倍。
|
图 7 不同虾壳虾青素与VC对羟基自由基的清除效果 Fig. 7 Scavenging effects of astaxanthin and VC on hydroxyl radicals in different shrimp shells |
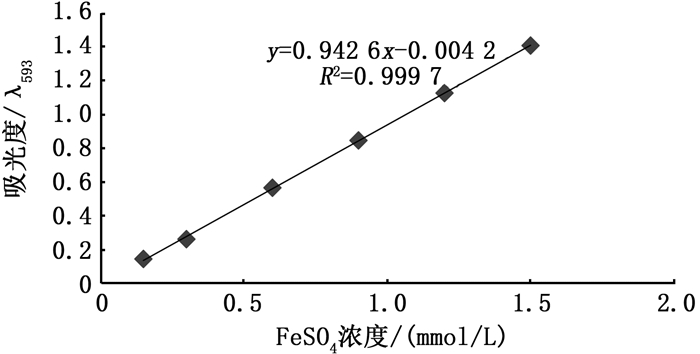
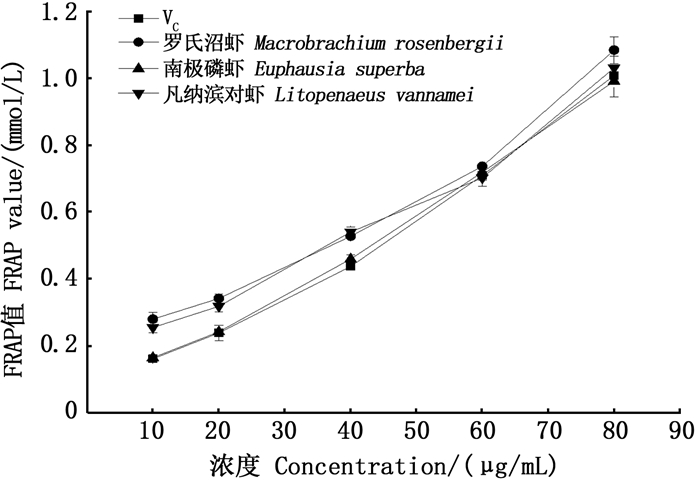
由图 8可得,硫酸亚铁标准曲线回归方程式为y = 0.942 6x-0.004 2,R2= 0.999 7。通过硫酸亚铁标准曲线来计算测试样品在复合体系中的FRAR值来体现其还原能力的强弱,FRAR值越大则总还原能力越强。从图 9可知,抗氧化剂的总还原能力随着抗氧化剂浓度的增加而增强。当抗氧化剂浓度低于60 μg/mL时,3种虾壳中虾青素的FRAR值均高于VC。而当浓度为80 μg/mL时,罗氏沼虾、南极磷虾及凡纳滨中虾青素与VC的FRAP值分别为1.08 mmol/L、0.99 mmol/L、1.03 mmol/L、1.00 mmol/L,罗氏沼虾虾壳中虾青素的铁离子还原力最好,其次为凡纳滨对虾虾壳中的虾青素。由此可知,随着南极磷虾源虾青素和VC浓度的增加,两者的总还原能力的差距较小,即在高浓度条件下南极磷虾虾壳中的虾青素的总还原能力与VC相当。
|
图 8 FeSO4标准曲线 Fig. 8 Standard curve of FeSO4 |
|
图 9 不同虾壳虾青素与VC铁还原能力比较 Fig. 9 Reduction ability comparison of astaxanthin and VC iron in different shrimp shells |
虾青素是一种脂溶性弱极性化合物,根据相似相容原理其在弱极性溶剂二氯甲烷中的溶解度较大。这与耿兆艳等[20]的研究发现二氯甲烷提取量高于无水乙醇、甲醇、石油醚及乙酸乙酯的结果相似。虾壳废弃物是虾青素的主要来源之一。南极磷虾生物储备量巨大,且虾个体小、虾壳薄,因此壳体内的虾青素较其他虾类更易获得,提取率也更高。由于虾青素的不稳定性,在使用有机溶剂浸提虾青素时,要着重考虑料液比、提取温度及提取时间对虾青素提取率的影响。当提取温度及料液比低时,虾壳与二氯甲烷溶剂接触不充分,提取不完全;随着温度的升高,虾青素溶解度增加,而虾青素性质不稳定,温度过高易受到破坏,为此选择30 ℃为虾青素的最佳提取温度。此外二氯甲烷的沸点温度较低为39.9 ℃,当提取温度升高时会使二氯甲烷含量减少从而降低料液比,因此会导致提取率下降。虾青素自身在加热条件下性质不稳定,易受到热的破坏,造成部分虾青素分解或变性,这就决定了提取时间不易过长。
DPPH不具有水溶性,只能溶于有机溶剂中,其乙醇溶液呈现深紫色。在517 nm处DPPH的单电子具有强烈的吸收,因此当溶剂体系中含有抗氧化剂提供电子使DPPH单电子配对时,DPPH在517 nm处的吸收将会减弱甚至消失,溶剂体系会发生褪色,其褪色程度与抗氧化剂提供的电子数呈现定量关系,可直观显示出抗氧化剂清除自由基能力的强弱[21]。水杨酸法是测定抗氧化剂清除羟基自由基能力的常用方法。其原理主要是由于水杨酸会与羟基自由基产生2, 3-二羟基苯甲酸,并且2, 3-二羟基苯甲酸在510 nm处具有强烈吸收峰,其吸光值与·OH的量成正相关。因此,将具有清除·OH作用的物质添加到水杨酸/羟基自由基反应体系中可导致吸光值的减少,通过测定吸光值的大小即可以测量出生物活性物质对羟基自由基的清除率[22-23],而虾青素独特的分子结构是其具有多种生物活性功能的主要原因。虾青素具有13个不饱和共轭双键和2个α-羟基酮六元环,可向DPPH自由基及羟基自由基提供多个电子,将其转化为稳定产物,从而终止其参与的各种生物体内的自由基链式反应[24]。在生物体内,虾青素分子可以跨越细胞膜,通过其结构中的一系列共轭键碳链运输自由基来清除细胞内部的自由基,并且有助于维持膜结构和降低膜流动性,展现了较其他类胡萝卜素更好的抗氧化性[14, 25]。铁离子还原能力实验对于抗氧化物总还原能力的测定是一种常用的研究方法。FRAR法所测定的值表示的是测试样品将三价铁离子还原为二价铁离子的总还原能力,能够准确地体现抗氧化剂向自由基提供电子的效率。虾青素对铁离子还原作用的机理主要是其分子结构中六元环上的羟基和酚羟基结构在起作用[26]。通过对3种虾壳中虾青素抗氧化性的研究发现,3种虾壳中虾青素对自由基都有很好的清除能力,综合3个抗氧化指标发现罗氏沼虾及凡纳滨对虾虾壳中的虾青素粗提液的抗氧化活性略高于南极磷虾,这可能与虾青素的结构及组成有关,需要后续进一步研究。
4 结论本试验比较了采用不同有机溶剂浸提罗氏沼虾、南极磷虾及凡纳滨对虾虾壳中虾青素的各项工艺因素的影响,并确定了二氯甲烷溶剂提取南极磷虾虾壳中虾青素的最佳工艺参数。在3种虾类中,南极磷虾壳中虾青素含量丰富,明显高于罗氏沼虾和凡纳滨对虾,可作为天然虾青素的重要来源。通过正交试验优化了南极磷虾虾青素提取最佳工艺条件为料液比为1∶30(g/mL)、提取温度为30 ℃、提取时间为2.5 h,使南极磷虾中虾青素提取率达到245.01 μg/g,明显高于罗氏沼虾的88.69 μg/g和凡纳滨对虾的172.21 μg/g。通过对3种虾壳中虾青素抗氧化性的研究发现,3种虾壳中虾青素对自由基都有很好的清除能力,且罗氏沼虾及凡纳滨对虾虾壳中的虾青素粗提液的抗氧化活性略高于南极磷虾,这可能与虾青素的结构及组成有关,需要进一步研究。
| [1] |
MARGALITH P Z. Production of ketocarotenoids by microalgae[J]. Applied Microbiology and Biotechnology, 1999, 51(4): 431-438. DOI:10.1007/s002530051413 |
| [2] |
李文娟. 载虾青素海藻酸钙微球体外抗肝癌机制探究[D]. 大连: 大连理工大学, 2019. LI W J. Mechanism of astaxanthin encapsulated in calcium alginate microspheres against hepatocellular carcinoma in vitro[D]. Dalian: Dalian University of Technology, 2019. |
| [3] |
沈振华. 饲料中添加镁、硒和虾青素对中华绒螯蟹幼蟹抗环境胁迫效应的研究[D]. 上海: 华东师范大学, 2017. SHEN Z H. The effects of dietary magnesium, selenium and astaxanthin in juvenile Chinese mitten crab Eriocheir sinensis exposed to ambient stress[D]. Shanghai: East China Normal University, 2017. |
| [4] |
JIANG X D, ZU L, WANG Z Y, et al. Micro-algal astaxanthin could improve the antioxidant capability, immunity and ammonia resistance of juvenile Chinese mitten crab, Eriocheir sinensis[J]. Fish & Shellfish Immunology, 2020, 102: 499-510. |
| [5] |
LEE S H, MIN D B. Effects, quenching mechanisms, and kinetics of carotenoids in chlorophyll-sensitized photooxidation of soybean oil[J]. Journal of Agricultural and Food Chemistry, 1990, 38(8): 1630-1634. DOI:10.1021/jf00098a002 |
| [6] |
FERRARO V, CRUZ I B, JORGE R F, et al. Valorisation of natural extracts from marine source focused on marine by-products: a Review[J]. Food Research International, 2010, 43(9): 2221-2233. DOI:10.1016/j.foodres.2010.07.034 |
| [7] |
董道顺. 基于响应面法的碱浸提法提取虾青素工艺优化[J]. 江苏农业科学, 2012, 40(12): 266-268. DONG D S. Optimization of the extraction process of astaxanthin by alkaline leaching method based on response surface methodology[J]. Jiangsu Agricultural Sciences, 2012, 40(12): 266-268. DOI:10.3969/j.issn.1002-1302.2012.12.106 |
| [8] |
谈俊晓, 赵永强, 李来好, 等. 响应面优化南极磷虾虾青素的复合酶法提取工艺研究[J]. 大连海洋大学学报, 2018, 33(4): 514-521. TAN J X, ZHAO Y Q, LI L H, et al. Optimization of multi-enzymatic extraction of astaxanthin from antarctic krill via response surface methodology[J]. Journal of Dalian Ocean University, 2018, 33(4): 514-521. |
| [9] |
任晓丽, 陈林, 刘天中, 等. 破壁方法对雨生红球藻湿藻生物质中虾青素提取的影响[J]. 中国食品学报, 2018, 18(12): 110-117. REN X L, CHEN L, LIU T Z, et al. The effect of cell-wall disruption methods on astaxanthin extraction from wet algal biomass of Haematococcus pluvialis[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(12): 110-117. |
| [10] |
翁婷. 超临界CO2萃取南极磷虾油及虾青素工艺研究[D]. 上海: 上海海洋大学, 2013. WENG T. Extraction of antarctic krill (Euphausia superba) oil including astaxanthin by supercritical carbon dioxide[D]. Shanghai: Shanghai Ocean University, 2013. |
| [11] |
杜云建, 陈卿. 稀碱法提取虾壳中虾青素的工艺条件研究[J]. 食品与机械, 2010, 26(4): 112-114. DU Y J, CHEN Q. Extraction astaxanthin from shrimp shell in dilute alkaline[J]. Food & Machinery, 2010, 26(4): 112-114. |
| [12] |
张晔, 刘志伟, 谭兴和. 响应面法优化复合酶提取雨生红球藻中虾青素的工艺[J]. 食品工业科技, 2019, 40(22): 87-92. ZHANG Y, LIU Z W, TAN X H. Optimization of multi-enzymatic extraction of astaxanthin from Haematococcus pluvialis by response surface methodology[J]. Science and Technology of Food Industry, 2019, 40(22): 87-92. |
| [13] |
于晓, 尚宪明, 刘云, 等. 木瓜蛋白酶酶解南极磷虾壳提取虾青素的研究[J]. 食品工业科技, 2013, 34(16): 212-217. YU X, SHANG X M, LIU Y, et al. Study on application of papain in astaxanthin extraction from Antarctic krill shell[J]. Science and Technology of Food Industry, 2013, 34(16): 212-217. |
| [14] |
郑鑫鑫, 黄青. 虾青素的免疫调节机制及在抗疫中的潜在应用[J]. 生物学杂志, 2021, 38(2): 3-7, 60. ZHENG X X, HUANG Q. Research progress on astaxanthin immunoregulation mechanisms and its potential applications in anti-pandemic[J]. Journal of Biology, 2021, 38(2): 3-7, 60. |
| [15] |
吴娇, 刁庆宇, 白雪, 等. 雨生红球藻的培养及虾青素的提取与检测[J]. 大连民族大学学报, 2019, 21(5): 406-411. WU J, DIAO Q Y, BAI X, et al. Cultivation of Haematococcus pluvialis and extraction and detection of astaxanthin[J]. Journal of Dalian Minzu University, 2019, 21(5): 406-411. DOI:10.3969/j.issn.1009-315X.2019.05.005 |
| [16] |
赵立艳, 陈贵堂, 赵广华, 等. 雨生红球藻提取物皂化前后体外抗氧化活性的研究[J]. 食品工业科技, 2008, 29(9): 81-83, 86. ZHAO L Y, CHEN G T, ZHAO G H, et al. Study on antioxidant activities of the extracts of Haematococcus pluvialis before and after saponification in vitro[J]. Science and Technology of Food Industry, 2008, 29(9): 81-83, 86. |
| [17] |
袁磊, 刘晓庚, 唐瑜. 不同类胡萝卜素清除自由基能力的比较[J]. 包装与食品机械, 2015, 33(2): 7-11. YUAN L, LIU X G, TANG Y. The comparison of free radical scavenging capacity of carotenoids[J]. Packaging and Food Machinery, 2015, 33(2): 7-11. DOI:10.3969/j.issn.1005-1295.2015.02.002 |
| [18] |
刘宏超. 虾壳生物活性物质提取及综合利用[D]. 湛江: 广东海洋大学, 2010. LIU H C. The extraction of bioactive substance from shrimp shell and its comprehensive utilization[D]. Zhanjiang: Guangdong Ocean University, 2010. |
| [19] |
尹蔷, 尚小玉, 张泽生, 等. 虾青素体外清除自由基活性的研究[J]. 食品科技, 2010, 35(4): 232-234. YI Q, SHANG X Y, ZHANG Z S, et al. Study on free radical scavenging property of astaxanthin[J]. Food Science and Technology, 2010, 35(4): 232-234. DOI:10.3969/j.issn.1672-979X.2010.04.002 |
| [20] |
耿兆艳, 孙翰, 管斌, 等. 雨生红球藻粉虾青素的提取及稳定性研究[J]. 中国食品学报, 2017, 17(7): 86-95. GENG Z Y, SUN H, GUAN B, et al. Study on the extraction of astaxanthin from Haematococcus pluvialis and the stability of astaxanthin[J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(7): 86-95. |
| [21] |
万仁口, 贺杨正, 李功景, 等. 酶解制备竹笋可溶性膳食纤维及其抗氧化活性研究[J]. 中国食品学报, 2021, 21(3): 153-160. WAN R K, HE Y Z, LI G J, et al. Preparation and antioxidant activity of bamboo shoot soluble dietary fiber extracted by enzyme method[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(3): 153-160. |
| [22] |
文镜, 贺素华, 杨育颖, 等. 保健食品清除自由基作用的体外测定方法和原理[J]. 食品科学, 2004, 25(11): 190-195. WEN J, HE S H, YANG Y Y, et al. The in vitro experimental methods and principles for the eliminationof free radicals by health functional foods[J]. Food Science, 2004, 25(11): 190-195. |
| [23] |
侯克会. 外源性羟基自由基杀灭枯草芽孢杆菌及芽孢研究[D]. 镇江: 江苏大学, 2011. HOU K H. Study on killing of bacillus subtilis and spores by hydroxyl solution[D]. Zhenjiang: Jiangsu University, 2011. |
| [24] |
MCNULTY H P, BYUN J, LOCKWOOD S F, et al. Differential effects of carotenoids on lipid peroxidation due to membrane interactions: X-ray diffraction analysis[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2007, 1768(1): 167-174. DOI:10.1016/j.bbamem.2006.09.010 |
| [25] |
KIDD P. Astaxanthin, cell membrane nutrient with diverse clinical benefits and anti-aging potential[J]. Alternative Medicine Review: A Journal of Clinical Therapeutic, 2011, 16(4): 355-364. |
| [26] |
王凯. 雨生红球藻虾青素酯的纯化、活性研究及不同虾青素的鉴定[D]. 厦门: 集美大学, 2016. WANG K. Purification and activties of astaxanthin esters from Haematococcus pluvialis and identification of different astaxanthins[D]. Xiamen: Jimei University, 2016. |
 2022,
Vol. 31
2022,
Vol. 31


