2. 中国水产科学研究院淡水渔业研究中心 农业农村部长江下游渔业资源环境科学观测实验站, 江苏 无锡 214081
鱼类的生殖洄游是一种生理性、周期性、高耗能的游泳运动[1],有些鱼类在洄游过程中减少摄食或者不摄食,洄游期间完全由身体储存物质供能[2],为了规避能量匮乏的风险,鱼类在洄游时会尽可能调节其身体结构、生理、行为模式以节省洄游前储备的能量[3]。鱼类洄游过程中,动用体内储存的能量除了用于新陈代谢以外,主要用于高强度的洄游活动和性腺发育等,这其中约有40%的能量储备用于长距离的游泳运动,而60%用于性腺发育[4]。碳水化合物、脂肪和蛋白质为动物体内三大主要供能物质,对于洄游过程不摄食的鱼类而言,洄游过程中所需的能量主要来源于体内存储的糖原、脂肪和蛋白的分解。国内外学者已对部分鱼类在洄游过程中的能量分配及代谢模式开展了研究[5-6],结果显示大部分洄游性鱼类主要利用脂肪和糖原供能,只有脂肪被消耗殆尽时,才利用蛋白质作为能源物质,而碳水化合物含量在鱼类洄游过程中变化较小[7]。鱼类血清能量指标与机体的营养状况、代谢水平等密切相关[8],因此可通过监测鱼类血清能量指标,评估其洄游过程营养物质及能量代谢情况,掌握鱼类洄游过程中物质及能量利用的适应性规律,为洄游性鱼类能量生态学研究积累素材。
刀鲚(Coilia nasus)是典型的溯河洄游性鱼类,每年初春季节,亲鱼在长江口集群,然后沿江逆流而上,进入长江下游沿途的支流、湖泊繁殖,最远可达洞庭湖[9],孵化后的幼鱼及亲鱼顺江而下返回近海索饵越冬。近年来,众多学者对刀鲚血液学的研究主要集中在盐度、饥饿胁迫以及注射催产素等[10-12],而对其生殖洄游期间与能量代谢相关的血清能量指标变化规律的探究较少。本研究拟通过比较不同洄游距离及不同发育期刀鲚血清能量指标的差异,分析刀鲚洄游过程中血清能量指标变化特征,初步研究其在生殖洄游过程中营养物质代谢规律,以期丰富其血液学基础指标,为深入开展刀鲚资源保护提供科学依据。
1 材料与方法 1.1 实验用鱼2019年刀鲚洄游汛期内,于4月15日—6月5日分别在崇明段(32°14′08″N, 119°40′29″E)、镇江段(31°30′31″N, 121°35′36″E)、安庆段(30°28′50″N, 116°59′13″E)使用刺网采集刀鲚样本(图 1),选取体长相近(300 ~ 320 mm)的雌性个体作为实验样本,并立即置于冰盘备用。
|
图 1 采样江段示意图 Fig. 1 Sketch of sampling station |
将实验样本置于冰盘,尾静脉采血并置于2.5 mL离心管中,4 ℃冰箱中放置4 h,待血清析出后,4 000 r/min离心15 min。取上层血清置于液氮中冻存并运回实验室,于-80 ℃冰箱保存,用于测定血清能量指标。采血后的刀鲚样本在冰盘上快速解剖,同期记录性别、发育期、胃肠含物、肠系膜脂肪等相关信息,性腺发育分期的鉴定根据徐钢春等[13]采用性腺外表形态特征的目测法。
1.2.2 血清能量指标的测定本研究包括空间特征实验和发育期特征实验两部分:空间特征实验选取崇明7尾、镇江10尾和安庆6尾发育期Ⅱ期的样本;发育期特征实验选取安庆段Ⅱ~Ⅳ样本,其中Ⅱ期6尾、Ⅲ期8尾、Ⅳ期3尾(考虑到刀鲚洄游群体的繁殖生物学特征,确定采样对象为Ⅱ~Ⅴ期样本,但安庆段未采集到满足采样体长的Ⅴ期样本)。分别测定血清中总蛋白(TP)、葡萄糖(GLU)、甘油三酯(TG)、总胆固醇(TCH)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)和游离脂肪酸(NEFA)含量。血糖采用葡萄糖氧化酶法进行测定;血清蛋白含量采用双缩脲法进行测定;甘油三酯采用GPO-PAP酶法进行测定;总胆固醇含量采用COD-PAP法进行测定;高密度脂蛋白和低密度脂蛋白含量采用直接法和微板法相结合进行测定;游离脂肪酸含量采用酶法、微板法测定,血清能量指标单位均为mmol/L,血清能量指标测定试剂盒购于南京建成生物工程研究所。
1.3 数据处理实验采用SPSS 23.0软件进行统计分析,用单因素方差分析法(One-Way ANOVA)对崇明、镇江和安庆段刀鲚血清能量指标进行差异显著性分析,若差异显著时,用Duncan’s法进行多重比较检验。
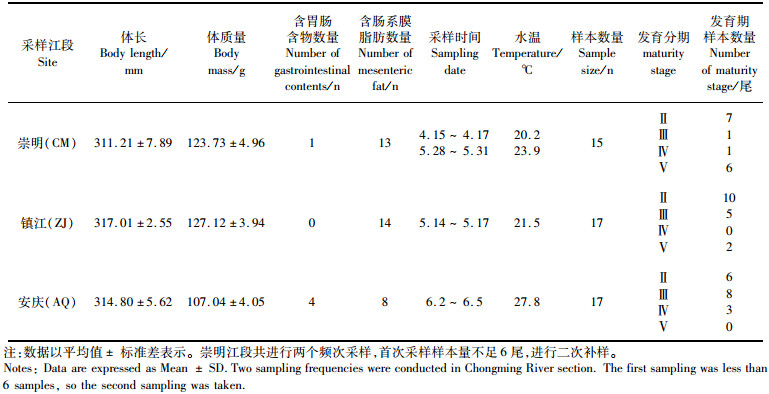
2 结果与分析 2.1 长江刀鲚样品形态学参数所采集的49尾雌性刀鲚样品,体长范围为311.21~317.01 mm,体质量范围为107.04~127.12 g,其中崇明、镇江和安庆江段Ⅱ期样本分别为7尾、10尾和6尾,安庆段Ⅱ期6尾、Ⅲ期8尾、Ⅳ期3尾。由崇明至安庆段,含有胃肠含物鱼体数量有所上升,由6.67%上升至23.53%,含肠系膜脂肪的鱼体数量由86.67%下降至47.06%。随着采样时间的后延,各江段采样时的水温存在差异,总体表现为随着时间的延迟水温逐渐小幅上升。见表 1。
|
表 1 长江刀鲚样品形态学参数 Tab.1 Information of Coilia nasus samples |
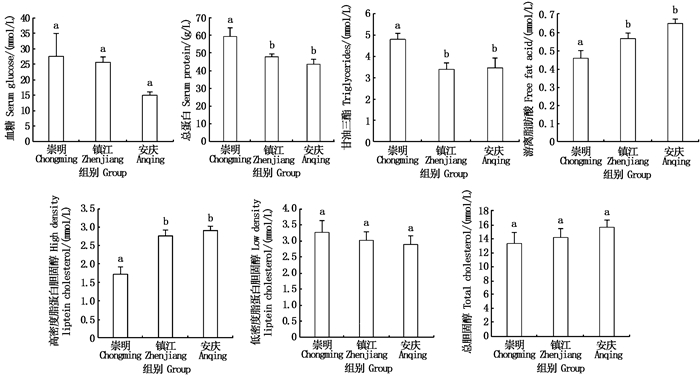
刀鲚生殖洄游过程血清总蛋白随着洄游距离的延长总体呈下降趋势,血糖和低密度脂蛋白胆固醇虽有所下降,但并不明显。高密度脂蛋白胆固醇、游离脂肪酸和总胆固醇总体呈有所上升趋势;血清中甘油三酯随着洄游距离的延长呈先降后升的趋势。见图 2。
|
柱子上方不同的小写字母代表各组间存在显著性差异(P < 0.05)。 Different superscript letters indicate significant differences(P < 0.05). 图 2 不同洄游距离长江刀鲚血糖、总蛋白、甘油三酯、游离脂肪酸、高密度脂蛋白、低密度脂蛋白和总胆固醇含量变化 Fig. 2 Serum glucose, total protein, triglycerides, free fat acid, high density lipoprotein cholesterol, low density lipoprotein cholesterol and total cholesterol concentration of Coilia nasus at different migration distances |
自崇明至安庆段的洄游过程,血糖、总胆固醇、低密度脂蛋白含量均无显著差异(P>0.05),血清总蛋白、甘油三酯、高密度脂蛋白和游离脂肪酸含量在镇江至安庆段均无显著差异(P>0.05),出现显著差异过程主要集中在崇明至镇江段,其中总蛋白和甘油三酯含量显著降低(P < 0.05),总蛋白下降19.36%,甘油三酯下降29.29%,高密度脂蛋白和游离脂肪酸含量显著升高(P < 0.05),分别升高了60.38%、23.65%。
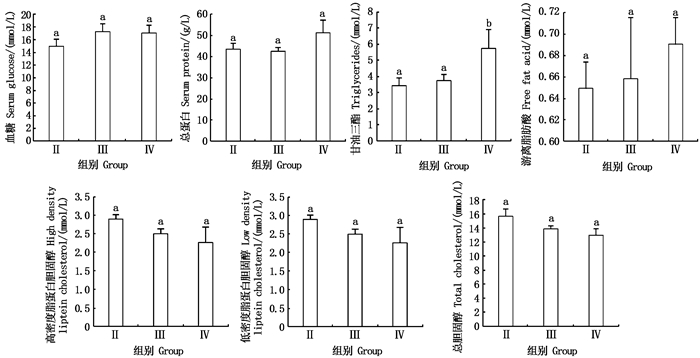
2.3 长江刀鲚血清能量指标与发育期的关系在同一江段,刀鲚性腺自Ⅱ期发育至Ⅲ期,血清总蛋白、总胆固醇、高密度脂蛋白和低密度脂蛋白均出现下降,分别下降了2.40%、11.33%、13.88%、2.23%;血糖、甘油三酯和游离脂肪酸出现上升,分别上升了15.21%、8.78%、1.39%。由Ⅲ期发育到Ⅳ期,血糖、总胆固醇、高密度脂蛋白和低密度脂蛋白均出现下降,分别下降了1.15%、6.46%、9.19%、14.02%;总蛋白、甘油三酯和游离脂肪酸均出现上升,分别上升了20.41%、53.75%(P < 0.05)、4.89%。见图 3。
|
柱子上方不同的小写字母代表各组间存在显著性差异(P < 0.05)。 Different superscript letters indicate significant differences(P < 0.05). 图 3 不同发育期长江刀鲚血糖、总蛋白、甘油三酯、游离脂肪酸、高密度脂蛋白、低密度脂蛋白和总胆固醇含量变化 Fig. 3 Serum glucose, total protein, triglycerides, free fat acid, high density lipoprotein cholesterol, low density lipoprotein cholesterol and total cholesterol concentration of Coilia nasus serum at different ovaries developmental stages |
鱼类各项血清能量指标均反映相应的代谢需求和生理功能,如血糖和血脂是鱼类代谢的主要供能物质,血清蛋白是脂质运输的载体[14],对机体脂肪酸代谢有重要作用;血浆游离脂肪酸则是血浆脂质中代谢最活跃的脂肪酸,可为鱼类持久性游泳运动提供能量来源[15];血脂水平一般用甘油三酯、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇和游离脂肪酸来衡量,甘油三酯和总胆固醇均为中性脂肪,是体内能量的主要来源[16];总胆固醇必须与脂蛋白结合才能运输[17],高密度脂蛋白胆固醇主要由肝脏合成,其作用是将血液和组织中多余的总胆固醇携带至肝脏分解逆向排出体外,与高密度脂蛋白胆固醇作用相反,低密度脂蛋白胆固醇则向组织转运肝脏合成的内源胆固醇[18]。影响鱼类血清能量指标主要包括与遗传特性相关的内源因子和外部环境因子。内源因子主要包括年龄、性别、发育期、食性等,其决定鱼类的血清能量指标特性并维持在正常的范围;外部环境因子主要包括水温、溶氧、盐度、pH和其他水环境因子,它通过刺激或抑制鱼体代谢水平,从而直接或间接影响血清能量指标的波动[19-20]。对于洄游性鱼类而言,水温随时间和空间的变化而改变,其主要通过一系列酶促反应对代谢速率起控制作用。一般来说,鱼体内的代谢速率随温度的升高而升高,从而引起血糖等指标的波动。刀鲚自长江口向长江下游段洄游,受到时序的影响,各江段出现刀鲚渔汛的时间存在差异,无法实现各江段同步采集,而随着采样时间的后延,各江段采样时的水温存在差异,总体表现为随着时间的延迟水温逐渐小幅上升。
3.2 长江刀鲚生殖洄游过程中能量代谢与血清能量指标特征血浆蛋白含量在维持正常渗透压、物质运输、体内酸碱度的平衡及增强抵抗力方面均有重要作用[14]。刀鲚洄游过程血清蛋白水平总体呈下降的趋势,其原因应是洄游过程长期处于饥饿状态,引起蛋白质分解代谢增强[21],且长期停食下肾脏功能受到影响,亦可能导致蛋白质合成减少。刀鲚由海淡水交汇的崇明段洄游至纯淡水的镇江段,血清蛋白水平呈显著性下降,可能与渗透压变化使得鱼体内大量离子排出导致能量消耗有关[22];而安庆段血清蛋白含量与镇江段相比无显著变化,表明进入纯淡水后,随着洄游距离的延伸,仍可维持稳定的血清蛋白水平。本实验解剖学上观察到洄游到安庆段的部分刀鲚肠道中存有少量食糜,表明其在洄游过程可能存在重摄食行为,重摄食在一定程度上可以补充其对能量的需求,同样有利于维持相对稳定的血清蛋白水平。
血糖是鱼类主要的能量来源,稳定的血糖水平对维持鱼类正常的生命活动至关重要,其主要通过糖原分解和糖异生途径进行自我调节。刀鲚整个洄游过程血糖呈下降趋势,但并未表现出显著性差异,这应是饥饿洄游和水温综合作用的结果,一定范围内血糖随水温的升高而升高[23],若排除水温的影响,刀鲚血糖的下降趋势在上溯洄游过程中应更显著。刀鲚在洄游过程处于饥饿状态,血糖持续被分解供能以确保完成长距离溯河洄游[24],因此其血糖整体呈下降趋势。由崇明至镇江约270 km的洄游距离,刀鲚血糖仅下降了6.89%,而由镇江至安庆约330 km的洄游距离则大幅下降了41.73%,表明饥饿后期其对血糖的需求大幅增加。有研究[25]表明,Na+离子浓度与血糖呈负相关。由崇明洄游至镇江,水体Na+离子浓度降低对刀鲚血糖有一定程度的补充,可能是洄游早期血糖水平下降幅度较低的原因之一;而镇江至安庆段的洄游距离更远,游泳过程需消耗更多能量,且性腺发育对能量的需求也大幅增加,因此代谢需求也大幅增加,从而引起血糖水平大幅降低。另一方面,刀鲚洄游过程无外源性营养物质的摄入,从而糖原储备不足,而大脑等器官依赖葡萄糖供能,需要依靠肝脏将非糖物质转变为葡萄糖,维持血糖稳定,保证基本的生命活动。洄游初期,体内储备的肠系膜脂肪、肝脏和肌肉中的脂肪既能代谢供能,又可氧化分解为糖类对血糖进行补充[26];而洄游后期,当体内存储的脂肪不足以维持正常代谢,刀鲚采取消耗部分组织蛋白的途径进行糖异生[11],因此,整个洄游过程血糖仍然维持稳定水平。
鱼类血液中脂肪只占机体脂肪总量的极少部分,并流动于各组织之间,因此可以及时反映机体脂类代谢与营养状况[27]。刀鲚在洄游停食过程中,通过内源性途径利用鱼体储存的脂质或其他能量载体,甘油三酯被脂蛋白脂肪酶分解[28],导致血清甘油三酯下降,在镇江段下降了29.29%,达到显著性差异水平。血清中总胆固醇的含量是高、低密度脂蛋白综合作用的结果[17],高密度脂蛋白含量升高使血清中更多的胆固醇被转运至肝脏,从而使肝脏中胆固醇含量积累,而低密度脂蛋白含量降低则会减少肝脏组织的胆固醇转运到血液中,二者综合作用使血清中胆固醇略有升高,胆固醇于肝脏中积累。肝脏中积累的胆固醇可能通过极低密度脂蛋白转运至机体其他组织储存或利用[29],用于长距离洄游运动以及性腺发育,而血清中胆固醇的升高可能是由于洄游过程中性腺发育使性激素的合成增加[30-31]。
血清游离脂肪酸由中性脂肪分解而来,作为能源物质从脂肪库经血液运输到各种利用组织[15]。刀鲚生殖洄游过程鱼体脂分解速率加快,血清中游离脂肪酸总体上升,能为高强度的游泳运动提供能量。肝脏、肌肉和肠系膜脂肪是刀鲚脂肪的主要储存组织,其长距离洄游过程优先利用肠系膜脂肪供能[32],实验解剖过程发现,由镇江段洄游至安庆段,含肠系膜脂肪的刀鲚数量比例由82.35%下降至47.05%,表明肠系膜脂肪在生殖洄游过程是逐渐减少的,且肝胰腺脂肪含量于生殖洄游过程呈下降趋势(由19.1%下降至15.6%)[33]。由此可见,大量的脂质可能以游离脂肪酸的形式优先利用肠系膜脂肪运输到肌肉等运动器官,肝胰腺脂肪次之。由崇明段洄游至镇江段,血清游离脂肪酸含量上升了23.65%,出现显著性差异,而由镇江段洄游至安庆段仅上升了14.54%,这应是长期饥饿导致鱼体脂质被大量利用,直至出现主要供能物质变化,从而导致饥饿后期对脂质储备的利用减少,血清游离脂肪酸上升幅度趋于平稳。
3.3 长江刀鲚性腺发育过程能量代谢调节与血清能量指标特征刀鲚属于多脂鱼类,在性腺发育的早期,脂肪主要以甘油三酯的形式储存在鱼体肝脏、肌肉和肠系膜脂肪中,随着性腺发育的进程,脂肪组织逐渐被代谢利用,性腺逐步发育成熟[34-35]。血清总蛋白、血糖、游离脂肪酸等能量指标在Ⅱ ~ Ⅳ期均维持稳定的水平,表明刀鲚在长期停食洄游状态下能维持基本的生命活动;血清总胆固醇、游离脂肪酸等血脂指标的变化表明,还需代谢脂肪以提供性腺发育和生殖洄游所需的能量[36];而甘油三酯含量随发育期进程呈上升趋势,且Ⅳ期相比Ⅱ期和Ⅲ期分别上升了67.24%和53.75%,差异均达到显著水平,表明为了满足性腺发育的需要,大量脂肪以甘油三酯的形式由肝脏、肌肉等组织转移并积累于卵巢[33]。因此,刀鲚性腺发育过程中卵巢脂肪及总脂肪酸均有明显增加[33, 37]。
| [1] |
成庆泰. 鱼类的洄游[J]. 生物学通报, 1984(6): 7-9. CHENGQ T. Migration of fish[J]. Bulletin of Biology, 1984(6): 7-9. |
| [2] |
JONSSON N, JONSSON B, HANSEN L P. Energetic cost of spawning in male and female Atlantic salmon (Salmo salar L.)[J]. Journal of Fish Biolog, 1991, 39(5): 739-744. DOI:10.1111/j.1095-8649.1991.tb04403.x |
| [3] |
KIESSLING A, LINDAHL-KIESSLING K, KIESSLING K H. Energy utilization and metabolism in spawning migrating Early Stuart sockeye salmon (Oncorhynchus nerka): the migratory paradox[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2004, 61(3): 452-465. DOI:10.1139/f04-006 |
| [4] |
VAN GINNEKEN V J T, VAN DEN THILLART G E E J M. Physiology: Eel fat stores are enough to reach the Sargasso[J]. Nature, 2000, 403(6766): 156-157. |
| [5] |
LEONARD J B, MCCORMICK S D. Effects of migration distance on whole-body and tissue-specific energy use in American shad (Alosasa pidissima)[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1999, 56(7): 1159-1171. DOI:10.1139/f99-041 |
| [6] |
MOMMSEN T P, FRENCH C J, HOCHACHKA P W. Sites and patterns of protein and amino acid utilization during the spawning migration of salmon[J]. Canadian Journal of Zoology, 1980, 58(10): 1785-1799. DOI:10.1139/z80-246 |
| [7] |
JONSSON N, JONSSON B, HANSEN L P. Changes in proximate composition and estimates of energetic costs during upstream migration and spawning in Atlantic salmon Salmosalar[J]. Journal of Animal Ecology, 1997, 66(3): 425-436. DOI:10.2307/5987 |
| [8] |
周玉, 郭文场, 杨振国, 等. 鱼类血液学指标研究的进展[J]. 上海水产大学学报, 2001, 10(2): 163-165. ZHOU Y, GUO W C, YANG Z G, et al. Advances in the study of haemotological indices of fish[J]. Journal of Shanghai Fisheries University, 2001, 10(2): 163-165. |
| [9] |
袁传宓. 刀鲚的生殖洄游[J]. 生物学通报, 1987(12): 1-3. YUAN C M. The migration and spawning of Colilia nasus[J]. Bulletin of Biology, 1987(12): 1-3. |
| [10] |
徐钢春, 杜富宽, 聂志娟, 等. 10‰盐度对长江刀鲚幼鱼装载和运输胁迫中应激指标的影响[J]. 水生生物学报, 2015, 39(1): 66-72. XU G C, DU F K, NIE Z J, et al. Effects of 10‰ salinity to the plasma osmotic pressure, cortisol, glucose and liver glycogen in Colilia nasus Stressed during loading and transportation[J]. Acta Hydrobiologica Sinica, 2015, 39(1): 66-72. |
| [11] |
金鑫, 徐钢春, 杜富宽, 等. 饥饿胁迫对刀鲚形体、体成分及血液生化指标的影响[J]. 动物学杂志, 2014, 49(6): 897-903. JIN X, XU G C, DU F K, et al. Impacts of starvation stress on morphological change, chemical composition and blood biochemical parameters in Coilia nasus[J]. Chinese Journal of Zoology, 2014, 49(6): 897-903. |
| [12] |
徐钢春, 杜富宽, 黎燕, 等. 注射LHRH-A2对刀鲚的催产效果及其雌鱼血液生化指标的影响[J]. 水产学报, 2016, 40(8): 1186-1194. XU G C, DU F K, LI Y, et al. Effects of LHRH-A2 on induced spawning and responses of plasma biochemical indices of Coilia nasus[J]. Journal of Fisheries of China, 2016, 40(8): 1186-1194. |
| [13] |
徐钢春, 万金娟, 顾若波, 等. 池塘养殖刀鲚卵巢发育的形态及组织学研究[J]. 中国水产科学, 2011, 18(3): 537-546. XU G C, WAN J J, GU R B, et al. Morphological and histological studies on ovary development of Coilia nasus under artificial farming conditions[J]. Journal of Fishery Sciences of China, 2011, 18(3): 537-546. |
| [14] |
ALEXANDER J B. Protein concentration in the serum of the Atlantic salmon (Salmo salar) in North-westEngland and Northern Ireland[J]. Journal of Fish Biology, 1977, 11(6): 673-679. DOI:10.1111/j.1095-8649.1977.tb05723.x |
| [15] |
STEINBERG D. Catecholamine stimulation of fat mobilization and its metabolic consequences[J]. Pharmacological Reviews, 1966, 18(1): 217-235. |
| [16] |
KRAJNOVIC O M, OZRETIC B. Detection and evaluation of hepatic intoxication in fish[J]. Journal of Hydrology, 1992, 340(3/4): 233-243. |
| [17] |
黄金凤, 徐奇友, 王常安, 等. 温度和饲料蛋白质水平对松浦镜鲤幼鱼血清生化指标的影响[J]. 大连海洋大学学报, 2013, 28(2): 185-190. HUANG J F, XU Q Y, WANG C A, et al. Effects of temperature and dietary protein content on the blood biochemical parameters in juvenile Songpu mirror carp Cyprinus specularis Songpu[J]. Journal of Dalian Fisheries University, 2013, 28(2): 185-190. DOI:10.3969/j.issn.2095-1388.2013.02.014 |
| [18] |
周顺伍. 动物生物化学[M]. 3版. 北京: 中国农业出版, 2000: 144-146. ZHOU S W. Animal biochemistry[M]. 3rd ed. Beijing: China Agricultural Press, 2000: 144-146. |
| [19] |
陈洁, 熊邦喜, 顾钱洪, 等. 内源及外源因子对鱼类血液生理生化指标的影响[J]. 湖北农业科学, 2011, 50(9): 1861-1865. CHEN J, XIONG B X, GU Q H, et al. The effect of endogenous and environment factors on hematology physiological and biochemical indices of fish[J]. Hubei Agricultural Sciences, 2011, 50(9): 1861-1865. DOI:10.3969/j.issn.0439-8114.2011.09.041 |
| [20] |
赵悦, 孙大川, 刘文畅, 等. 低盐度对澳洲龙纹斑生长、血液及非特异性免疫酶的影响[J]. 上海海洋大学学报, 2021, 30(3): 435-441. ZHAO Y, SUN D C, LIU W C, et al. Effects of low salinity on the growth, blood and non-specific immune enzymes of Maccullo chellapeelii peelii[J]. Journal of Shanghai Ocean University, 2021, 30(3): 435-441. |
| [21] |
SAUER D M, HAIDER G. Enzyme activities in the plasma of rainbow trout, Salmo gairdneri Richardson; the effects of nutritional status and salinity[J]. Journal of Fish Biology, 1979, 14(4): 407-412. DOI:10.1111/j.1095-8649.1979.tb03536.x |
| [22] |
FLETCHER G L, WATTS E G, KING M J. Copper, zinc, and total protein levels in the plasma of sockeye salmon (Oncorhynchus nerka) during their spawning migration[J]. Journal of the Fisheries Research Board of Canada, 1975, 32(1): 78-82. DOI:10.1139/f75-012 |
| [23] |
徐钢春, 聂志娟, 薄其康, 等. 水温对刀鲚幼鱼耗氧率、窒息点、血糖及肌肝糖元指标的影响[J]. 生态学杂志, 2012, 31(12): 3116-3120. XU G C, NIE Z J, BO Q K, et al. Effects of water temperature on oxygen consumption rate, asphyxiant point, blood glucose content, and muscle and liver glycogen content of juvenile Coilia nasus[J]. Chinese Journal of Ecology, 2012, 31(12): 3116-3120. |
| [24] |
BLACK D, LOVE R M. The sequential mobilisation and restoration of energy reserves in tissues of Atlantic cod during starvation and refeeding[J]. Journal of Comparative Physiology B, 1986, 156(4): 469-479. DOI:10.1007/BF00691032 |
| [25] |
WAGNER T, CONGLETON J L. Blood chemistry correlates of nutritional condition, tissue damage, and stress in migrating juvenile chinook salmon (Oncorhynchus tshawytscha)[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2004, 61(7): 1066-1074. DOI:10.1139/f04-050 |
| [26] |
封功能, 杨文平, 王爱民, 等. 饥饿胁迫对鲤形体、体成分及血液生理指标的影响[J]. 上海海洋大学学报, 2011, 20(6): 814-819. FENG G N, YANG W P, WANG A M, et al. Effects of starvation stress on body shape, chemical composition and blood physiological of Cyprinus carpio[J]. Journal of Shanghai Ocean University, 2011, 20(6): 814-819. |
| [27] |
刘波, 唐永凯, 俞菊华, 等. 饲料脂肪对翘嘴红鲌生长、葡萄糖激酶和葡萄糖-6-磷酸酶活性与基因表达的影响[J]. 中国水产科学, 2008, 15(6): 1024-1033. LIU B, TANG Y K, YU J H, et al. Effects of dietary lipids on growth, GK and G6Pase activities and mRNA levels in top-mouth cutler (Erythrocutler ilishaeformis Bleeker)[J]. Journal of Fishery Sciences of China, 2008, 15(6): 1024-1033. DOI:10.3321/j.issn:1005-8737.2008.06.017 |
| [28] |
MA F J, YANG Y P, JIANG M, et al. Digestive enzyme activity of the Japanese grenadier anchovy Coilia nasus during spawning migration: influence of the migration distance and the water temperature[J]. Journal of Fish Biology, 2019, 95(5): 1311-1319. DOI:10.1111/jfb.14136 |
| [29] |
艾庆辉, 严晶, 麦康森. 鱼类脂肪与脂肪酸的转运及调控研究进展[J]. 水生生物学报, 2016, 40(4): 859-868. AI Q H, YAN J, MAI K S. Research progresses of lipids and fatty acids transport in fish[J]. Acta Hydrobiologica Sinica, 2016, 40(4): 859-868. |
| [30] |
王瑞芳, 安晓萍, 齐景伟, 等. 达里湖瓦氏雅罗鱼生殖洄游过程中能量代谢和消化酶活性的变化[J]. 中国水产科学, 2019, 26(4): 703-712. WANG R F, AN X P, QI J W, et al. Energy metabolism and digestive enzyme activity regulation in Amur Ide (Leuciscus waleckii) during spawning migration from Dali Nor Lake to Gongger River[J]. Journal of Fishery Sciences of China, 2019, 26(4): 703-712. |
| [31] |
帅滇, 张利娜, 蒲金成, 等. 不同发育时期雄性鳗鲡精巢和GtH分泌细胞的结构观察及相关组织中性类固醇激素的变化[J]. 上海海洋大学学报, 2017, 26(2): 161-170. SHUAI D, ZHANG L N, PU J C, et al. Histological and ultrastructural observation of testis and GtH cell and quantification of sexual steroid hormones in the male Japanese eel during artificially induced maturation[J]. Journal of Shanghai Ocean University, 2017, 26(2): 161-170. |
| [32] |
BILINSKI E, GARDNER L J. Effect of starvation on free fatty acid level in blood plasma and muscular tissues of rainbow trout(Salmo gairdneri)[J]. Journal of the Fisheries Research Board of Canada, 1968, 25(8): 1555-1560. DOI:10.1139/f68-140 |
| [33] |
吴利红, 唐文乔, 张亚. 从体内脂肪的转移过程探讨凤鲚和刀鲚溯河产卵洄游距离的差异性[J]. 水产学报, 2017, 41(2): 212-220. WU L H, TANG W Q, ZHANG Y. Research on the differences of anadromous migratory distance between Coilia mystus and Coilia nasus based on the transfer process of body lipid[J]. Journal of Fisheries of China, 2017, 41(2): 212-220. |
| [34] |
管卫兵, 陈辉辉. 长江口刀鲚洄游群体和越冬群体能量利用方式[J]. 海洋湖沼通报, 2014(4): 35-40. GUAN W B, CHEN H H. Energy dynamics in anadromous C. Ectens during spawning and overwintering in Yangtze estuary[J]. Transactions of Oceanology and Limnology, 2014(4): 35-40. |
| [35] |
郑飞, 郭弘艺, 唐文乔, 等. 溯河洄游的长江刀鲚种群的年龄结构及其生长特征[J]. 动物学杂志, 2012, 47(5): 24-31. ZHENG F, GUO H Y, TANG W Q, et al. Age structure and growth characteristics of anadromous populations of Coilia nasus in the Yangtze river[J]. Chinese Journal of Zoology, 2012, 47(5): 24-31. |
| [36] |
滕静, 陶宁萍, 李玉琪. 卵巢发育不同阶段长江刀鲚肉营养成分的分析及评价[J]. 现代食品科技, 2016, 32(9): 267-274. TENG J, TAO N P, LI Y Q. Analysis and evaluation of nutritional composition of Yangtze River-Coilia meat at different ovarian development stages[J]. Modern Food Science and Technology, 2016, 32(9): 267-274. |
| [37] |
李丽, 唐文乔, 张亚. 长江下游雌性刀鲚生殖洄游过程中脂肪酸含量及其组分的变化[J]. 水产学报, 2019, 43(4): 790-800. LI L, TANG W Q, ZHANG Y. Changes of fatty acid content and its components in different tissues during spawning migration processes of female Coilia nasus in the lower reaches of the Yangtze River[J]. Journal of Fisheries of China, 2019, 43(4): 790-800. |
2. Scientific Observing and Experimental Station of Fishery Resources and Environment in the Lower Reaches of the Changjiang River, Ministry of Agriculture and Rural Afaris, Freshwater Fisheries Research Center, CAFS, Wuxi 214081, Jiangsu, China
 2022,
Vol. 31
2022,
Vol. 31


