2. 中国水产科学研究院东海水产研究所, 上海 200090;
3. 农业农村部东海与长江口渔业资源环境科学观测实验站, 上海 200090
金钱鱼(Scatophagus argus),别名金鼓鱼,隶属于鲈形目(Perciformes)刺尾鱼亚目(Acanthuroidei)金钱鱼科(Scatophagidae)金钱鱼属(Scatophagus),主要分布于我国东南沿海地区[1],属于广温、广盐性物种。金钱鱼肉质鲜美,营养丰富,且体形优美、色彩斑斓,是深受青睐的食用鱼和观赏鱼,具有很高的经济价值[2]。金钱鱼环境适应性和抗病抗逆性极强,性情温顺且食性较杂,可实现单养、混养、立体生态养殖等模式,是我国南方沿海池塘和网箱养殖的重要种类[3]。
盐度是鱼类养殖中重要的环境影响因子,盐度的改变对鱼类的存活、生长、代谢和非特异性免疫具有显著的影响[4-6]。例如,盐度为10~20时对半滑舌鳎(Cynoglossus semilaevis)[7]幼鱼的生长有促进作用;盐度为24~35时可显著抑制暗纹东方鲀(Takifugu obscurus)[8]的生长。对篮子鱼(Siganus guttatus)[4]、银鲳(Pampus argenteus)[9]、多鳞四指马鲅(Eleutheronema rhadinum)[10]、褐牙鲆(Paralichthys olivaceus)[11]等的研究表明,环境盐度变化可能对鱼体施加氧化压力,进而使抗氧化系统产生不同程度的生理应答。鱼体中的抗氧化系统以酶促系统和非酶促系统为主,酶促系统主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽S-转移酶(GST)、谷胱甘肽过氧化物酶(GPx)等, 非酶促系统主要包括还原型谷胱甘肽(GSH)等[12]。丙二醛(MDA)是自由基攻击膜不饱和脂肪酸的产物,可与蛋白质的游离氨基作用,导致细胞损伤[13],其含量的高低可作为机体细胞受自由基攻击程度的指标[14]。
关于盐度对金钱鱼影响的研究已经开展,主要集中在渗透调节[15-17]机理方面,此外研究发现,盐度影响金钱鱼的生长[18]、性腺发育[19]和排氨率[20]。目前已有实践证明,金钱鱼可实现淡化养殖[21],但淡水环境对其生长和抗氧化系统的影响仍缺乏相关研究,且盐度对不同发育阶段金钱鱼的影响尚未阐明,幼鱼的最佳养殖盐度仍处于探索阶段。本研究在以往研究的基础上进一步扩大了实验盐度范围,将金钱鱼幼鱼实验水体盐度降至淡水,进而对其存活、生长和不同组织中的抗氧化状态进行研究,探讨金钱鱼幼鱼适宜的养殖盐度范围,有助于了解抗氧化系统响应盐度变化的生理机制,指导鱼类健康养殖,为提高金钱鱼幼鱼的海水养殖效率以及拓展养殖空间提供理论依据。
1 材料与方法 1.1 实验材料与实验设计养殖实验在中国水产科学研究院东海水产研究所福鼎科研基地进行。实验用鱼为东海水产研究所海南琼海实验基地同一批人工繁育的金钱鱼幼鱼。暂养期间温度为(22±0.5)℃,盐度20,24 h充气泵充氧。暂养20 d后挑选健康无病,初始体质量为(6.27±0.28)g的金钱鱼幼鱼驯化至实验所需盐度。
实验设置6个盐度梯度:淡水和盐度5、10、20(对照组)、30和35,每个盐度梯度设置3个平行,每个平行随机放入30尾鱼。养殖容器采用体积为300 L的圆塑料桶。实验所用淡水来源于福鼎当地山泉水,盐度为0。盐度35、30的实验用水由当地海水(盐度20)与海水晶配制而成,盐度10和5的实验用水由自然海水和淡水按比例配制而成,并用盐度计进行校正。各实验组鱼驯化方法:从盐度20组开始驯化,每天增加或减少3个盐度,直至达到实验所需盐度,稳定3 d后养殖60 d。每天以鱼体质量的2%投喂“正大”牌浮性配合饲料(福州大福有限公司,主要营养成分:粗蛋白≥30%,粗脂肪≥3%,粗灰分≤14%,水分≤12%,粗纤维≤14%,总磷≥0.8%,赖氨酸≥1.43%),早晚各1次。实验期间不间断充气,保持水中溶氧质量浓度>6.5 mg/L,pH为7.9±0.1,水温为(22±0.5)℃。各盐度用水提前配制、曝气并进行盐度校正,3 d换水1次,每次换水量约为2/3,每天监测盐度变化,盐度波动在1以内,每天定时吸污。
1.2 存活率及生长数据的测定统计幼鱼死亡情况,实验结束时对金钱鱼幼鱼体长、体质量等指标进行测量,计算存活率(survival rate, SR)、肥满度(condition factor, CF)、增重率(weight gain rate, WGR)和特定增长率(specific growth rate, SGR),计算方法如下:
 (1)
(1)
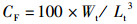 (2)
(2)
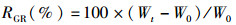 (3)
(3)
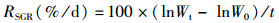 (4)
(4)
式中:RSR为存活率;RWGR为增重率;RSGR为特定增长率;N1、N2分别为t1和t2时实验鱼的尾数,尾;W0、Wt分别为实验开始和结束时鱼的体质量,g;Lt为实验结束时鱼的体长,cm;t为实验天数,d。
1.3 抗氧化指标的测定实验结束时饥饿24 h,每个平行随机取3尾鱼进行MS-222麻醉处理,在冰盘上解剖,取其肝脏、鳃、肌肉组织放入离心管中,迅速投入液氮冷冻,再转移到-80 ℃冰箱保存。所有样品带回实验室后,用于测定SOD、CAT、GPx、GST活力以及GSH和MDA含量。组织样品先用剪刀剪碎,准确称取0.2 g于玻璃匀浆管中,按质量与体积比1∶ 9加入生理盐水,于冰水浴下匀浆,以2 500 r/min离心10 min后取上清,然后分别稀释至所需浓度后进行酶活的测定。所有抗氧化酶活力、GSH、MDA及蛋白含量的测定均采用南京建成生物研究所提供的试剂盒。
1.4 数据处理实验数据采用平均值±标准差(Mean±SD)表示,运用SPSS 23.0统计软件进行单因素方差分析(ANOVA),并用Duncan’s检验法进行多重比较,P < 0.05表明差异显著。
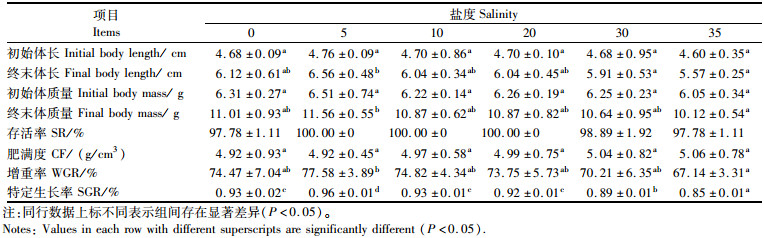
2 结果 2.1 盐度对金钱鱼幼鱼存活和生长的影响实验结束时各盐度组存活率为97.78%~100%,盐度5、10和对照组幼鱼的存活率最高,达100%,各组间存活率差异不显著(P>0.05)。金钱鱼幼鱼终末体长、终末体质量、增重率和特定生长率随盐度的升高均呈先升高后降低的趋势,且均在盐度为5时达到最高,其中终末体长、终末体质量和增重率显著高于盐度35组(P < 0.05)。盐度为5时,金钱鱼幼鱼的特定生长率为(0.96±0.01)%,显著高于其余盐度组(P < 0.05);盐度30和35组的特定生长率显著低于对照组(P < 0.05);淡水组和盐度10与对照组之间无显著性差异(P>0.05)。盐度对金钱鱼幼鱼肥满度的影响不显著(P>0.05)。见表 1。
|
表 1 不同盐度下金钱鱼幼鱼的存活和生长情况 Tab.1 Growth of juvenile Scatophagus argus at different salinities |
以金钱鱼幼鱼的特定生长率(SGR)为因变量(Y),盐度作为自变量(X)的二次回归方程为Y=-0.0001X2+0.0015X+0.9359 (R2=0.931 1)(P < 0.05),通过分析得到体质量为(6.27±0.28)g的金钱鱼幼鱼在本实验条件下理论上获得最大特定生长率的养殖盐度为7.5。见图 1。
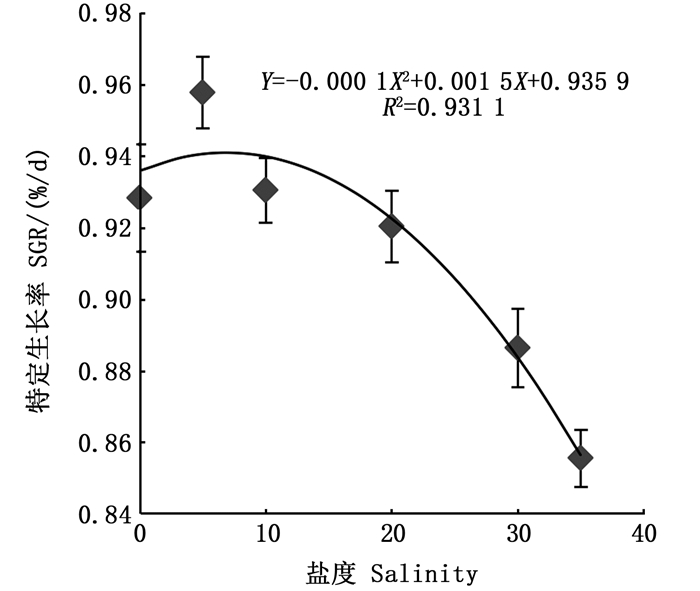
|
图 1 金钱鱼幼鱼的特定生长率与盐度之间的二次回归分析 Fig. 1 Quadratic regression analysis of specific growth rate with salinity for juveniles Scatophagus argus |
在同一盐度条件下,金钱鱼幼鱼不同组织间SOD、CAT、GPx、GST4种抗氧化酶活性和GSH含量差异显著,均为肝脏>鳃>肌肉(P < 0.05),且盐度对鳃和肌肉组织中4种抗氧化酶活力和GSH含量无显著性影响(P>0.05),见图 2~5。
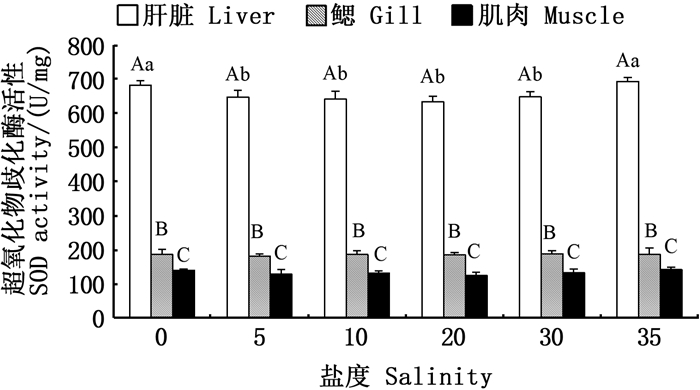
|
图标上方不同大写字母表示同一盐度下不同组织有显著性差异(P < 0.05);不同小写字母表示同一组织在不同盐度下有显著性差异(P < 0.05)。 Different upper case letters above the icon indicate significant differences in different tissues at the same salinity (P < 0.05); Different lowercase letters indicate that the same tissues has significant differences at different salinities (P < 0.05). 图 2 盐度对金钱鱼幼鱼肝脏、鳃、肌肉SOD活力的影响 Fig. 2 Effects of salinity on SOD activity in liver, gill and muscle of juvenile Scatophagus argus |
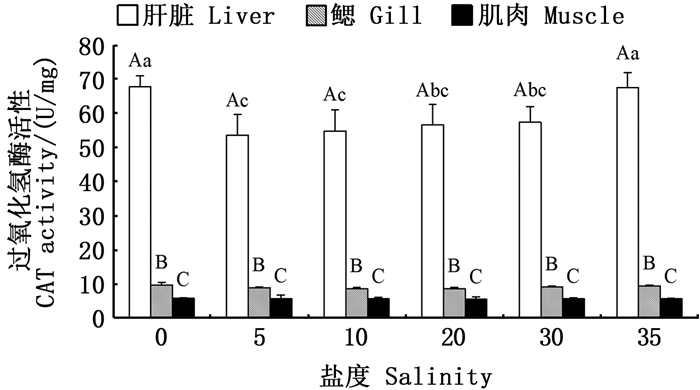
|
图标上方不同大写字母表示同一盐度下不同组织有显著性差异(P < 0.05);不同小写字母表示同一组织在不同盐度下有显著性差异(P < 0.05)。 Different upper case letters above the icon indicate significant differences in different tissues at the same salinity (P < 0.05); Different lowercase letters indicate that the same tissues has significant differences at different salinities (P < 0.05). 图 3 盐度对金钱鱼幼鱼肝脏、鳃、肌肉CAT活力的影响 Fig. 3 Effects of salinity on CAT activity in liver, gill and muscle of juvenile Scatophagus argus |
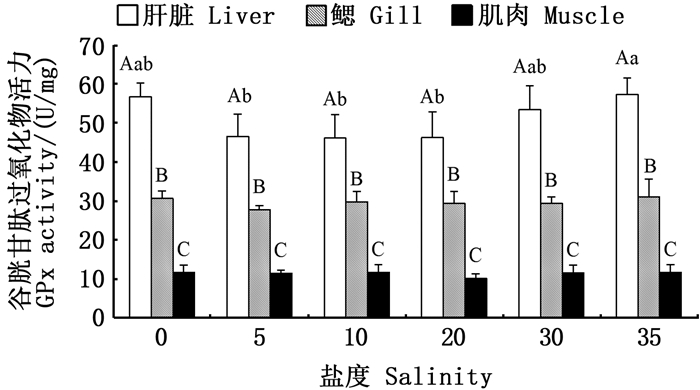
|
图标上方不同大写字母表示同一盐度下不同组织有显著性差异(P < 0.05);不同小写字母表示同一组织在不同盐度下有显著性差异(P < 0.05). Different upper case letters above the icon indicate significant differences in different tissues at the same salinity (P < 0.05); Different lowercase letters indicate that the same tissues has significant differences at different salinities (P < 0.05). 图 4 盐度对金钱鱼幼鱼肝脏、鳃、肌肉GPx活力的影响 Fig. 4 Effects of salinity on GPx activity in liver, gill and muscle of juvenile Scatophagus argus |
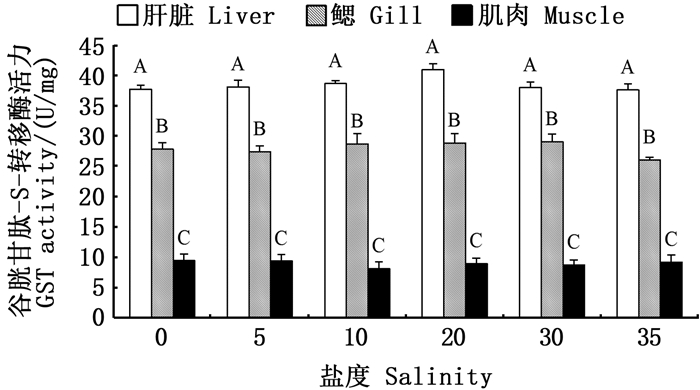
|
图标上方不同大写字母表示同一盐度下不同组织有显著性差异(P < 0.05)。 Different upper case letters above the icon indicate significant differences in different tissues at under the same salinity (P < 0.05). 图 5 盐度对金钱鱼幼鱼肝脏、鳃、肌肉GST活力的影响 Fig. 5 Effects of salinity on GST activity in liver, gill and muscle of juvenile Scatophagus argus |
淡水和盐度35条件下,金钱鱼幼鱼肝脏中SOD活力显著高于其他盐度组(P < 0.05),盐度为5、10和30时,肝脏SOD活力与对照组相比无显著性差异(P>0.05)。见图 2。
淡水组肝脏中CAT活力与盐度35组之间差异不显著(P>0.05),但二者均显著高于其余盐度组(P < 0.05)。盐度5、10、30与对照组相比,肝脏CAT活力无显著性差异(P>0.05)。见图 3。
盐度35组肝脏中GPx活力与淡水组和盐度30组相比无显著差异(P>0.05),但显著高于盐度5、10和对照组(P < 0.05)。见图 4。
盐度对各组织中GST活力和GSH含量均无显著性影响(P>0.05)。金钱鱼幼鱼肝脏和鳃中的GSH含量在淡水组和盐度35高盐组中较高,但与其余盐度组相比无显著性差异(P>0.05)。见图 5~6。
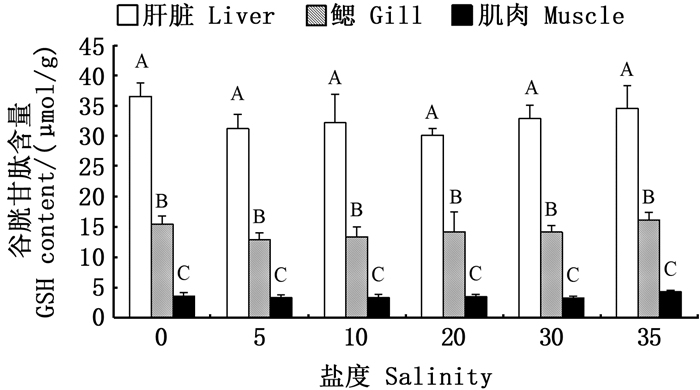
|
图标上方不同大写字母表示同一盐度下不同组织有显著性差异(P < 0.05)。 Different upper case letters above the icon indicate significant differences indifferent tissues at the same salinity (P < 0.05). 图 6 盐度对金钱鱼幼鱼肝脏、鳃、肌肉GSH含量的影响 Fig. 6 Effects of salinity on GSH contents in liver, gill and muscle of juvenile Scatophagus argus |
如图 7所示:在相同盐度下,不同组织中MDA含量依次为肝脏>鳃>肌肉,鳃与肌肉组织中MDA含量在不同盐度组间均无显著差异(P>0.05);盐度为35时,肝脏中MDA含量最高,且显著高于盐度5、10、20和30(P < 0.05),但与淡水组间没有显著差异(P>0.05);盐度5、10和30处理组与对照组相比,肝脏中MDA含量差异不显著(P>0.05)。
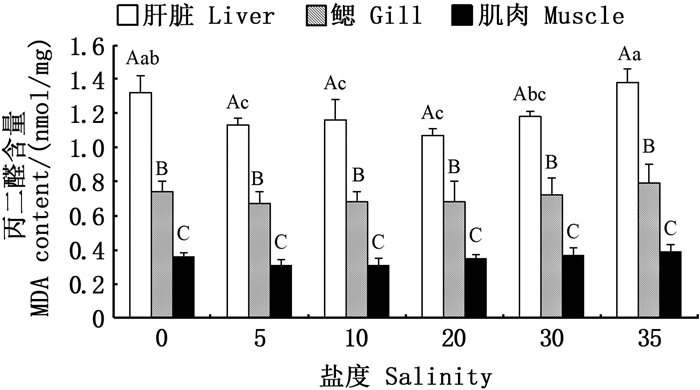
|
图标上方不同大写字母表示同一盐度下不同组织有显著性差异(P < 0.05);不同小写字母表示同一组织在不同盐度下有显著性差异(P < 0.05)。 Different upper case letters above the icon indicate significant differences in different tissues at the same salinity (P < 0.05); Different lowercase letters indicate that the same tissues has significant differences at different salinities (P < 0.05). 图 7 盐度对金钱鱼幼鱼肝脏、鳃、肌肉MDA含量的影响 Fig. 7 Effects of salinity on MDA contents in liver, gill and muscle of juvenile Scatophagus argus |
研究表明,金钱鱼幼鱼经驯化在0~35盐度范围内有很强的适应性。与金钱鱼相似,花鲈(Lateolabrax maculatus)[22]也是广温和广盐性鱼类,苗种经淡化驯养后可在淡水中生存,适合开展淡水大规模集约化养殖。金钱鱼幼鱼在淡水中的存活率高达(97.78±1.11)%,表明开展金钱鱼淡化养殖推广具有技术可行性。
在不同盐度下,金钱鱼幼鱼的生长情况存在差异。MOOKKAN等[18]研究发现金钱鱼幼鱼在盐度为5时的特定生长率最高,在盐度为30时的特定生长率最低。仲勇[17]发现在盐度为2时金钱鱼幼鱼生长速度较快,在盐度35条件下生长速度较慢。与以上结果类似,本研究中,在高盐环境(30~35)下金钱鱼幼鱼生长缓慢,而在低盐环境(5~10)下具有生长优势。仲勇设置的盐度梯度仅为2、25和35,本研究所设置的盐度范围广且梯度较多,进一步筛选出金钱鱼幼鱼适宜生长的盐度区间为5~10。刘龙龙等[23]认为鱼类代谢率可能与自然栖息地及生活史阶段有关,鱼类某一阶段在最常出现的栖息地环境中代谢率最低。自然环境中发现金钱鱼幼鱼时常会出现在河口淡咸水区域(盐度6~8)[1],推测在此环境下金钱鱼幼鱼用于渗透调节和代谢的能量相对较少,用于生长的能量较多,而在高盐条件下,金钱鱼需消耗更多能量来调节渗透压,导致生长变缓。因此,盐度的正确选择是提高养殖效率的重要因素,结合金钱鱼幼鱼特定生长率与盐度之间的二次回归分析可知,低盐(盐度为7.5)环境下,特定生长率达到最高,养殖更高效,可为养殖实践提供参考。
3.2 盐度对金钱鱼幼鱼抗氧化系统的影响本研究中,在同一盐度下,在肝脏抗氧化系统相关指标显著高于鳃和肌肉组织。同其他鱼类[24]相似,肝脏也是金钱鱼幼鱼发挥抗氧化功能的主要组织,其抗氧化防御体系高度发达,抗氧化酶活力最高。GHANAVATINASAB等[25]发现环境盐度的变化不影响斑点黄鳍鲷(Acanthopagrus sheim)鳃中抗氧化酶的活性和抗氧化剂的原氧平衡;王妤等[4]发现篮子鱼经40 d的盐度驯化后肌肉中抗氧化酶的活性与对照组水平一致。本研究结果与之相似,盐度对鳃和肌肉中的抗氧化状态影响不显著。这说明肝脏、鳃和肌肉对盐度变化的响应具有组织特异性,对氧化应激可能有不同的应对机制。
SOD与CAT是鱼体应对氧化损伤的两种重要的抗氧化酶,SOD催化机体内的超氧化物经歧化反应转化为O2和H2O2,但过多的H2O2也会对细胞造成毒害,CAT能够将H2O2转化为H2O,降低损伤[9]。本研究发现在淡水和盐度35条件下肝脏中SOD活性较其余盐度组高,表明淡水和高盐环境下鱼体出现了一定程度的氧化应激,为清除细胞内产生的多余自由基,SOD活性升高。相应地,淡水组与盐度35处理组肝脏中CAT活力也较高,这一结果与在多鳞四指马鲅[10]研究中的现象一致。本研究发现,金钱鱼幼鱼的肝脏中,SOD在各盐度下的整体活力水平较高,高于条石鲷(Oplegnathus fasciatus)[26]、云纹石斑鱼(Epinehelus moara)[27]、钝吻黄盖鲽(Pleuronectes yokohama)[28]、花鲈[29]等鱼类,初步推测金钱鱼应对环境变化有较强的抗逆性和较高的存活率也与其体内高度发达的SOD酶系有关。
鱼体内发生氧化应激时,GPx以GSH作为底物,进而催化H2O2和氢过氧化物降解[30]。在本研究中,淡水组和高盐组肝脏中GPx活性较高,与SOD和CAT活性保持一致,这与盐度对大菱鲆(Scophthalmus maximus)[31]幼鱼的研究结果相似,当盐度为5时,大菱鲆幼鱼肝脏中SOD、CAT与GPx活力水平均较高,推测GPx与CAT协同发挥作用,共同降解氢过氧化物,维持内环境稳定。刘永士等[32]研究发现随着盐度升高,金钱鱼幼鱼SOD、CAT和GPx的活性基本呈降低趋势,而在本研究中,淡水组和高盐组SOD、CAT和GPx活性较高,其原因可能是前者养殖时间为70 d,长于本研究的养殖时间,抗氧化酶活力水平发生了变化。该推测与鲜博等[33]的研究结果一致,刀鲚(Coilia nasus)在不同盐度下养殖50 d时,盐度环境造成刀鲚出现氧化应激,使得盐度组肝脏中SOD、CAT和MDA水平高于淡水组,但长期的盐度胁迫应激造成鱼体抗氧化能力下降,135 d时盐度组肝脏中SOD和CAT活力低于淡水组。此外,刘永士等[32]的研究对象是野生金钱鱼幼鱼,而本研究采用的是人工繁育的金钱鱼幼鱼,在抗氧化水平上可能存在一定差异。
GST具有消除体内自由基和解毒的功能,并对生物机体肝脏的早期损伤诊断具有一定的参考价值[34]。研究[26]发现,条石鲷幼鱼在盐度28骤变为48时,其肝脏中GST活力在6 h时迅速上升至最高,然后酶活力水平回落并趋于稳定。本研究中GST活力在各盐度组间差异不显著的原因可能是随盐度处理时间的延长,组织中GST活力已恢复至对照组水平,或盐度处理对金钱鱼幼鱼肝脏GST活性产生的影响较小,肝脏未产生损伤。以上仅为初步探讨,还需进一步验证。GSH是一种重要的非酶抗氧化剂,能够清除体内的自由基[12]。张晨捷等[35]发现,银鲳经低盐胁迫后其肝脏中的GSH含量先升高后降低,趋于稳定。在本研究中,在淡水和盐度35条件下,肝脏中的GSH含量较高但无显著性差异,推测肝脏中GSH含量已趋于正常水平。
MDA是细胞氧化代谢产物,一般在正常的生理状态下,体内的MDA含量很低。在淡水与盐度35条件下,肝脏中MDA含量较高,表明淡水和高盐加强了金钱鱼幼鱼肝脏中脂质过氧化反应,MDA含量升高,相比之下,盐度5、10和20盐度组金钱鱼幼鱼各组织中MDA含量较低,表明机体受自由基攻击较弱。本研究发现MDA含量与SOD和CAT的活力表现出相同的变化趋势,这一结果与多鳞四指马鲅[10]、革胡子鲇(Claries lazera)[36]、褐牙鲆[37]的研究结果一致。
4 结语综上所述,金钱鱼幼鱼的盐度适应性极强,在盐度0~35的范围内都有很高的存活率,淡水养殖具有很好的推广养殖前景,但低盐环境更适合金钱鱼幼鱼的快速生长,并且淡水和高盐环境能够引起金钱鱼幼鱼体内产生氧化应激,鱼体抗氧化系统通过提高抗氧化酶活力抵抗氧化应激,以维持机体的正常功能。综上所述,推荐金钱鱼幼鱼养殖的适宜盐度范围为5~10。
| [1] |
兰国宝, 阎冰, 廖思明, 等. 金钱鱼生物学研究及回顾[J]. 水产科学, 2005, 24(7): 39-41. LAN G B, YAN B, LIAO S M, et al. Biology of spotted scat Scatophagus argus: a review[J]. Fisheries Science, 2005, 24(7): 39-41. DOI:10.3969/j.issn.1003-1111.2005.07.013 |
| [2] |
杨尉, 陈华谱, 江东能, 等. 金钱鱼生物学及繁养殖技术研究进展[J]. 生物学杂志, 2018, 35(5): 104-108. YANG W, CHEN H P, JIANG D N, et al. An overview on biology and artificial propagation and culture in the spotted scat Scatophagus argus[J]. Journal of Biology, 2018, 35(5): 104-108. DOI:10.3969/j.issn.2095-1736.2018.05.104 |
| [3] |
蔡泽平, 胡家玮, 王毅. 金钱鱼早期发育的观察[J]. 热带海洋学报, 2014, 33(4): 20-25. CAI Z P, HU J W, WANG Y. Observing early development of Scatophagus argus[J]. Journal of Tropical Oceanography, 2014, 33(4): 20-25. DOI:10.3969/j.issn.1009-5470.2014.04.002 |
| [4] |
王妤, 庄平, 章龙珍, 等. 盐度对点篮子鱼的存活、生长及抗氧化防御系统的影响[J]. 水产学报, 2011, 35(1): 66-73. WANG Y, ZHUANG P, ZHANG L Z, et al. Effects of salinity on survival, growth and antioxidant defense system of Siganus guttatus[J]. Journal of Fisheries of China, 2011, 35(1): 66-73. |
| [5] |
BIRNIE-GAUVIN K, COSTANTINI D, COOKE S J, et al. A comparative and evolutionary approach to oxidative stress in fish: a review[J]. Fish and Fisheries, 2017, 18(5): 928-942. DOI:10.1111/faf.12215 |
| [6] |
刘玲, 陈超, 李炎璐, 等. 短期低盐度胁迫对驼背鲈(♀)×鞍带石斑鱼(♂)杂交子代幼鱼抗氧化及消化生理的影响[J]. 海洋科学, 2018, 42(2): 78-87. LIU L, CHEN C, LI Y L, et al. Effects of short-term salinity stress on antioxidant and digestive physiology of hybrid progeny (Cromilepptes altivelis ♀ × Epinephelus lanceolatus ♂)[J]. Marine Sciences, 2018, 42(2): 78-87. |
| [7] |
房子恒, 田相利, 董双林. 低盐驯化对半滑舌鳎幼鱼生长、渗透生理及糖代谢酶活力影响的研究[J]. 中国海洋大学学报, 2016, 46(8): 19-27. FANG Z H, TIAN X L, DONG S L. The growth performance, osmotic physiology and carbohydrate metabolism activity of juvenile Cynoglossus semilaevis acclimated to low salinity water[J]. Periodical of Ocean University of China, 2016, 46(8): 19-27. |
| [8] |
边平江, 邱成功, 徐善良, 等. 盐度对暗纹东方鲀生长、非特异性免疫和抗氧化酶活力的影响[J]. 水生生物学报, 2014, 38(1): 108-114. BIAN P J, QIU C G, XU S L, et al. Effects of salinity on growth, activity of non-specific immune and antioxidant enzymes in obscure puffer Takifugu obscures[J]. Acta Hydrobiologica Sinica, 2014, 38(1): 108-114. |
| [9] |
尹飞, 孙鹏, 彭士明, 等. 低盐度胁迫对银鲳幼鱼肝脏抗氧化酶、鳃和肾脏ATP酶活力的影响[J]. 应用生态学报, 2011, 22(4): 1059-1066. YIN F, SUN P, PENG S M, et al. Effects of low salinity stress on the antioxidant enzyme activities in juvenile Pampus argenteus liver and the APTase activities in its gill and kidney[J]. Chinese Journal of Applied Ecology, 2011, 22(4): 1059-1066. |
| [10] |
张琴星, 张涛, 侯俊利, 等. 盐度变化对多鳞四指马鲅幼鱼鳃丝Na+/K+-ATP酶及肝脏抗氧化酶活性的影响[J]. 海洋渔业, 2013, 35(3): 324-330. ZHANG Q X, ZHANG T, HOU J L, et al. Effects of salinity on activities of gill Na+/K+-ATPase and liver antioxidase in juvenile Eleutheronema rhadinum[J]. Marine Fisheries, 2013, 35(3): 324-330. |
| [11] |
CHOI C Y, AN K W, AN M I. Molecular characterization and mRNA expression of glutathione peroxidase and glutathione S-transferase during osmotic stress in olive flounder (Paralichthys olivaceus)[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2008, 149(3): 330-337. |
| [12] |
SINHA A K, ABDELGAWAD H, ZINTA G, et al. Nutritional status as the key modulator of antioxidant responses induced by high environmental ammonia and salinity stress in European sea bass (Dicentrarchus labrax)[J]. PLoS One, 2015, 10(8): e0135091. |
| [13] |
PAPADIMITRIOU E, LOUMBOURDIS N S. Exposure of the frog Rana ridibunda to Copper: impact on two biomarkers, lipid peroxidation, and glutathione[J]. Bulletin of Environmental Contamination and Toxicology, 2002, 69(6): 885-891. |
| [14] |
王奇, 范灿鹏, 陈锟慈, 等. 三种磺胺类药物对罗非鱼肝脏组织中谷胱甘肽转移酶(GST)和丙二醛(MDA)的影响[J]. 生态环境学报, 2010, 19(5): 1014-1019. WANG Q, FAN C P, CHEN K C, et al. Effects of three typical sulfonamides on GST activity and MDA content in liver tissue of Oreochromis niloticus[J]. Ecology and Environmental Sciences, 2010, 19(5): 1014-1019. |
| [15] |
MU X J, SU M L, GUI L, et al. Comparative renal gene expression in response to abrupt hypoosmotic shock in spotted scat (Scatophagus argus)[J]. General and Comparative Endocrinology, 2015, 215: 25-35. |
| [16] |
梁雪梅. 催乳素在金钱鱼盐度适应过程中的机理研究[D]. 上海: 上海海洋大学, 2018. LIANG X M. Studies about the role of prolactin in osmoregulation of the spotted scat (Scatophagus argus) response to environmental salinity change[D]. Shanghai: Shanghai Ocean University, 2018. |
| [17] |
仲勇. 盐度影响金钱鱼生长及渗透相关基因的表达[D]. 上海: 上海海洋大学, 2019. ZHONG Y. Effects of salinity on growth and osmotic gene expression in spotted scat (Scatophagus argus)[D]. Shanghai: Shanghai Ocean University, 2019. |
| [18] |
MOOKKAN M, MUNIYANDI K, RENGASAMY T A, et al. Influence of salinity on survival and growth of early juveniles of spotted scat Scatophagus argus (Linnaeus, 1766)[J]. Indian Journal of Innovations and Developments, 2014, 3(2): 23-29. |
| [19] |
SU M L, DUAN Z Y, SHI H W, et al. The effects of salinity on reproductive development and egg and larvae survival in the spotted scat Scatophagus argus under controlled conditions[J]. Aquaculture Research, 2019, 50(7): 1782-1794. |
| [20] |
XU J B, SHUI C, SHI Y H, et al. Effect of salinity on survival, growth, body composition, oxygen consumption, and ammonia excretion of juvenile spotted scat[J]. North American Journal of Aquaculture, 2020, 82(1): 54-62. |
| [21] |
盘润洪, 骆明飞. 金钱鱼池塘淡化养殖试验[J]. 海洋与渔业, 2008(8): 43-44. PAN R H, LUO M F. Experiment of desalination culture in pond of spotted scat[J]. Ocean & Fishery, 2008(8): 43-44. |
| [22] |
王勇, 吴宾. 花鲈淡水大规模集约化养殖技术[J]. 福建农业, 2015(3): 87. WANG Y, WU B. Intensive freshwater aquaculture on a large scale of Lateolabrax maculatus[J]. Fujian Agriculture, 2015(3): 87. |
| [23] |
刘龙龙, 罗鸣, 陈傅晓, 等. 盐度对珍珠龙胆石斑鱼幼鱼渗透调节与耗氧率的影响[J]. 中国水产科学, 2020, 27(6): 692-700. LIU L L, LUO M, CHEN F X, et al. Influence of salinity on osmoregulation and oxygen consumption rate in juvenile hybrid grouper (Epinephelus lanceolatus ♂×Epinephelus fuscoguttatus ♀)[J]. Journal of Fishery Sciences of China, 2020, 27(6): 692-700. |
| [24] |
赵峰, 庄平, 章龙珍, 等. 施氏鲟不同组织抗氧化酶对水体盐度升高的响应[J]. 海洋水产研究, 2008, 29(5): 65-69. ZHAO F, ZHUANG P, ZHANG L Z, et al. Responses of antioxidases in different tissues of Acipenser schrenckii to increased salinity in water[J]. Marine Fisheries Research, 2008, 29(5): 65-69. |
| [25] |
GHANAVATINASAB Y, SALATI A P, MOVAHEDINIA A, et al. Changes in gill antioxidant status in Acanthopagrus sheim exposed to different environmental salinities[J]. Iranian Journal of Science and Technology, Transactions A: Science, 2019, 43(4): 1479-1483. |
| [26] |
孙鹏, 尹飞, 彭士明, 等. 盐度对条石鲷幼鱼肝脏抗氧化酶活力的影响[J]. 海洋渔业, 2010, 32(2): 154-159. SUN P, YIN F, PENG S M, et al. Effects of salinity on the activity of antioxidant enzymes in livers of juvenile Oplegnathus fasciatus[J]. Marine Fisheries, 2010, 32(2): 154-159. |
| [27] |
廖雅丽, 张晨捷, 彭士明, 等. 盐度对云纹石斑鱼抗氧化酶及溶菌酶活性的影响[J]. 上海海洋大学学报, 2016, 25(2): 169-176. LIAO Y L, ZHANG C J, PENG S M, et al. Effects of salinity on activities of liver antioxidant enzymes and plasma lysozyme of Epinehelus moara[J]. Journal of Shanghai Ocean University, 2016, 25(2): 169-176. |
| [28] |
崔前进, 陈冰, 邱丽华, 等. 低盐胁迫对钝吻黄盖鲽幼鱼鳃Na+/K+-ATP酶、肝脏抗氧化酶和非特异免疫酶的影响[J]. 广东海洋大学学报, 2017, 37(6): 26-32. CUI Q J, CHEN B, QIU L H, et al. Influence of low salinity stress on the gill Na+/K+-ATPase, liver antioxidase and non-specific immune enzyme in juvenile Pleuronectes yokohama[J]. Journal of Guangdong Ocean University, 2017, 37(6): 26-32. |
| [29] |
温久福, 蓝军南, 周慧. 盐度对花鲈幼鱼消化酶和抗氧化系统的影响[J]. 动物学杂志, 2019, 54(5): 719-726. WEN J F, LAN J N, ZHOU H. Effects of salinity on digestive enzymes and antioxidant system of juvenile Lateolabrax maculatus[J]. Chinese Journal of Zoology, 2019, 54(5): 719-726. |
| [30] |
DOYEN P, BIGOT A, VASSEUR P, et al. Molecular cloning and expression study of pi-class glutathione S-transferase (pi-GST) and selenium-dependent glutathione peroxidase (Se-GPx) transcripts in the freshwater bivalve Dreissena polymorpha[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2008, 147(1): 69-77. |
| [31] |
郭黎, 马爱军, 王新安, 等. 盐度和温度对大菱鲆幼鱼抗氧化酶活性的影响[J]. 大连海洋大学学报, 2012, 27(5): 422-428. GUO L, MA A J, WANG X A, et al. Effects of temperature and salinity on the activities of antioxidant enzymes of juvenile turbot Scophthalmus maximus[J]. Journal of Dalian Ocean University, 2012, 27(5): 422-428. |
| [32] |
刘永士, 徐嘉波, 施永海, 等. 盐度对金钱鱼幼鱼消化酶和抗氧化酶活性的影响[J]. 水产科技情报, 2020, 47(4): 181-185. LIU Y S, XU J B, SHI Y H, et al. Effects of salinities on activities of digestive and antioxidant enzymes in young fish Scatophagus argus[J]. Fisheries Science & Technology Information, 2020, 47(4): 181-185. |
| [33] |
鲜博, 高建操, 徐钢春, 等. 盐度对刀鲚生长、抗氧化应激和渗透压调节能力的影响[J]. 海洋湖沼通报, 2020(2): 152-159. XIAN B, GAO J C, XU G C, et al. Influence of salinity on the growth, digestive ability, antioxidant ability and osmoregulation of Coilia nasus[J]. Transactions of Oceanology and Limnology, 2020(2): 152-159. |
| [34] |
瞿建宏, 陈家长, 胡庚东, 等. 苯酚胁迫下罗非鱼组织中过氧化氢酶与谷胱甘肽-S-转移酶的动态变化[J]. 生态环境, 2006, 15(4): 687-692. QU J H, CHEN J Z, HU G D, et al. Dynamic changes of catalase and glutathione-s-transferase in the different tissues of tilapia exposed to phenol[J]. Ecology and Environment, 2006, 15(4): 687-692. |
| [35] |
张晨捷, 高权新, 施兆鸿, 等. 低盐度和不同硫酸铜浓度对银鲳鳃离子调节酶和肝抗氧化功能的影响[J]. 中国水产科学, 2014, 21(4): 711-719. ZHANG C J, GAO Q X, SHI Z H, et al. The effects of low salinity and different CuSO4 concentrations on gill ion-regulatory enzyme activities and liver antioxidant function in sil-ver pomfret[J]. Journal of Fishery Sciences of China, 2014, 21(4): 711-719. |
| [36] |
季延滨, 孙学亮, 陈成勋. 盐度对革胡子鲇部分抗氧化指标的影响[J]. 江苏农业科学, 2014, 42(8): 233-235. JI Y B, SUN X L, CHEN C X. Effects of salinity on some antioxidant indexes of Catfish japonicas[J]. Jiangsu Agricultural Sciences, 2014, 42(8): 233-235. |
| [37] |
郭勤单, 王有基, 吕为群. 温度和盐度对褐牙鲆幼鱼渗透生理及抗氧化水平的影响[J]. 水生生物学报, 2014, 38(1): 58-67. GUO Q D, WANG Y J, LYU W Q. Combined effects of temperature and salinity on the physiological osmotic induction and antioxidant responses in the juvenile Japanese flounder (Paralichthys olivaceus)[J]. Acta Hydrobiologica Sinica, 2014, 38(1): 58-67. |
2. East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China;
3. Key Scientific Observing and Experimental Station of Fisheries Resource and Environment in the Yangtze Estuary and East China Sea, Ministry of Agriculture and Rural Affairs, Shanghai 200090, China
 2022,
Vol. 31
2022,
Vol. 31


