2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306;
3. 食品科学与工程国家级实验教学示范中心, 上海 201306
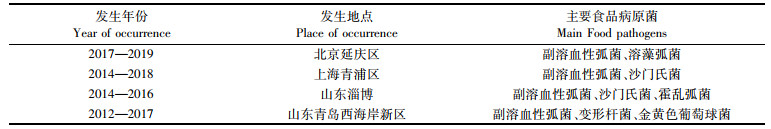
我国是水产养殖大国,《2020年中国渔业统计年鉴》[1]显示,2019年水产品总量达6 480万t。水产品中含有丰富的蛋白质与微量元素,营养价值高,在我国居民膳食宝塔中占有重要位置,其食用安全性也备受关注[2]。食源性疾病是指食品中致病因素进入人体引起的感染性与中毒性等疾病[3]。该疾病是当今世界最广泛的公共卫生问题之一,更是食品安全问题的关键[4]。2003—2017年,我国食源性疾病暴发监测系统共报告了19 517次暴发事件,引起疾病235 754例、住院107 470例与死亡1 457例[5]。食源性疾病事件中多数由致病菌引起,其中水产品占有相当的比例[6],见表 1。
|
表 1 我国部分地区水产品食源性疾病暴发情况分布 Tab.1 Distribution of foodborne disease outbreaks in aquatic products at some areas in China |
由表 1可知,北京延庆区、上海青浦区、山东淄博和青岛均为我国部分水产较丰富地区,食品监测结果中水产品致病菌检出率最高。其中,副溶血性弧菌为最常见的致病菌,其次为沙门氏菌、溶藻弧菌、霍乱弧菌等。因此,开展水产品安全控制研究极为重要。当前对水产品中病原菌的控制主要以抗生素为主,而大量抗生素的使用导致耐药细菌的出现,因此迫切需要寻求一种新方法来控制病原菌生长。
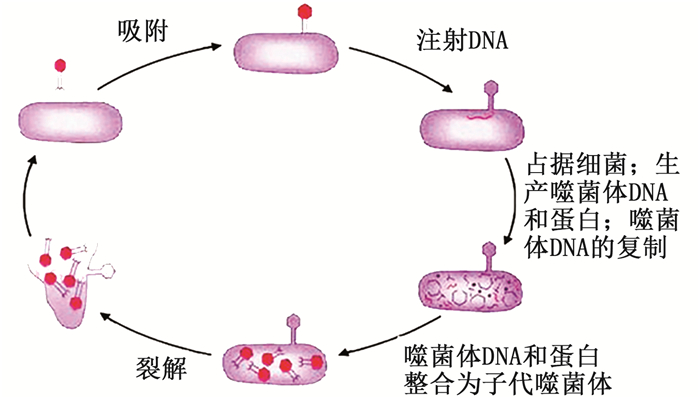
噬菌体是一种高特异性感染细菌细胞的病毒,为地球上最丰富的生物之一。研究[11]表明,噬菌体主要分为温和噬菌体与烈性噬菌体,在医学、制药、动物育种与食品加工等领域应用广泛。温和噬菌体因其遗传物质结合在溶原细胞中,而不适于杀灭病原菌[12];烈性噬菌体可通过裂解攻击细菌,利用细菌的营养物质进行繁殖,直至将所有细菌全部裂解,其对靶细菌具有高度特异性,可定向杀灭特定致病菌[13]。见图 1 [14]。
|
图 1 烈性噬菌体侵入过程示意图 Fig. 1 Invasion process of virulent phage |
20世纪20年代,TWORT与HERELLE研究发现噬菌体能有效杀灭病原菌,可用于治疗人体细菌感染,将此法称为噬菌体疗法,此疗法一经问世后便得到快速发展[12]。然而由于其缺乏科学数据辅证,美国制药和化学委员会在开展噬菌体疗法的潜在与安全性研究后,建议停止使用噬菌体治疗。弗莱明青霉素的发现使医疗行业进入抗生素时代,暂时停止了噬菌体治疗研究[12]。抗生素是抵御细菌感染的第一道防线,在水产养殖疾病控制中发挥着重要作用[15]。然而,随着抗生素的滥用,细菌的耐药性逐渐增强,耐药菌株随之出现,这些菌株同目前水产品高发病率与死亡率有关[16]。如PATEL等[17]对印度养虾场水源地抗药性沙门氏菌的流行情况进行调查,鉴定出高抗药性沙门氏菌为蒙得维的亚沙门氏菌,属新型食源性致病菌。鉴于抗生素抗性细菌的数量迅速增多,噬菌体疗法再次被认定为经典的替代疗法[18]。
本文拟在介绍噬菌体定义与作用机制的基础上,综述噬菌体对水产品中致病菌作用的相关研究进展,分析其杀灭病原菌的局限性与发展潜力,判断其作为生物抑菌剂的可行性,以期为噬菌体在水产品安全中的应用提供理论参考。
1 噬菌体对水产品中主要病原菌的作用 1.1 副溶血性弧菌副溶血性弧菌(Vibrio parahaemolyticus)是一种革兰氏阴性嗜盐与中温细菌,主要从鱼、虾、牡蛎与蛤蜊等水产品中分离,为引起肠胃炎与败血症的主要食源性病原体[19]。随着我国经济的蓬勃发展,国民人均水产品消费量迅速增加,副溶血性弧菌被报道为导致食源性细菌中毒的主因[20]。目前,国内外已有研究人员开展了噬菌体抑制副溶血性弧菌的研究工作。郑小双[21]将106 PFU/mL副溶血性弧菌噬菌体联合600 μg/mL柠檬酸作为一种新型生物抑菌剂,用于抑制三文鱼中副溶血性弧菌的生长,发现其可显著降低柠檬酸的用量,使三文鱼的感官品质及营养价值得到较好保持;同时,其还使用副溶血性弧菌污染黄鱼,模拟噬菌体混合悬液对污染黄鱼的抑菌效果,结果得出高浓度噬菌体混合悬液可有效抑制鱼片中多个致病性副溶血性弧菌菌株的生长,菌株失活效率与噬菌体浓度正相关[22];江艳华等[23]对1株副溶血性弧菌裂解性噬菌体VpJYP2进行生物学特性分析,探讨其对生三文鱼片中副溶血性弧菌的抑菌效果,结果表明VpJYP2能显著降低生三文鱼片中副溶血性弧菌数,且噬菌体浓度越高,抑菌效果越显著;STALIN等[24]从斑节对虾中分离并鉴定副溶血性弧菌及潜在裂解噬菌体,得出副溶血性弧菌噬菌体对副溶血性弧菌有较好的抑制作用,分离出的溶藻噬菌体(VVP1)对副溶血性弧菌特异性较强;YIN等[25]研究了噬菌体对水产品中副溶血性弧菌生物膜的破坏能力,得出3种噬菌体有效控制了菌体生物膜的形成,其可能是水产品中控制副溶血性弧菌生长的有效制剂。
1.2 沙门氏菌肠炎沙门氏菌(Salmonella)血清型伤寒沙门氏菌是一种非伤寒的食源性病原体,可引起人类急性小肠结肠炎、菌血症与肠外局灶性感染[26]。据报道,全世界每年约有9 380万例胃肠炎病例由沙门氏菌引起,导致15.5万人死亡。在我国,由沙门氏菌引发的食源性疾病占22.2%,每年致病903万例、死亡800例[27]。沙门氏菌并非水生动物正常菌群的组成部分,这些细菌在水产品中存在主要由于污水污染和粪便、运输或储存过程中的交叉污染所致[28]。水产品在从捕获或养殖到销售的整个价值链中的任何地方都可能发生污染,高温长时间烹饪会杀死沙门氏菌[29]。然而,水产食品通常以生食为主,这就可能对人类构成危险[30]。其中:LU等[26]从废水中分离到新型沙门氏菌噬菌体vB_ SenS_SE1,其能有效杀灭沙门氏菌且无毒性基因,在防治致病菌方面具有较好的应用前景;仇笑笑[31]通过对沙门氏菌烈性噬菌体分离鉴定与生物学特性研究得出,噬菌体CR5是一种长尾科裂解性噬菌体,对沙门氏菌生长有良好的抑制效果;许东勤[32]研究了噬菌体对三文鱼与扇贝柱中沙门氏菌的控制作用,结果表明当噬菌体SLMP1浓度为108 PFU/g时,对沙门氏菌的抑制效果最显著。
1.3 溶藻弧菌溶藻弧菌(Vibrio alginolyticus)是最严重的机会致病菌之一,其可导致鱼类、贝类和珍珠牡蛎中的弧菌感染[33]。食用受溶藻弧菌污染的海产品可能引发腹泻、肠胃炎等疾病。耐多药溶藻毒素的出现和抗生素的禁用都要求开发新的抗毒策略与具有替代作用方式的治疗药物[34]。提供一种溶藻弧菌噬菌体与噬菌体组合物,并加以应用成为当务之急。其中:GAO等[35]从海南省三亚市海水中分离到一种新型溶藻弧菌噬菌体VAP7,可感染31株溶藻弧菌,其代表了一个潜在的用于噬菌体治疗的候选菌株;毕晓泽[36]以溶藻弧菌噬菌体PVA1为主要研究对象,考察其治疗效果和安全性,结果得出该溶藻弧菌具有良好的抑菌效果且安全性高,并通过实际应用验证了其治疗效果,其可使感染了由溶藻弧菌引起弧菌病的大菱鲆生存率显著提高;中国科学院青岛生物能源与过程研究所[37]筛选获得两株新的烈性溶藻弧菌噬菌体,其宿主专一性强,对溶藻弧菌具有强力裂解和杀灭作用;欧阳敏等[34]以溶藻弧菌VAf 211为宿主菌,分离纯化获得裂解性噬菌体,得到1株溶藻弧菌烈性噬菌体,其能显著抑制宿主菌在鱼汁中的增长,抑制溶藻弧菌生物被膜的形成;LE等[38]研究探讨弧菌特异性噬菌体对牡蛎中弧菌的作用效果,得出将该噬菌体应用于致病性弧菌悬浮液中,可在2 h内显著减少弧菌数量。
1.4 霍乱弧菌霍乱弧菌(Vibrio cholerae)是一种致病细菌,造成严重急性腹泻病霍乱的主要毒素为霍乱毒素[39],可引起人类严重腹泻。每年在全球范围内造成数千人死亡,是影响蛤蜊和牡蛎等水产品商业化的主要问题[15]。其中:SARKAR等[40]分离出5种新的霍乱噬菌体,其具有较宽的裂解霍乱弧菌抑菌谱;蔡俊鹏等[41]以霍乱弧菌为宿主菌,采用双层平板法从鲍鱼养殖环境中分离到5株霍乱弧菌噬菌体,同时还以23株弧菌为宿主菌,研究了霍乱弧菌噬菌体对海产品中常见弧菌的裂解消除能力,结果表明,5株Sh10霍乱弧菌噬菌体能使23菌株弧菌属的海洋弧菌交叉裂解,裂解率达91.3%,表明霍乱弧菌噬体在消除海产品食源性致病弧菌方面具有较好的应用前景。
1.5 其他细菌除以上水产品病原菌外,还有部分致病菌存在于水产品中。金黄色葡萄球菌(Staphylococcus aureus)是一种主要的食源性致病菌,可引起人类严重疾病[42],其广泛分布于如空气、灰尘与家居用品等环境中,通过不同机制对用于治疗的抗生素产生耐药性,其可能感染水产品引起食源性疾病[43]。高明明等[44]以多重耐药的金黄色葡萄球菌为宿主菌分离噬菌体,得到1株vB_SauH_IME522金黄色葡萄球菌噬菌体,其具有较强的裂解与短潜伏期能力。单增李斯特菌(Listeria monocytogenes)是革兰氏阳性杆菌,对免疫低下人群会引起菌血症与中枢神经系统感染等侵袭性疾病,该病原菌也存在于水产品中[45]。AXELSSON等[46]模拟了商业生产中鱼类受单增李斯特菌污染的可能情况。从鲑鱼业来看,这种污染途径非常普遍。在鲑鱼发酵和成熟期间添加噬菌体P100能使单增李斯特菌降低1个对数值。添加噬菌体,可减少单增李斯特菌在成熟过程和包装产品中的数量,使提高产品安全性成为可能;变形杆菌(Proteus)广泛分布在自然环境中,可引起腹泻、食物中毒等食源性疾病,特别是奇异变形杆菌,易引起败血症,死亡率较高,在水产品中也有分布[47]。孙盟盟等[48]以奇异变形杆菌为宿主菌,从居民区生活污水中分离针对奇异变形杆菌的噬菌体,得到4株针对奇异变形杆菌的噬菌体,其表现出特异性高、裂解性强的毒性噬菌体特征。
2 存在问题及解决办法虽然噬菌体对特定微生物有较好作用效果,但其仍存在易变异、专一性强、用量与作用时间有待深入研究、公众对噬菌体缺乏认知、可能存在疑虑与抵触等问题。
2.1 噬菌体安全性及易变异特点噬菌体作为病毒之一,其本身是否含有毒性基因,是否对人体造成危害并不明确,且噬菌体易变异,可能会向对噬菌体不敏感的方向突变,而使其失去生物防治效果,也可能向损害人体健康的方向突变。为防止此类问题的发生,部分研究学者在进行噬菌体作为新型生物减菌剂的研究中,会对噬菌体予以安全性评价,通过全基因组测序,并对照毒力基因文库,判定其是否对人体有害。为分析噬菌体是否向不敏感的方向突变,可通过相关实验予以验证,如YANG等[49]研究冷冻斑点叉尾鮰生物保存中的应用时,就进行了噬菌体不敏感突变体突变频率测定,以确保其有效性。有关噬菌体治疗的一期和二期临床试验已得出结论,表明噬菌体不存在安全问题[50]。因此,消费者可放心食用已投入市场使用噬菌体进行生物防治的食品。
2.2 噬菌体的特异性一种噬菌体只能裂解一种致病菌,而在水产品中往往是多种致病菌并存。因此,单一噬菌体并不能防止食源性疾病的发生。为解决此类问题,国内外已有利用多种噬菌体混合制作成为广谱抑菌剂的研究,即“鸡尾酒”疗法。郑小双等[22]用不同来源的多种副溶血性弧菌混合物模拟对污染黄鱼的抑菌效果,结果表明高浓度噬菌体混合物混合悬液噬菌体可有效抑制鱼片中多种致病性副溶血性弧菌株生长;YANG等[49]在进行波罗的海希瓦氏菌和腐败希瓦氏菌噬菌体的分离和鉴定中,通过混合其中几株菌株得到具有广谱抑菌效果的鸡尾酒噬菌体,并将其在冷冻斑点叉尾回鮰的保鲜中应用,取得良好效果;不仅如此,同种噬菌体间可能存在相互协作,增加其抑菌活性,如PHOTHAWORNA等[51]进行沙门氏菌噬菌体鸡尾酒研制,发现从鼠伤寒沙门氏菌分离的ST-W77与从肠炎沙门氏菌分离的SE-W109噬菌体结合,能使其抗菌活性延长1周。
2.3 噬菌体的使用研究不足噬菌体发挥其作用须在一定浓度下,而关于噬菌体在杀灭致病菌的使用剂量与用药时间仍需深入研究。其中,MALIK等[52]提出噬菌体在溶液中的稳定性有限,在加工储存过程中滴度显著下降,若噬菌体作为生物减菌剂,其稳定剂量与贮藏时间须予以明确。但目前为止尚无完善的国家标准及行业标准,规定其用量。随着科研人员对噬菌体更加深入地研究及其在市场上的推广应用,相关国家标准及行业标准对其规定用量必将得到完善。
2.4 公众对噬菌体缺乏认知丛聪等[53]探讨了噬菌体自身安全性的问题,论述了噬菌体在自然界中广泛存在、对肠道菌群无害、使用历史悠久等3个方面,力证了噬菌体的安全性。当前噬菌体治疗可取代抗生素治疗不容置疑。其中:YANG等[49]发现1组具有广谱抑菌作用的鸡尾酒噬菌体,并将其应用于冷冻斑点叉尾鮰,得出其具有较好的减菌效果;陈冬霞[54]从淡水鱼中分离出1株新的噬菌体PspYZU01,利用其进行淡水鱼保鲜实验,表明添加了噬菌体的鱼块,其菌落总数在整个过程中始终低于对照组,抑菌效果明显;江艳华等[48]研究了噬菌体复配抑菌剂对三文鱼中沙门氏菌的抑制与保鲜作用,结果显示,含噬菌体的抑菌剂能明显降低样品中的沙门氏菌数;ZHANG等[55]用噬菌体处理人工污染副溶血性弧菌的牡蛎,牡蛎表面细菌数显著减少。可见,噬菌体在水产品保鲜加工中的应用具有较大的发展潜力。
3 前景与展望由于水产品中抗生素的大量使用使耐药菌株随之出现,迫切需要使用其他方法来杀灭水产品中的致病菌,噬菌体是一种较好选择。目前,噬菌体在国内外的最新研究,人们开始关注噬菌体对水产品中致病菌的作用效果,开展了噬菌体对水产品病原菌控制方面研究,取得显著成效。因此,其在水产品安全控制中应用前景广阔。目前,人们所关注的不仅仅是噬菌体对水产品中病原菌的杀灭作用,未来可通过噬菌体与水产品生物保鲜剂的复配,以延长其抑菌时间,取得更好杀菌效果;同时,还可通过噬菌体来实现水产品加工环境贮藏环境及加工器械的消毒;最后,可研究多种噬菌体的混合悬液,拓宽其抑菌谱,使噬菌体在水产品中的应用更加广泛。相信不久的将来,噬菌体类新型抑菌剂将会面世,并为我国的水产品保鲜加工带来深远影响。
| [1] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2019中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2020. Fisheries and Fisheries Administration of the Ministry of Agriculture and Affairs Rural, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistics yearbook 2019[M]. Beijing: China Agriculture Press, 2020. |
| [2] |
刘嘉莉, 蓝蔚青, 刘大勇, 等. 壳聚糖在水产品保鲜中应用研究进展[J]. 食品与机械, 2019, 35(3): 231-236. LIU J L, LAN W Q, LIU D Y, et al. Research progress of chitosan in aquatic products preservation[J]. Food & Machinery, 2019, 35(3): 231-236. |
| [3] |
宗雯琦, 朱谦让, 吴雨晨. 江苏省餐饮类食源性疾病暴发流行病学特征分析及监管建议[J]. 南京医科大学学报(自然科学版), 2020, 40(6): 915-919. ZONG W Q, ZHU Q R, WU Y C. Analysis of epidemiological characteristics and supervisory suggestions of foodborne disease outbreaks in catering in Jiangsu Province[J]. Journal of Nanjing Medical University (Natural Sciences), 2020, 40(6): 915-919. |
| [4] |
钟延旭, 赵鹏. 我国食源性疾病监测工作进展[J]. 应用预防医学, 2019, 25(1): 80-83. ZHONG Y X, ZHAO P. Progress of foodborne disease surveillance in my country[J]. Journal of Applied Preventive Medicine, 2019, 25(1): 80-83. |
| [5] |
LI W W, PIRES S M, LIU Z T, et al. Surveillance of foodborne disease outbreaks in China, 2003-2017[J]. Food Control, 2020, 118: 107359. DOI:10.1016/j.foodcont.2020.107359 |
| [6] |
孙亮, 陈莉莉, 廖宁波, 等. 2006年-2017年浙江省食源性疾病暴发监测资料分析[J]. 中国卫生检验杂志, 2019, 29(15): 1874-1877. SUN L, CHEN L L, LIAO N B, et al. Analysis of foodborne disease outbreak surveillance data in Zhejiang Province, 2006-2017[J]. Chinese Journal of Health Laboratory Technology, 2019, 29(15): 1874-1877. |
| [7] |
陈静. 2017年-2019年某区食品中食源性致病菌监测结果的分析[J]. 中国医药指南, 2020, 18(13): 291-293. CHEN J. Analysis on the monitoring results of foodborne pathogens in food in a district from 2017 to 2019[J]. Guide of China Medicine, 2020, 18(13): 291-293. |
| [8] |
高红梅, 吴丽珠, 马英. 2014-2018年上海市青浦区食源性疾病病原学监测分析[J]. 职业与健康, 2020, 36(5): 608-612, 617. GAO H M, WU L Z, MA Y. Pathogen monitoring and analysis of foodborne disease in Qingpu District of Shanghai from 2014 to 2018[J]. Occupation and Health, 2020, 36(5): 608-612, 617. |
| [9] |
武玉平, 汪洋, 杨爱青, 等. 淄博市2013-2016年食源性致病菌监测结果分析[J]. 中国公共卫生管理, 2019, 35(4): 540-542. WU Y P, WANG Y, YANG A Q, et al. Analysis of foodborne pathogen contamination in Zibo, 2013-2016[J]. Chinese Journal of Public Health Management, 2019, 35(4): 540-542. |
| [10] |
常方媛, 常学洪, 赵久飞, 等. 2012-2017年青岛市西海岸新区食源性疾病暴发事件流行病学分析[J]. 预防医学论坛, 2017, 23(10): 767-769. CHANG F Y, CHANG X H, ZHAO J F, et al. Epidemiological analysis on food borne disease outbreaks in Qingdao West Coast New Area, 2012-2017[J]. Preventive Medicine Tribune, 2017, 23(10): 767-769. |
| [11] |
KONOPACKI M, GRYGORCEWICZ B, DOŁGOWSKA B, et al. PhageScore:a simple method for comparative evaluation of bacteriophages lytic activity[J]. Biochemical Engineering Journal, 2020, 161: 107652. DOI:10.1016/j.bej.2020.107652 |
| [12] |
CULOT A, GROSSET N, GAUTIER M. Overcoming the challenges of phage therapy for industrial aquaculture:a review[J]. Aquaculture, 2019, 513: 734423. DOI:10.1016/j.aquaculture.2019.734423 |
| [13] |
SEVILLA-NAVARRO S, CATALÁ-GREGORI P, GARCÍA C, et al. Salmonella Infantis and Salmonella Enteritidis specific bacteriophages isolated form poultry faeces as a complementary tool for cleaning and disinfection against Salmonella[J]. Comparative Immunology, Microbiology and Infectious Diseases, 2020, 68: 101405. DOI:10.1016/j.cimid.2019.101405 |
| [14] |
李男.灿烂、哈维弧菌噬菌体的分离鉴定及其生物学特性的研究[D].大连: 大连海洋大学, 2016. LI N. The separation and identification of bacteriophage of Vibrio harveyi, Vibro splendidus and study of the biological characteristic[D]. Dalian: Dalian Ocean University, 2016. |
| [15] |
MOLINA-CÁRDENAS C A, LICEA-NAVARRO A F, DEL PILAR SÁNCHEZ-SAAVEDRA M. Effects of Vibrio cholerae on fatty acid profiles in Isochrysis galbana[J]. Algal Research, 2020, 46: 101802. DOI:10.1016/j.algal.2020.101802 |
| [16] |
SKARADZIN'SKA A, OCHOCKA M, S'LIWKA P, et al. Bacteriophage amplification-a comparison of selected methods[J]. Journal of Virological Methods, 2020, 282: 113856. DOI:10.1016/j.jviromet.2020.113856 |
| [17] |
PATEL A, JEYASEKARAN G, JEYASHAKILA R, et al. Prevalence of antibiotic resistant Salmonella spp. strains in shrimp farm source waters of Nagapattinam region in South India[J]. Marine Pollution Bulletin, 2020, 155: 111171. DOI:10.1016/j.marpolbul.2020.111171 |
| [18] |
ADNAN M, SHAH M R A, JAMAL M, et al. Isolation and characterization of bacteriophage to control multidrug-resistant Pseudomonas aeruginosa planktonic cells and biofilm[J]. Biologicals, 2020, 63: 89-96. DOI:10.1016/j.biologicals.2019.10.003 |
| [19] |
JO S B, SHIN C H, SHIN Y J, et al. Heavy metal and antibiotic co-resistance in Vibrio parahaemolyticus isolated from shellfish[J]. Marine Pollution Bulletin, 2020, 156: 111246. DOI:10.1016/j.marpolbul.2020.111246 |
| [20] |
XU X K, CHENG J H, WU Q P, et al. Prevalence, characterization, and antibiotic susceptibility of Vibrio parahaemolyticus isolated from retail aquatic products in North China[J]. BMC Microbiology, 2016, 16: 32. DOI:10.1186/s12866-016-0650-6 |
| [21] |
郑小双.副溶血性弧菌裂解性噬菌体的分离鉴定及其在三文鱼中的靶向抑菌作用[D].扬州: 扬州大学, 2019. ZHENG X S. Isolation and identification of lytic bacteriophage of Vibrio parahaemolyticus and its targeted bacteriostatic effect in salmon[D]. Yangzhou: Yangzhou University, 2019. |
| [22] |
郑小双, 高璐, 张辉, 等. 副溶血性弧菌广谱裂解性噬菌体的筛选及其在海产品安全控制中的应用[J]. 食品科学, 2019, 40(10): 141-148. ZHENG X S, GAO L, ZHANG H, et al. Screening for broad-spectrum lytic phage against Vibrio parahaemolyticus and its application to marine products[J]. Food Science, 2019, 40(10): 141-148. |
| [23] |
江艳华, 王联珠, 李风玲, 等. 1株副溶血性弧菌裂解性噬菌体VpJYP2的生物学特性及应用[J]. 食品科学, 2020, 41(14): 146-152. JIANG Y H, WANG L Z, LI F L, et al. Biological properties and application of a lytic Vibrio parahaemolyticus phage[J]. Food Science, 2020, 41(14): 146-152. |
| [24] |
STALIN N, SRINIVASAN P. Characterization of Vibrio parahaemolyticus and its specific phage from shrimp pond in Palk Strait, South East coast of India[J]. Biologicals, 2016, 44(6): 526-533. |
| [25] |
YIN Y J, NI P E, LIU D L, et al. Bacteriophage potential against Vibrio parahaemolyticus biofilms[J]. Food Control, 2019, 98: 156-163. |
| [26] |
LU M, LIU H H, LU H, et al. Characterization and genome analysis of a novel salmonella phage vB_SenS_SE1[J]. Current Microbiology, 2020, 77(7): 1308-1315. |
| [27] |
XIE J, WU F L, XU X B, et al. Antibiotic resistance and molecular characterization of the hydrogen sulfide-negative phenotype among diverse Salmonella serovars in China[J]. BMC Infectious Diseases, 2018, 18(1): 292. |
| [28] |
YANG X J, WU Q P, ZHANG J M, et al. Prevalence, enumeration, and characterization of Salmonella isolated from aquatic food products from retail markets in China[J]. Food Control, 2015, 57: 308-313. |
| [29] |
BANIGA Z, MDEGELA R H, LISA B, et al. Prevalence and characterisation of Salmonella Waycross and Salmonella enterica subsp. salamae in Nile perch (Lates niloticus) of Lake Victoria, Tanzania[J]. Food Control, 2019, 100: 28-34. |
| [30] |
LIN H H, CHEN H L, WENG C C, et al. Activation of apoptosis by Salmonella pathogenicity island-1 effectors through both intrinsic and extrinsic pathways in Salmonella-infected macrophages[J]. Journal of Microbiology, Immunology and Infection, 2020. DOI:10.1016/j.jmii.2020.02.008 |
| [31] |
仇笑笑. 沙门氏菌烈性噬菌体的分离鉴定与生物学特性分析[J]. 生物化工, 2020, 6(2): 66-69. QIU X X. Isolation, identification and biological characteristics analysis of salmonella phage[J]. Biological Chemical Engineering, 2020, 6(2): 66-69. |
| [32] |
许东勤.沙门氏菌噬菌体SLMP1裂解酶的重组表达及噬菌体在水产品中的应用研究[D].上海: 上海海洋大学, 2018. XU D Q. Recombinant expression of Salmonella phageSLMP1 lysin and application of phage in aquatic product[D]. Shanghai: Shanghai Ocean University, 2018. |
| [33] |
LYU T T, ZHUANG Q T, ZHAO X L, et al. Outer membrane protein OmpU is related to iron balance in Vibrio alginolyticus[J]. Microbiological Research, 2020, 230: 126350. |
| [34] |
欧阳敏, 高璐, 高亚军, 等. 溶藻弧菌烈性噬菌体分离鉴定及其抑菌作用研究[J]. 扬州大学学报(农业与生命科学版), 2019, 40(4): 75-79, 88. OUYANG M, GAO L, GAO Y J, et al. Isolation and identification of Vibrio alginolyticus bacteriophage and anti-bacteria activity[J]. Journal of Yangzhou University (Agricultural and Life Science Edition), 2019, 40(4): 75-79, 88. |
| [35] |
GAO M M, QIN Y H, FAN H, et al. Characteristics and complete genome sequence of the virulent Vibrio alginolyticus phage VAP7, isolated in Hainan, China[J]. Archives of Virology, 2020, 165(4): 947-953. |
| [36] |
毕晓泽.大菱鲆溶藻弧菌噬菌体制剂制备及其应用效果评价[D].大连: 大连理工大学, 2019. BI X Z. Preparation and application of bacteriophage agent for controlling Vibrio alginolyticus infection in the turbot[D]. Dalian: Dalian University of Technology, 2019. |
| [37] |
中国科学院青岛生物能源与过程研究所.溶藻弧菌噬菌体和噬菌体组合物及其应用: 中国, 110129282A[P]. 2019-08-16. Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences. Vibrio alginolyticus bacteriophage, bacteriophage composition and application of Vibrio alginolyticus bacteriophage, bacteriophage composition: China, 110129282A[P]. 2019-08-16. |
| [38] |
LE T S, SOUTHGATE P C, O'CONNOR W, et al. Use of bacteriophages to control Vibrio contamination of microalgae used as a food source for oyster larvae during hatchery culture[J]. Current Microbiology, 2020, 77(8): 1811-1820. |
| [39] |
PANT A, DAS B, BHADRA R K. CTX phage of Vibrio cholerae:genomics and applications[J]. Vaccine, 2020, 38(Suppl 1): A7-A12. |
| [40] |
SARKAR S, DAS M, BHOWMICK T S, et al. Isolation and characterization of novel broad host range bacteriophages of Vibrio cholerae O1 from Bengal[J]. Journal of Global Infectious Diseases, 2018, 10(2): 84-88. |
| [41] |
蔡俊鹏, 王沛贤. 霍乱弧菌噬菌体在消除海产品中相关弧菌的潜在应用研究[J]. 现代食品科技, 2009, 25(12): 1375-1379. CAI J P, WANG P X. Lysis study of bacteriophages of Vibrio cholera on seafood-borne potentially pathogenic vibrios[J]. Modern Food Science and Technology, 2009, 25(12): 1375-1379. |
| [42] |
AL-NABULSI A A, OSAILI T M, ABUNASER R A, et al. Factors affecting the viability of Staphylococcus aureus and production of enterotoxin during processing and storage of white-brined cheese[J]. Journal of Dairy Science, 2020, 103(8): 6869-6881. |
| [43] |
PUGAZHENDHI A, MICHAEL D, PRAKASH D, et al. Antibiogram and plasmid profiling of beta-lactamase producing multi drug resistant Staphylococcus aureus isolated from poultry litter[J]. Journal of King Saud University-Science, 2020, 32(6): 2723-2727. |
| [44] |
高明明, 刘慧莹, 李璞媛, 等. 金黄色葡萄球菌噬菌体vB_SauH_IME522的分离鉴定及全基因组分析[J]. 第三军医大学学报, 2020, 42(3): 229-240. GAO M M, LIU H Y, LI P Y, et al. Isolation and complete genome analysis of Staphylococcus aureus bacteriophage vB_SauH_IME522[J]. Journal of the Third Military Medical University, 2020, 42(3): 229-240. |
| [45] |
GERSTEIN S, GAUTAM-GOYAL P, GOYAL S. A case of Listeria monocytogenes meningitis complicated by Hydrocephalus and Intraventricular hemorrhage:a review of treatment options and outcomes[J]. IDCases, 2020, 19: e00704. |
| [46] |
AXELSSON L, BJERKE G A, MCLEOD A, et al. Growth behavior of Listeria monocytogenes in a traditional norwegian fermented fish product (Rakfisk), and its inhibition through bacteriophage addition[J]. Foods, 2020, 9(2): 119. |
| [47] |
何洋.淡水鱼消化道噬菌体多样性及噬菌体受体的遗传学分析[D].天津: 天津科技大学, 2015. HE Y. Phage diversity in freshwater fish gastrointestinal and genetic analysis of phage receptor[D]. Tianjin: Tianjin University of Science and Technology, 2015. |
| [48] |
孙盟盟, 宋天一, 胡士华, 等. 奇异变形杆菌噬菌体的分离鉴定及其生物学特性分析[J]. 中国生物制品学杂志, 2012, 25(3): 336-339. SUN M M, SONG T Y, HU S H, et al. Isolation, identification and biological characters of bacteriophages of Proteus mirabilis[J]. Chinese Journal of Biologicals, 2012, 25(3): 336-339. |
| [49] |
YANG Z Q, TAO X Y, ZHANG H, et al. Isolation and characterization of virulent phages infecting Shewanella baltica and Shewanella putrefaciens, and their application for biopreservation of chilled channel catfish (Ictalurus punctatus)[J]. International Journal of Food Microbiology, 2019, 229: 107-117. |
| [50] |
江艳华, 许东勤, 姚琳, 等. 噬菌体复配抑菌剂对三文鱼中沙门氏菌的抑制与保鲜作用[J]. 农业工程学报, 2018, 34(16): 287-293. JIANG Y H, XU D Q, YAO L, et al. Effects of combination of bacteriophage with other bacteriostatic agents on Salmonella control and freshness preservation of raw salmon[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(16): 287-293. |
| [51] |
PHOTHAWORN P, SUPOKAIVANICH R, LIM J, et al. Development of a broad-spectrum salmonella phage cocktail containing Viunalike and Jerseylike viruses isolated from Thailand[J]. Food Microbiology, 2020, 92: 103586. |
| [52] |
MALIK D J, SOKOLOV I J, VINNER G K, et al. Formulation, stabilisation and encapsulation of bacteriophage for phage therapy[J]. Advances in Colloid and Interface Science, 2017, 249: 100-133. |
| [53] |
丛聪, 袁玉玉, 王丽丽, 等. 噬菌体在食品应用中的安全性[J]. 国外医药(抗生素分册), 2019, 40(5): 410-419. CONG C, YUAN Y Y, WANG L L, et al. The safety of bacteriophage in food applications[J]. World Notes on Antibiotics, 2019, 40(5): 410-419. |
| [54] |
陈冬霞.淡水鱼冷藏过程中优势腐败菌群鉴定及其噬菌体控制[D].扬州: 扬州大学, 2019. CHEN D X. Identification of dominant spoilage bacteria and control of bacteriophage during cold storage of freshwater fish[D]. Yangzhou: Yangzhou University, 2019. |
| [55] |
ZHANG H, YANG Z Q, ZHOU Y, et al. Application of a phage in decontaminating Vibrio parahaemolyticus in oysters[J]. International Journal of Food Microbiology, 2018, 275: 24-31. |
2. Shanghai Engineering Research Center of Aquatic Product Processing & Preservation, Shanghai 201306, China;
3. National Experimental Teaching Demonstration Center for Food Science and Engineering, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


