2. 国家淡水水产品加工技术研发分中心, 上海 201306;
3. 上海水产品加工及贮藏工程技术研究中心, 上海 201306;
4. 农业农村部水产品贮藏保鲜质量安全风险评估实验室, 上海 201306
虾青素是酮式类胡萝卜素[1],广泛存在于细菌、藻类、酵母、植物、甲壳类动物以及鲑鱼等鱼类中[2],与维生素和其他抗氧化剂相比,虾青素是一种有效的抗氧化剂[3]。由于其独特的结构和渗透血脑屏障的能力,虾青素还具有很强的抗炎、抗凋亡等作用[4]。近年来,虾青素的需求量稳步增长,而且,作为功能性食品越来越受欢迎[5]。然而,市场上很多虾青素都是通过化学合成获得的,不能满足人们追求绿色天然的需求。因此,从天然的生物资源中获得虾青素成为研究的热点。雨生红球藻是藻类生物技术工业中使用的一种绿色微藻,可以积累大量的储存三酰甘油和虾青素[6]。雨生红球藻中所含虾青素量达到1.5%~10.0%,被称作是天然虾青素的“浓缩品”[7]。
目前已经有许多方法可以使虾青素的提取率达到90%以上,比如碱提法、有机溶剂萃取法、酶解法等,但是仍然存在很多问题。碱提法耗碱量多且严重腐蚀设备;有机溶剂萃取法存在试剂残留、污染环境的风险;酶解法的缺点是酶用量高且耗时长[8]。这些方法都没有满足安全、高效、绿色的理念。此外,由于虾青素气味强烈、水溶性低、生物利用度低,以及它的高共轭结构和非饱和性质,极大地限制了它的广泛应用[9-10]。
虾青素的运载体系主要有乳液运载体系、脂质体运载体系、固体脂质纳米颗粒运载体系和微胶囊运载体系[11]。以人参皂苷制备虾青素纳米乳液,热处理(30~90 ℃,30 min)对乳液的稳定性影响不大。而且,在不同温度(5、25和40 ℃)下储存15 d,纳米乳液也具有良好的长期稳定性[12]。KHAN等[13]以酪蛋白酸钠为原料,采用自发乳化和超声技术制备虾青素和生育酚纳米乳,结果表明:纳米乳在正常pH下,具有较高的稳定性,粒径小,无毒性。利用脂质体包封技术改善了虾青素实际生物利用度低的问题,揭示了脂质体包裹的虾青素在血液中具有高度稳定的循环和肝脏的高效摄取,增强了肝内细胞抗氧化酶的活性[14]。KHALID等[15]研究了改性卵磷脂(ML)和酪蛋白酸钠(SC)虾青素纳米乳的生物利用度,这些纳米乳液贮存30 d后,化学稳定性大于70%。ML虾青素纳米乳剂中的生物利用度为33%明显高于SC虾青素纳米乳的生物利用度(6%)。所以,既要保持虾青素的稳定性,又要提高虾青素的生物利用度,选择合适的递送体系至关重要。
自微乳化释药系统是由油相、表面活性剂、助表面活性剂和药物组成的均一、澄清的液体或固体制剂,作为一种新型的制剂,目前得到研究者的广泛关注[16]。作为一种新型药物传递系统, 药物被包裹在油滴中, 口服后遇体液在胃肠蠕动下自发分散形成10~100 nm的O/W型微乳, 提高药物溶解度和渗透率, 改善药物的口服吸收有助于提高药物的生物利用度[17]。LIAO等[18]制备的黄芩素自微乳不仅显著提高了黄芩苷的口服生物利用度,而且增加了经淋巴运输的比例。目前使用自微乳体系制备虾青素的研究较少,MAO等[19]以98%的虾青素为原料,建立了固体自乳化给药系统,用于虾青素的口服给药,经消化后,生物可得性可达10%。此方法有利于虾青素的吸收,但是成本较高会限制虾青素的应用。
本研究直接选取雨生红球藻粉来制备含虾青素的雨生红球藻粉自微乳,一方面提高了虾青素的稳定性和生物利用度,另一方面跳过了雨生红球藻粉提取虾青素的复杂步骤,节约成本,拓宽了虾青素的应用。
1 材料与方法 1.1 试剂与仪器主要试剂:雨生红球藻粉(虾青素含量4%,粉碎度:80目),西安瑞迪生物科技有限公司;虾青素标准品,质量分数96%、肉桂油、三乙酸甘油酯、橄榄油、丙三醇、1, 2-丙二醇、聚乙二醇400(PEG-400)、聚乙二醇800(PEG-800), 麦克林试剂有限公司;胰蛋白酶、胃蛋白酶,国药集团化学试剂有限公司;去离子水。
主要仪器:ZEN3600型激光粒度仪,Malvenrn Panalytical;磁力搅拌器,上海司乐仪器有限公司;uv-1600紫外分光光度计,上海美普达仪器有限公司;XW-80A型涡旋混合器,上海精科实业有限公司;RCZ-8型药物溶出度仪,上海黄海药检仪器有限公司;TECNAL F30透射电镜,FEI公司。
1.2 虾青素含量的测定用无水乙醇溶液溶解虾青素标准品, 通过紫外可见光分光光度计在400~600 nm处扫描, 吸收图谱显示在478 nm处有明显的吸收峰。使用无水乙醇溶解虾青素标准品, 配置不同浓度的虾青素溶液,绘制标准曲线为Y=0.081 1x+0.090 1,相关系数R2=0.992 9[20]。
1.2.1 不同介质中雨生红球藻粉中虾青素溶解度的测定称取0.5 g雨生红球藻粉,少量多次加入到分别装有2 mL油相、乳化剂、助乳化剂的10 mL离心管中,涡旋混合2 min,然后放到恒温摇床连续摇24 h,在5 000 r/min条件下离心15 min,取上清液用无水乙醇稀释,在478 nm处测吸光度,根据标准曲线,计算虾青素的浓度[21]。
1.2.2 雨生红球藻粉虾青素保留率的测定虾青素的保留率是虾青素乳液在一定条件下的虾青素的保留程度,准确量取含虾青素乳液10 μL,稀释1 000倍,在478 nm处测吸光度,根据标准曲线,计算虾青素的浓度[20]。根据公式(1)计算虾青素的保留率:
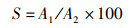 (1)
(1)
式中:S为虾青素的保留率, %;A1为一段时间后虾青素的质量, mg;A2为虾青素的初始质量, mg。
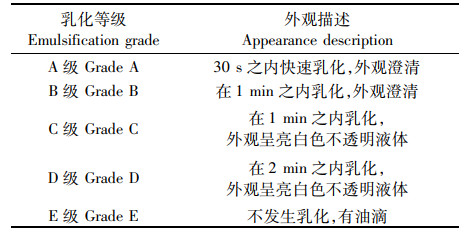
1.3 配伍性实验 1.3.1 油相与乳化剂的筛选通过配伍实验可以进一步确定自微乳中的油相、乳化剂和助乳化剂的相容性和乳化性能,乳化等级按照表 1进行分类[22]。分别将油相与乳化剂按照质量比为1∶ 9、2∶ 8、3∶ 7、4∶ 6、5∶ 5涡旋混合2 min,室温条件下静置,观察是否存在浑浊或分层。取1 g未发生浑浊或分层的混合物,在200 r/min磁力搅拌下加入到100 mL水中,观察并记录乳化情况,根据表 1进行乳化等级分类。
|
表 1 乳化等级分类 Tab.1 Classification of emulsion grade |
通常在自微乳处方中加入助乳化剂以提高自微乳的稳定性。将乳化剂与助乳化剂按照质量比(Km)为1∶ 1涡旋混合2 min,再与油相按照质量比为1∶ 9、2∶ 8、3∶ 7、4∶ 6、5∶ 5涡旋混合2 min,室温静置。取1 g未发生浑浊或分层的混合物,在200 r/min磁力搅拌下加入到100 mL水中,观察并记录乳化情况,根据表 1进行乳化等级分类[22]。
1.4 伪三元相图的绘制采用伪三元相图法确定空白自微乳的各组成分的用量范围。分别按照Km为1∶ 1、2∶ 3、1∶ 2、3∶ 2、2∶ 1、3∶ 1称取乳化剂与助乳化剂,涡旋2 min,形成均一的混合物,取该混合物依次与油相按照质量比1∶ 9、2∶ 8、3∶ 7、4∶ 6、5∶ 5、6∶ 4、7∶ 3、8∶ 2、9∶ 1涡旋2 min,形成空白自微乳。取1 g空白自微乳在200 r/min磁力搅拌器中加入100 mL去离子水中,水温为常温,乳化效果等级参照表 1,记录乳化情况,使用Origin 8.0软件绘制空白自微乳的自乳化区域,确定各组分的用量范围[19]。
1.5 虾青素自微乳处方的优化 1.5.1 星点设计效应面法确定处方制备虾青素自微乳过程中,主要的影响因素有油相(三乙酸甘油酯)在乳液中所占的比例、乳化剂与助乳化剂的比例(Km),以溶解度、微乳粒径、PDI为评价指标,采用2因素5水平的星点设计确定最优处方。
1.6 质量评价 1.6.1 外观与形态在低温(4 ℃)和室温(25 ℃)下,观察自微乳的形态。取自微乳适量,加入37 ℃蒸馏水稀释100倍,取适量滴加到200目铜网表面,滤纸吸取多余液体,2%磷钨酸溶液负染色2 min,滤纸吸取多余液体,自然晾干,在透射电镜(TEM)下观察[23]。
1.6.2 体外抗氧化活性研究根据以往的研究报告,1, 1-二苯基-2-苦味酸肼(DPPH)被用于评估活性成分的抗氧化活性,但是很多有色抗氧化剂在500 nm附近存在着吸收峰,可能对DPPH测定产生光谱干扰,而ABTS测量波长在700 nm附近存在吸收峰,有色氧化剂不容易产生光谱干扰。因此本实验采用ABTS自由基清除试验来评估自乳化对虾青素抗氧化活性的影响,具体实验步骤参照文献[24]。
1.6.3 体外释药研究溶解实验是由体外溶出度仪测定的。采用中国药典2015年版第四部0931溶出度与释放度测定方法,采用模拟胃液(SGF)或模拟肠液(SIF)和水作为溶解介质。将虾青素自微乳和含有等量虾青素的雨声红球藻粉,灌入00号胶囊中,置于自动溶解测试仪中。溶出介质体积为300 mL,在0、5、10、20、30、45和60 min后,取出5 mL溶出介质,并加入等体积的空白介质。提取的样品经0.22 μm的滤膜过滤,同1.2节测得虾青素的含量[22]。
1.6.4 稳定性考察针对虾青素不溶于水,在高温和光照下降解较快的特点,对制备的含虾青素的雨生红球藻粉自微乳进行以下3个方面的评价。
(1) 高速离心实验:取自微乳10 μL,使用37 ℃去离子水稀释到10 mL, 在10 000 r/min的条件下离心15 min[25]。
(2) 紫外线稳定性实验:为了阐明自乳化对虾青素抗紫外线稳定性的影响,比较了无水乙醇中游离虾青素的剩余含量和自微乳中虾青素的总量,将样品放置在开口、透明的管中,并在35 ℃和10 cm距离下暴露于紫外线灯泡(30 W)下10 h。在预定的暴露时间间隔(1、2、3、4、5、6、7、8、9和10 h)下,按照1.2节所述计算乙醇中的游离虾青素和自微乳中的虾青素总量[26]。
(3) 温度对自微乳稳定性的影响:取自微乳2 mL,避光放置于55 ℃的环境下保存,分别于2、4、6、8、10 h取样,计算虾青素的保留率及自由基的清除率[27]。
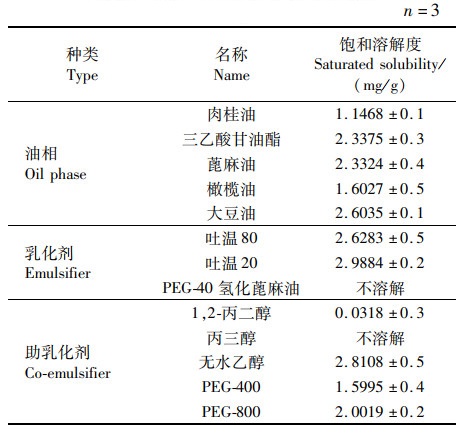
2 结果 2.1 虾青素在不同介质中的溶解度原则上选择对雨生红球藻粉中的虾青素有较高溶解度的油相、乳化剂和助乳化剂作为自微乳的组成成分,以达到对药物的最大溶解能力,防止自微乳在储存过程中药物析出结晶体。虾青素在各种油相、乳化剂和助乳化剂中的饱和溶解度如表 2所示,在所筛选的油相中,雨生红球藻粉中的虾青素在大豆油、三乙酸甘油酯和蓖麻油中溶解度较高,分别为(2.603 5±0.1)mg/g、(2.337 5±0.3)mg/g和(2.332 4±0.4)mg/g。
|
表 2 雨生红球藻粉中的虾青素在辅料中的溶解度 Tab.2 Solubility of astaxanthin in excipients of Haematococcus pluvialis powder |
乳化剂中,虾青素在吐温20和吐温80中溶解度最大,分别达到了(2.988 4±0.2)mg/g和(2.628 3±0.5)mg/g,由于吐温20相对于吐温80危害较大,所以选择吐温80作为乳化剂;助乳化剂中,虾青素在无水乙醇和PEG-800中溶解度较高,分别为(2.810 8±0.5)mg/g和(2.001 9±0.2)mg/g。
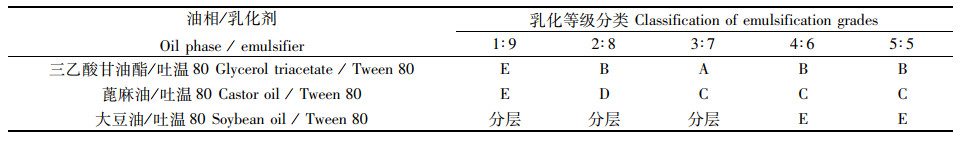
2.2 配伍性实验结果由相容性和乳化结果(表 3)可知,在考察的用量比例范围之内,三乙酸甘油酯与吐温80配伍后相容性和乳化性能较好,而其他2组油相与乳化剂配伍的相容性和乳化性能较差,因此选择三乙酸甘油酯为油相,吐温80为乳化剂作进一步研究。
|
表 3 不同油相与乳化剂的配伍实验 Tab.3 Compatibility experiment of different oils and surfactants |
由表 4可知,吐温80与无水乙醇配伍,形成的微乳由油滴絮凝,而吐温80与PEG-800配伍,形成的微乳透明,澄清。因此选择PEG-800作为助乳化剂。
|
表 4 油相与混合乳化剂的配伍实验 Tab.4 Compatibility experiment of oils and mixed surfactants |
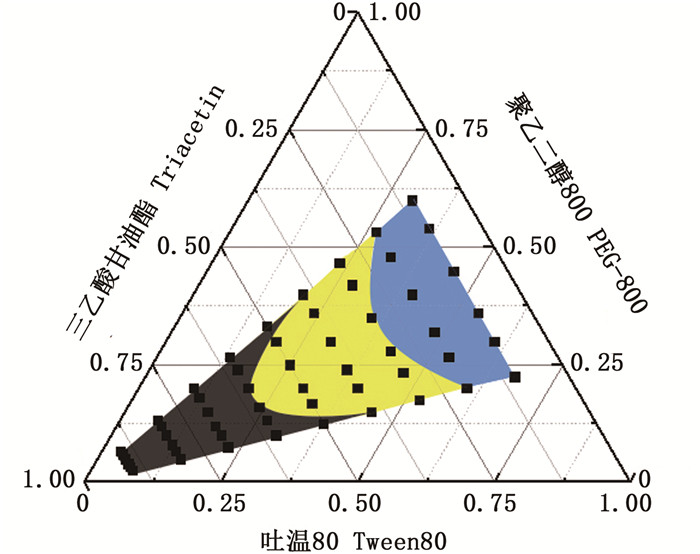
伪三元相图的建立是确定所选载剂自乳化区的一种操作。由三乙酸甘油酯、吐温80和PEG-800组成的自微乳体系的伪三元相图如图 1所示。黄色部分表示该区域中的空白自微乳处方能够形成澄清或淡蓝色乳光微乳液,蓝色部分表示该区域能形成半透明微乳液,灰色部分表明该区域中的处方形成的乳液中有油滴。结果表明,对于乳化剂浓度小于70%和三乙酸甘油酯浓度大于30%的制剂,自发乳液体系是不成功的。从图 1中可以看出,当液体自微乳配方中吐温80和PEG-800的总浓度大于80%时,表面活性高,自乳化效果良好。
|
图 1 空白自微乳的伪三元相图 Fig. 1 Pseudo ternary phase diagram of blank self- microemulsion |
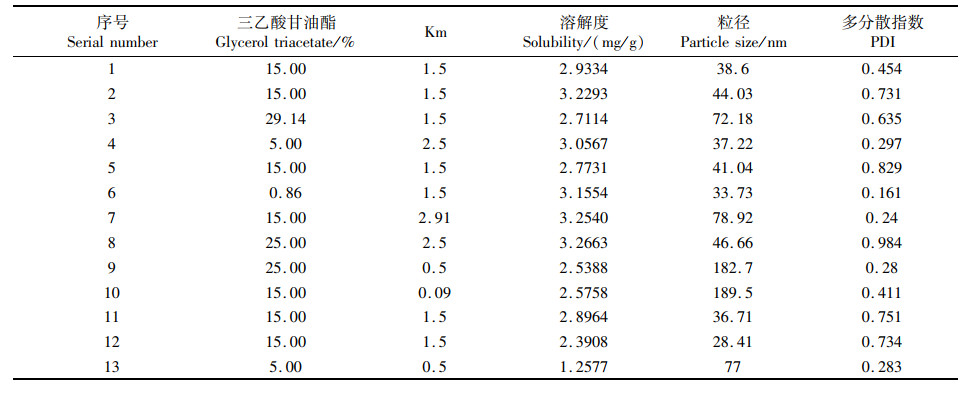
将三乙酸甘油酯、吐温80、PEG-800的总量定为100%,根据伪三元相图结合各相实际配伍特点,确定各相质量比例范围分别为三乙酸甘油酯5%~25%、, Km为0.5~2.5,将以上三相按响应面法试验设计比例加入西林瓶中,总含量为10 mL,旋涡振荡5 min混合均匀,再加入2 g雨生红球藻粉,超声助溶1 h后静置,再在5 000 r/min的条件下离心15 min,即得自微乳。取自微乳10 μL,加水稀释1 000倍乳化,纳米粒度仪测定自微乳平均粒径和PDI;再根据1.2节方法测定载药量。根据两因素,五水平的星点设计方案,实验结果见表 5,考察指标为各处方实验测得的平衡溶解度、粒径、PDI,对油相质量百分比(X1),表面活性剂与助表面活性剂的比例Km(X2)进行二次多项式拟合。
|
表 5 星点设计与结果 Tab.5 Composition of preparations used in central composition design Expermental responses and results of central composite design |
对实验数据进行二次多项式拟合,模型如下:
Y(平衡溶解度)=1.956 91+0.0107 85X1 +0.435 70X2(R2=0.461 8,Radj2=0.354 1)P < 0.05;
Y(粒径)=131.072 29+4.025 72X1-144.340 34X2-2.406 50X1X2+0.056 766X12+46.304 13X22 (R2=0.978 3,Radj2=0.962 9)P < 0.000 1;
Y(PDI)=0.0957 49+0.0288 80X1+0.287 78X2+0.017 250X1X2-1.260 88×10-3X12-0.162 34X22 (R2=0.746 4,Radj2=565 2)P < 0.05;
上述方程,失拟项P均大于0.05,相对于纯误差水平不显著,二次多项式拟合结果较好。用Design-Expert软件绘制星点设计实验结果的三维效应面图。
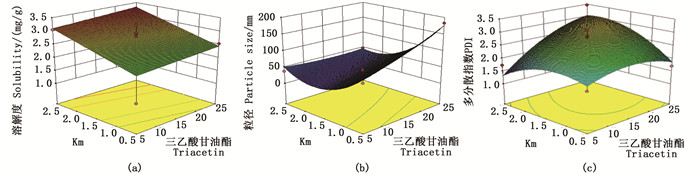
由图 2a可知,随着油相比例的增加,雨生红球藻粉中虾青素的溶解度逐渐增加,增加趋势缓慢。当油相比例一定时,虾青素的溶解度随着Km(表面活性剂/助表面活性剂)值的增加而增加;由图 2b可知,当Km=2.5时,虾青素自微乳乳化后的粒径随油相百分比的增加而减小,减小趋势缓慢。当油相比例为25%时,Km很小,粒径最大,即就粒径大小而言,需要控制油相的比例,才能有利于药物的吸收。当油相比例一定时,虾青素的粒径随着Km的增加,呈现先减小后增大的趋势。由图 2c可以得出,当油相比例为25%,Km很大时,此时的PDI也很大,这也验证了伪三元相图的结果,油相比例不宜过大。
|
图 2 溶解度、粒径和PDI的响应面图 Fig. 2 Response surface graph of solubility, particle size and PDI |
根据拟合方程、三维效应面图综合分析评价,在实验范围内以载药量大小和粒径为原则,确定最优处方油相(三乙酸甘油酯)∶表面活性剂(吐温80)∶助表面活性剂(PEG-800)=5∶67.86∶27.14,即X1=5,X2=2.5。
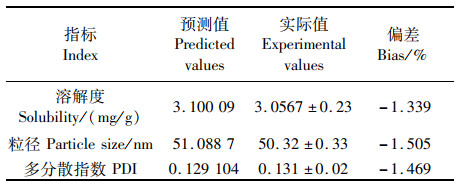
以虾青素载药量越大,粒径、PDI越小为优化指标[23],然后,根据上述最优处方制备3份自微乳进行验证试验,实验预测值与实测值偏差结果见表 6,两指标溶解度、粒径和PDI的偏差均较小,表明效应面法优化得到的数学模型预测性良好。
|
表 6 预测值与实际值的比较 Tab.6 Predicted values and the experimental results |
在低温(4 ℃)下,自微乳较黏稠,不透明,并呈深红色;在室温(25 ℃)下,自微乳流动性较好,依然成呈深红色。将自微乳浓缩液用蒸馏水稀释100倍后,可得澄清透明的红色溶液。在透射电镜(TEM)下观察,结果见图 3。由图 3可知,自微乳经蒸馏水稀释后呈圆球形,大小均匀,乳滴之间无粘连,粒径大小在50 nm左右。

|
图 3 虾青素自微乳的透射电镜结果图 Fig. 3 TEM results of astaxanthin self-microemulsion |
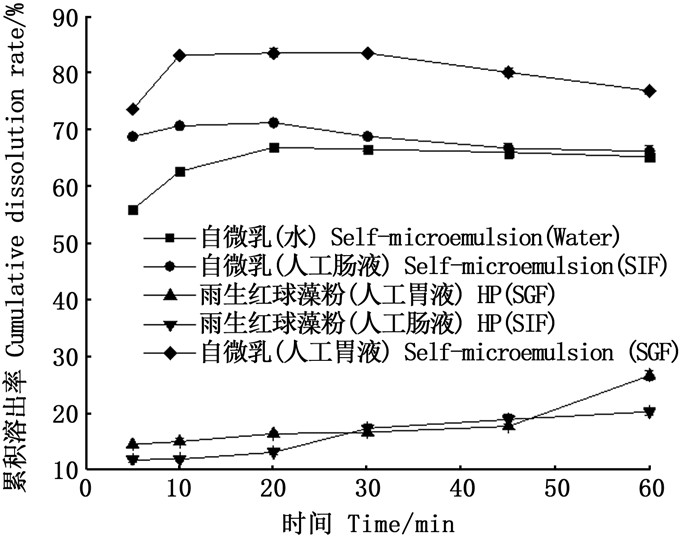
根据1.2节方法测定雨生红球藻粉中虾青素的含量,绘制溶出曲线,见图 4。虾青素不溶于水,而自微乳中的虾青素在水中的累积溶出率在20 min时达到了67%左右,在人工胃液和人工肠液中的累积溶出率在20 min时,分别达到了83.61%和71.33%。这表明自微乳可有效提高雨生红球藻粉中虾青素的溶出速率。
|
图 4 虾青素自微乳和雨生红球藻粉(HP)的体外溶出曲线 Fig. 4 In vitro dissolution curves of astaxanthin from microemulsion and Haematococcus pluvialis powde(HP) |
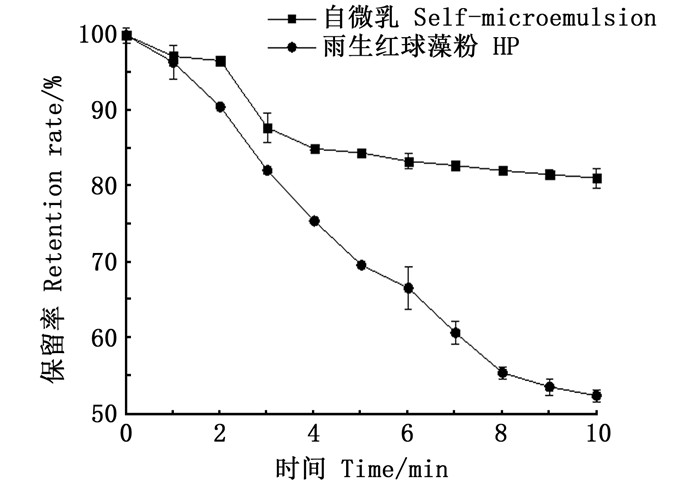
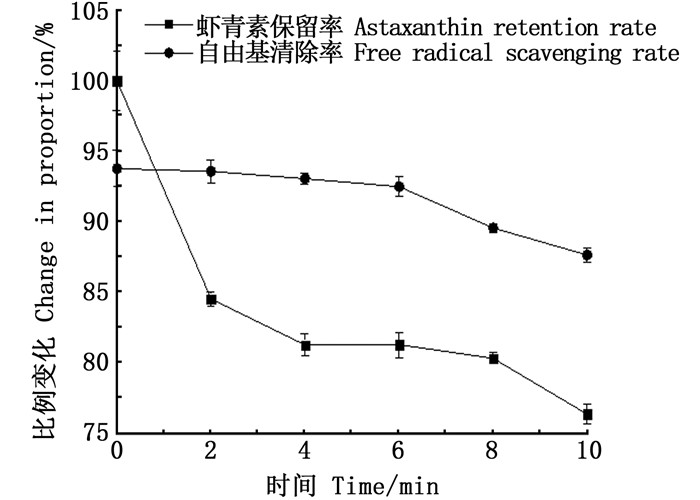
由图 5可知,离心之后,溶液外观透明,但有少许沉淀,放置4 h,沉淀消失,与未离心前几乎没有差异。由于虾青素难溶于水,在光照(特别是紫外光照射)和高温等条件下易降解[2]。图 6显示了自乳化的效果对虾青素紫外光稳定性的影响。无自乳化虾青素(乙醇中游离虾青素)对紫外光非常敏感,当暴露在紫外线下时,降解非常快。紫外线照射10 h后,只有约52%的虾青素残留量,而自乳化虾青素的保护效果较好,抗紫外光诱导分解,其中虾青素残留量为81.1%。这与虾青素-玉米醇溶蛋白-壳聚糖复合物的制备及其在食品加工中的应用文章中虾青素的残留量相差无几[19]。图 7展示了高温55 ℃下虾青素的保留率和清除率的变化,在第10小时时虾青素的保留率为76.3%,自由基清除率下降到87.61%。虾青素的保留率在前2 h下降比较明显,与文献[27]报道的结果一致。

|
图 5 加速离心前后照片对比图 Fig. 5 Comparison of photos before and after accelerated centrifugation |
|
图 6 自乳化对虾青素的紫外光稳定性的影响 Fig. 6 Effect of ultraviolet light stability on self-emulsifying astaxanthin |
|
图 7 自微乳中的虾青素在55 ℃下的保留率的变化和自由基清除率的变化 Fig. 7 Changes of astaxanthin retention rate and free radical scavenging rate in self-microemulsion at 55 ℃ |
雨生红球藻中的虾青素具有抗氧化、抗肿瘤、预防心脑血管疾病等多种生物活性, 可以用作食品添加剂,延长食品的货架期,在医药、保健品及化妆品也有诸多用途[28]。但是,雨生红球藻的细胞壁会影响提取溶剂向细胞内渗透和虾青素的溶解,即实验选取已经破壁的雨生红球藻。有研究[29]表明,使用大豆油作为提取溶剂, 料液比为1∶ 30, 提取压力为150 MPa, 提取2次,虾青素的提取率可达54.68 mg/g。本文比较雨生红球藻粉中的虾青素在大豆油、橄榄油等多种辅料中的溶解度,选择溶解度高且配伍性好的辅料制备自微乳,即空白自微乳相当于提取溶剂[30],实现虾青素高效提取的同时,也可以直接制备含虾青素的雨生红球藻粉的自微乳。本文溶出度实验的结果表明:虾青素自微乳为在水中累积溶出率为66.97%,在人工胃液里的累积溶出率为83.61%,在人工肠液里的累积溶出率为71.33%, 提高了虾青素的溶出度。最后,针对载药量(3.056 7 mg/g)而言,是文献[14]报道的自微乳的载药量(0.352 5 mg/g)的10倍左右。
油相、乳化剂和助乳化剂之间的比例及种类对自微乳的性质有很大的影响[31]。本文比较雨生红球藻粉中的虾青素在大豆油、橄榄油等多种辅料中的溶解度,结果表明,在大豆油中的溶解度最高,但在实际应用中需要考虑各成分之间的相互作用,即在测出溶解度的基础上进行配伍实验,直观地看出各成分之间的影响。大豆油与乳化剂配伍性不好,综合考虑,选择溶解度高且配伍性好的三乙酸甘油酯作为自微乳的油相。乳化剂和助乳化剂对乳液的成乳能力影响较大,乳化剂可根据亲水亲油平衡值(HLB值)筛选, HLB值为8~18的乳化剂可制备O/W型纳米乳[32], 本实验选择的乳化剂吐温80(HLB=15)符合要求,且对雨生红球藻粉中的虾青素溶解度较高。本实验选择的助乳化剂PEG-800已广泛应用于医药、化妆品等领域,且雨生红球藻粉中的虾青素在其中的溶解度最高,即选择其作为助乳化剂对提高处方的载药量及安全性有重要的意义。
自微乳的初步稳定性通过高速离心、光照和温度实验进行表征。加速实验结果表明自微乳比较稳定。通过光照和高温试验结果可知,光照和温度会影响自微乳的稳定性,使虾青素的保留率有所下降,分别为81.1%和76.3%。目前关于虾青素自微乳稳定性的研究,不仅有光照和高温方面的研究,还在长期稳定性方面进行实验。BOONLAO等[33]制备了乳清分离蛋白和黄原胶乳状液,在较低的贮藏温度(5、25和37 ℃)下表现出较高的虾青素稳定性,15 D内虾青素损失为10%~12%。本实验也在5 ℃和37 ℃下比较了虾青素的长期稳定性,目前结果表明:15天内虾青素的损失为13%~15%,与上述文献相比差别较小。本研究采用效应面优化法制备出粒径小、载药量高、质量稳定的自微乳,后续将从长期稳定性和固化以及体内活性等方面进行深入研究, 为虾青素的广泛应用打下基础。
| [1] |
FAKHRI S, ABBASZADEH F, DARGAHI L, et al. Astaxanthin: a mechanistic review on its biological activities and health benefits[J]. Pharmacological Research, 2018, 136: 1-20. DOI:10.1016/j.phrs.2018.08.012 |
| [2] |
MARTÍNEZ-DELGADO A A, KHANDUAL S, VILLANUEVA-RODRÍGUEZ S J. Chemical stability of astaxanthin integrated into a food matrix: effects of food processing and methods for preservation[J]. Food Chemistry, 2017, 225: 23-30. DOI:10.1016/j.foodchem.2016.11.092 |
| [3] |
CHINTONG S, PHATVEJ W, RERK-AM U, et al. In vitro antioxidant, antityrosinase, and cytotoxic activities of astaxanthin from shrimp waste[J]. Antioxidants, 2019, 8(5): 128. DOI:10.3390/antiox8050128 |
| [4] |
NAN B Y, GU X, HUANG X S. The role of the reactive oxygen species scavenger agent, astaxanthin, in the protection of cisplatin-treated patients against hearing loss[J]. Drug Design, Development and Therapy, 2019, 13: 4291-4303. DOI:10.2147/DDDT.S212313 |
| [5] |
BRENDLER T, WILLIAMSON E M. Astaxanthin: how much is too much? a safety review[J]. Phytotherapy Research, 2019, 33(12): 3090-3111. DOI:10.1002/ptr.6514 |
| [6] |
NGUYEN T, XU Y, ABDEL-HAMEED M, et al. Characterization of a type-2 diacylglycerol acyltransferase from Haematococcus pluvialis reveals possible allostery of the recombinant enzyme[J]. Lipids, 2020, 55(5): 425-433. DOI:10.1002/lipd.12210 |
| [7] |
班磊, 尤建伟. 虾青素制备方法的研究进展[J]. 化工管理, 2019(21): 31-32. BAN L, YOU J W. Research progress of astaxanthin preparation methods[J]. Chemical Enterprise Management, 2019(21): 31-32. DOI:10.3969/j.issn.1008-4800.2019.21.020 |
| [8] |
张莉莉, 李婉菁, 彭锦学, 等. 应用离子液体溶剂体系提取天然虾青素的研究进展[J]. 食品工业科技, 2020, 41(8): 341-346. ZHANG L L, LI W J, PENG J X, et al. Progress of extracting natural astaxanthin by ionic liquids[J]. Science and Technology of Food Industry, 2020, 41(8): 341-346. |
| [9] |
HIGUERA-CIAPARA I, FELIX-VALENZUELA L, GOYCOOLEA F M, et al. Microencapsulation of astaxanthin in a chitosan matrix[J]. Carbohydrate Polymers, 2004, 56(1): 41-45. DOI:10.1016/j.carbpol.2003.11.012 |
| [10] |
EDELMAN R, ENGELBERG S, FAHOUM L, et al. Potato protein-based carriers for enhancing bioavailability of astaxanthin[J]. Food Hydrocolloids, 2019, 96: 72-80. DOI:10.1016/j.foodhyd.2019.04.058 |
| [11] |
姜燕蓉, 刘锴锴, 齐筱莹, 等. 虾青素的生物功效及其运载体系研究现状[J]. 食品与发酵工业, 2019, 45(13): 250-256. JANG Y R, LIU K K, QI X Y, et al. Biological activities and delivery systems of astaxanthin[J]. Food and Fermentation Industries, 2019, 45(13): 250-256. |
| [12] |
SHU G F, KHALID N, CHEN Z, et al. Formulation and characterization of astaxanthin-enriched nanoemulsions stabilized using ginseng saponins as natural emulsifiers[J]. Food Chemistry, 2018, 255: 67-74. DOI:10.1016/j.foodchem.2018.02.062 |
| [13] |
KHAN I, BAHUGUNA A, KUMAR P, et al. In vitro and in vivo antitumor potential of carvacrol nanoemulsion against human lung adenocarcinoma A549 cells via mitochondrial mediated apoptosis[J]. Scientific Reports, 2018, 8(1): 144. DOI:10.1038/s41598-017-18644-9 |
| [14] |
CHIU C H, CHANG C C, LIN S T, et al. Improved hepatoprotective effect of liposome-encapsulated astaxanthin in lipopolysaccharide-induced acute hepatotoxicity[J]. International Journal of Molecular Sciences, 2016, 17(7): 1128. DOI:10.3390/ijms17071128 |
| [15] |
KHALID N, SHU G F, HOLLAND B J, et al. Formulation and characterization of O/W nanoemulsions encapsulating high concentration of astaxanthin[J]. Food Research International, 2017, 102: 364-371. DOI:10.1016/j.foodres.2017.06.019 |
| [16] |
王丽萍. 自微乳化释药系统的研究进展[J]. 中国医疗前沿, 2010, 5(15): 16-17. WANG L P. Research progress of self microemulsifying drug delivery system[J]. National Medical Frontiers of China, 2010, 5(15): 16-17. |
| [17] |
PORTER C J H, WASAN K M, CONSTANTINIDES P. Lipid-based systems for the enhanced delivery of poorly water soluble drugs[J]. Advanced Drug Delivery Reviews, 2008, 60(6): 615-616. DOI:10.1016/j.addr.2007.10.009 |
| [18] |
LIAO H F, GAO Y, LIAN C F, et al. Oral absorption and lymphatic transport of baicalein following drug-phospholipid complex incorporation in self-microemulsifying drug delivery systems[J]. International Journal of Nanomedicine, 2019, 14: 7291-7306. DOI:10.2147/IJN.S214883 |
| [19] |
MAO X Y, SUN R, TIAN Y, et al. Development of a solid self-emulsification delivery system for the oral delivery of astaxanthin[J]. European Journal of Lipid Science and Technology, 2019, 121(5): 1800258. DOI:10.1002/ejlt.201800258 |
| [20] |
吴婉仪, 李璐, 解新安, 等. 基于响应面法构建虾青素纳米乳液[J]. 食品工业科技, 2018, 39(10): 204-210. WU W Y, LI L, XIE X A, et al. Preparation of astaxanthin-loaded nanoemulsions by response surface methodology[J]. Science and Technology of Food Industry, 2018, 39(10): 204-210. |
| [21] |
张伟玲, 刘晓娟. 槲皮素自微乳制剂的制备[J]. 山东大学学报(医学版), 2016, 54(3): 41-44, 49. ZHANG W L, LIU X J. Preparation of self-microemulsifying drug delivery system for quercetin[J]. Journal of Shandong University (Health Sciences), 2016, 54(3): 41-44, 49. |
| [22] |
张小飞, 果秋婷, 邹俊波, 等. 黄芪甲苷自乳化释药系统的制备及大鼠在体肠吸收研究[J]. 中草药, 2019, 50(13): 3037-3043. ZHANG X F, GUO Q T, ZOU J B, et al. Preparation of astragaloside Ⅳ self-microemulsifying drug delivery system and in situ intestinal absorption in rats[J]. Chinese Traditional and Herbal Drugs, 2019, 50(13): 3037-3043. DOI:10.7501/j.issn.0253-2670.2019.13.007 |
| [23] |
马祖兵, 李小芳, 谢龙, 等. 大黄素-桂皮醛自微乳的制备及体外评价[J]. 中成药, 2019, 41(1): 1-7. MA Z B, LI X F, XIE L, et al. Preparation of emodin-cinnamaldehyde self-microemulsions and in vitro evaluation[J]. Chinese Traditional Patent Medicine, 2019, 41(1): 1-7. DOI:10.3969/j.issn.1001-1528.2019.01.001 |
| [24] |
莫镜池, 李晓芬, 熊华斌, 等. 虾青素清除ABTS自由基的紫外-可见吸收光谱研究[J]. 食品工业, 2018, 39(3): 94-97. MO J C, LI X F, XIONG H B, et al. UV-Vis absorption spectrometric investigation of the astaxanthin against ABTS free radicals[J]. The Food Industry, 2018, 39(3): 94-97. |
| [25] |
潘凤. 连翘苷元固体自微乳胶囊的制备及其质量研究[D]. 开封: 河南大学, 2017. PAN F. Study on the preparation and quality of phillygenin solid self-microemulsion capsule system[D]. Kaifeng: Henan University, 2017. |
| [26] |
JIANG G L, ZHU M J. Preparation of astaxanthin-encapsulated complex with zein and oligochitosan and its application in food processing[J]. LWT, 2019, 106: 179-185. DOI:10.1016/j.lwt.2019.02.055 |
| [27] |
FENG Z Z, LI M Y, WANG Y T, et al. Astaxanthin from Phaffia rhodozyma: microencapsulation with carboxymethyl cellulose sodium and microcrystalline cellulose and effects of microencapsulated astaxanthin on yogurt properties[J]. LWT, 2018, 96: 152-160. DOI:10.1016/j.lwt.2018.04.084 |
| [28] |
张广伦, 肖正春, 张锋伦, 等. 雨生红球藻中虾青素的研究与应用[J]. 中国野生植物源, 2019, 38(2): 72-77. ZHANG G L, XIAO Z C, ZHANG F L, et al. Study and application of astaxanthin in Haematococcus pluvialis[J]. Chinese Wild Plant Resources, 2019, 38(2): 72-77. |
| [29] |
方婷, 段明慧, 马晋芳, 等. 高压破碎提取雨生红球藻中虾青素的工艺研究[J]. 中药材, 2018, 41(9): 2163-2166. FANG T, DUAN M H, MA J F, et al. Extraction of astaxanthin from Haematococcus pluvialis by high pressure crushing[J]. Journal of Chinese Medicinal Materials, 2018, 41(9): 2163-2166. |
| [30] |
卢瑞芯, 卢文彪. 微乳法提取番石榴叶中槲皮素的研究[J]. 中药材, 2009, 32(4): 608-610. LU R X, LU W B. Study on extraction of quercetin in guava leaf by microemulsion[J]. Journal of Chinese Medicinal Materials, 2009, 32(4): 608-610. DOI:10.3321/j.issn:1001-4454.2009.04.041 |
| [31] |
郑立, 汤韵秋, 余琳媛, 等. 连翘挥发油自微乳的制备及解热作用[J]. 中华中医药学刊, 2020, 38(3): 149-153. ZHENG L, TANG Y Q, YU L Y, et al. Preparation and antipyretic effect of forsythia volatile oil self-microemulsifying drug delivery system[J]. Chinese Archives of Traditional Chinese Medicine, 2020, 38(3): 149-153. |
| [32] |
宁远兰, 沈文, 敖芬. 基于增溶槲皮素的稳定纳米乳的制备[J]. 陕西科技大学学报, 2020, 38(3): 34-40. NING Y L, SHEN W, AO F. Preparation of stable nanoemulsion based on solubilization of quercetin[J]. Journal of Shaanxi University of Science & Technology, 2020, 38(3): 34-40. DOI:10.3969/j.issn.1000-5811.2020.03.006 |
| [33] |
BOONLAO N, SHRESTHA S, SADIQ M B, et al. Influence of whey protein-xanthan gum stabilized emulsion on stability and in vitro digestibility of encapsulated astaxanthin[J]. Journal of Food Engineering, 2020, 272: 109859. DOI:10.1016/j.jfoodeng.2019.109859 |
2. National R & D Branch Center for Freshwater Aquatic Products Processing Technology, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China;
4. Laboratory of Quality and Safety Risk Assessment for Aquatic Product on Storage and Preservation, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


