2. 国家远洋渔业工程技术研究中心, 上海 201306;
3. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
4. 农业农村部大洋渔业资源环境科学观测实验站, 上海 201306;
5. 浙江省海洋水产养殖研究所, 浙江 温州 325005
脂肪酸是生物体内脂质的主要组成部分,机体主要能量来源之一,在生物整个生活史中起着重要的作用[1]。海洋中初级生产者浮游植物和大型藻类会产生不同程度的不饱和14C~24C脂肪酸[2],这些初级生产者中的一些特定脂肪酸能够通过摄食过程保守地传递到较高营养级生物中,从而使得脂肪酸可用作生物标志物,指示生物在一定时期内的摄食情况[3-5],如C20∶1和C22∶1是指示桡足类(Copepods)摄食浮游植物和高营养级摄食植食性桡足类的特征脂肪酸指标[6]。在海洋生物的食性分析中,特征脂肪酸已被广泛应用于研究其摄食来源,HOWELL等[7]采用胃含物分析结合脂肪酸标记技术来研究大西洋9种海星的食性,通过胃含物分析结果证实了利用C22∶2n6和C16∶1n7等特征脂肪酸确定食物来源模式的准确性;PETHYBRIDGE等[8]把脂肪酸标志法作为胃含物分析的补充方法,利用特征脂肪酸的多变量分析对澳大利亚塔斯马尼亚岛大陆坡的16种软骨鱼的食性进行研究;金鑫等[5]基于脂肪酸标志法和碳氮稳定同位素比值法对东海水母常见种的食性进行分析,发现不同水母在不同季节的摄食种类存在较大差异;李莉等[9]对海州湾脊尾白虾(Exopalaemon carinicauda)脂肪酸组成特点及食性进行了探讨,认为脊尾白虾为底栖杂食食性,主要摄食硅藻、甲壳类和双壳类等。
小黄鱼(Larimichthys polyactis),隶属石首鱼科(Sciaenidae)黄鱼属(Larimichthys),暖温性近底层鱼类,广泛分布于中国东海、黄海和渤海[10]。小黄鱼是中国近海重要的渔业经济种类,也是中国近海海洋食物网中的优势种类,在食物网结构中起着承上启下的作用,其资源变动对近海食物网结构稳定至关重要。当前由于渔业捕捞和环境污染的影响,小黄鱼的资源量较20世纪60年代出现大幅下降[11-12]。林龙山等[13-14]、严利平等[15]发现东海及南、黄海小黄鱼种群结构均出现低龄化、小型化和性成熟提前等资源衰退迹象。考虑到个体发育与摄食习性息息相关,小黄鱼的小型化特征势必影响其摄食习性,随之表现出不同体型鱼体可能存在不同的食物来源。为此,本研究通过浙江南部近海2017年5月(春季)、8月(夏季)、11月(秋季)和2018年2月(冬季)等4个季节底拖网调查采集到的小黄鱼样本,对不同体长和季节小黄鱼肌肉中的脂肪酸含量进行测定,分析脂肪酸的组成变化特征和探究特征脂肪酸在发育过程中的变动规律,揭示特征脂肪酸对小黄鱼食源种类的指示功能,为我国近海小黄鱼摄食生态及能量流动研究提供科学参考。
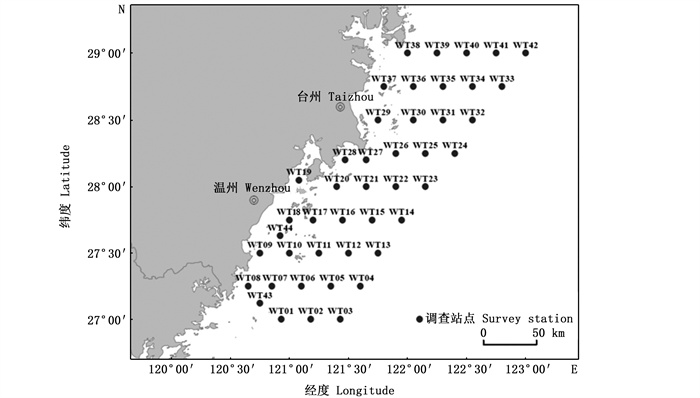
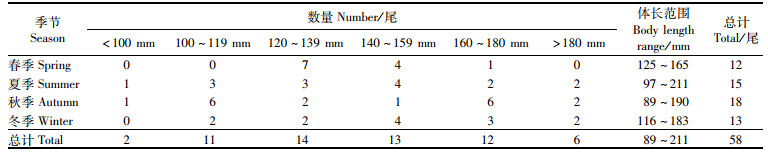
1 材料与方法 1.1 样本来源样本来源于2017年5月、8月、11月和2018年2月浙江南部近海海域(27°00′N~29°00′N和120°30′E~123°00′E)的海洋渔业资源调查项目。调查船为大型单船网板底拖网作业船,根据《海洋调查规范》开展定点拖网调查(图 1)。所捕渔获以冷冻方式保存并带回实验室进行分析。在实验室对渔获物进行种类鉴定[16]和生物学测定,每个站点随机选择30尾小黄鱼样本进行测定,不足30尾的全部测定,测定小黄鱼的体长、体质量等生物学数据,体长精确至0.1 cm。选择58尾不同体长组小黄鱼样本开展脂肪酸测定及含量分析,并按照20 mm的组距对样本进行分组(表 1)。
|
图 1 浙江南部近海调查站位 Fig. 1 Survey stations in the offshore waters of southern Zhejiang |
|
表 1 样品采集季节、数量及体长范围 Tab.1 Sampling season, number and body length range of samples |
取小黄鱼背部肌肉组织,用超纯水冲洗,置于冷冻干燥机(Christ 1-4α)冷冻干燥24 h,干燥样品用混合型球磨仪(Retsch-MM440)粉碎研磨,过100目筛,以备粗脂提取。粗脂提取方法参考FORLCH等[17]方法进行,取0.2 g粉末置于离心管,加入15 mL体积比为2∶1的三氯甲烷-甲醇溶液,浸泡24 h,离心后取上层清液,再加入10 mL三氯甲烷-甲醇溶液润洗,离心取上层清液,合并2次所得的上层清液于离心管中,加入4 mL 0.9%的氯化钠溶液,静置2 h,取下层溶液于圆底烧瓶中进行水浴蒸发得到总脂质;参照国家动植物油脂、脂肪酸甲酯制备的标准方法(GB T/17376—2008)进行脂肪酸甲酯化:在圆底烧瓶中加入4 mL 0.5 mol/L的氢氧化钠-甲醇溶液,混合后连接水浴回流装置,水浴加热8 min,加入4 mL三氟化硼-甲醇溶液煮沸25 min,最后加入4 mL正己烷回流萃取2 min;冷却后加入10 mL饱和氯化钠溶液,摇晃均匀后倒入试管静置分层1 h。用注射器吸取一定量的上层正己烷层待测。以37种脂肪酸甲酯混标的保留时间作为对照进行定性,以十九烷酸甲酯标准品作为内标进行定量。脂肪酸含量使用以下内标法公式得出其质量分数,单位为mg/g。
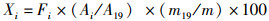 (1)
(1)
式中:Xi为待测样品中组分i的含量,%;Ai为组分i的峰面积;m为样品的质量,mg;m19为内标物十九烷酸甲酯的质量,mg;A19为待测样品中加入内标物的峰面积;Fi为组分i与内标物的校正因子之比,称为相对校正因子。
测试仪器为气相色谱-质谱联用仪(GC-MS 7890B,美国Agilent),在上海海洋大学大洋渔业资源可持续开发教育部重点实验室分析测试平台完成脂肪酸含量测定。
1.3 数据处理脂肪酸含量结果以平均值±标准误差的形式表示。利用Pearson相关分析研究脂肪酸与体长之间的相关性;在开展脂肪酸的体长和季节变化分析时考虑到这2种变量可能在脂肪酸含量的组间差异分析中存在一定的交互影响,因此采用随机区组设计方差分析判断两因素间是否存在交互作用,若无交互作用,则分析两因素各自的主效应,反之采用双因素的简单效应检验;采用非参数检验特征脂肪酸含量在不同季节和不同体长组间的差异性,统计分析的显著性水平为P<0.05。开展方差检验之前,利用了K-S检验样本数据的正态性分布,并使用Levene检验方差齐性。以上统计分析在SPSS 23.0软件中开展。
2 结果 2.1 脂肪酸组成从浙江南部近海58尾小黄鱼的肌肉组织中共检测出30种脂肪酸(表 2),其中:饱和脂肪酸(saturated fatty acid, SFA)有10种,占总脂肪酸含量的39.80%;不饱和脂肪酸(unsaturated fatty acids, UFA)包含9种单不饱和脂肪酸(monounsaturated fatty acids, MUFA)和11种多不饱和脂肪酸(polyunsaturated fatty acids, PUFA),分别占总脂肪酸含量的33.80%和26.40%,不饱和脂肪酸含量是饱和脂肪酸含量的1.5倍。饱和脂肪酸C16∶0的平均含量最高,占总脂肪酸含量的23.12%,含量较高的单种脂肪酸还有C16∶1n7(11.45%)、C18∶0(8.07%)、C18∶1n9c(16.67%)和C22∶6n3(11.40%)。n-3和n-6系列多不饱和脂肪酸的含量分别为(10.80±3.56)mg/g和(3.89±1.60)mg/g,占总脂肪酸含量的18.47%和6.66%,其中具有高营养价值的DHA和EPA分别占11.40%和4.14%。

|
表 2 浙江南部近海小黄鱼肌肉的脂肪酸组成 Tab.2 The fatty acid composition in the muscle of small yellow croaker (Larimichthys polyactis) from the offshore waters of southern Zhejiang |
SFA、MUFA、PUFA和DHA/EPA是小黄鱼肌肉脂肪酸组成特征的重要指标。经随机分组设计方差分析,小黄鱼的SFA、MUFA、PUFA和DHA/EPA的双因素交互作用均不显著(P>0.05),因此只需考虑体长和季节的主效应。根据主效应检验结果(表 3)显示,SFA含量在各体长组间存在显著差异(P<0.05),在体长<100 mm时,SFA的含量最高为(39.35±2.8)mg/g,随着体长的增加SFA含量呈显著降低趋势,经Pearson相关分析显示,SFA含量与体长呈极显著的线性负相关性(P=0.002<0.01);其他如MUFA和PUFA等在体长组间均无显著差异(P>0.05),但通过比对数据发现,PUFA在≥160 mm的体长组含量明显低于<160 mm的体长组,经独立样本非参数检验两体长组间PUFA含量的确存在显著差异(P=0.036<0.05)。

|
表 3 小黄鱼肌肉组织SFA、MUFA、PUFA和DHA/EPA的体长组变化 Tab.3 The body length classes variations of fatty acid composition of SFA, MUFA, PUFA, DHA/EPA in the muscle tissue of Larimichthys polyactis |
根据季节的主效应检验结果(表 4)显示:MUFA含量在季节间存在显著性差异(P<0.05),春季、夏季与秋季的含量明显高于冬季;SFA、PUFA未呈现出显著的季节差异(P>0.05),但冬季含量相对其他季节要偏低;DHA/EPA在季节和体长组间均无显著性差异(P>0.05),但是检验<119 mm体长组与>120 mm体长组的DHA/EPA时发现该值在两组间存在显著差异(P=0.002<0.05),Pearson相关性检验显示体长组与含量间呈显著正相关系(P=0.003<0.05),表明小个体中的DHA/EPA相对更低。

|
表 4 小黄鱼肌肉组织SFA、MUFA、PUFA和DHA/EPA的季节变化 Tab.4 The seasonal variations of fatty acid composition of SFA, MUFA, PUFA, DHA/EPA in the muscle tissue of Larimichthys polyactis |
浙江南部近海小黄鱼肌肉中发现有13种特征脂肪酸,其中有几种主要特征脂肪酸C18∶1n9c、C16∶1n7、C22∶6n3、C20∶5n3和C20∶4n6的平均含量相对占比较高(>2%),基于特征脂肪酸指示小黄鱼的初始食源包括浮游硅藻、甲藻、褐藻和底栖生物等。
采用非参数检验主要特征脂肪酸在季节和体长间的组成变化差异(表 5):从体长组差异来看,除冬季的C17∶0和夏季、冬季的C18∶3n3外,其他的特征脂肪酸在各季节的体长组间并无显著差异(P>0.05);从季节差异来看,部分主要特征脂肪酸含量具有显著的季节差异,如120~139 mm体长组和>180 mm体长组的C14∶0、C16∶1n7、C20∶1和C18∶1n9c存在显著的季节差异(P<0.05),冬季的含量要显著小于其他季节;个别特征脂肪酸C20∶4n6、C20∶5n3和C22∶6n3含量在各季节间和体长组间均无显著差异(P>0.05)。

|
表 5 小黄鱼主要特征脂肪酸含量的季节和体长组变化 Tab.5 Variations of signature fatty acid content with respect to different sampling seasons and body length classes for Larimichthys polyactis |
小黄鱼是我国近海重要的鱼类,肉质鲜美,营养价值高[23]。浙江南部近海小黄鱼的肌肉组织中饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸的比例分别为39.80%、33.80%和26.40%,不饱和脂肪酸含量显著高于饱和脂肪酸,这与水生生物中脂肪酸主要为不饱和脂肪酸的结论[2]一致。衡量油脂营养价值高低的两个重要指标是不饱和脂肪酸和必需脂肪酸的含量[24]。研究中小黄鱼的不饱和脂肪酸含量达到60.20%(单不饱和脂肪酸MUFA 33.80%+多不饱和脂肪酸PUFA 26.40%),高于舟山小黄鱼[25]的不饱和脂肪酸含量(41.13%),其中26.4%的PUFA含量与刘慧慧等[26]检测舟山海域小黄鱼的PUFA含量相近,PUFA是重要的风味前体物质,体现出小黄鱼肌肉的鲜美多汁。必需脂肪酸是指机体无法自身合成,只能从较低的营养级生物中摄食获得,如n-3、n-6系列多不饱和脂肪酸[27]。本文中n-3、n-6系列多不饱和脂肪酸含量达到25.13%,其中与人和动物生长发育相关的C20∶5n3(EPA,2.42 mg/g)和C22∶6n3(DHA,6.67 mg/g)[28]的含量在PUFA总含量中占比较高,与王立改等[23]检测的4个地域野生小黄鱼的含量基本一致,n-3、n-6系列多不饱和脂肪酸含量更进一步证明了小黄鱼的营养价值较高。
3.2 小黄鱼脂肪酸组成的体长和季节变化体长较大的鱼类游泳能力要强于体长小的鱼类,这反映在脂肪酸组成上便是供能脂肪酸在不同体型个体中的含量存在一定差异[29]。脂肪酸中的饱和脂肪酸SFA可以为机体提供能量,动物在游动过程中会优先消耗SFA[30-31],因此大体长组SFA的含量要低于小体长组。本研究发现大个体(>180 mm)的SFA含量仅为小个体(<100 mm)的0.44倍,也证实了这一结论。生物体主要靠自身合成和食物摄入来补充脂肪酸的含量,在脂肪酸的合成能力方面,低等生物比高等生物更胜一筹,对于鱼类这种在水体中等级较高的物种来说,多数多不饱和脂肪酸PUFA无法自身合成,只能通过摄食低营养层级的浮游动植物获得[2, 32]。本研究中,<160 mm体长组的PUFA明显比>160 mm体长组的含量高,究其原因,很可能是个体相对较小的小黄鱼个体摄取大量具有较强脂肪酸合成能力的初级生物,如浮游动物等。研究发现冬季SFA、MUFA和PUFA的含量相对其他季节要更低,尤其MUFA的冬季含量显著小于其他季节(P<0.05),究其原因为冬季海水温度下降,鱼体利用氨基酸作为能量代谢的能力大大下降,在代谢适应方面会转为以脂肪酸作为主要能量来源,同时冬季低温会影响初始碳源的生长及动物的摄食率,相应也会降低必需氨基酸的摄入量[33-34]。
3.3 特征脂肪酸的食源指示分析JEFFRIES等[35]研究表明,海洋生态系统中浮游植物会影响生物的脂肪酸组成,每一类浮游植物可以由某些特征脂肪酸指示。C16∶0在小黄鱼中虽含量较高,但它是机体中普遍存在且可通过自身合成的一类脂肪酸,无法采信其指示信息[9];C16∶1n7在机体中无法自身合成,指示了浮游硅藻[19]在小黄鱼初始食源中的重要性,硅藻是世界上光能利用最成功、光能利用率最高的有机体,也是浮游动物、鱼虾类等水生生物喜爱摄食种类,文中C16∶1n7的总含量达到11.45%,考虑到小黄鱼并非是初级消费者[36],应是通过摄食浮游动物或鱼虾等方式间接摄入。在海洋生态系统中,C18∶1n9被认为是肉食性的食性表征,在底栖生态系统中则被认为是褐藻、浮游动物等的食物标志[20],研究中小黄鱼的C18∶1n9含量较高,表明底栖甲壳类或其他无脊椎动物幼体可能是小黄鱼的摄食来源之一。同时,本研究中小黄鱼的C20∶1含量占总脂肪酸含量的1.64%,表现出一定的植食性桡足类食性[21],说明小黄鱼捕食植食性桡足类,但其含量较低,无法判断是直接或间接摄食。C18∶2n6和C18∶3n3是指示陆生植物的特征脂肪酸[22],而本文中小黄鱼含有该种脂肪酸(1.53%和1.16%),显示小黄鱼的食物中可能有陆源成分,其来源有可能是温州瓯江和台州椒江等陆源河流带来的陆地植物碎屑,也可能是浮游动物对植物碎屑的摄入[37]。食物网中浮游细菌对应的特征脂肪酸为C15∶0和C17∶0[18],本研究中小黄鱼肌肉中检测出该种脂肪酸,说明浮游细菌对小黄鱼食物能量来源有一定的贡献,也可能来自细菌附着的悬浮颗粒或者碎屑物质,但在本研究中含量较低(分别占0.80%和1.18%),因此浮游细菌对小黄鱼的饵料贡献相对较小。综上,小黄鱼是具有浮游、底栖与游泳动物混合食性的一类经济鱼种,其中摄食的浮游动物可能是桡足类。
研究中对小黄鱼的主要特征脂肪酸季节和体长差异进行分析,发现其中几种主要特征脂肪酸C16∶1n7、C20∶1和C18∶1n9c在冬季的含量相对更低,主要原因为冬季的水温低导致外界环境中饵料生物生长的减缓[34],小黄鱼为满足自身的生长需求,在摄食策略上发生一定改变。这种摄食策略还体现在个体发育过程中,一般来说,DHA/EPA会随着营养级的升高而升高[5],本文中大个体的DHA/EPA相对小个体更大,说明随着小黄鱼的长大,其在食物网中的营养地位有所提高,间接地说明了小黄鱼食性的转变,可能由浮游动物食性转变到营养级更高的虾/鱼食性,尤其<120 mm体长组与≥120 mm体长组存在显著差异,这与高春霞[38]利用稳定同位素研究不同体长组小黄鱼营养级变动结果一致,小个体组(8.00~11.57 mm, TL=10.2)的小黄鱼营养级要显著低于中个体组(11.58~15.13 mm, TL=11.03)。小黄鱼这种食性转换既能满足不同阶段生长发育的营养需求, 又可以缓和它们对饵料资源的竞争。
| [1] |
LEE R F, NEVENZEL J C, PAFFENHÖFER G A. Importance of wax esters and other lipids in the marine food chain: Phytoplankton and copepods[J]. Marine Biology, 1971, 9(2): 99-108. DOI:10.1007/BF00348249 |
| [2] |
IVERSON S J. Tracing aquatic food webs using fatty acids: from qualitative indicators to quantitative determination[M]//KAINZ M, BRETT M T, ARTS M T. Lipids in Aquatic Ecosystems. New York: Springer, 2009: 281-308.
|
| [3] |
DALSGAARD J, JOHN M S, KATTNER G, et al. Fatty acid trophic markers in the pelagic marine environment[J]. Advances in Marine Biology, 2003, 46: 225-340. |
| [4] |
PARRISH C C, ABRAJANO T A, BUDGE S M, et al. Lipid and phenolic biomarkers in marine ecosystems: analysis and applications[M]//WANGERSKY P J. Marine Chemistry. Berlin, Heidelberg: Springer, 2000: 193-223.
|
| [5] |
金鑫, 李超伦, 孙松, 等. 基于脂肪酸标记的长江口海区浮游动物常见种食性分析[J]. 海洋与湖沼, 2012, 43(6): 1083-1090. JIN X, LI C L, SUN S, et al. The diet of the common zooplankton species in Changjiang estuary adjacent sea revealed by fatty acid analysis[J]. Oceanologia et Limnologia Sinica, 2012, 43(6): 1083-1090. |
| [6] |
FALK-PETERSEN S, SARGENT J R, TANDE K S. Lipid composition of zooplankton in relation to the sub-Arctic food web[J]. Polar Biology, 1987, 8(2): 115-120. DOI:10.1007/BF00297065 |
| [7] |
HOWELL K L, BILLETT D S M, TYLER P A, et al. Feeding ecology of deep-sea seastars (Echinodermata: Asteroidea): a pigment biomarker approach[J]. Marine Ecology Progress Series, 2004, 266: 103-110. DOI:10.3354/meps266103 |
| [8] |
PETHYBRIDGE H, DALEY R K, NICHOLS P D. Diet of demersal sharks and chimaeras inferred by fatty acid profiles and stomach content analysis[J]. Journal of Experimental Marine Biology and Ecology, 2011, 409(1/2): 290-299. |
| [9] |
李莉, 张硕, 吴立珍. 脊尾白虾脂肪酸组成特点及其食性分析[J]. 大连海洋大学学报, 2019, 34(4): 552-557. LI L, ZHANG S, WU L Z. Fatty acid composition and feeding habits of ridgetail white prawn Exopalaemon carinicauda with different body length[J]. Journal of Dalian Ocean University, 2019, 34(4): 552-557. |
| [10] |
戴黎斌, 田思泉, 彭欣, 等. 浙江南部近海小黄鱼资源分布及其与环境因子的关系[J]. 应用生态学报, 2018, 29(4): 1352-1358. DAI L B, TIAN S Q, PENG X, et al. Distribution of Larimichthys polyactis and its relationship with environmental factors in offshore water of southern Zhejiang[J]. Chinese Journal of Applied Ecology, 2018, 29(4): 1352-1358. |
| [11] |
林龙山. 东海区小黄鱼现存资源量分析[J]. 海洋渔业, 2004, 26(1): 18-23. LIN L S. Analysis on extant abundance of small yellow croaker Pseudosciaena polyactis in the East China Sea[J]. Marine Fisheries, 2004, 26(1): 18-23. DOI:10.3969/j.issn.1004-2490.2004.01.004 |
| [12] |
李建生, 程家骅. 长江口渔场渔业生物资源动态分析[J]. 海洋渔业, 2005(1): 33-37. LI J S, CHENG J H. Analysis on the dynamic of fishery biological resources on the fishing grounds of the Changjiang estuary[J]. Marine Fisheries, 2005(1): 33-37. DOI:10.3969/j.issn.1004-2490.2005.01.006 |
| [13] |
林龙山, 程家骅. 东海区小黄鱼渔业生物学现状的分析[J]. 中国海洋大学学报(自然科学版), 2004, 34(4): 565-570. LIN L S, CHENG J H. An Analysis of the current situation of fishery biology of small yellow croaker in the East China Sea[J]. Peridical of Ocean University of China(natural science), 2004, 34(4): 565-570. |
| [14] |
林龙山, 程家骅, 任一平, 等. 东海区小黄鱼种群生物学特性的分析[J]. 中国水产科学, 2004, 11(4): 333-338. LIN L S, CHENG J H, REN Y P, et al. Analysis of population biology of small yellow croaker Pseudosciaena polyactis in the East China Sea region[J]. Journal of Fishery Sciences of China, 2004, 11(4): 333-338. DOI:10.3321/j.issn:1005-8737.2004.04.010 |
| [15] |
严利平, 李建生, 沈德刚, 等. 黄海南部、东海北部小黄鱼饵料组成和摄食强度的变化[J]. 海洋渔业, 2006, 28(2): 117-123. YAN L P, LI J S, SHEN D G, et al. Variations in diet composition and feeding intensity of small yellow croaker Larimichthys polyactis Bleeker in the southern Yellow Sea and northern East China Sea[J]. Marine Fisheries, 2006, 28(2): 117-123. DOI:10.3969/j.issn.1004-2490.2006.02.006 |
| [16] |
赵盛龙, 徐汉祥, 钟俊生, 等. 浙江海洋鱼类志[M]. 杭州: 浙江科学技术出版社, 2016. ZHAO S L, XU H X, ZHONG J S, et al. Marine fish flora of Zhejiang province[J]. Hangzhou: Zhejiang Science and Technology Press, 2016. |
| [17] |
FOLCH J, LEES M, STANLEY G H S. A simple method for the isolation and purification of total lipides from animal tissues[J]. Journal of Biological Chemistry, 1957, 226(1): 497-509. DOI:10.1016/S0021-9258(18)64849-5 |
| [18] |
RAJENDRAN N, SUWA Y, URUSHIGAWA Y. Distribution of phospholipid ester-linked fatty acid biomarkers for bacteria in the sediment of Ise Bay, Japan[J]. Marine Chemistry, 1993, 42(1): 39-56. DOI:10.1016/0304-4203(93)90248-M |
| [19] |
POND D W, BELL M V, HARRIS R P, et al. Microplanktonic polyunsaturated fatty acid markers: a mesocosm trial[J]. Estuarine, Coastal and Shelf Science, 1998, 46(2): 61-67. DOI:10.1006/ecss.1998.0334 |
| [20] |
JOHNS R B, NICHOLS P D, PERRY G J. Fatty acid composition of ten marine algae from Australian waters[J]. Phytochemistry, 1979, 18(5): 799-802. DOI:10.1016/0031-9422(79)80018-7 |
| [21] |
Parrish C C. Determination of total lipid, lipid classes, and fatty acids in aquatic samples[M]. New York: Springer, 1999: 5-20.
|
| [22] |
NAPOLITANO G E, POLLERO R J, GAYOSO A M, et al. Fatty acids as trophic markers of phytoplankton blooms in the Bahía Blanca estuary (Buenos Aires, Argentina) and in Trinity Bay (Newfoundland, Canada)[J]. Biochemical Systematics and Ecology, 1997, 25(8): 739-755. DOI:10.1016/S0305-1978(97)00053-7 |
| [23] |
王立改, CORNEL A, 楼宝, 等. 四个地域小黄鱼肌肉营养成分分析与评价[J]. 营养学报, 2018, 40(2): 203-205. WANG L G, CORNEL A, LOU B, et al. Nutritional analysis and evaluation of muscle in Small Yellow Croaker Larimichthys polyactis from four different localities[J]. Acta Nutrimenta Sinica, 2018, 40(2): 203-205. DOI:10.3969/j.issn.0512-7955.2018.02.022 |
| [24] |
母昌考, 王春琳. 鱼类必需脂肪酸营养研究现状[J]. 饲料工业, 2003, 24(6): 44-46. MU C K, WANG C L. Nutrition research situation of necessary fatty acid of fish[J]. Feed Industry, 2003, 24(6): 44-46. DOI:10.3969/j.issn.1001-991X.2003.06.017 |
| [25] |
朱羽庄, 梅光明, 严忠雍, 等. 舟山小黄鱼的营养成分测定与分析[J]. 食品安全质量检测学报, 2019, 10(5): 1184-1190. ZHU Y Z, MEI G M, YAN Z Y, et al. Determination and analysis of the nutritional components of Zhoushan Larimichthys polyactis[J]. Journal of Food Safety & Quality, 2019, 10(5): 1184-1190. |
| [26] |
刘慧慧, 迟长凤, 李海峰. 舟山海域小黄鱼主要营养成分分析[J]. 营养学报, 2013, 35(6): 604-606. LIU H H, CHI C F, LI H F. Analysis of the nutritional composition of Pseudosciaena polyacti in Zhoushan[J]. Acta Nutrimenta Sinica, 2013, 35(6): 604-606. |
| [27] |
INNIS S M. The role of dietary n-6 and n-3 fatty acids in the developing brain[J]. Developmental Neuroscience, 2000, 22(5/6): 474-480. |
| [28] |
SIMOPOULOS A P. Evolutionary aspects of diet: the Omega-6/Omega-3 ratio and the brain[J]. Molecular Neurobiology, 2011, 44(2): 203-215. DOI:10.1007/s12035-010-8162-0 |
| [29] |
杨清源, 朱国平. 阿根廷巴塔哥尼亚陆架拉氏南美南极鱼(Patagonotothen ramsayi)不同组织中脂肪酸分布及食物来源指示[J]. 海洋学报, 2020, 42(4): 20-28. YANG Q Y, ZHU G P. The distribution of fatty acids in tissues of rock cod (Patagonotothen ramsayi) in the Argentina Patagonian Shelf and their implications to feeding habit[J]. Haiyang Xuebao, 2020, 42(4): 20-28. DOI:10.3969/j.issn.0253-4193.2020.04.003 |
| [30] |
陈银基, 鞠兴荣, 周光宏. 饱和脂肪酸分类与生理功能[J]. 中国油脂, 2008, 33(3): 35-39. CHEN Y J, JU X R, ZHOU G H. Classification and physiological function of saturated fatty acids[J]. China Oils and Fats, 2008, 33(3): 35-39. DOI:10.3321/j.issn:1003-7969.2008.03.010 |
| [31] |
王艳, 胡先成, 韩强. 不同盐度条件下饥饿及恢复摄食鲈稚鱼脂肪酸的组成[J]. 水产科学, 2008, 27(7): 334-339. WANG Y, HU X C, HAN Q. Composition of fatty acids in starved and refeeding juvenile Sea Perch Lateolabrax japonicus under different salinities[J]. Fisheries Science, 2008, 27(7): 334-339. DOI:10.3969/j.issn.1003-1111.2008.07.003 |
| [32] |
刘梦坛. 脂肪酸标记在黄海生态系统营养关系研究中的指示作用[D]. 青岛: 中国科学院研究生院(海洋研究所), 2010. LIU M T. Study on the trophic relationships in the Yellow Sea ecosystem using fatty acid markers[D]. Qingdao: The Institute of Oceanology, Chinese Academy of Sciences, 2010. |
| [33] |
叶元土. 淡水鱼类营养与饲料配制技术发展趋势与存在问题分析(上)[J]. 饲料广角, 2005(9): 32-34. YE Y T. Analysis of development trend and problems of freshwater fish nutrition and feed preparation technology (Part one)[J]. Feed China, 2005(9): 32-34. DOI:10.3969/j.issn.1002-8358.2005.09.013 |
| [34] |
金琼贝, 盛连喜, 张然. 温度对浮游动物群落的影响[J]. 东北师大学报(自然科学版), 1991(4): 103-111. JIN Q B, SHENG L X, ZHANG R. Effect of temperature on zooplankton community[J]. Journal of Northeast Normal University, 1991(4): 103-111. |
| [35] |
JEFFRIES H P. Seasonal composition of temperate plankton communities: fatty acids[J]. Limnology and Oceanography, 1970, 15(3): 419-426. DOI:10.4319/lo.1970.15.3.0419 |
| [36] |
纪炜炜, 姜亚洲, 阮雯, 等. 基于稳定同位素方法分析东海中北部及黄海南部春季主要鱼类的食性特征[J]. 海洋渔业, 2013, 35(4): 415-422. JI W W, JIANG Y Z, RUAN W, et al. Stable isotope analysis on the feeding character of representative fishes during spring in central and northern East China Sea and south Yellow Sea[J]. Marine Fisheries, 2013, 35(4): 415-422. DOI:10.3969/j.issn.1004-2490.2013.04.006 |
| [37] |
陈雷, 徐兆礼, 姚炜民, 等. 瓯江口春季营养盐、浮游植物和浮游动物的分布[J]. 生态学报, 2009, 29(3): 1571-1577. CHEN L, XU Z L, YAO W M, et al. The distribution of nutrients, phytoplankton and zooplankton in spring of the Oujiang River estuary[J]. Acta Ecologica Sinica, 2009, 29(3): 1571-1577. DOI:10.3321/j.issn:1000-0933.2009.03.056 |
| [38] |
高春霞. 基于稳定同位素技术的浙江中南部近海渔业生物群落营养结构研究[D]. 上海: 上海海洋大学, 2020. GAO C X. Stable isotope-based community trophic structure of fishery organisms in the offshore waters of central and southern Zhejiang[D]. Shanghai: Shanghai Ocean University, 2020. |
2. National Engineering Research Center for Oceanic Fisheries, Shanghai Ocean University, Shanghai 201306, China;
3. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Shanghai Ocean University, Shanghai 201306, China;
4. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
5. Zhejiang Mariculture Research Institute, Wenzhou 325005, Zhejiang, China
 2021,
Vol. 30
2021,
Vol. 30


