2. 上海海洋大学 海洋工程技术研究中心, 上海 201306
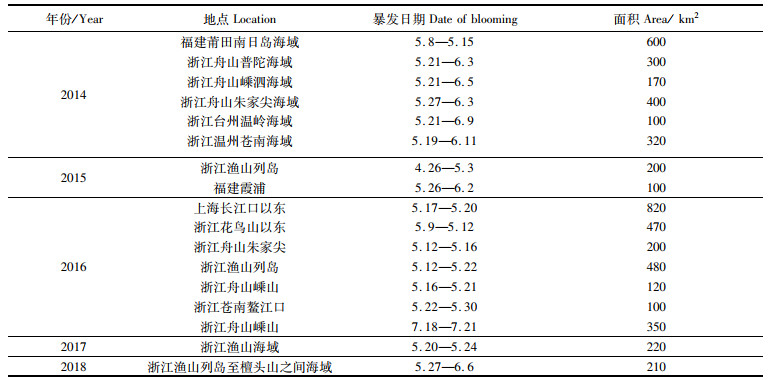
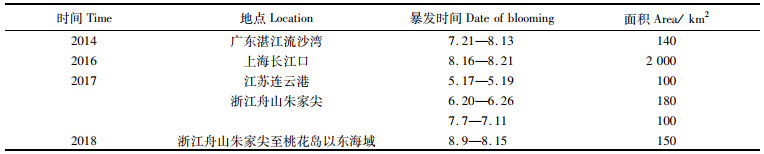
在水生生态系统中,浮游植物因作为初级生产者而具有特殊的生态位。藻华是在短期内浮游植物聚集性增殖爆发的现象,又分为水华和赤潮,分别在淡水和海水中出现。赤潮危害次级生产者和消费者[1-2],从而影响海洋生态健康,对水产养殖业等造成损失[3]。东海原甲藻(Prorocentrum donghaiense)属于甲藻门(Pyrrophyta),每年5月左右在我国东海海域会引发赤潮[4-5],中肋骨条藻(Skeletonema costatum)属于硅藻门(Bacillariophyta),主要分布于我国近海沿岸[6]。近年来,在我国东部沿海地区,尤其在江浙沿海海域,常年大面积暴发的主要赤潮种多为东海原甲藻和中肋骨条藻[7-8] (表 1、表 2)等。
|
表 1 2014—2018年我国近海东海原甲藻赤潮面积≥100 km2事件(中国海洋灾害公报) Tab.1 Red tide of Prorocentrum donghaiensis with an area ≥100 km2 off the coast of China from 2014 to 2018 (China Marine Disaster Bulletin) |
|
表 2 2014—2018年中肋骨条藻赤潮我国近海面积≥100 km2事件(中国海洋灾害公报) Tab.2 Red tide of Skeletonema costatum with an area ≥100 km2 off the coast of China from 2014 to 2018 (China Marine Disaster Bulletin) |
浮游藻类在海表进行光合作用产生有机物,维持海洋物质循环及其能量转化[9],是最重要的初级生产者[10]。温度、光照、磷酸盐、初始生物量在赤潮发生过程中的作用至关重要[11-13]。大量的陆源排放导致沿海海域氮、磷等营养盐浓度居高不下。其中,相对的高无机氮、低磷酸盐导致的高氮磷比是长江口海域营养盐分布的主要特点[14],磷酸盐成为浮游藻类生长的相对限制性因素[15]。综合考虑温度、光照、营养盐等多种因素及其交互作用对中肋骨条藻等赤潮种的影响研究相对较少[16],以往研究[17-20]多考虑1~2种环境因子的影响作用。本文旨在对4种环境和生物因素(温度、光照、磷酸盐、初始生物量)共同作用下对上述两种赤潮高发藻的生长条件和光合活性变化进行对比,为我国沿海、特别是长江和江浙近海赤潮的科学防治提供实验依据。
1 材料与方法 1.1 藻种培养除磷酸盐外,按照f/2培养基[21]添加方法配置培养液,磷酸盐浓度设置为0.1、1.0、5.0、10.0 μmol/L 4个水平,所有实验组浓度N的起始浓度为f/2培养基浓度。藻类实验培养配置盐度30的人工海水,由0.45 μm滤膜过滤后的海水、锥形瓶等实验所需用品经高温灭菌待用,高温灭菌条件为121 ℃高压下20 min。模拟实际海域光照情况,将光照培养箱光暗比调至12 h∶ 12 h。
1.2 藻细胞丰度计数培养过程中每2天取1 mL藻液,用鲁戈氏剂固定后立刻在显微镜下用计数器测定藻液细胞丰度,每个样品计数3次,取平均值。
1.3 实验方法及数据采集将处于指数生长期的东海原甲藻和中肋骨条藻接入锥形瓶进行室内培养实验,每组实验条件设置3个平行样,为防止藻类附壁生长或者下沉同时保证一致的生长环境,每天定时手动摇动藻液3次且随机调整3个平行样锥形瓶在培养箱中的位置,实验过程均在超净工作台上采用无菌操作。实验分为两个阶段,第一阶段培养周期为10 d,分别于第0、2、4、6、8、10天取样测量叶绿素a质量浓度、藻细胞丰度、叶绿素荧光参数。第0天数据为各实验组适应环境半天后测得,各组初始生物量及实验条件不同,故叶绿素a质量浓度及各参数第0天初始值具有差异。实验第二阶段为磷酸盐添加实验,生长周期第10天进行磷酸盐的添加,浓度添加至之前设置的实验水平,分别于第12、14、16天测定各指标。采用叶绿素荧光仪(PHYTO-PAM WALZ)测得Fv/Fm、α、rETRmax、IK等荧光参数,即最大量子产量、光能利用率、最大相对电子传递速率、耐受光强,进而得到快速曲线方程[22]:
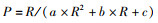 (1)
(1)
式中:P和R分别为相对电子传递速率rETR和光强;a、b、c为系数。
1.4 正交实验设计选取温度、光照、磷酸盐浓度、初始生物量4个因素,温度参照我国东海长江口及附近海域赤潮高发期水温,设定17、20、23、26 ℃ 4个水平;光照参考不同透明度下照度计在水下0.2~0.5 m测得的数据,设定40、80、120、160 μmol photons/(m2·s);磷酸盐参照发生赤潮时磷酸盐浓度及浮游植物生长的需求[23-25],设定0.1、1.0、5.0、10.0 μmol/L等4个水平;东海原甲藻和中肋骨条藻细胞丰度分别超过106 cells/L、5×106 cells/L判定形成赤潮[26],藻细胞接种密度设定1×104、3×104、5×104、7×104cells/mL等4个水平,均超过两种藻的赤潮发生标准。使用正交表L16(45)安排室内实验(表 3)。
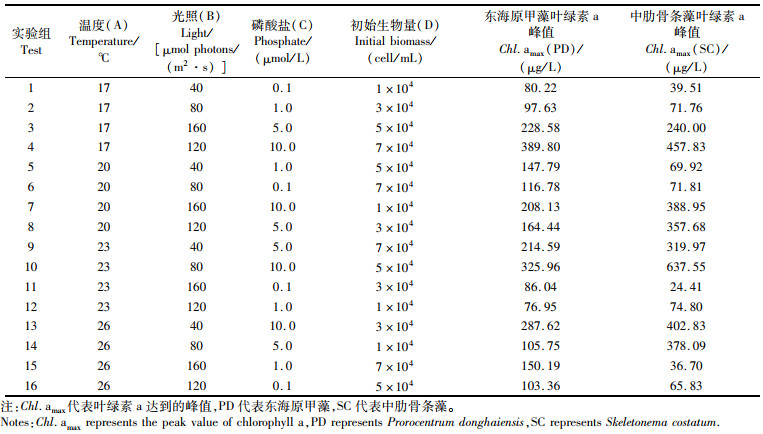
|
表 3 正交实验表及叶绿素a质量浓度峰值 Tab.3 Orthogonal experiment table and the peak value of chlorophyll a mass concentation |
叶绿素a质量浓度是光合作用浮游植物(主要是微藻)生物量的良好指标,并且浮游植物生物量与初级生产力之间存在显著的正相关[27]。各实验组由于培养条件不同导致生长差异显著,故本文选取叶绿素a质量浓度峰值作为分析指标进行单因素方差分析(One-Way ANOVA),所有数据为3个平行样的均值。见表 4。

|
表 4 叶绿素a质量浓度峰值方差分析表 Tab.4 Table of Chlorophyll a mass concentration variance analysis |
通过方差分析(表 4)表明,本研究4个因素中磷酸盐浓度对东海原甲藻和中肋骨条藻叶绿素a质量浓度峰值有极其显著的影响(P < 0.01),温度、光照、初始生物量的影响不显著,故下文以磷酸盐浓度分组,分析两种微藻叶绿素a质量浓度在不同磷酸盐浓度组的变化规律(图 1)。在0.1 μmol/L磷酸盐浓度组,东海原甲藻叶绿素a质量浓度峰值均值±标准差为(70.64±6.96)μg/L;1.0 μmol/L磷酸盐浓度组为(79.22±8.05)μg/L;5.0 μmol/L磷酸盐浓度组为(137.85±16.91)μg/L;10.0 μmol/L磷酸盐浓度组为(206.31±10.57)μg/L。在0.1 μmol/L和1.0 μmol/L两组低磷酸盐浓度组,除A4B3C2D4(NO.15)从第0天持续下降,第8天降至0 μg/L外,其他实验组叶绿素a质量浓度较稳定,分别在培养期间第0~2、0~4、0~6天增长,达到峰值后缓慢下降。在5.0 μmol/L磷酸盐浓度组,A3B1C3D4(NO.9)、A4B2C3D1(NO.14)培养初期上升,在第4天达到峰值后下降,A1B3C3D3(NO.3)、A2B4C3D3(NO.8)在培养周期内持续上升;在10 μmol/L磷酸盐浓度组,除A3B2C4D3(NO.10)在第4天达到峰值外,其余3组持续增加。
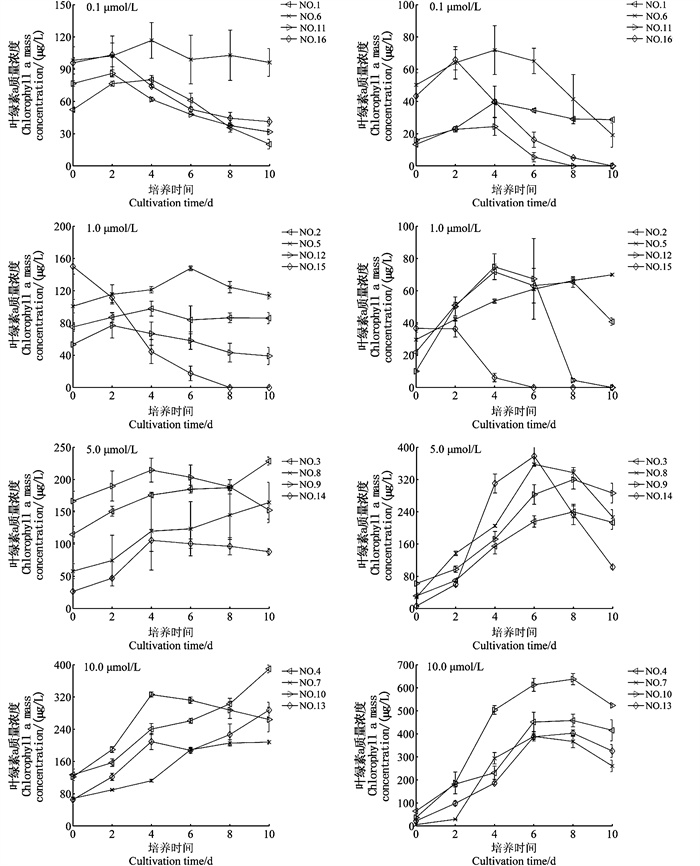
|
NO.表示正交实验组。 NO. represents orthogonal experiment group. 图 1 东海原甲藻(左图)和中肋骨条藻(右图)不同磷酸盐浓度组叶绿素a质量浓度变化 Fig. 1 Mass concentration variation with time of chlorophyll a in different phosphate concentration groups of Prorocentrum donghaiensis(left panel) and Skeletonema costatum(right panel) |

|
图 2 磷酸盐添加对东海原甲藻和中肋骨条藻细胞丰度的影响 Fig. 2 Effect of phosphate addition on algal cell abundance of Prorocentrum donghaiensis and Skeletonema costatum |
在0.1 μmol/L磷酸盐浓度组,中肋骨条藻叶绿素a质量浓度峰值均值±标准差为(29.97±4.21)μg/L;1.0 μmol/L磷酸盐浓度组为(38.46±3.36)μg/L;5.0 μmol/L磷酸盐浓度组为(188.73±12.62)μg/L;10.0 μmol/L磷酸盐浓度组为(294.63±19.30)μg/L,5.0μmol/L、10.0 μmol/L磷酸盐浓度组叶绿素a浓度显著高于其他两组。在0.1 μmol/L磷酸盐浓度组,叶绿素a浓度于第2或第4天达到峰值,在培养末期均降至较低水平(< 40 μg/L),其中A3B3C1D2(NO.11)、A4B4C1D3(NO.16)分别于第8、10天降至0 μg/L。在1.0 μmol/L磷酸盐浓度组,A2B1C2D3(NO.5)在培养周期内持续上升;A4B3C2D4(NO.15)持续下降并于第6天降至0 μg/L;其余两组于第4天达到峰值,其中A3B4C2D1(NO.12)第8天降至0 μg/L。在5.0 μmol/L磷酸盐浓度组,各组于第6天或第8天达到峰值后下降,在10.0 μmol/L磷酸盐浓度组,各组同样于第6天或第8天达到峰值后下降,且培养末期在4组磷酸盐浓度水平叶绿素a质量浓度值最高(>200 μg/L)。
在0.1 μmol/L、1.0 μmol/L磷酸盐浓度组,东海原甲藻中除A4B3C2D4(NO.15)叶绿素a质量浓度在培养周期内持续下降,其余各组较稳定;中肋骨条藻随时间变化的幅度较大,而东海原甲藻叶绿素a质量浓度相对稳定,且质量浓度峰值大于中肋骨条藻。在5.0 μmol/L、10.0 μmol/L磷酸盐浓度组,东海原甲藻中除A3B1C3D4(NO.9)、A3B2C4D3(NO.10)两组,叶绿素a质量浓度呈不断上升趋势;中肋骨条藻生长周期较完整,叶绿素a质量浓度呈现由上升到峰值继而下降的变化,与低磷酸盐浓度的2组相比,中肋骨条藻叶绿素a质量浓度显著大于东海原甲藻。东海原甲藻和中肋骨条藻叶绿素a质量浓度在培养周期内分别于A1B4C4D4(NO.4)、A3B2C4D3(NO.10)达到最大值。
2.2 东海原甲藻和中肋骨条藻添加磷酸盐后的生长对比考虑到实际海域海水平流和垂向对流带来的营养盐补给,在实验第一阶段培养末期对各组进行磷酸盐的添加,讨论磷酸盐的添加对东海原甲藻和中肋骨条藻细胞丰度的影响。藻细胞丰度是用来表征微藻生长状态的重要参数之一,叶绿素a质量浓度是浮游植物生物量的良好指示[27],经测定东海原甲藻、中肋骨条藻叶绿素a质量浓度与细胞丰度呈显著的线性正相关关系,分别为y=0.05x+0.57, R2=0.88, n=96, P < 0.01和y=0.18x-0.99, R2=0.98, n=76, P < 0.01,故本部分赤潮种生物量以细胞丰度来表示。
在0.1 μmol/L、1.0 μmol/L磷酸盐浓度组,东海原甲藻[除A4B3C2D4(NO.15)]细胞丰度由下降转为上升趋势;中肋骨条藻细胞丰度持续下降,其中,A1B2C2D2(NO.2)、A2B1C2D3(NO.5)两组在培养末期降至较低水平,其余各组在培养周期内降至0。在5.0 μmol/L和10.0 μmol/L磷酸盐浓度组,磷酸盐的添加使两种微藻细胞丰度上升,东海原甲藻生长缓慢,中肋骨条藻快速增殖。在10.0 μmol/L磷酸盐浓度组细胞丰度增加最快,A3B2C4D3(NO.10)持续上升,在培养周期内达到最大值。
2.3 东海原甲藻和中肋骨条藻荧光参数的对比对叶绿素荧光参数的对比分析,发现东海原甲藻[除A4B3C2D4(NO.15)]Fv/Fm稳定于0.5左右,波动较小(< 0.2),且一般高于中肋骨条藻,中肋骨条藻Fv/Fm波动范围较大(>0.5) (图 3)。东海原甲藻A4B3C2D4(NO.15)Fv/Fm从接入环境的第0天持续下降,第8天降至0,此时叶绿素a质量浓度也降至0。除A4B3C2D4(NO.15),在0.1 μmol/L和1.0 μmol/L磷酸盐浓度组中其余组东海原甲藻Fv/Fm较5 μmol/L、10 μmol/L磷酸盐浓度组稳定,表明东海原甲藻对低磷环境的耐受力更强。中肋骨条藻Fv/Fm分别于第0、2、4天快速达到峰值,A4B4C1D3(NO.16)、A3B4C2D1(NO.12)在培养末期出现异常高值,表明叶绿素a质量浓度为0时短期内可能造成藻细胞内部系统紊乱。在5.0 mol/L、10.0 μmol/L磷酸盐浓度组,中肋骨条藻Fv/Fm在培养初期上升速度最快,光化学反应潜力大于东海原甲藻;同时此两组磷酸盐浓度组,两种微藻分别达到最大值,此时光合活性最强。在10.0 μmol/L磷酸盐浓度组,东海原甲藻和中肋骨条藻的两组不同环境组合Fv/Fm变化趋势相近,表示在磷酸盐充足条件下,温度、光照、初始生物量对光合活性的影响较小。
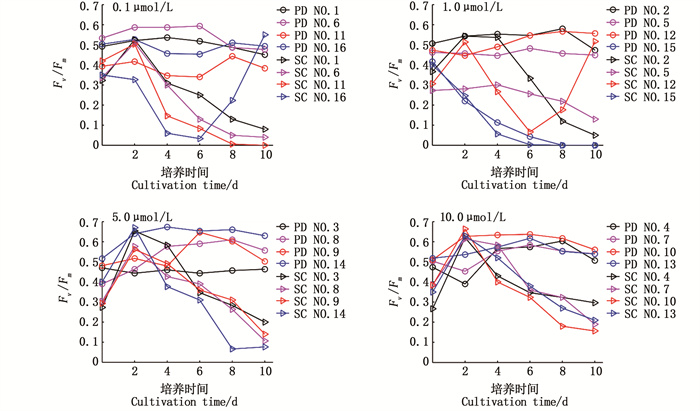
|
图 3 两种赤潮藻Fv/Fm变化对比 Fig. 3 Fv/Fm variation between the two red tide algae |
藻类的光能利用率α与Fv/Fm变化趋势相似(图 4),Fv/Fm与α具有显著的线性正相关关系,y=0.38, R2=0.83, n=192,P < 0.01,表明光能利用率代表最大光合活性,最大电子传递速率与光合作用能力共同促进藻类生长。东海原甲藻中除A4B3C2D4(NO.15)持续下降并于第6天降至0,其余各组α值稳定于0.2左右,5.0 μmol/L磷酸盐组最高,表明此时东海原甲藻的光能利用率最强。中肋骨条藻整体变化较大(>0.2),表明东海原甲藻光合器官对光能的利用率稳定。
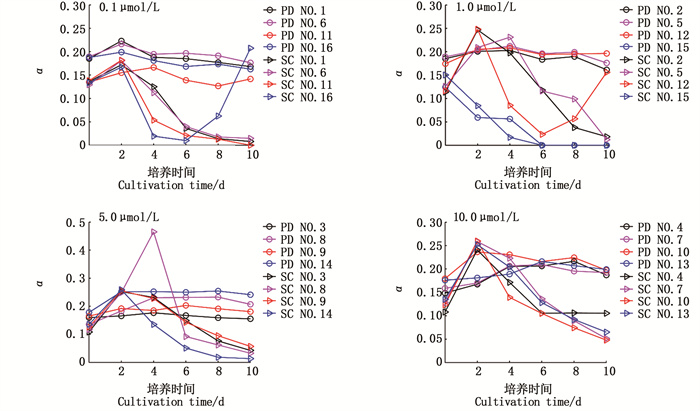
|
图 4 两种赤潮藻α变化对比 Fig. 4 α variation between the two red tide algae |
在0.1 μmol/L和1.0 μmol/L磷酸盐浓度组,东海原甲藻rETRmax变化稳定(图 5),在1.0 μmol/L磷酸盐浓度组,中肋骨条藻rETRmax变化较小。在5.0 μmol/L、10.0 μmol/L磷酸盐浓度组,两种微藻rETRmax波动较大,说明磷酸盐浓度过高导致细胞相对电子传递速率不稳定。
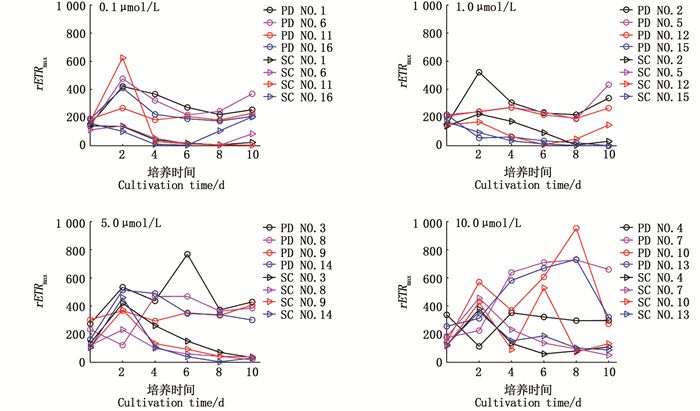
|
图 5 两种赤潮藻rETRmax变化 Fig. 5 rETRmax variation between the two red tide algae |
Ik与rETRmax变化趋势相近(图 6),rETRmax与Ik呈线性正相关关系,y=0.36x+583.88, R2=0.48, n=96,P < 0.01。总体来说,东海原甲藻和中肋骨条藻在0.1 μmol/L与1.0 μmol/L磷酸盐浓度组波动范围较小,在5.0 μmol/L、10.0 μmol/L磷酸盐浓度组波动最大(>5 000)。在10.0 μmol/L磷酸盐浓度组,Ik耐受光强达到最大值(东海原甲藻>4 000、中肋骨条藻>5 000),高磷酸盐条件下耐受光强范围越大,表示藻类对强光的耐受力越强,适应环境的能力越强。
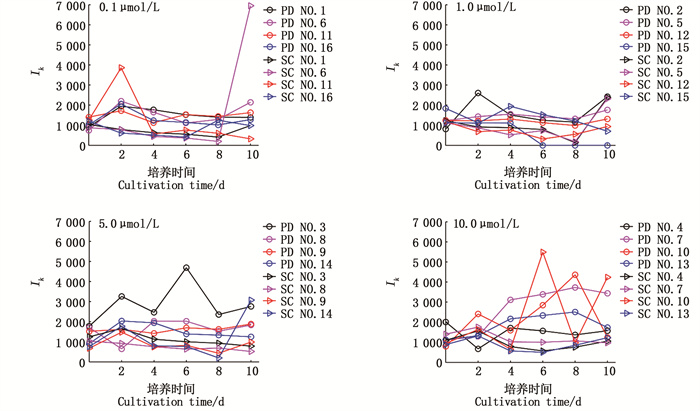
|
图 6 两种赤潮藻Ik变化 Fig. 6 Ik variation between the two red tide algae |
各环境因子对荧光参数的方差分析(表 5)表明,光照对东海原甲藻Fv/Fm、α均有显著影响(P < 0.05),温度、磷酸盐、初始生物量均未产生显著影响,表明东海原甲藻进行光化学反应的最大潜力和光能的利用效率受光照的制约明显。磷酸盐对中肋骨条藻Fv/Fm造成极其显著的影响(P < 0.01)(表 5),光照对Ik产生显著影响(P < 0.05),温度、初始生物量均未对荧光参数造成显著影响,表明磷酸盐对光化学反应潜力的影响效能最大。
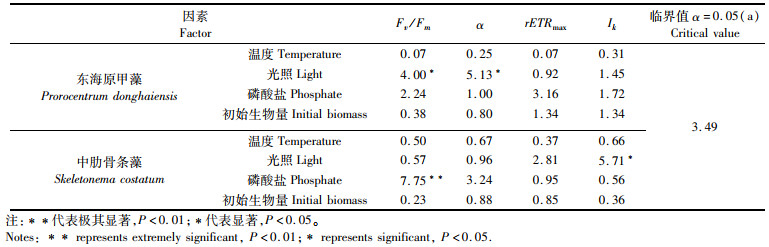
|
表 5 环境因子对叶绿素荧光参数的方差分析 Tab.5 Analysis of variance of environmental factors on chlorophyll fluorescence parameters |
叶绿素a质量浓度在一定程度上可表示浮游植物的细胞丰度,是表示浮游植物生物量的常用变量,其时空分布可直观反映浮游植物细胞生长是否受到环境因子的胁迫。叶绿素a质量浓度随时间的变化则可反映环境因子变化对藻类光合活性的影响[28]。
东海原甲藻叶绿素a质量浓度在17 ℃时达到最高,26 ℃时相对较低,温度在20~26 ℃各水平差异不显著。温度过低阻碍细胞脂膜相态转换,降低相对电子传递速率[29];温度过高藻细胞新陈代谢加快,细胞活性增加,维持生长需要的能量不足致细胞死亡增加[30]。东海原甲藻适温范围分别为15~25 ℃[26],表明17 ℃、26 ℃并未达到限制生长的阈值。叶绿素a质量浓度在120 μmol photons/(m2·s)时最高,在其他3个光强水平下差异不显著,因为东海原甲藻适宜生存在低光照条件下或次表层水中,且在强光下不会发生光抑制现象[18]。
本文实验中,中肋骨条藻叶绿素a质量浓度峰值出现在23 ℃、80 μmol photons/(m2·s)、10.0 μmol/L、5×104 cells/mL水平条件下,中肋骨条藻在22~28 ℃[6]时细胞分裂增殖较快,其中15~25 ℃会出现明显的指数增长[31]。叶绿素a质量浓度在一定范围内随着光照的增加而增加,80 μmol photons/(m2·s)达到峰值后下降。
中肋骨条藻对磷酸盐的利用能力更强,藻细胞丰度快速增加,过高的生物密度产生遮蔽作用,从而降低藻细胞内部对光能的利用效率[32],故在5×104 cells/mL时叶绿素a质量浓度达到最高;东海原甲藻叶绿素a质量浓度相对稳定,故在7×104 cells/mL初始生物量时达到峰值。磷酸盐对两种微藻叶绿素a质量浓度峰值产生显著影响,温度、光照、初始生物量对其影响不显著。
3.2 磷酸盐添加藻细胞丰度对比磷酸盐添加后,东海原甲藻在不同磷酸盐浓度组藻细胞丰度均增加,表明东海原甲藻更适宜在低磷环境中较好生存。中肋骨条藻在0.1 μmol/L、1.0 μmol/L磷酸盐浓度组,A1B1C1D1(NO.1)、A2B1C2D3(NO.5)在第一阶段培养周期内,叶绿素a质量浓度和藻细胞丰度处于低值,磷酸盐添加未阻止藻细胞持续衰落;在5.0 μmol/L、10.0 μmol/L磷酸盐浓度组藻细胞快速分裂增殖,表明中肋骨条藻对磷酸盐利用效率高,较低磷酸盐浓度因不能满足其生长需求,藻细胞持续衰落,在较高磷酸盐浓度时藻细胞急剧增长,高磷酸盐浓度组的中肋骨条藻细胞丰度明显高于东海原甲藻。
3.3 荧光参数对比两种微藻不同生长环境的荧光参数对比分析反映藻类的生长状况。东海原甲藻和中肋骨条藻细胞大小差异较大,东海原甲藻细胞长15~22 μm,宽9~14 μm[33],根据SUN等[34]得出:东海原甲藻细胞体积为636~2 257 μm3;中肋骨条藻细胞呈圆柱形,直径约6~7 μm,细胞单体体积约195 μm3[35]。细胞的体积越小,其比表面积越大,细胞的物质输运效率和对光子利用的效率更高。东海原甲藻较中肋骨条藻细胞比表面积小,物质输运效率和光照利用率低,从而东海原甲藻生物量随时间变化较中肋骨条藻稳定,中肋骨条藻更容易产生生物量的大起大落。
Fv/Fm为最大光量子产量,反映植物进行光化学反应的最大潜力[6],作为衡量光合活性的主要指标,在环境胁迫条件下会明显下降[36-37]。Fv/Fm、α具有显著的线性正相关关系,y=0.38x, R2=0.83, n=192,P < 0.01,东海原甲藻除A4B3C2D4(NO.15)持续下降,其他各组变化稳定,Fv/Fm在值0.5上下波动,α在0.2上下波动,东海原甲藻体内存在磷库[19],耐低磷胁迫能力更强;中肋骨条藻各组变化较大,由于对藻液中磷酸盐吸收利用强,分别于第0、2、4天快速达到峰值。rETRmax、Ik呈线性正相关,关系式为y=0.36x+583.88, R2=0.48, n=192,P < 0.01。两种微藻在0.1 μmol/L、1.0 μmol/L磷酸盐浓度组变化相对稳定,在5.0 μmol/L、10.0 μmol/L磷酸盐浓度组出现较大值且波动较大,表示高磷酸盐条件下相对电子转化速率和对光强的耐受力越大,在磷酸盐充足条件下对其温度、光照、初始生物量不同环境因子适应能力强。
中肋骨条藻在叶绿素a质量浓度降至0 μg/L时,Fv/Fm、α、rETRmax、Ik也降至0或在培养末期测得异常值,可能是因为叶绿素a浓度刚刚降至0 μg/L,导致叶绿素荧光参数不稳定,更深层次原因还有待开展更多实验研究。
结合实际海域赤潮发生时,磷酸盐浓度大都为1.0 μmol/L[38],东海原甲藻A3B4C2D1(NO.12)的Fv/Fm,α始终维持较高水平,中肋骨条藻A3B4C2D1(NO.12)、A4B3C2D4(NO.15)在第2~6天急剧下降,光合活性变弱,中肋骨条藻A3B4C2D1(NO.12)、A4B3C2D4(NO.15)叶绿素a质量浓度和藻细胞丰度不断下降,在第一阶段培养周期内降至0 μg/L,且磷酸盐的添加并未使叶绿素a质量浓度出现上升,未扭转藻细胞死亡。东海原甲藻A3B4C2D1(NO.12)叶绿素a质量浓度培养初期上升,第2天达到峰值,在培养周期内较稳定,磷酸盐添加后藻细胞稳定增长,各荧光参数均保持稳定。此时,接近现场海域日常磷酸盐浓度(≤1.0 μmol/L)环境中,中肋骨条藻达到峰值浓度后逐渐衰落,若有营养盐的持续供给,往往东海原甲藻慢慢成长为优势种。
4 结论(1) 在0.1 μmol/L、1.0 μmol/L磷酸盐浓度组,东海原甲藻叶绿素a质量浓度峰值均值大于中肋骨条藻;在5.0 μmol/L、10.0 μmol/L磷酸盐浓度组,中肋骨条藻生物量显著大于东海原甲藻。
(2) 本文实验中,两种赤潮高发藻最适宜的生长条件不同,东海原甲藻实验组最适宜生长条件为17 ℃、120 μmol photons/(m2·s)、10.0 μmol/L、7×104 cells/mL,中肋骨条藻为23 ℃、80 μmol photons/(m2·s)、10.0 μmol/L、5×104 cells/mL。对两种微藻叶绿素a质量浓度峰值产生极其显著影响的是磷酸盐(P < 0.01),其他3个环境因子温度、光照、初始生物量未对其产生显著影响。
(3) 磷酸盐添加表明:在0.1 μmol/L、1.0 μmol/L低磷环境中东海原甲藻能够生存,高初始生物量下中肋骨条藻细胞丰度难以维持,快速衰落;在5.0和10.0 μmol/L高磷环境中,中肋骨条藻较东海原甲藻快速增殖,增速最快,对磷酸盐利用能力强,6~8天后开始衰落。
(4) 荧光参数的对比分析显示,10.0 μmol/L磷酸盐浓度组,4个荧光参数最大,光合活性最强,藻类叶绿素a质量浓度最高,生长条件最好。东海原甲藻荧光参数Fv/Fm、α较中肋骨条藻稳定,东海原甲藻体内存在磷库从而对低磷环境耐受力强,故光合活性稳定;中肋骨条藻于培养初期快速达到峰值,对磷酸盐利用能力强,但衰落期更早,生物量衰落时间与荧光参数下降时间对应良好。由于两种细胞体积和比表面积的差异,东海原甲藻的光合活性在更大程度上受光照的影响,中肋骨条藻的光合活性在更大程度上受磷酸盐、光照的影响。
| [1] |
曹洁茹, 桓清柳, 吴霓, 等. 光照、温度和氮磷限制对6种典型鱼毒性藻类生长及产毒的影响[J]. 海洋环境科学, 2015, 34(3): 321-329. CAO J R, HUAN Q L, WU N, et al. Effects of temperature, light intensity and nutrient condition on the growth and hemolytic activity of six species of typical ichthyotoxicalgae[J]. Marine Environmental Science, 2015, 34(3): 321-329. |
| [2] |
谭志军, 颜天, 周名江. 有害赤潮藻对鱼类影响的研究进展[J]. 水产学报, 2002, 26(6): 561-568. TAN Z J, YAN T, ZHOU M J. Current status of studies on the effects of harmful algae on fish[J]. Journal of Fisheriesof China, 2002, 26(6): 561-568. |
| [3] |
陈舜, 佟蒙蒙, 江天久, 等. 赤潮灾害对水产养殖业损失的分级评估[J]. 水产学报, 2009, 33(4): 610-616. CHEN S, TONG M M, JIANG T J, et al. The assessment of aquaculture loss caused by red tides[J]. Journal of Fisheries of China, 2009, 33(4): 610-616. |
| [4] |
LU D D, GOEBEL J. Five red tide species in genus Prorocentrum including the description of Prorocentrum donghaiense Lu SP. nov.from the East China Sea[J]. Chinese Journal of Oceanology and Limnology, 2001, 19(4): 337-344. DOI:10.1007/BF02850738 |
| [5] |
LU D D, GOEBEL J, QI Y Z, et al. Morphological and genetic study of Prorocentrum donghaiense Lu from the East China Sea, and comparison with some related Prorocentrum species[J]. Harmful Algae, 2005, 4(3): 493-505. DOI:10.1016/j.hal.2004.08.015 |
| [6] |
王志宝, 赵奎峰, 梁黎明, 等. 温度、盐度和硅酸钠浓度对中肋骨条藻生长的影响[J]. 烟台大学学报(自然科学与工程版), 2018, 31(3): 275-282. WANG Z B, ZHAO K F, LIANG L M, et al. Effects of temperature, salinity and silicate density on growth of Skeletonema costatum[J]. Journal of Yantai University (Natural Science and Engineering Edition), 2018, 31(3): 275-282. |
| [7] |
邓光, 耿亚洪, 胡鸿钧, 等. 几种环境因子对高生物量赤潮甲藻——东海原甲藻光合作用的影响[J]. 海洋科学, 2009, 33(12): 34-39. DENG G, GENG Y H, HU H J, et al. Effects of environmental factors on photosynthesis of a high biomass bloom forming species Prorocentrum donghaiense[J]. Marine Sciences, 2009, 33(12): 34-39. |
| [8] |
陈炳章, 王宗灵, 朱明远, 等. 温度、盐度对具齿原甲藻生长的影响及其与中肋骨条藻的比较[J]. 海洋科学进展, 2005, 23(1): 60-64. CHEN B Z, WANG Z L, ZHU M Y, et al. Effects of temperature and salinity on growth of Prorocentrum dentatum and comparisons between growths of Prorocentrum dentatum and Skeletonema costatum[J]. Advances in Marine Science, 2005, 23(1): 60-64. DOI:10.3969/j.issn.1671-6647.2005.01.008 |
| [9] |
KALNAY E, KANAMITSU M, KISTLER R, et al. The NCEP/NCAR 40-year reanalysis project[J]. Bulletin of the American Meteorological Society, 1996, 77(3): 437-472. DOI:10.1175/1520-0477(1996)077<0437:TNYRP>2.0.CO;2 |
| [10] |
RAMARAJ R, TSAIDD W, CHEN P H. Algae growth in natural water resources[J]. Journal of Soil and Water Conservation, 2010, 42(4): 439-450. |
| [11] |
DAVIDSON K, GOWEN R J, HARRISON P J, et al. Anthropogenic nutrients and harmful algae in coastal waters[J]. Journal of Environmental Management, 2014, 146: 206-216. |
| [12] |
SIGNORINI S R, MCCLAIN C R. Environmental factors controlling the Barents Sea spring-summer phytoplankton blooms[J]. Geophysical Research Letters, 2009, 36(10): L10604. DOI:10.1029/2009GL037695 |
| [13] |
郭文霞, 丁洪昌, 严兴洪. 光强和温度对圆紫菜叶状体体细胞发育分化的影响[J]. 上海海洋大学学报, 2020, 29(2): 209-217. GUO W X, DING H C, YAN X H. The effects of light intensity and temperature on the development and differentiation of single somatic cells isolated from the gametophytic blades in Pyropia suborbiculata (Bangiales, Rhodophyta)[J]. Journal of Shanghai Ocean University, 2020, 29(2): 209-217. |
| [14] |
CHAI C, YU Z M, SONG X X, et al. The status and characteristics of eutrophication in the Yangtze River (Changjiang) estuary and the adjacent East China Sea, China[J]. Hydrobiologia, 2006, 563(1): 313-328. DOI:10.1007/s10750-006-0021-7 |
| [15] |
金月梅. 氮磷限制对8株微藻叶绿素荧光特性及生长的影响[D]. 青岛: 中国海洋大学, 2008. JIN Y M. Effects of nitrogen and phosphorus limitation on the chlorophyll fluorescence and growth of eight microalgaistrains [D]. Qingdao: Ocean University of China, 2008. |
| [16] |
宋娅婷, 林军, 沈敏, 等. 环境因子对中肋骨条藻生长及叶绿素荧光特性的影响[J]. 上海海洋大学学报, 2020, 29(3): 346-354. SONG Y T, LIN J, SHEN M, et al. Effects of environmental factors on growth and chlorophyll fluorescence characteristics of Skeletonemacostatum[J]. Journal of Shanghai Ocean University, 2020, 29(3): 346-354. |
| [17] |
许珍, 殷大聪, 陈进, 等. 温度和光强对4种常见水华藻叶绿素荧光特性的影响[J]. 长江科学院院报, 2017, 34(6): 39-44. XU Z, YIN D C, CHEN J, et al. Effects of temperature and illumination on chlorophyll fluorescence characteristics of four common bloom algae[J]. Journal of Yangtze River Scientific Research Institute, 2017, 34(6): 39-44. |
| [18] |
孙百晔, 王修林, 李雁宾, 等. 光照在东海近海东海原甲藻赤潮发生中的作用[J]. 环境科学, 2008, 29(2): 362-367. SUN B Y, WANG X L, LI Y B, et al. Effects of irradiance on blooms of the dinoflagellate Prorocentrum donghaiense Lu in the coastal area in East China Sea[J]. Environmental Science, 2008, 29(2): 362-367. |
| [19] |
周钦. 甲藻细胞磷库变化特征及赤潮生消周期内浮游生物群落结构变化研究[D]. 温州: 温州大学, 2017. ZHOU Q. Studies on cellular phosphorus pool characteristics of dinoflagellates and changes in plankton community during the occurrence and vanishment process of algal blooms [D]. Wenzhou: Wenzhou University, 2017. |
| [20] |
纪鹏, 王伟隆, 黄旭雄. 不同C/N对绿球藻生长和细胞组分的影响[J]. 上海海洋大学学报, 2020, 29(4): 542-551. JI P, WANG W L, HUANG X X. Effects of different C/N ratios on growth and cell biochemical components of Chlorococcum sp[J]. Journal of Shanghai Ocean University, 2020, 29(4): 542-551. |
| [21] |
GUILLARD R R L, RYTHER J H. Studies of marine planktonic diatoms. I. Cyclotella nana hustedt, and detonulaconfervacea (Cleve) gran[J]. Canadian Journal of Microbiology, 1962, 8(2): 229-239. DOI:10.1139/m62-029 |
| [22] |
EILERS P H C, PEETERS J C H. A model for the relationship between light intensity and the rate of photosynthesis in phytoplankton[J]. Ecological Modelling, 1988, 42(3/4): 199-215. |
| [23] |
刘慧, 董双林, 方建光. 全球海域营养盐限制研究进展[J]. 海洋科学, 2002, 26(8): 47-53. LIU H, DONG S L, FANG J G. The progress of nutrient salts control research in global oceans[J]. Marine Sciences, 2002, 26(8): 47-53. DOI:10.3969/j.issn.1000-3096.2002.08.013 |
| [24] |
张传松, 王修林, 石晓勇, 等. 东海赤潮高发区营养盐时空分布特征及其与赤潮的关系[J]. 环境科学, 2007, 28(11): 2416-2424. ZHANG C S, WANG X L, SHI X Y, et al. Seasonal variation and spatial distribution of nutrients and their relationships with harmful algal blooms in coastal area of the East China Sea[J]. Environmental Science, 2007, 28(11): 2416-2424. DOI:10.3321/j.issn:0250-3301.2007.11.002 |
| [25] |
秦伯强, 高光, 朱广伟, 等. 湖泊富营养化及其生态系统响应[J]. 科学通报, 2013, 58(10): 855-864. QING B Q, GAO G, ZHU G W, et al. Lake eutrophication and its ecosystem response[J]. Chinese Science Bulletin, 2013, 58(9): 961-970. |
| [26] |
霍文毅, 俞志明, 邹景忠, 等. 胶州湾中肋骨条藻赤潮与环境因子的关系[J]. 海洋与湖沼, 2001, 32(3): 311-318. HUO W Y, YU Z M, ZOU J Z, et al. Outbreak of Skeletonema costatum red tide and its relations to environmental factors in Jiaozhoubay[J]. Oceanologiaet Limnologia Sinica, 2001, 32(3): 311-318. DOI:10.3321/j.issn:0029-814X.2001.03.012 |
| [27] |
PLATT T, SATHYENDRANATH S. Estimators of primary production for interpretation of remotely sensed data on ocean color[J]. Journal of Geophysical Research: Oceans, 1993, 98(C8): 14561-14576. DOI:10.1029/93JC01001 |
| [28] |
LORENZEN C J. A method for the continuous measurement of in vivo chlorophyll concentration[J]. Deep Sea Research and Oceanographic Abstracts, 1966, 13(2): 223-227. DOI:10.1016/0011-7471(66)91102-8 |
| [29] |
KRAUSE G H, WEIS E. Chlorophyll fluorescence and photosynthesis: the basics[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1991, 42(1): 313-349. DOI:10.1146/annurev.pp.42.060191.001525 |
| [30] |
郭瑾, 杨维东, 刘洁生, 等. 温度、盐度和光照对球形棕囊藻生长和产毒的影响研究[J]. 环境科学学报, 2007, 27(8): 1341-1346. GUO J, YANG W D, LIU J S, et al. Effects of salinity, temperature and light intensity on the growth and toxin production of Phaeocystis globosa[J]. Acta Scientiae Circumstantiae, 2007, 27(8): 1341-1346. DOI:10.3321/j.issn:0253-2468.2007.08.020 |
| [31] |
BISHOP D G. Chilling sensitivity in higher plants: the role of phosphatidylglycerol[J]. Plant, Cell &Environment, 1986, 9(8): 613-616. |
| [32] |
王爱军, 王修林, 韩秀荣, 等. 光照对东海赤潮高发区春季赤潮藻种生长和演替的影响[J]. 海洋环境科学, 2008, 27(2): 144-148. WANG A J, WANG X L, HAN X R, et al. Effects of solar radiation on the growth and succession of harmful algae in the East China Sea in spring[J]. Marine Environmental Science, 2008, 27(2): 144-148. DOI:10.3969/j.issn.1007-6336.2008.02.011 |
| [33] |
沈盎绿. 东海原甲藻和米氏凯伦藻种间竞争对海水温度变化的响应机制[D]. 上海: 华东师范大学, 2014. SHEN A L. Response mechanism of interspecific competition between Prorocentrum donghaiense and Kareniamikimotoito the changes of seawater temperature [J]. Shanghai: East China Normal University, 2014. |
| [34] |
SUN J, LIU D Y. Geometric models for calculating cell Biovolume and surface area for phytoplankton[J]. Journal of Plankton Research, 2003, 25(11): 1331-1346. DOI:10.1093/plankt/fbg096 |
| [35] |
林军, 朱建荣, 张经, 等. 长江口外海区浮游植物生物量分布及其与环境因子的关系[J]. 水产学报, 2011, 35(1): 74-87. LIN J, ZHU J R, ZHANG J, et al. Distribution of phytoplankton biomass and its relationships with the environmental factors off the Changjiang(Yangtze River) Estuary[J]. Journal of Fisheries of China, 2011, 35(1): 74-87. |
| [36] |
RAE R, VINCENT W F. Phytoplankton production in subarctic lake and river ecosystems: development of a photosynthesis-temperature-irradiance model[J]. Journal of Plankton Research, 1998, 20(7): 1293-1312. DOI:10.1093/plankt/20.7.1293 |
| [37] |
LIPPEMEIER S, FRAMPTON D M F, BLACKBURN S I, et al. Influence of phosphorus limitation on toxicity and photosynthesis of Alexandriumminutum(Dinophyceae) monitored by in-line detection of variable chlorophyll fluorescence[J]. Journal of Phycology, 2003, 39(2): 320-331. DOI:10.1046/j.1529-8817.2003.01019.x |
| [38] |
邹双燕. 福建海域东海原甲藻赤潮初探[J]. 江西水产科技, 2018, 157(1): 47-48. ZOU S Y. A preliminary study on the red tide of Prorocentrum donghaiense in the East China Sea in Fujian Sea[J]. Jiangxi Fishery Sciences and Technology, 2018, 157(1): 47-48. DOI:10.3969/j.issn.1006-3188.2018.01.019 |
2. Ocean Engineering Technology Research Center, Shanghai Ocean University, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


