2. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
为了适应环境中的光线,鱼类在生长发育过程中形成了背部颜色深腹部颜色浅的隐蔽伪装色(countershading)[1-3]。生活在不同水环境中的鱼类,其体色存在较大的差别。决定这一现象的主要成因是鱼类皮肤上的色素细胞吸收射入水体中的特定波长的光线,同时反射其他波长的光线。最终的体色由色素细胞的数目、所处位置和细胞内色素颗粒的形态等共同呈现。
鱼类的光感受器为视蛋白,主要由5种视蛋白基因编码,分别为视紫红质(Rhodopsin,rh1)基因、感绿光的敏感视蛋白(Rhodopsin-like opsin,rh2)基因、中长波敏感视蛋白(Middle/Long-wavelength-sensitive opsin,m/lws)基因、感紫光/紫外光的短波敏感视蛋白(Short-wavelength-sensitive opsin,sws1)基因和感蓝光的短波敏感视蛋白(sws1-like opsin,sws2)基因[4]。研究表明,各种感光的视蛋白基因除了在鱼类的眼睛中表达外,在一些鱼类的仔稚鱼或成鱼的皮肤中也有表达[5],这说明硬骨鱼类的皮肤具有接收光线的作用。
硬骨鱼类的隐蔽伪装色是其背腹部黑色素细胞数量差异显著的外在体现[6-11]。研究表明,高强度的紫外光照射白鲑(Coregonus lavaretus)[5]、真鲷(Pagrus major)[12]或虹鳟(Oncorhynchus mykiss)[13]会使鱼类皮肤变黑,这可能是由于黑色素细胞密度增加或者黑色素细胞扩散导致的, 说明紫光/紫外光是影响鱼类皮肤黑色素细胞分布、增殖的一个重要因素。但对于紫光/紫外光是否通过sws1基因对鱼类皮肤的黑色素细胞数量产生影响的研究还较少。
pomc和asip1都是与黑色素细胞产生相关的基因。前阿黑皮素(pro-opiomelanocortin,Pomc)是编码促肾上腺皮质激素(Acth)、黑色素细胞刺激激素(Msh)等的前体蛋白[14]。在泥鳅中,高水平的α-Msh促进皮肤黑色素分泌的增加而形成黑斑[15]。KANG等[16]研究发现,pomc基因可能参与养殖牙鲆在避光环境中出现无眼侧黑化的现象。Pomc及其衍生的Msh也与条斑星鲽的色素调节以及无眼侧黑化相关[17-20]。刺鼠信号蛋白(agouti signaling protein,Asip1)是Agouti信号蛋白家族成员之一,通过与α-Msh竞争性结合Mc1r(Melanacortin receptor 1)的方式调控黑色素生成[21]。VRIELING等[22]发现asip的不同转录本调控小鼠背部黑色毛发和腹部白色毛发的形成。在灵长类中,其毛发颜色和腹部颜色被认为与asip基因的表达有关[23]。视黄醛脱氢酶基因(Retinal dehydrogenase,raldhs)是与视黄酸合成相关的重要基因,能够促进小鼠胚胎黑色素细胞的形成[24], 也可以在光诱导后生成异构化9-顺式视黄醛与UV-A结合诱导人体皮肤黑色素细胞产生黑色素[25]。斑马鱼中只有raldh2和raldh3这2个基因,raldh1缺失[26]。
本研究构建感紫光短波视蛋白sws1基因纯合缺失斑马鱼品系,探究sws1基因在紫光照射中对斑马鱼黑色素细胞形成的作用,以及与黑色素细胞形成相关的pomc、asip1、raldhs的表达水平变化。研究结果为紫光/紫外光通过sws1基因对鱼类皮肤的黑色素细胞数量产生影响提供理论依据,能更好地解释光线调控鱼类隐蔽伪装色的形成机制。
1 材料与方法 1.1 sws1基因敲除 1.1.1 感紫光短波视蛋白sws1靶点设计在UCSC (The University of California Santa Cruz) Genome Browser(https://genome.ucsc.edu/)网站上设计斑马鱼感紫光短波视蛋白sws1基因的敲除靶点。靶点包含20个碱基,序列为5′-GGACTCTGACTCGGCCTGCT-3′。由于本实验所用的sgRNA(single-guide RNA,向导RNA)体外转录采用了T7启动子, 所以要求靶点5′端为GG。紧邻靶点的3′端的碱基序列为NGG (N为任意碱基,表 1)。
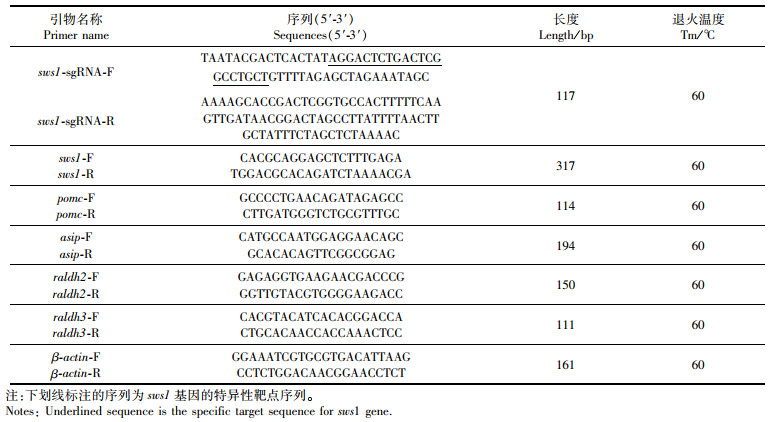
|
表 1 sgRNA合成和PCR所用引物 Tab.1 Primers for sgRNA synthesis and PCR analysis |
通过生工生物合成靶点上游引物sws1-sgRNA-F,在靶点的5′端加上T7启动子序列5′-TAATACGACTCACTATA-3′, 在靶点的3′端加上与基因组互补的序列5′-GCTGTTTTAGAGCTAGAAATAGC-3′,下游引物sws1-sgRNA-R为通用引物(表 1)。通过PCR合成带有T7启动子和基因组的sgRNA靶点。配置20 μL体系:2×Taq PCR Master Mix 10 μL、sws1-sgRNA-F/R各1.5 μL、ddH2O 7 μL。PCR反应步骤和条件为98 ℃变性2 min,50 ℃退火10 min,72 ℃延伸10 min。利用HiScribeTM T7 Quick(NEB)试剂盒对PCR产物进行体外转录后,通过RNA Clean & ConcentratorTM-25(ZYMO RESEARCH)试剂盒纯化。经1%琼脂糖凝胶电泳检测sgRNA的质量后,用Nanodrop 2000测定浓度及OD260/OD280,将样品保存于- 80 ℃备用。
1.1.3 Cas9 mRNA合成采用的质粒为T3质粒pT3TS-nCas9n,具有氨苄抗性,长度为7 330 bp。通过酶切手段将质粒线性化后,用PCR Purification Kit试剂盒进行纯化。接着通过mMESSAGE mMACHINETM T3试剂盒将线性化的质粒进行体外转录后,用RNA Clean & ConcentratorTM-25(ZYMO RESEARCH)试剂盒纯化转录得到的Cas9 mRNA,测浓度后保存于-80 ℃备用。
1.1.4 显微注射及基因敲除有效性检测将sg RNA和Cas9 mRNA混合后注射到野生型AB品系斑马鱼Ⅰ细胞期的胚胎中。在注射后6、12以及24 h时剔除死卵,显微注射后胚胎成活率为70%。使用碱裂解法提取基因组DNA。选取受精后48 h胚胎或者少许尾鳍,加入10 μL 50 mmol/L NaOH溶液95 ℃裂解10 min,加入1 μL 1 mol/L HCl中和后即为所需的斑马鱼基因组DNA。在NCBI上设计靶点特异性引物sws1 -F/R(表 1)对模板DNA进行PCR,配置25 μL体系,其中2×Taq PCR Master Mix 12.5 μL、DNA 1 μL、sws1-F 1 μL、sws1-R 1 μL、ddH2O补齐至25 μL。PCR反应步骤及条件为95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。得到的PCR产物送往生工生物有限公司测序,如果在靶点附近有杂峰出现,说明sgRNA有效。
1.1.5 分子克隆和序列比对将PCR产物进行胶回收处理、连接和转化。通过蓝白斑筛选后,挑取目的片段条带大小的单克隆菌落送到生工生物有限公司进行测序。将测得的序列在NCBI中进行Blast,分析在靶点位置突变的碱基数目和类型,选取非3倍数的样本进行杂交传代,得到sws1-/-纯合突变斑马鱼品系。
1.2 紫光照射实验将饲养至孵化后15 d的野生型AB品系斑马鱼和sws1-/-纯合突变品系斑马鱼置于避光实验架上,在顶部安置紫光灯。设置3个对照组及3个实验组,每组的鱼缸内放置20尾仔鱼,早晚投喂两次,定时换水。通过调节鱼缸和灯管的位置,保持水面光照的强度为(2 000±100) lx。
1.3 黑色素细胞统计分析紫光照射60和100 d时于对照组和实验组分别取30尾鱼,在尼康体视显微镜11.25×视野下进行拍照,统计斑马鱼背腹部各6处(图 1,箭头所指部位分别为背部和腹部从头到尾的1/4、1/2和3/4处)皮肤1 cm2面积中黑色素细胞的数量。所有数据采用平均值±标准差表示。采用SPSS 22.0软件对实验数据进行统计分析,用t检验(independent samples t-test)进行差异显著性分析,当P < 0.05为差异显著。

|
图 1 黑色素细胞计数部位 Fig. 1 Counting site of melanocytes |
紫光照射100 d后,利用Trizol法提取AB野生型斑马鱼和sws1-/-纯合斑马鱼(n=3)背部皮肤的和腹部皮肤RNA。通过1%琼脂糖凝胶电泳检测RNA的质量,用Nanodrop 2000测定RNA浓度,使用M-MLV反转录试剂盒(Promega) 将RNA反转成cDNA,反转录所用RNA的量为1 μg。将得到的cDNA分装保存于-80 ℃。
1.4.2 实时荧光定量PCR在NCBI上设计各基因(pomc/asip1/raldh2/raldh3/β-actin)实时荧光定量qRT-PCR的引物(表 1)。采用SYBR Green染料法检测各基因表达情况,以β-actin为内参基因,设置3个重复组。在避光低温环境下配置20 μL体系。样品加入量如下:qPCR SYBR Green Master Mix 10 μL;Forward Primer(10 μmol/L)0.4 μL;Reverse Primer(10 μmol/L)0.4 μL;cDNA 1 μL;ddH2O 8.2 μL。扩增程序采用3步法:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s,循环数为40;95 ℃ 15 s;60 ℃ 1 min;95 ℃ 30 s;60 ℃15 s。使用ABI 7 500 software分析溶解曲线和Ct值,相对表达量的计算采用2-ΔΔCt法。统计分析使用SPSS软件,采用单因素方差分析比较各基因的背腹表达差异,当P < 0.05时差异显著。
2 结果与分析 2.1 斑马鱼sws1-/-品系构建用CRISPR/Cas9敲除斑马鱼感紫光视蛋白sws1基因后,对突变序列进行鉴定分析,发现在靶序列附近出现4 bp的碱基缺失。测序结果如图 2所示。经过杂交得到sws1-/-纯合敲除品系斑马鱼。
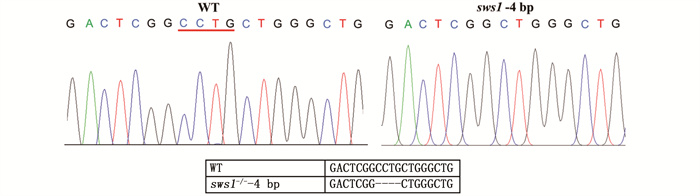
|
图 2 sws1基因敲除检测结果 Fig. 2 Result of sws1 gene knockout |
在紫光照射60和100 d时,WT和sws1-/-斑马鱼背腹部皮肤见图版。背部皮肤黑色素广泛分布,而腹部皮肤几乎没有黑色素细胞分布。对黑色素数量进一步统计分析发现,在紫光照射60和100 d时,WT和sws1-/-这2组斑马鱼的背部皮肤黑色素细胞数量显著多于腹部皮肤(图 3)。对WT和sws1-/-这2组斑马鱼的背部皮肤黑色素细胞数量进行比较发现,sws1基因被敲除之后,背部黑色素细胞的数量显著降低(图 3)。

|
1. 照射60 d时野生型斑马鱼背部皮肤;2. 照射60 d时sws1-/-斑马鱼背部皮肤;3.照射100 d时野生型斑马鱼背部皮肤;4.照射100 d时sws1-/-斑马鱼背部皮肤;5.照射60 d时野生型斑马鱼腹部皮肤;6.照射60 d时sws1-/-斑马鱼腹部皮肤;7.照射100 d时野生型斑马鱼腹部皮肤;8.照射100 d时sws1-/-斑马鱼腹部皮肤。箭头指向黑色素细胞,标尺= 200 μm。 1. The dorsal skin in WT after 60 days irradiation; 2. the dorsal skin in sws1-/- after 60 days irradiation; 3. the dorsal skin in WT after 100 days irradiation; 4.the dorsal skin in sws1-/- after 100 days irradiation; 5. the ventral skin in WT after 60 days irradiation; 6.the ventral skin in sws1-/- after 60 days irradiation; 7. the ventral skin in WT after 100 days irradiation; 8.the ventral skin in sws1-/- after 100 days irradiation. Arrows point to melanocyte. Bar=200 μm. 图版 紫光照射60和100 d时斑马鱼皮肤黑色素细胞形成情况 Plate Formation of melanocytes in zebrafish skin after 60 and 100 days of UV irradiation |
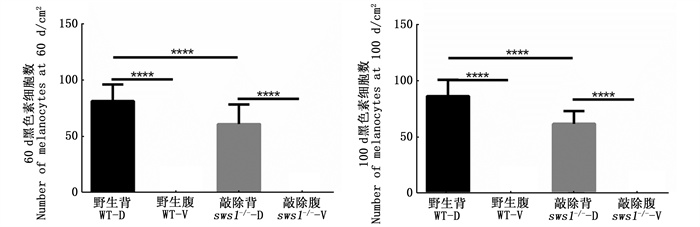
|
柱状图上方含“****”代表差异极显著(P < 0.000 1)。 The "****" above the histogram shows significant difference (P < 0.000 1). 图 3 黑色素细胞数量的差异分析 Fig. 3 Differential analysis of the number of melanocytes |
在紫光照射100 d后,对野生型AB品系斑马鱼和sws1-/-纯合品系斑马鱼背腹部皮肤的pomc和asip1基因表达量进行比较(图 4),结果显示:野生型斑马鱼背部皮肤pomc的表达量高于腹部且差异极显著(P < 0.01),而pomc基因在sws1-/-突变体斑马鱼背腹部之间的表达无显著差异。pomc基因在野生型背部皮肤中的表达量显著高于sws1-/-突变体背部皮肤中的表达量(P < 0.05)。此外,对2种斑马鱼背腹部皮肤pomc的表达水平差异进行比较分析发现,与野生型相比,sws1-/-突变体中pomc基因表达下调的程度极其显著(P < 0.01)。asip1基因在野生型斑马鱼和sws1-/-斑马鱼突变体背、腹部皮肤中的表达量均无显著差异。背部皮肤中asip1的表达量在野生型与sws1-/-突变型中也无显著差异。对2种斑马鱼背腹部皮肤asip1的表达差量进行比较,发现2种品系间并没有显著差异。
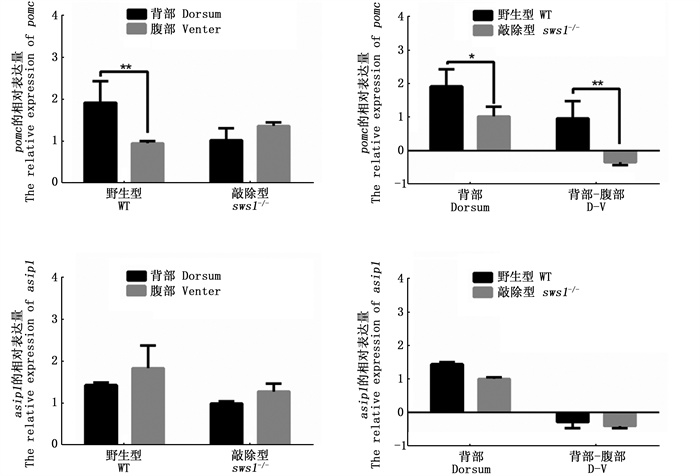
|
柱状图上方含“*”代表差异显著(P < 0.05),“**”代表差异极显著(P < 0.01),背部-腹部表示基因在背部皮肤中的表达量-腹部皮肤中的表达量。 The "*" above the histogram shows significant difference (P < 0.05), "**" represents that the difference is very significant (P < 0.01), D-V represents the gene expression in the dorsal skin-the gene expression in the ventral skin. 图 4 pomc和asip1基因在野生型和sws1-/-突变型斑马鱼背部、腹部皮肤中表达情况 Fig. 4 Expression of pomc and asip1 in the dorsum and venter skins of WT and sws1-/-zebrafish |
在紫光照射100 d时,对野生型AB品系斑马鱼和sws1-/-纯合品系斑马鱼背腹部皮肤的raldh2和raldh3基因进行表达差异分析(图 5)。结果表明,野生型背部皮肤raldh2的表达量高于腹部且差异显著(P < 0.05),sws1-/-斑马鱼突变体中raldh2的表达量腹部高于背部且差异极显著(P < 0.01)。raldh2的表达量在野生型背部极显著高于sws1-/-突变体背部(P < 0.01)。此外,对两种斑马鱼背腹部皮肤raldh2的表达差量进行比较发现,与野生型相比,sws1-/-突变体表达下调的程度极其显著(P < 0.001)。对两种品系斑马鱼背腹部皮肤中的raldh3基因进行差异分析。结果显示,两种品系各自背腹部皮肤间raldh3的表达量均无显著差异,背部皮肤中raldh3的表达量在野生型和sws1-/-突变型之间也没有显著差异。对2种斑马鱼背腹部皮肤raldh3的表达差量进行比较,发现2种品系间没有显著差异。
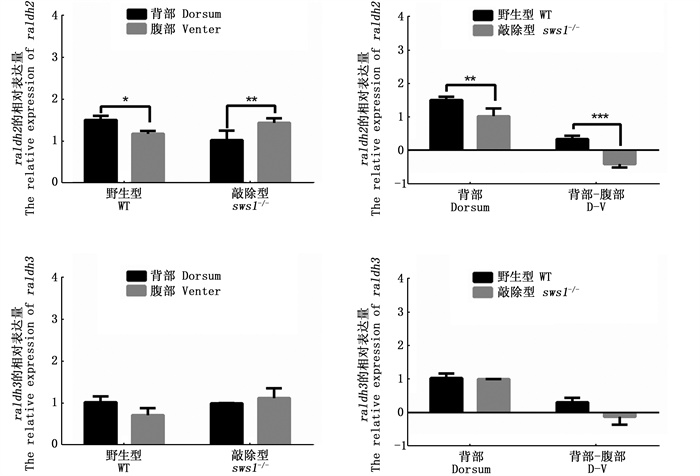
|
柱状图上方含“*”代表差异显著(P < 0.05),“**”代表差异极显著(P < 0.01),背部-腹部表示基因在背部皮肤中的表达量-腹部皮肤中的表达量。 The "*" above the histogram shows significant difference (P < 0.05), "**" represents that the difference is very significant (P < 0.01), D-V represents the gene expression in the dorsal skin-the gene expression in the ventral skin. 图 5 raldh2和raldh3基因在野生型和sws1-/-突变型斑马鱼背部、腹部皮肤中表达情况 Fig. 5 Expression of raldh2 and raldh3 in the dorsum and venter skins of WT and sws1-/- zebrafish |
斑马鱼的体色呈现典型的中上层硬骨鱼类背腹轴的色素模式,即背部体色深腹部体色浅。而这种色素模式的形成,可能与其生存的水层所接受到的光线种类及强度有关[27]。紫光/紫外光可以促进皮肤黑色素的合成[28]。在鱼类中,用高强度的UV-B照射刚孵化的白鲑稚鱼,2周之后其皮肤黑色素细胞的浓度明显增加[5]。另外,与生活在有阴影的环境和自然环境中的同类相比,长期暴露在光照下的成年真鲷表现出皮肤亮度下降的特点,并且皮肤上黑色素细胞的密度增加[12]。将虹鳟置于UV-B辐射环境下48 h后,虹鳟皮肤中黑色素细胞会表现出扩散行为从而导致皮肤变黑[13]。利用CRISPR/Cas9基因敲除技术构建sws1-/-斑马鱼突变体,紫光照射后分析发现,sws1基因敲除后,斑马鱼背部皮肤的黑色素细胞数量极显著降低,导致其背腹轴的隐蔽伪装色的作用也显著减弱。本研究表明,紫光可能通过感紫光视蛋白sws1基因促进斑马鱼皮肤黑色素细胞的形成,当感紫光视蛋白sws1基因被敲除后,斑马鱼黑色素细胞的形成受到了显著影响。
当SWS1接收到紫光后,其调控黑色素细胞形成的下游分子机制还不清楚。在牙鲆的蓝光照射实验中发现,背部接收到蓝光照射的牙鲆其上侧面皮肤中催化合成9-顺-视黄酸的视黄醛脱氢酶Ⅲ型(aldh1a3/raldh3)基因的表达量要显著高于下侧面,并且上侧面的视黄酸浓度也要高于下侧面。同时,通过在牙鲆下侧面皮肤注射9-顺-视黄酸,发现下侧面皮肤黑色素细胞的数量也会显著增加,说明牙鲆皮肤上的感蓝光视蛋白基因sws2在接收到蓝光后,通过促进raldh3基因的表达诱导皮肤大量合成9-顺-视黄酸,从而促进黑色素细胞的形成[29]。视黄醛脱氢酶raldhs基因家族能够将视黄醛氧化为视黄酸,从而调控视黄酸的分泌。在小鼠体内raldh2可能参与全反式视黄酸的合成[30]。在斑马鱼中,紫光是否以相似的机制,通过sws1基因影响视黄醛脱氢酶(raldhs)基因的表达,进而影响视黄酸合成,最后调控斑马鱼黑色素细胞的形成?在本研究中,当sws1基因被敲除后,斑马鱼皮肤无法接收到紫光,导致raldh2的表达量明显降低,进而影响了黑色素细胞的形成,而raldh3基因在每种鱼背腹部之间的表达上均未有显著差异,说明紫光对黑色素细胞的影响是通过调控raldh2基因的表达进而调控视黄酸的浓度来完成的。
Pomc所衍生的多种激素,如Acth、Msh等能够通过影响黑色素颗粒的存在形态影响鱼类的体色。POMC经内源性蛋白水解后生成的α-MSH刺激黑色素细胞,使酪氨酸转化成黑色素,同时能刺激黑色素细胞树突的形成,并通过树突与周围角质细胞的连接转运黑色素颗粒,从而导致体色变深[31]。在对马来西亚红罗非鱼体色与背景色关系研究的过程中,WANG等[32]发现在黑色背景下罗非鱼脑垂体中pomcRNA表达的水平要显著高于白色背景下的罗非鱼。这些研究表明pomc基因的表达量与黑色素细胞的形成有关。在本研究中,pomc基因在野生型斑马鱼背部的表达量显著高于腹部,而在缺失sws1基因的斑马鱼中pomc基因表达量在背腹之间没有显著差异。同时,pomc的表达量在sws1-/-突变体背部的表达量显著下降。这说明sws1基因接收到紫光后能促进pomc基因的表达,进而部分影响黑色素细胞的形成。
此外,斑马鱼的背腹轴隐蔽伪装色还部分取决于asip1基因的表达。腹部高表达的asip1能通过抑制腹部皮肤黑色素细胞的分化影响色素细胞的分化平衡[33]。在asip1基因纯合敲除的斑马鱼中,其腹部黑色素细胞和黄色素细胞的数量增加而虹彩细胞的色素减少,整体呈现与背部相似的色素分布模式[34]。在本研究中,野生型斑马鱼和sws1-/-突变体背腹部皮肤asip1的表达差量也没有显著差异。推测asip1基因没有参与到紫光通过sws1基因调控鱼类黑色素细胞的形成通路中,asip1基因可能参与到其他光调控黑色素细胞的形成通路中。
综上,本研究首次在斑马鱼中敲除了感紫光短波视蛋白sws1基因,发现sws1基因缺失会显著影响黑色素细胞的数量,显著影响黑色素合成基因pomc和视黄酸合成相关基因raldh2的基因表达量。研究结果表明,紫光可能通过sws1影响背部皮肤raldh2的表达量从而影响视黄酸的合成,最终通过影响pomc的表达调控黑色素细胞的形成,进而影响鱼类的隐蔽伪装色。研究结果为分析紫光调控鱼类皮肤黑色素细胞形成的分子机制提供了基础。
| [1] |
THAYER A H. The law which underlies protective coloration[J]. The Auk, 1896, 13(2): 124-129. DOI:10.2307/4068693 |
| [2] |
ROWLAND H M. From Abbott Thayer to the present day: what have we learned about the function of countershading?[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2009, 364(1516): 519-527. DOI:10.1098/rstb.2008.0261 |
| [3] |
肖繁荣, 杨灿朝, 史海涛. 动物的伪装方式[J]. 四川动物, 2015, 34(6): 955-960. XIAO F R, YANG C C, SHI H T. A review of different types of animal camouflage[J]. Sichuan Journal of Zoology, 2015, 34(6): 955-960. |
| [4] |
YOKOYAMA S. Molecular evolution of vertebrate visual pigments[J]. Progress in Retinal and Eye Research, 2000, 19(4): 385-419. DOI:10.1016/S1350-9462(00)00002-1 |
| [5] |
HÖKKINEN J, VEHNIÄINEN E, YLÖNEN O, et al. The effects of increasing UV-B radiation on pigmentation, growth and survival of coregonid embryos and larvae[J]. Environmental Biology of Fishes, 2002, 64(4): 451-459. DOI:10.1023/A:1016165802417 |
| [6] |
LECLERCQ E, TAYLOR J F, MIGAUD H. Morphological skin colour changes in teleosts[J]. Fish and Fisheries, 2010, 11(2): 159-193. |
| [7] |
SUGIMOTO M. Morphological color changes in fish: regulation of pigment cell density and morphology[J]. Microscopy Research and Technique, 2002, 58(6): 496-503. DOI:10.1002/jemt.10168 |
| [8] |
SUGIMOTO M, YUKI M, MIYAKOSHI T, et al. The influence of long-term chromatic adaptation on pigment cells and striped pigment patterns in the skin of the zebrafish, Danio rerio[J]. Journal of Experimental Zoology Part A: Comparative Experimental Biology, 2005, 303A(6): 430-440. DOI:10.1002/jez.a.177 |
| [9] |
VAN DER SALM A L, METZ J R, BONGA S E W, et al. Alpha-MSH, the melanocortin-1 receptor and background adaptation in the Mozambique tilapia, Oreochromis mossambicus[J]. General and Comparative Endocrinology, 2005, 144(2): 140-149. DOI:10.1016/j.ygcen.2005.05.009 |
| [10] |
余陆伟, 曹思雨, 王军, 等. 两种体色瓯江彩鲤黑色素形成比较[J]. 上海海洋大学学报, 2020, 29(4): 481-488. YU L W, CAO S Y, WANG J, et al. Formation of melanin and mitfa in-situ in the Oujiang color common carp (Cyprinus carpio var. color)[J]. Journal of Shanghai Ocean University, 2020, 29(4): 481-488. |
| [11] |
彭康康, 张博, 鲍宝龙, 等. 黑化牙鲆不同部位皮肤黑色素细胞和鳞片形态的比较[J]. 上海海洋大学学报, 2019, 28(5): 708-715. PENG K K, ZHANG B, BAO B L, et al. Comparative analysis of skin melanophore and scales in different parts of melanized Japanese flounder Paralichthys olivaceus[J]. Journal of Shanghai Ocean University, 2019, 28(5): 708-715. |
| [12] |
ADACHI K, KATO K, WAKAMATSU K, et al. The histological analysis, colorimetric evaluation, and chemical quantification of melanin content in 'suntanned' fish[J]. Pigment Cell Research, 2005, 18(6): 465-468. |
| [13] |
LITTLE E, FABACHER D L. Comparative sensitivity of rainbow trout and two threatened salmonids, Apache trout and Lahontan cutthroat trout, to ultraviolet-B radiation[J]. Archiv fur Hydrobiologie, 1994, 43: 217-226. |
| [14] |
NAKANISHI S, INOUE A, KITA T, et al. Nucleotide sequence of cloned cDNA for bovine corticotropin-β-lipotropin precursor[J]. Nature, 1979, 278(5703): 423-427. DOI:10.1038/278423a0 |
| [15] |
徐敏圣. 鄱阳湖泥鳅黑色素相关基因及其蛋白分子特征表达分析以及胚胎发育和苗种培育研究[D]. 南昌: 南昌大学, 2016. XU M S. Molecular characteristics and expression analysis of melanin related gene and research on the embryonic development and fry rearing in the loach Misgurnus anguillicaudatus of Poyang Lake[D]. Nanchang: Nanchang University, 2016. |
| [16] |
KANG D Y, KIM H C. Relevance of environmental factors and physiological pigment hormones to blind-side hypermelanosis in the cultured flounder, Paralichthys olivaceus[J]. Aquaculture, 2012, 356-357: 14-21. DOI:10.1016/j.aquaculture.2012.05.041 |
| [17] |
KOBAYASHI Y, MIZUSAWA K, YAMANOME T, et al. Possible paracrine function of α-melanocyte-stimulating hormone and inhibition of its melanin-dispersing activity by N-terminal acetylation in the skin of the barfin flounder, Verasper moseri[J]. General and Comparative Endocrinology, 2009, 161(3): 419-424. DOI:10.1016/j.ygcen.2009.02.009 |
| [18] |
TAKAHASHI A, AMANO M, ITOH T, et al. Nucleotide sequence and expression of three subtypes of proopiomelanocortin mRNA in barfin flounder[J]. General and Comparative Endocrinology, 2005, 141(3): 291-303. DOI:10.1016/j.ygcen.2005.01.010 |
| [19] |
TAKAHASHI A, KOBAYASHI Y, AMANO M, et al. Structural and functional diversity of proopiomelanocortin in fish with special reference to barfin flounder[J]. Peptides, 2009, 30(7): 1374-1382. DOI:10.1016/j.peptides.2009.04.014 |
| [20] |
YOSHIKAWA N, MATSUDA T, TAKAHASHI A, et al. Developmental changes in melanophores and their asymmetrical responsiveness to melanin-concentrating hormone during metamorphosis in barfin flounder (Verasper moseri)[J]. General and Comparative Endocrinology, 2013, 194: 118-123. DOI:10.1016/j.ygcen.2013.09.006 |
| [21] |
CONE R D, LU D, KOPPULA S, et al. The melanocortin receptors: agonists, antagonists, and the hormonal control of pigmentation[J]. Recent Progress in Hormone Research, 1996, 51: 287-317. |
| [22] |
VRIELING H, DUHL D M, MILLAR S E, et al. Differences in dorsal and ventral pigmentation result from regional expression of the mouse agouti gene[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(12): 5667-5671. DOI:10.1073/pnas.91.12.5667 |
| [23] |
MUNDY N I, KELLY J. Investigation of the role of the agouti signaling protein gene (ASIP) in coat color evolution in primates[J]. Mammalian Genome, 2006, 17(12): 1205-1213. DOI:10.1007/s00335-006-0056-0 |
| [24] |
INOUE Y, HASEGAWA S, YAMADA T, et al. Bimodal effect of retinoic acid on melanocyte differentiation identified by time-dependent analysis[J]. Pigment Cell & Melanoma Research, 2012, 25(3): 299-311. |
| [25] |
WICKS N L, CHAN J W, NAJERA J A, et al. UVA phototransduction drives early melanin synthesis in human melanocytes[J]. Current Biology, 2011, 21(22): 1906-1911. DOI:10.1016/j.cub.2011.09.047 |
| [26] |
PITTLIK S, DOMINGUES S, MEYER A, et al. Expression of zebrafish aldh1a3(raldh3) and absence of aldh1a1 in teleosts[J]. Gene Expression Patterns, 2008, 8(3): 141-147. DOI:10.1016/j.gep.2007.11.003 |
| [27] |
姚晓华, 王森, 鲍宝龙. 几种近海底层鱼类和中上层鱼类隐蔽伪装色的比较[J]. 上海海洋大学学报, 2020, 29(2): 199-208. YAO X H, WANG S, BAO B L. Comparative analysis on the countershading between several marine pelagic fishes and demersal fishes[J]. Journal of Shanghai Ocean University, 2020, 29(2): 199-208. |
| [28] |
GILCHREST B A, PARK H Y, ELLER M S, et al. Mechanisms of ultraviolet light-induced pigmentation[J]. Photochemistry and Photobiology, 1996, 63(1): 1-10. DOI:10.1111/j.1751-1097.1996.tb02988.x |
| [29] |
SHAO C W, BAO B L, XIE Z Y, et al. The genome and transcriptome of Japanese flounder provide insights into flatfish asymmetry[J]. Nature Genetics, 2017, 49(1): 119-124. DOI:10.1038/ng.3732 |
| [30] |
GAGNON I, DUESTER G, BHAT P V. Kinetic analysis of mouse retinal dehydrogenase type-2(RALDH2) for retinal substrates[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 2002, 1596(1): 156-162. DOI:10.1016/S0167-4838(02)00213-3 |
| [31] |
TSATMALIA M, WAKAMATSU K, GRAHAM A J, et al. Skin POMC peptides. Their binding affinities and activation of the human MC1 receptor[J]. Annals of the New York Academy of Sciences, 1999, 885(1): 466-469. |
| [32] |
WANG L M, LUO M K, YIN H R, et al. Effects of background adaptation on the skin color of Malaysian red tilapia[J]. Aquaculture, 2020, 521: 735061. DOI:10.1016/j.aquaculture.2020.735061 |
| [33] |
CEINOS R M, GUILLOT R, KELSH R N, et al. Pigment patterns in adult fish result from superimposition of two largely independent pigmentation mechanisms[J]. Pigment Cell & Melanoma Research, 2015, 28(2): 196-209. |
| [34] |
CAL L, SUAREZ-BREGUA P, COMESAÑA P, et al. Countershading in zebrafish results from an Asip1 controlled dorsoventral gradient of pigment cell differentiation[J]. Scientific Reports, 2019, 9(1): 3449. DOI:10.1038/s41598-019-40251-z |
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


