2. 上海海洋大学 水产与生命学院, 上海 201306;
3. 山东省海洋渔业生物技术与遗传育种重点实验室, 山东 青岛 266071;
4. 莱州明波水产有限公司, 山东 烟台 261400
斑石鲷隶属于鲈形目(Perciformes)石鲷科(Oplegnathidae)石鲷属(Oplegnathus),又被称为斑鲷,主要分布于太平洋东北部的中国、朝鲜等温热带近岸中下层海域[1],常见其栖息于近岸珊瑚礁或者岩礁丛中[2]。在自然海域中斑石鲷几乎看不到以群体形式出现,没有形成明显的渔汛。其生长速度较快、肉质鲜美、营养价值高,是极具潜力的优质可食用海水鱼类[3]。此外,斑石鲷还具有很好的药用价值和观赏价值[4-5]。近年来,作为海水养殖的新兴鱼类,斑石鲷人工养殖业的规模逐渐扩大。目前对于斑石鲷的研究主要集中在基础生物学、生态学、苗种培育及病害防控等方面[6-9],而对于斑石鲷性腺分化特征与发育规律的研究至今未见报道,因此本研究通过采用解剖学及组织学方法对斑石鲷性腺的发生及分化发育规律进行研究,旨在为斑石鲷的人工繁育、遗传改良及种质保护奠定基础。
1 材料与方法实验鱼取自莱州明波水产有限公司养殖基地,培育期水温为20~28 ℃,盐度为17~20。
1.1 性腺分化实验材料2019年3月3日完成斑石鲷布卵,30 h左右孵化出膜,自30日龄开始取样,2019年4月3日到2020年4月3日期间,每30天取样1次,每次随机取30尾,进行遗传性别鉴定[10]保证雌雄实验鱼数量能够达到各10条,并测定斑石鲷的全长、体质量等生物学参数。
1.2 性腺发育实验材料包括部分分化阶段的实验鱼,2016、2018年3月布卵,2019—2020年取样,间隔一定时间取样1次,每次随机取30尾实验鱼,进行遗传性别鉴定,保证雌雄实验鱼数量能够达到各10条,并测定斑石鲷的全长,体质量等形态学指标。
1.3 性腺的采集120日龄之前的鱼苗较小,性腺不易单独取出,取样时性腺连同附近组织一并取出;120日龄之后,性腺可单独取出,取样时仅取性腺样品。
1.4 切片的制作与观察取出的斑石鲷的性腺组织浸没在4%组织固定液(北京索莱宝科技公司)中固定18~24 h(时间的长短由浸泡组织样的大小决定)后,转至体积分数为75%的乙醇中保存,为后续进行组织切片做准备。
将保存在75%乙醇中的性腺组织用油纸包裹,置于已编号的包埋盒中,依次进行梯度体积分数乙醇的脱水(使用85%乙醇脱水2次,每次30 min左右,再使用95%乙醇脱水2次,每次20 min左右,最后使用无水乙醇脱水2次,每次20 min左右),可根据组织大小调整脱水时间,以达到最佳的效果。乙醇脱水完成后使用无水乙醇和二甲苯体积比为1∶ 1的溶液对组织进行每次10 min的浸泡,共浸泡2次。然后转移至二甲苯中进行2次浸泡,每次浸泡5~10 min。之后,将组织转移至二甲苯和石蜡体积比为1∶ 1混合的溶液中浸泡1 h左右,最后将组织样转移至石蜡溶液中,浸泡3 h。
逐个取出浸泡后的性腺组织进行包埋,随后用轮转式石蜡切片机切片(切片厚度为5~7 μm),通过脱蜡、复水、苏木精-伊红(H.E)染色后,切片样品用中性树脂(北京索莱宝科技公司)封片保存。
用尼康生物显微镜(Elipse Ci-L)观察各个样品,拍照记录性腺在各个发育时期的状态及细胞的特征等,并进行分析。
2 结果 2.1 性腺的分化 2.1.1 原始性腺孵化后30 d,斑石鲷仔鱼(全长10.3~12.2 mm)的原始生殖细胞已经迁入生殖嵴中,原始性腺形成,原始性腺呈鸭梨型,两端扁长,中间凸起。由系膜悬挂在鳔管下方、肠管上方的腹腔膜上皮上,中间组织突起处可明显观察到一个原始生殖细胞(PGC), 见图版Ⅰ-1。

|
1.30dph原始性腺,示原始生殖细胞(PGC);2.90 dph,Ⅰ期精巢,示精原细胞(SG);3.120 dph, 示输精管原基(ED);4.180 dph,Ⅱ期精巢,示精小叶(SL)和初级精母细胞(PSC)形成;5.210 dph,Ⅲ期精巢;6. Ⅳ期精巢;7.Ⅴ期精巢;8.Ⅵ期精巢。 1. 30 dph the original gonad, showing the original germ cells (PGC); 2.90 dph stage I testis, showing the spermatocyte (SG); 3.120 dph, showing the efferent duct (ED); 4. 180 dph, showing the formation of the seminal lobule (SL) and primary spermatocyte (PSC); 5.210dph, stage Ⅲ testis; 6.stage Ⅳ testis; 7.stage Ⅴ testis; 8.stage Ⅵ testis. 图版 Ⅰ 斑石鲷雄性性腺发育分期 Plate Ⅰ Development of testis of the spotted knifejaw |
60日龄(全长28.2~40.7 mm)之前,斑石鲷的精巢几乎处于生长相对休止状态。
90日龄(全长32.3~52.5 mm),精原细胞散布于间质细胞之中(图版Ⅰ-2)。
120日龄(全长56.1~64.5 mm),精巢中细胞数量明显增多,靠近体腔膜处出现输精管原基,是精巢分化解剖学上的标志[11](图版Ⅰ-3)。
180日龄(全长97.2~110.5 mm),精巢中出现多个无规则分布的精小叶,标志着精巢解剖学分化的完成[11]。精小叶内含有簇状分散的精原细胞和初级精母细胞。初级精母细胞的出现标志着精巢细胞学水平分化的开始(图版Ⅰ-4)。
210日龄(全长130.1~150.7 mm),精巢中形成小叶腔,含多个初级精母细胞(图版Ⅰ-5)。
2.1.3 卵巢的分化60日龄(全长26.2~38.7 mm),性腺外观呈椭圆形,细胞数量较少,含有数个原始生殖细胞,肉眼无法分辨雌雄(图版Ⅱ-1)。
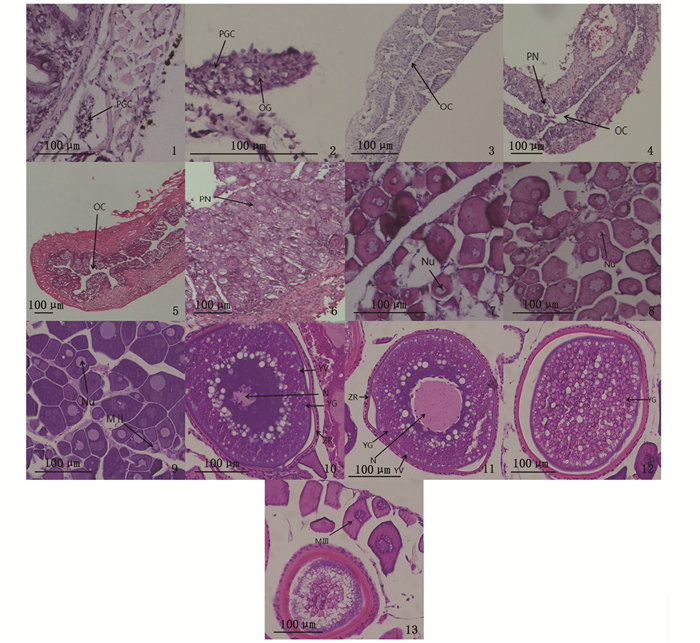
|
1.60 dph, 早期卵巢;2.90 dph,示卵原细胞(OG);3.150 dph,示卵巢腔(OC)开始形成;4.180 dph,示初级卵母细胞(PN)的形成以及形成中的卵巢腔;5.240 dph,示卵巢腔发育完成;6.Ⅱ期卵巢;第Ⅱ时相卵母细胞(MⅡ);7. 第Ⅲ时相卵母细胞(MⅢ), 示核仁(Nu);8. 第Ⅲ时相卵母细胞;9. 第Ⅲ时相卵母细胞后期;10. 2龄半卵巢中的第Ⅳ时相卵母细胞;11. 3龄卵巢中的第Ⅳ时相卵母细胞;12. 第Ⅴ时相卵母细胞;13. Ⅵ期卵巢。PGC.原始生殖细胞;SG.精原细胞;PSC.初级精母细胞;SL.精小叶;ED.输精管原基;OG.卵原细胞;PN.初级卵母细胞;OC.卵巢腔;ST.精细胞; SP.精子; N.细胞核;Nu.核仁;ZR.放射带; YV.滤泡细胞;YG.卵黄颗粒。 1. 60 dph, early ovaries; 2. 90 dph, showing oogonia (OG); 3. 150 dph, showing the onset of ovarian cavity (OC) formation; 4. 180 dph, showing the formation of early perinucleolus stage oocytes (PN) as well as the developing ovarian cavity; 5.240 dph, showing the complete formation of ovarian cavity; 6.stage Ⅱ ovary, showing the oocytes in Ⅱstage (MⅡ); 7. The oocytes in Ⅲ stage (MⅢ), showing nucleolus (Nu); 8. The middle phase of oocytes in Ⅲ stage; 9. The telophase of oocytes in Ⅲ stage; 10. oocytes in Ⅳ stage in a 2.5y female; 11. oocytes in Ⅳ stage in a 3y female; 12. The oocytes in Ⅴ stage; 13. stage Ⅵ ovary. PGC. primordial germ cell; SG. spermatogonium; PSC. primary spermatocyte; SL. seminal lobule; ED. efferent duct; OG. oogonium; PN. early perinucleolus stage oocytes; OC. ovarian cavity; ST. spermatids; SP. spermatozoa; N. nucleus; Nu. nucleoli; ZR. zona radiata; YV. follicle cells; YG. yolk granule. 图版 Ⅱ 斑石鲷雌性性腺发育分期 Plate Ⅱ Development of ovary of the spotted knifejaw |
90日龄(全长30.4~49.5 mm),性腺中的部分原始生殖细胞开始了有丝分裂,形成数个卵原细胞和体细胞,簇状发育的细胞群出现(图版Ⅱ-2)。卵原细胞群的出现是解剖学上原始性腺向卵巢分化的开始[12]。
150日龄(全长68.4~86.2 mm),组织中央出现细长条状的裂缝,为卵巢腔的雏形,裂缝由中央向两缘延伸生长(图版Ⅱ-3)。
180日龄(全长95.7~114.6 mm),卵巢腔体积明显增大,呈扁带状,腔体四周的生殖上皮出现初级卵母细胞。初级卵母细胞的出现是卵巢细胞学分化的开始(图版Ⅱ-4)。
240日龄(全长159.5~177.8 mm),卵巢腔为封闭的腔体,且嗜曙红性增强,标志着卵巢腔的发育完成(图版Ⅱ-5)。
2.2 性腺的发育 2.2.1 精巢的发育与分期根据精巢的发育特征,分为6个时期,各时期特征如下:
Ⅰ期精巢:60~90日龄精巢组织切片可见少量精原细胞,精原细胞体积较大,呈圆形或椭圆形,细胞核较大,染色较深,在精巢中排列较稀疏(图版Ⅰ-2)。
Ⅱ期精巢:160~190日龄前后精巢内的精原细胞进入增殖期,分化出初级精母细胞,分布在精小叶内部边缘(图版Ⅰ-4)。
Ⅲ期精巢:210~240日龄精巢主要由精小叶组成,该时期的精巢主要以初级精母细胞为主(图版Ⅰ-5)。
Ⅳ期精巢:2龄5个月左右的精巢,精小囊中出现精细胞。精巢内同时含有少量的精原细胞,初级精母细胞。挤压腹部无精液流出(图版Ⅰ-6)。
Ⅴ期精巢:4龄左右的精巢内,小叶腔显著扩大,腔内含有大量成熟精子。精子经H.E染色呈现蓝紫色。轻压腹部有少许的精液流出(图版Ⅰ-7)。
Ⅵ期精巢:排精后精巢体积萎缩变小,精巢中含有少量的初级精母细胞、精细胞和残留的精子(图版Ⅰ-8)。
2.2.2 卵巢的发育与分期根据卵巢的发育特征,将卵巢分为6个时期,各时期特征如下:
Ⅰ期卵巢:150日龄卵巢内出现卵巢腔,但不完善(图版Ⅱ-3)。
Ⅱ期卵巢:320~350日龄卵巢中的生殖细胞主要由第Ⅱ时相卵母细胞组成,处于初级卵母细胞的小生长期阶段,细胞质和细胞核体积都明显增大(图版Ⅱ-6)。
Ⅲ期卵巢:1.5龄左右的卵巢中主要为第Ⅲ时相卵母细胞早期,此时的卵母细胞嗜碱性变强,被H.E染色成蓝紫色,形状大多近似圆形,核仁的数量增多,分散在核膜内缘(图版Ⅱ-7, 8)。随着卵母细胞发育,形状逐渐不规则,细胞体积增大,核的外围出现空泡(图版Ⅱ-9)。
Ⅳ期卵巢:2龄半左右卵巢内多为第Ⅳ时相卵母细胞。切片观察可见在包膜外层有明显的放射带,在细胞中出现彼此相连的滤泡细胞,核仁数量减少,在细胞外周出现少量卵黄颗粒(图版Ⅱ-10)。3龄左右卵巢内滤泡细胞数量减少,卵黄颗粒增多,核仁逐渐缩小(图版Ⅱ-11)。
Ⅴ期卵巢:4龄左右卵巢发育成熟,内部以成熟的第Ⅴ时相卵母细胞为主,细胞内卵黄颗粒大量积累并融合,空泡和卵黄颗粒密布排列,细胞核溶解消失,核仁分解(图版Ⅱ-12)。
Ⅵ期卵巢:排卵后的卵巢,组织中有大量排空的滤泡囊壁,卵细胞退化吸收,体积减小,颗粒细胞层肥大且多层,卵巢内仍有第Ⅲ时相卵母细胞(图版Ⅱ-13)。
3 讨论鱼类原始生殖细胞出现于胚胎发育早期,以不同的迁移方式到达生殖嵴后,与周围的上皮细胞相互作用形成原始性腺,最终分化为精巢或卵巢[13]。硬骨鱼类性腺分化分为3种类型:(1)雌雄同体型,鱼体内同时具有的两性腺体同步或者不同步行使功能;(2)雌雄异体型,先形成一个早期性腺,之后直接发育为精巢或者卵巢,例如大黄鱼(Larimichthy crocea)[14]和圆鳍鱼(Cylopterus lumpus)[15];(3)性逆转型,所有个体首先出现类似卵巢样的性腺,半数个体之后向卵巢方向开始分化,其余部分则向精巢方向进行分化,例如:黄鳝(Monopterus albus)[16]和石斑鱼(Epinephelus)[17]。鱼类中,最普遍的性腺分化形式是雌雄异体型。YAMAMOTO[18]将雌雄异体型分为两种类型,第一种是分化型雌雄异体型,例如鲤(Cyprinus carpio)[19];第二种是未分化型雌雄异体型,例如斑马鱼(Danio rerio)[20]。在斑石鲷中,未分化的早期性腺半数左右直接发育为精巢,其余个体则直接发育为卵巢,因此,斑石鲷属于雌雄异体分化型鱼类。
鱼类性腺分化的研究主要基于解剖学和细胞学两方面[21]。解剖学方面,主要是指生殖腺的结构变化,包含有无簇状发育的原始生殖细胞群、卵巢腔、生精导管、精小叶等。细胞学方面,主要是指生殖细胞如精(卵)原细胞和精(卵)母细胞的有丝分裂和减数分裂,以及出现的时间等[14]。解剖学上,卵原细胞群的出现标志着原始性腺向卵巢分化的开始[12],例如:玫瑰鲫(Puntius conchonius)[21],半滑舌鳎[11]。90日龄斑石鲷原始性腺中出现成簇发育的卵原细胞群,这时卵原细胞群进行快速有丝分裂,向卵巢分化,为斑石鲷卵巢分化的解剖学标志。在不同的鱼类中,卵巢腔形成的时间和方式各不相同,主要分成3种类型:(1)体细胞从性腺的腹、背部向体壁的侧面延伸,构成两个分支,腹部的分支向上延伸,背部的分支向下延伸,最后相遇并形成一个处于性腺边缘、宽且扁平的腔体,即卵巢腔[23],例如银汉鱼(Odontesthes bonariensis)[24]; (2)与性腺相连的腹膜壁上有一团细胞,这团细胞沿性腺方向延伸生长,和性腺边缘融合形成卵巢腔; (3)卵巢的侧壁向背部延伸生长,其边缘与体腔后壁融合形成卵巢腔,例如青鳉鱼[21]。斑石鲷卵巢腔的形成方式和第一种类型相似,在150日龄出现卵巢腔的雏形,即性腺组织切片中央出现一条较长的裂缝,裂缝两缘出现若干方向各异的小裂缝,随着性腺的发育,处于中央位置的裂缝使得游离缘的两边贴近生殖腔相对生长,直至到达卵巢的边缘,240日龄卵巢腔发育完成。目前原始性腺向精巢分化开始的解剖学标志是输精管原基的出现,性腺集中进行有丝分裂并出现精小叶是精巢分化的另一重要标志,例如:半滑舌鳎[11]。斑石鲷120日龄原始性腺贴近腔膜的位置形成输精管原基,180日龄精巢中形成成熟的精小叶,为斑石鲷精巢分化的解剖学标志。硬骨鱼类的精巢一般分为小叶型和小管型[25],斑石鲷和大多数硬骨鱼类一样都是小叶型,精原细胞一般分布在精小叶的周围,伴随着精原细胞的逐步分裂、成熟,精细胞逐渐向着小叶的中间迁移,成熟的精子一般集中在精小叶中间的小叶腔中,随后进入输精管。斑石鲷的精巢在Ⅳ期时就会出现少量的成熟精子,这与西伯利亚鲟(Acipenseri baerii)[26]、泰山螭霖鱼(Varicorhinus macrolepis)[27]等类似。到了精巢Ⅴ期,精子的数量达到最大值,Ⅵ期之后精巢逐渐萎缩,精子逐渐退化吸收。
细胞学上的分化一般指性原细胞通过减数分裂产生初级性母细胞的过程[28]。南方鲇(Silurus meridionalis)[29]的雌性仔鱼在孵化后55天,雌性卵原细胞发生减数分裂并产生初级卵母细胞,而雄性仔鱼在孵化后130 d出现初级精母细胞,表明雌性在细胞学分化上早于雄性。牙鲆(Paralichthys olivaceus)[28]在孵化后95 d开始出现初级精母细胞,雌性则在孵化后105 d出现初级卵母细胞;表明雄性牙鲆在细胞学分化上早于雌性。泰山螭霖鱼[27]的雌鱼比雄鱼早4 d进行减数分裂产生性母细胞。斑石鲷雌雄性出现初级性母细胞的时间上大致相同, 均在孵出后180 d出现初级性母细胞。因此斑石鲷雌雄性腺的发育在细胞学分化上基本同步。
鱼类的性腺发育特征是长期自然选择的结果,依据卵母细胞在卵巢中的发育特点,一般将鱼类的卵巢分为3种类型[30]:完全同步产卵型,即卵巢内卵母细胞处于相同发育阶段或者卵子发育基本同步;分批同步产卵型,卵巢中至少有两种处于不同发育阶段的卵母细胞群组成,卵子发育不同步,成熟系数至少出现两次高峰,一个繁殖周期内多次产卵;不同步产卵型,卵巢内含有不同发育阶段的卵母细胞,一年内多次产卵,生殖季节相对长。与同步产卵型相比,不同步产卵型鱼类的卵母细胞在早期发育就开始存在差异,分批发育成熟,但呈现连续性分布,卵巢发育的不同步现象导致鱼类产卵的分批性,且对环境具有更好的适应性[31]。
本研究中,根据对斑石鲷卵巢发育不同时期的组织学切片观察可以发现,第Ⅲ期卵巢中含有第Ⅱ时相卵母细胞,产卵后的第Ⅵ期卵巢中含有第Ⅲ时相卵母细胞,以及正在退化并被吸收的卵母细胞。由此可以判定斑石鲷的卵巢产卵类型为分批同步产卵型,一年可以多次同步产卵。这与黄颡鱼(Pelteobagrus fulvidraco)[32]、牙鲆[28]等类似。
本实验通过解剖学和组织学的方法对斑石鲷性腺的发生以及分化与发育做了初步的研究,明确了早期性腺分化时间点及分化时性腺的特征、性腺发育的分期、特征,其结果将为斑石鲷种质资源保护和良种选育提供理论依据和参考资料。
| [1] |
王杉, 徐文腾, 李明, 等. 斑石鲷TGF-β1基因克隆和表达分析[J]. 渔业科学进展, 2020, 41(3): 78-87. WANG S, XU W T, LI M, et al. Molecular cloning and expression pattern analysis of TGF-β1 inspotted knifejaw (Oplegnathus punctatus)[J]. Progress in Fishery Sciences, 2020, 41(3): 78-87. |
| [2] |
孟庆闻, 苏锦祥, 缪学祖, 等. 鱼类分类学[M]. 北京: 中国农业出版社, 1995: 734-756. MENG Q W, SU J X, MIAO X Z, et al. Systematics of fishes[M]. Beijing: China Agriculture Press, 1995: 734-756. |
| [3] |
范超, 史成银, 刘江春. 中国养殖斑石鲷(Oplegnathus puncatus)上皮囊肿病的发现及显微观察[J]. 渔业科学进展, 2017, 38(2): 177-180. FAN C, SHI C Y, LIU J C. First report and microscopic examination of epitheliocystis in cultured spotted knifejaw (Oplegnathus puncatus) in China[J]. Progress in Fishery Sciences, 2017, 38(2): 177-180. |
| [4] |
王立改, 鲁琼, 詹炜, 等. 斑石鲷肌肉营养成分分析[J]. 食品工业科技, 2016, 37(9): 357-362. WANG L G, LU Q, ZHAN W, et al. Analysis of muscle nutrition composition and the nutrition evaluation of Oplegnathus punctatus[J]. Science and Technology of Food Industry, 2016, 37(9): 357-362. |
| [5] |
刘学会. 珍珠龙胆石斑鱼、斑石雕鱼工厂化养殖成功[J]. 河北渔业, 2015(11): 86. LIU X H. A successful factory culture of pearl gentian grouper[J]. Hebei Fisheries, 2015(11): 86. |
| [6] |
王雨福. 斑石鲷(Oplegnathus punctatus)早期生长特征及消化系统发育的研究[D]. 青岛: 中国科学院研究生院(海洋研究所), 2015. WANG Y F. Studies on early growth and development of digestive system in spotted knifejaw (Oplegnathus punctatus)[D]. Qingdao: Graduate School of Chinese Academy of Sciences (Institute of Oceanography), 2015. |
| [7] |
王雨福, 肖志忠, 刘清华, 等. 斑石鲷早期发育的异速生长模式[J]. 海洋科学, 2016, 40(5): 43-48. WANG Y F, XIAO Z Z, LIU Q H, et al. Allometric growth pattern during early ontogeny of spotted knifejaw (Oplegnathus punctatus)[J]. Marine Science, 2016, 40(5): 43-48. |
| [8] |
钟鸿干, 张旭, 张海滨, 等. 南方地区斑石鲷工厂化养殖试验[J]. 中国水产, 2015(5): 64-66. ZHONG H G, ZHANG X, ZHANG H B, et al. Industrial aquaculture of spotted knifejaw (Oplegnathus punctatus) in southern China[J]. China Fisheries, 2015(5): 64-66. |
| [9] |
DONG C F, WENG S P, LUO Y W, et al. A new marine megalocytivirus from spotted knifejaw, Oplegnathus punctatus, and its pathogenicity to freshwater mandarinfish, Siniperca chuatsi[J]. Virus Research, 2010, 147(1): 98-106. DOI:10.1016/j.virusres.2009.10.016 |
| [10] |
LI M, XU H, XU W, et al. Isolation of a male-specific molecular marker and development of a genetic sex identification technique in spotted knifejaw (Oplegnathus punctatus)[J]. Marine Biotechnology, 2020, 22(4): 467-474. |
| [11] |
马学坤, 柳学周, 温海深, 等. 半滑舌鳎性腺分化的组织学观察[J]. 海洋学研究, 2006, 27(2): 55-61. MA X K, LIU X Z, WEN H S, et al. Histological observation on gonadal sex differentiation in Cynoglossus semilaevis günther[J]. Marine Fisheries Research, 2006, 27(2): 55-61. |
| [12] |
尹洪滨, 贾中贺, 姚道霞, 等. 黄颡鱼性腺分化的组织学观察[J]. 动物学杂志, 2008, 43(6): 103-108. YIN H B, JIA Z H, YAO D X, et al. Sex differentiation in Pelteobagrus fulvidraco[J]. Chinese Journal of Zoology, 2008, 43(6): 103-108. |
| [13] |
刘晨斌, 徐革锋, 黄天晴, 等. 鱼类性腺发育研究进展[J]. 水产学杂志, 2019, 32(1): 46-54. LIU C B, XU G F, HUANG T Q, et al. A review of research progress on gonadal development in fish[J]. Chinese Journal of Fisheries, 2019, 32(1): 46-54. |
| [14] |
游秀容, 蔡明夷, 姜永华, 等. 大黄鱼性腺性别分化的组织学观察[J]. 水产学报, 2012, 36(7): 1057-1064. YOU X R, CAI M Y, JIANG Y H, et al. Histological observation on gonadal sex differentiation in large large yellow croaker (Larimichthys crocea)[J]. Journal of Fisheries of China, 2012, 36(7): 1057-1064. |
| [15] |
MARTIN-ROBICHAUD D J. Sex differentiation and hormonal feminization of lumpfish(Cylopterus lumpus Linnaeus)[D]. University of New Brumswich(Fredereton), 1993.
|
| [16] |
刘修业, 崔同昌, 王良臣, 等. 黄鳝性逆转时生殖腺的组织学与超微结构的变化[J]. 水生生物学报, 1990, 14(2): 166-169. LIU X Y, CUI T C, WANG L C, et al. Histological and ultrastructural changes in the gonad during sex reversal in Monopterus albus[J]. Acta Hydrobiologica Sinica, 1990, 14(2): 166-169. |
| [17] |
邢晨光, 金珊, 袁思平. 石斑鱼性逆转研究现状[J]. 水产科学, 2006, 25(4): 214-216. XING C G, JIN S, YUAN S P. Sex reversal of grouper (Epinephelus sp.)[J]. Fisheries Science, 2006, 25(4): 214-216. |
| [18] |
YAMAMOTO T. Sex differentiation[M]//HOAR W S, RANDALL D J. Fish Physiology (Vol. Ⅲ). New York: Academic Press, 1969: 117-175.
|
| [19] |
KOMEN J, de BOER P, RICHTER J J. Male sex reversal in gynogentic XX females of common carp (Cyprinus carpio L) by a recessive mutation in a sex-determining gene[J]. Hered, 1992, 83(6): 431-434. |
| [20] |
MAACK G, SEGNER H. Morphological development of the gonads in zebrafish[J]. Journal of Fish Biology, 2003, 62(4): 895-906. |
| [21] |
STRVSSMANN C A, NAKAMURA M. Morphology, endocrinology, and environmental modulation of gonadal sex differentiation in teleost fishes[J]. Fish Physiology and Biochemistry, 2002, 26(1): 13-29. |
| [22] |
LIN F, DABROWSKI K, TIMMERMANS L P M. Early gonadal development and sexual differentiation in muskellunge (Esox masquinongy)[J]. Canadian Journal of Zoology, 1997, 75: 1262-1269. |
| [23] |
代丽. 稀有鮈鲫原始生殖细胞的起源、迁移和分化及卵巢发育和卵子发生研究[D]. 重庆: 西南大学, 2013. DAI L. Studies on the PGCs' origin migration and differentiation of Gobiocypris rarus and its ovarian development and oogenesis[D]. Chongqing: Southwest University, 2013. |
| [24] |
STRVSSMANN C A, TAKASHIMA F, TODA K. Sex differentiation and hormonal feminization in pejerrey Odontesthes bonariensis[J]. Aquaculture, 1996, 139(1/2): 31-45. |
| [25] |
BILLARD R. Spermatogenesis and spermatology of some teleost fish species[J]. Reproduction Nutrition Development, 1986, 26(4): 877-920. |
| [26] |
田美平, 庄平, 张涛, 等. 西伯利亚鲟性腺早期发生、分化、发育的组织学观察[J]. 中国水产科学, 2010, 17(3): 496-506. TIAN M P, ZHUANG P, ZHANG T, et al. Histological observation on early development and differentiation of gonad in siberian sturgeon, Acipenser baerii[J]. Journal of Fishery Sciences of China, 2010, 17(3): 496-506. |
| [27] |
宋卉. 泰山螭霖鱼(Varicorhinus macrolepis)性腺分化与发育规律的研究[D]. 泰安: 山东农业大学, 2004. SONG H. Studies on the differentiation and development of the gonad of Varicorhinus macrolepis[D]. Taian: Shandong Agricultural University, 2004. |
| [28] |
孙朝徽. 牙鲆Paralichthys olivaceus性腺分化与发育的组织学研究[D]. 哈尔滨: 东北农业大学, 2008. SUN C H. Histological studies on sex differentiation and development in flounder (Paralichthys olivaceus)[D]. Harbin: Northeast Agricultural University, 2008. |
| [29] |
张修月, 焦保卫, 吴天利, 等. 南方鲇性腺分化的组织学观察[J]. 动物学杂志, 2005, 40(1): 41-48. ZHANG X Y, JIAO B W, WU T L, et al. Histological observation on gonadal sex differentiation in the southern catfish, Silurus meridionalis[J]. Chinese Journal of Zoology, 2005, 40(1): 41-48. |
| [30] |
林浩然. 第六章: 生殖生理[M]. //2版. 林浩然. 鱼类生理学. 广州: 广东高等教育出版社, 2007: 153-219. LIN H. Chapter 6: Reproductive physiology[M]. //LIN H. Fish physiology: 2nd Edition. Guangzhou: Guangdong Higher Education Press. 2007: 153-219. |
| [31] |
CONOVER D O. Field and laboratory assessment of patterns in fecundity of a multiple spawning fish: the Atlantic silverside Menidia menidia[J]. Fishery Bulletin, 1985, 83(3): 331-341. |
| [32] |
胡成钰, 洪一江, 林光华, 等. 繁殖季节黄颡鱼[Pseudobugrus fucridraco (Rich)]性腺的研究[J]. 江西科学, 1993, 11(3): 159-163. HU C Y, HONG Y J, LIN G H, et al. A research on gonadal development of Pseudobugrus fucridraco during the breeding season[J]. Jiangxi Science, 1993, 11(3): 159-163. |
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Shandong Key Laboratory of Marine Fisheries Biotechnology and Genetic Breeding, Qingdao 266071, Shandong, China;
4. Ming Bo Aquatic Co. Ltd., Laizhou, Yantai 261400, Shandong, China
 2021,
Vol. 30
2021,
Vol. 30


