2. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
鱼粉因具有蛋白质含量高、必需氨基酸齐全、适口性好且易被水产动物消化吸收等优点,是肉食性鱼类饲料中主要的蛋白源。但近年来海洋渔业资源的日益短缺及鱼粉价格不断攀升,限制了鱼粉在水产饲料中的应用。因此,寻求可部分或完全替代鱼粉的蛋白源成为水产动物营养领域的研究热点。通常,植物蛋白由于其价格低廉、来源广泛而成为主要的鱼粉替代源。已有一些研究报道植物蛋白能部分替代鱼粉而不影响鱼的生长,如豆粕[1]、发酵棉粕[2]和玉米蛋白粉[3]等。然而,随着饲料中植物蛋白替代鱼粉比例的升高,饲料适口性会下降而导致生长减缓的问题[4]。此外,植物蛋白含有的抗营养因子[5]和氨基酸不平衡[6]也是导致生长下降的重要原因之一。
海洋性动物水解蛋白是一类由海产品加工副产物或废弃物经由一系列处理工艺而制得的水解蛋白产品,如鱼溶浆、鱿鱼膏和酶解虾膏,由于其出众的营养价值和富含多种功能性小分子物质,被广泛认为是水产饲料中的优质蛋白原料[7]。与植物蛋白源相比,海洋性动物水解蛋白氨基酸组成更为均衡,此外,其富含的一些水溶性小分子物质,如游离氨基酸、牛磺酸、核苷酸、小肽等均具有良好的促摄食效果[8]。因此,添加如鱼溶浆、酶解虾膏等海洋性动物水解蛋白来改善低鱼粉饲料的适口性是一个可行的方法。已有研究表明,在饲料中添加如水解鱼蛋白这一类型的海洋性动物水解蛋白能有效提高鱼的生长性能和饲料利用率。有关海洋性动物水解蛋白在水产动物中的应用已有诸多报道,在大西洋鲑(Salmo salar)[9]、花鲈(Lateolabrax japonicus)[10]上发现,在饲料中添加适量的水解蛋白能促进养殖动物的生长。KHOSRAVI等[11]对真鲷(Pagrus major)和牙鲆(Paralichthys olivaceus)的研究显示,磷虾水解物可有效提高两者的生长性能;ZHENG等[12]发现饲料中添加适量水解鱼蛋白可显著提高牙鲆的特定生长率。KADER等[8]发现鱼溶浆的添加可以明显地提高真鲷的生长性能。珍珠龙胆石斑鱼(Epinephelus lanceolatus♂ × Epinephelus fuscoguttatus♀)因肉质可口、生长快、抗病力强的优点,现已成为国内主要的海水养殖品种之一,鉴于海洋性动物蛋白的良好效果,而有关3种海洋性动物蛋白(鱼溶浆、酶解虾膏、鱿鱼膏)在珍珠龙胆石斑鱼幼鱼低鱼粉饲料中的应用还未见报道。本实验旨在探究在珍珠龙胆石斑鱼幼鱼饲料中添加海洋性动物蛋白源对其生长、饲料利用、鱼体组成的影响,寻求在低鱼粉状况下珍珠龙胆石斑鱼对饲料的高效利用。
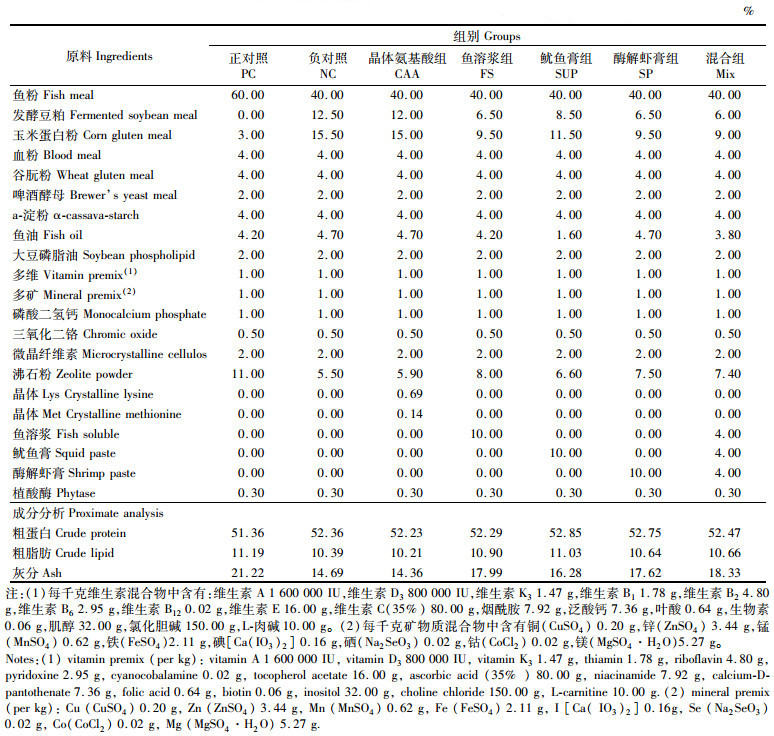
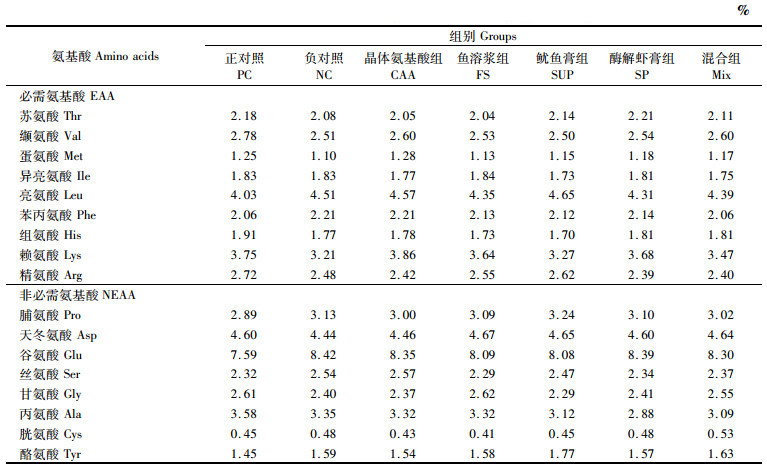
1 材料与方法 1.1 试验饲料根据等氮、等脂、等能的要求设计珍珠龙胆石斑鱼试验饲料,以60%鱼粉组为正对照(NC)、40%鱼粉为负对照(PC),突出比较鱼粉含量的降低对鱼体作用效果的差异;同时,在40%鱼粉基础上分别添加晶体必需氨基酸(赖氨酸及蛋氨酸,CAA)、鱼溶浆(fish soluble,FS)、酶解虾膏(shrimp paste,SP)、鱿鱼膏(squid paste,SUP)及上述3种海洋蛋白混合物(鱼溶浆、酶解虾膏和鱿鱼膏的质量比为1∶ 1∶ 1),比较3种海洋性蛋白源对低鱼粉(40%)饲料的改善效果。CAA组在NC组基础上参照PC组补充晶体赖氨酸和蛋氨酸;鱼溶浆组、酶解虾膏组、鱿鱼膏组和混合组(mixture,Mix)是在添加复合植物蛋白源(发酵豆粕和玉米蛋白粉)的基础上,分别添加10%鱼溶浆、10%酶解虾膏、10%鱿鱼膏及12%海洋性动物水解蛋白混合物(鱼溶浆、酶解虾膏和鱿鱼膏的质量比为1∶ 1∶ 1)等氮替代饲料中20%鱼粉。饲料氨基酸和游离氨基酸含量见表 1和表 2。
|
表 1 试验饲料配方和营养水平(干物质) Tab.1 Formulation and nutrition levels of experimental diets (dry matter) |
|
表 2 实验饲料氨基酸含量(干物质) Tab.2 Amino acid contents of experimental diets (dry matters) |
所有原料经粉碎过80目筛,然后依据饲料配方采用逐级混匀的方式将原料混合均匀,继而加入油和水揉匀,最后经饲料挤压制粒机制成硬质颗粒料,在60 ℃烘箱中烘干,包装好放置于-20 ℃冰箱中待用。
1.2 养殖管理试验所用鱼苗均购自湛江农好水产科技有限公司。养殖试验于广东省湛江市遂溪县乐民镇万利虾苗场和上海海洋大学室内循环水养殖系统进行。试验开始前鱼苗采用湛江农好水产科技有限公司生产的石斑鱼专用饲料驯化两周,以适应养殖环境。在试验开始前,挑选大小匀称,体格健壮的珍珠龙胆石斑鱼幼鱼[(9.6±0.01)g]进行随机分组;每试验组设置3个重复,每重复放置35尾鱼,分别放于21个圆柱形玻璃钢养殖桶(直径1.1 m,高1.2 m)内,水位保持在1 m左右;每天2次(7:00和17:00)表观饱食投喂。养殖用水经海绵、珊瑚砂过滤后再经紫外线杀菌消毒备用;整个试验期间不间断充气,采用自然光照,海水温度保持在(28±1)℃,溶解氧>6 mg/L,pH为7.7~7.9,养殖试验共进行80 d。
1.3 样品采集在养殖试验开始前随机取30尾鱼于-20 ℃保存,用作初始样本的全鱼组成分析。在试验开始后的第3周参考LEE[13]的方法收集粪便;在每个养殖桶底部安装1个粪便储积的装置,粪便会随着水流的不断循环储积在装置中,在每天上午喂食后的排粪高峰期,将装置中粪便取出,以养殖桶为单位保存于-20 ℃冰箱中,用于营养物质表观消化率的测定。试验结束时,试验鱼禁食24 h,将所有鱼称重,记录每桶鱼的总质量及尾数,随后用丁香酚进行麻醉,随机从每个养殖桶取13尾鱼,其中:3尾冷冻保存用于全鱼体组成及氨基酸分析;其余10尾在记录体质量体长后解剖,取其内脏团及肝脏称重,用于计算鱼体脏体比和肝体比。
1.4 体成分分析饲料、粪便和鱼体中水分的测定采用105 ℃恒温烘干失重法测定;粗灰分采用马弗炉于550 ℃灼烧至恒重;粗脂肪采用氯仿-甲醇法测定;粗蛋白采用全自动凯氏定氮仪(OPSIS,瑞典)测定;饲料、粪便的Cr2O3采用DIVAKARAN等[14]的方法测定。
1.5 氨基酸分析饲料、组织牛磺酸含量的测定参照周铭文等[15]的方法并作适当调整。先准确称量样品放入10 mL离心管中,加入甲醇水溶液(甲醇与水的体积比为3∶ 1),用电动研磨器研磨3 min,然后放入超声波仪超声匀质30 min,于8 000 r/min在4 ℃下离心15 min,将上清液转移至50 mL容量瓶中,沉淀物再用上述方法提取2次,最后合并上清液,定容。再稀释至合适倍数,经0.22 μm针式过滤器过滤,滤液上机测定。牛磺酸含量采用美国WATERS-TQS液相色谱质谱联用仪测定。
氨基酸的测定采用酸水解法,首先准确称量样品放入消化管中,加入15 mL盐酸(6 mol/L), 用真空泵抽真空后充氮气,往复3次,然后将其置于110 ℃消化炉上消化24 h,待消化完成后将其取出置于室温冷却,将冷却后样品经滤纸过滤到100 mL容量瓶中,用超纯水反复冲洗消化管及滤纸,定容至刻度。从容量瓶中取1 mL样液稀释4倍,于小烧杯中在真空干燥箱蒸干,往复3次,残留物加4 mL的样品稀释液(pH 2.2)溶解,经0.22 μm过滤上机测定。氨基酸含量采用德国SYKAM S-433D全自动氨基酸分析仪测定。
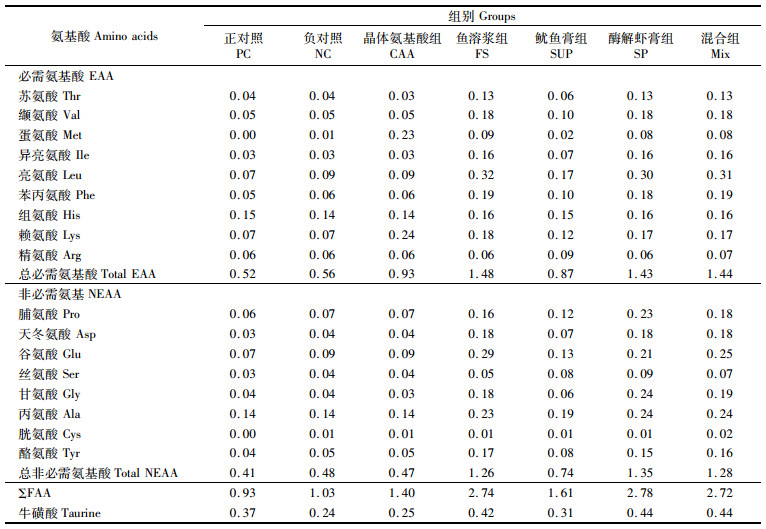
游离氨基酸含量的测定,先准确称量样品放入5 mL离心管中,加入4%磺基水杨酸溶液,用电动研磨器研磨3 min,然后放入超声波仪超声匀质30 min,于8 000 r/min在4 ℃下离心15 min,将上清液转移至50 mL容量瓶中,沉淀物再用上述方法提取2次,最后合并上清液,混合均匀,定容,再稀释至合适倍数,经0.22 μm针式过滤器过滤,滤液上机测定。游离氨基酸含量采用德国SYKAM S-433D全自动氨基酸分析仪测定。见表 3。
|
表 3 试验饲料游离氨基酸含量(干物质) Tab.3 Free amino acid contents of experimental diets (dry matters) |
所有实验数据采用SPSS 19.0进行单因素方差分析(one-way ANOVA),显著水平为P<0.05,多重比较采用Duncan氏检验方法,实验数据以平均数±标准误(Mean±SE)表示。
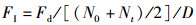 (1)
(1)
式中:FI为摄食率,g/(尾·d);Fd为饲料摄入量,g;N0为初始尾数,尾;Nt为终末尾数,尾;D为试验天数,d。
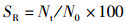 (2)
(2)
式中:SR为存活率,%;N0为初始尾数,尾;Nt为终末尾数,尾。
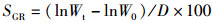 (3)
(3)
式中:SGR为特定生长率,%/d;Wt为终末体质量,g;W0为初始体质量,g; D为试验天数,d。
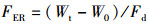 (4)
(4)
式中:FER为饲料效率;Wt为终末体质量,g;W0为初始体质量,g; Fd为饲料摄入量,g。
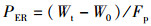 (5)
(5)
式中:PER为蛋白质效率;Wt为终末体质量,g;W0为初始体质量,g;Fp为摄入蛋白质质量,g。
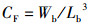 (6)
(6)
式中:CF为肥满度,g/cm3;Wb为鱼体质量,g;Lb为体长,cm。
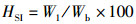 (7)
(7)
式中:HSI为肝体比,%;W1为肝脏质量,g。
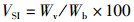 (8)
(8)
式中:VSI为脏体比,%;Wv为内脏质量,g。
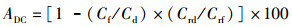 (9)
(9)
式中:ADC为营养物质表观消化率,%;Cf为粪便中营养物质含量,%;Cd为饲料中营养物质含量,%;Crd为饲料中Cr2O3含量,%;Crf为粪便中Cr2O3含量,%。
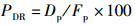 (10)
(10)
式中:PDR为蛋白质沉积率,%;Dp为体蛋白质沉积质量,g;Fp为摄入蛋白质质量,g。
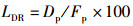 (11)
(11)
式中:LDR为脂肪沉积率,%;Dp为体脂肪沉积质量,g;Fp为摄入脂肪质量,g。
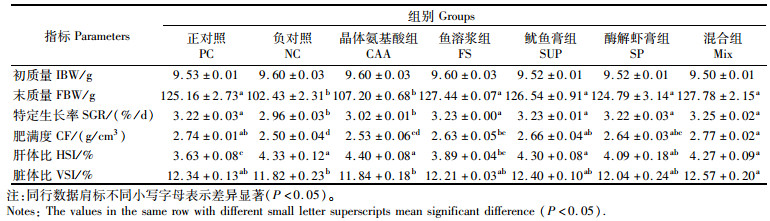
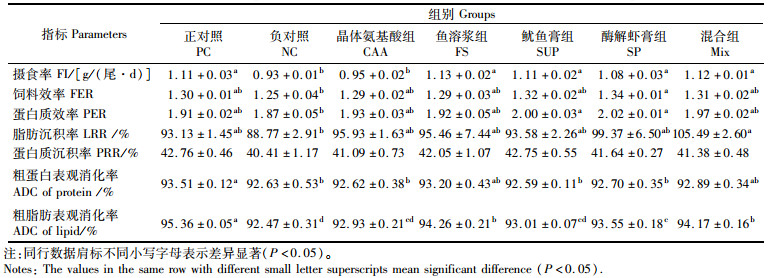
2 结果 2.1 海洋性动物水解蛋白对珍珠龙胆石斑鱼生长和饲料利用的影响由表 4和5可知:各试验组间存活率均为100%,表明鱼粉含量降低没有对石斑鱼的存活率造成影响。但在特定生长率、摄食率上,NC组和CAA组较PC组显著降低(P<0.05),其余组较PC组无显著差异(P>0.05)。NC组的饲料效率最低,PC组与其余各组间均无显著差异(P>0.05),其中以SP组最高。SUP组、SP组蛋白质效率显著高于NC组(P<0.05),除NC组外,其余组间差异不显著(P>0.05)。在脂肪沉积率上,NC组最低,其余组较PC组无显著差异(P>0.05),其中混合组最高。蛋白沉积率以FS组最高,显著高于SUP组和NC组(P<0.05),SUP组最低,NC组次之,PC组、CAA组、SP组和混合组与FS组差异不显著(P>0.05)。PC组的粗蛋白表观消化率为所有实验组中最高,且显著高于NC组、CAA组、SUP组和SP组(P<0.05),但与FS组和混合组相比差异不显著(P>0.05)。PC组粗脂肪表观消化率显著高于其余各组(P<0.05)。
|
表 4 实验饲料对珍珠龙胆石斑鱼生长性能的影响 Tab.4 Effects of experimental diets on growth performance of juvenile hybrid grouper |
|
表 5 实验饲料对珍珠龙胆石斑鱼饲料利用的影响 Tab.5 Effects of experimental diets on feed utilization of juvenile hybrid grouper |
各处理间全鱼的粗蛋白和粗脂肪含量间没有显著性差异(P>0.05),但NC组水分含量显著高于PC组和FS组(P<0.05),与其余组无显著差异(P>0.05)。在全鱼灰分含量上,CAA组和FS组显著高于SUP组(P<0.05),其余组间无显著差异(P>0.05)。见表 6。
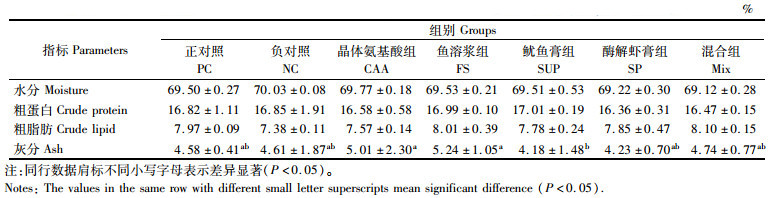
|
表 6 实验饲料对珍珠龙胆石斑鱼鱼体组成的影响(湿物质) Tab.6 Effects of experimental diets on body composition of juvenile hybrid grouper (wet matter) |
各实验组间蛋氨酸、赖氨酸和精氨酸含量没有显著性差异。苏氨酸在SUP组中最高,其余组无显著差异(P>0.05);缬氨酸在FS组最高且显著高于PC组、CAA组、SP组和混合组(P<0.05);异亮氨酸在FS组最高,其余组间无显著差异(P>0.05);SUP组亮氨酸含量最高,且显著高于CAA组和混合组(P<0.05);苯丙氨酸在PC组最高,剩余组间差异不显著(P>0.05);组氨酸含量以SUP组最高,其余组间差异不显著(P>0.05)。在非必需氨基酸中,天冬氨酸、谷氨酸、甘氨酸和胱氨酸在各组间无显著差异(P>0.05);脯氨酸以PC组最高,其余组间差异不显著(P>0.05);丝氨酸在CAA组中最低,剩余组间差异不显著(P>0.05);丙氨酸在SUP组中最高,FM组中最低,其余组间无显著差异(P>0.05)。见表 7。
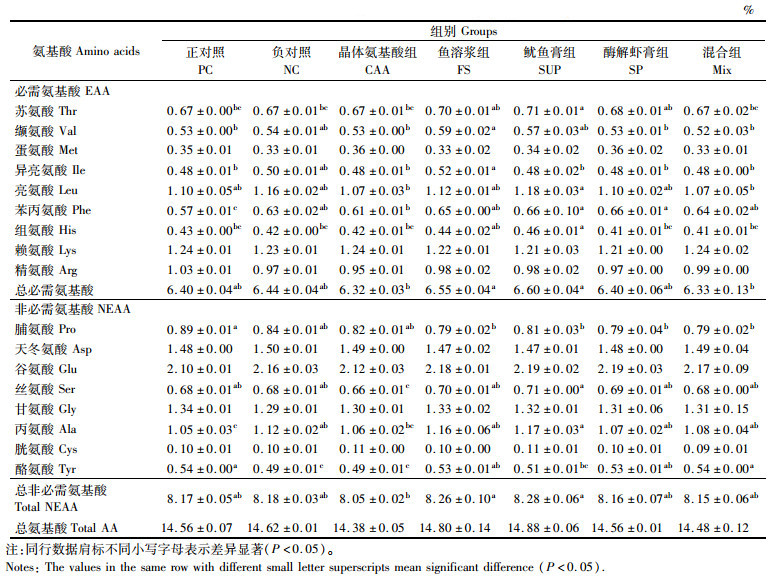
|
表 7 全鱼氨基酸含量(干物质) Tab.7 Amino acid contents of whole body (dry matter) |
在本实验中,所有实验鱼成活率均为100%,表明本实验养殖环境及养殖过程均无问题。本实验生长结果表明,珍珠龙胆石斑鱼是一种对鱼粉有较强依赖性的鱼类。当饲料鱼粉含量由60%降至40%时,NC组特定生长率和摄食率相较PC组均出现明显下降。这和在金头鲷(Sparus aurata)[16]、牙鲆(Paralichthys olivaceu)[17]、褐点石斑鱼(Epinephelus fuscoguttatus)[18]上的研究结果相似,即植物蛋白替代鱼粉比例过高时会导致生长下降。必需氨基酸的缺乏是植物蛋白难以高比例替代鱼粉的一个重要限制因素,其中,蛋氨酸和赖氨酸通常是水产动物养殖生产中最主要的两种限制性氨基酸[19]。在本实验中,NC组蛋氨酸及赖氨酸含量均明显低于PC组,这可能是NC组生长显著低于PC组的一个重要原因。CAA组的特定生长率相较NC组无显著差异但显著低于PC组,原因有:一方面是补充晶体氨基酸没能有效改善饲料适口性,导致摄食率较低(表 6),最终导致生长性能较差;另一方面,有可能存在鱼类对晶体氨基酸和蛋白质吸收不同步的情况[20]。在特定生长率上,单独添加3种动物蛋白的实验组和混合添加组均显著高于NC组且和PC组持平,这表明3种动物蛋白对珍珠龙胆石斑鱼幼鱼的生长均有显著的促进作用,这与在半滑舌鳎(Cynoglossus semilaevis)[21]、大菱鲆(Scophthalmus maximus) [22]上的实验结果相似,即在饲料中添加适量的海洋性水解蛋白可有效提高水产动物的特定生长率。
在本实验中,在复合植物蛋白替代鱼粉的基础上补充鱼溶浆、鱿鱼膏、酶解虾膏对鱼体的摄食有显著的促进作用。FS组、SUP组、SP组和Mix组的摄食率相较PC组无显著差异,且显著高于NC组和CAA组。在GABER[23]对尼罗罗非鱼的研究中发现,养殖动物的摄食率随着磷虾粉添加水平的升高而增加;相似地,KOLKOVSKI等[24]在黄金鲈(Perca flavescens)的研究中也表明,在商业饲料中添加磷虾水解物可有效提高动物的摄食;TOFTEN等[25]对大西洋鲑的研究表明,在饲料中添加鱿鱼提取物能有效促进摄食。在本实验条件下,NC组和CAA组的摄食率显著低于其余组,这极可能是饲料适口性的差别导致的;而摄食率较高的实验组普遍含有较高含量的海洋动物蛋白,这在一定程度上表明高含量的海洋性动物蛋白能极大地改善饲料的适口性。此外,牛磺酸能有效提高鱼类的生长;LI等[26]对黄颡鱼(Pelteobagrus fulvidraco)的实验证实,增重率与饲料牛磺酸含量显示出显著正相关;MATSUNARI等[27]证明,在真鲷幼鱼基础饲料中添加牛磺酸能有效提高摄食进而促进生长。本实验发现,PC组和添加动物蛋白组牛磺酸含量均明显高于NC组和CAA组。核苷酸及游离氨基酸也能起到促摄食效果;总游离氨基酸含量在各组饲料间出现明显差异,除CAA组是添加晶体赖氨酸和蛋氨酸外,动物蛋白组相较NC组均具有较高的游离氨基酸含量。其中动物蛋白组中的甘氨酸和丙氨酸含量明显高于NC组,这也可能是鱼类摄食得到改善的另一个原因。LIASET等[28]研究发现,水解鱼蛋白中含有高含量的游离氨基酸,如甘氨酸、丙氨酸、牛磺酸等,而这些物质对许多肉食性鱼类有促摄食作用[29]。此外,海洋性动物水解蛋白有较强的气味,对鱼类可起到较好的诱食作用[30]。在本实验中,石斑鱼的饲料效率和蛋白质效率在各实验组中的变化表现出相似的趋势。NC组和CAA组及动物蛋白组的饲料效率和蛋白质效率相较PC组均无显著差异,其中NC组最低。对花鲈(Lateolabrax japonicus)[31]的研究发现,添加晶体氨基酸组饲料系数显著低于未添加组,而在本实验中,CAA组饲料效率相较NC组有所提高,但幅度较小,这主要是由于本实验在饲料配方中采用的发酵豆粕及玉米蛋白粉有效弥补了必需氨基酸的缺乏,维持饲料氨基酸的平衡,进而保证养殖动物对饲料的利用率,故而NC组饲料效率仍然保持在一个较高水平。而其余动物蛋白组饲料效率和蛋白质效率相较PC组均无显著差异,表明添加海洋动物水解蛋白可提高石斑鱼对饲料的利用率。对尖吻鲈(Lates calcarifer)[32]的研究发现,零鱼粉饲料中添加不同水解条件的鱼内脏水解物对各实验组饲料系数没有显著性影响。对非洲鲇(Clarias gariepinus)[33]的实验也发现,随着饲料中水解鱼蛋白替代鱼粉比例的升高,饲料系数在各组间无显著差异。但水解鱼蛋白替代鱼粉比例的升高却显著降低了大菱鲆(Scophthalmus maximus)的饲料效率、蛋白质效率及蛋白质沉积率[34]。矿物质在鱼体内的沉积会导致鱼体灰分含量的变化。在本实验中,SUP组鱼体灰分含量在所有组中最低且显著低于CAA组及FS组,这有可能是鱿鱼膏中灰分含量较低(表 1),导致饲料中灰分含量也比FS低,在生长速度相似的情况下,鱼体中灰分沉积较少。
综上所述,在低鱼粉饲料中添加鱼溶浆、酶解虾膏、鱿鱼膏能显著促进珍珠龙胆石斑鱼幼鱼的摄食和生长。因此,通过添加海洋性动物水解蛋白有望进一步降低肉食性鱼类饲料中鱼粉用量,以期达到节约鱼粉的目的。
| [1] |
OLSEN R E, HANSEN A C, ROSENLUND G, et al. Total replacement of fish meal with plant proteins in diets for Atlantic cod (Gadus morhua L.) Ⅱ-health aspects[J]. Aquaculture, 2007, 272(1/4): 612-624. |
| [2] |
SUN H, TANG J W, YAO X H, et al. Partial substitution of fish meal with fermented cottonseed meal in juvenile black sea bream (Acanthopagrus schlegelii) diets[J]. Aquaculture, 2015, 446: 30-36. DOI:10.1016/j.aquaculture.2015.04.020 |
| [3] |
PEREIRA T G, OLIVA-TELES A. Evaluation of corn gluten meal as a protein source in diets for gilthead sea bream (Sparus aurata L.) juveniles[J]. Aquaculture Research, 2003, 34(13): 1111-1117. DOI:10.1046/j.1365-2109.2003.00909.x |
| [4] |
DAVIS D A, JIRSA D, ARNOLD C R. Evaluation of soybean proteins as replacements for menhaden fish meal in practical diets for the red drum Sciaenops ocellatus[J]. Journal of the World Aquaculture Society, 1995, 26(1): 48-58. DOI:10.1111/j.1749-7345.1995.tb00208.x |
| [5] |
OPSTVEDT J, AKSNES A, HOPE B, et al. Efficiency of feed utilization in Atlantic salmon (Salmo salar L.) fed diets with increasing substitution of fish meal with vegetable proteins[J]. Aquaculture, 2003, 221(1/4): 365-379. |
| [6] |
BAUTISTA-TERUEL M N, FERMIN A C, KOSHIO S S. Diet development and evaluation for juvenile abalone, Haliotis asinina: animal and plant protein sources[J]. Aquaculture, 2003, 219(1/4): 645-653. |
| [7] |
CHALAMAIAH M, KUMAR B D, HEMALATHA R, et al. Fish protein hydrolysates: Proximate composition, amino acid composition, antioxidant activities and applications: a review[J]. Food Chemistry, 2012, 135(4): 3020-3038. DOI:10.1016/j.foodchem.2012.06.100 |
| [8] |
KADER M A, KOSHIO S, ISHIKAWA M, et al. Supplemental effects of some crude ingredients in improving nutritive values of low fishmeal diets for red sea bream, Pagrus major[J]. Aquaculture, 2010, 308(3/4): 136-144. |
| [9] |
REFSTIE S, OLLI J J, STANDAL H. Feed intake, growth, and protein utilisation by post-smolt Atlantic salmon (Salmo salar) in response to graded levels of fish protein hydrolysate in the diet[J]. Aquaculture, 2004, 239(1/4): 331-349. |
| [10] |
LIANG M Q, WANG J L, CHANG Q, et al. Effects of different levels of fish protein hydrolysate in the diet on the nonspecific immunity of Japanese sea bass, Lateolabrax japonicus (Cuvieret Valenciennes, 1828)[J]. Aquaculture Research, 2006, 37(1): 102-106. DOI:10.1111/j.1365-2109.2005.01392.x |
| [11] |
KHOSRAVI S, BUI H T D, RAHIMNEJAD S, et al. Dietary supplementation of marine protein hydrolysates in fish-meal based diets for red sea bream (Pagrus major) and olive flounder (Paralichthys olivaceus)[J]. Aquaculture, 2015, 435: 371-376. DOI:10.1016/j.aquaculture.2014.10.019 |
| [12] |
ZHENG K, LIANG M, YAO H, et al. Effect of dietary fish protein hydrolysate on growth, feed utilization and IGF-I levels of Japanese flounder (Paralichthys olivaceus)[J]. Aquaculture Nutrition, 2012, 18(3): 297-303. DOI:10.1111/j.1365-2095.2011.00896.x |
| [13] |
LEE S M. Apparent digestibility coefficients of various feed ingredients for juvenile and grower rockfish (Sebastes schlegeli)[J]. Aquaculture, 2002, 207(1/2): 79-95. |
| [14] |
DIVAKARAN S, OBALDO L G, FORSTER I P. Note on the methods for determination of chromic oxide in shrimp feeds[J]. Journal of Agricultural and Food Chemistry, 2002, 50(3): 464-467. DOI:10.1021/jf011112s |
| [15] |
周铭文, 王和伟, 叶继丹. 斜带石斑鱼生长性能、体成分和组织游离氨基酸含量对饲料中牛磺酸含量的响应[J]. 动物营养学报, 2015, 27(3): 785-794. ZHOU M W, WANG H W, YE J D. Responses of growth performance, body composition and tissue free amino acid contents of grouper (Epinephelus coioides) to dietary taurine content[J]. Chinese Journal of Animal Nutrition, 2015, 27(3): 785-794. DOI:10.3969/j.issn.1006-267x.2015.03.016 |
| [16] |
KISSIL G W, LUPATSCH I, HIGGS D A, et al. Dietary substitution of soy and rapeseed protein concentrates for fish meal, and their effects on growth and nutrient utilization in gilthead seabream Sparus aurata L.[J]. Aquaculture Research, 2000, 31(7): 595-601. DOI:10.1046/j.1365-2109.2000.00477.x |
| [17] |
刘襄河, 叶继丹, 王子甲, 等. 饲料中豆粕替代鱼粉比例对牙鲆生长性能及生化指标的影响[J]. 水产学报, 2010, 34(3): 450-458. LIU X H, YE J D, WANG Z J, et al. Partial replacement of fish meal by soybean meal in diets for juvenile Japanese flounder (Paralichthys olivaceus)[J]. Journal of Fisheries of China, 2010, 34(3): 450-458. |
| [18] |
王赛, 陈刚, 张健东, 等. 不同蛋白质源部分替代鱼粉对褐点石斑鱼幼鱼生长性能、体组成以及血清生化指标的影响[J]. 动物营养学报, 2012, 24(1): 160-167. WANG S, CHEN G, ZAHNG J D, et al. Influence of partial replacement of fish meal by different protein sources on growth performance, body composition and serum biochemical indices of juvenile Epinephelus fuscoguttatus[J]. Chinese Journal of Animal Nutrition, 2012, 24(1): 160-167. DOI:10.3969/j.issn.1006-267x.2012.01.023 |
| [19] |
冷向军, 李小勤, 陈丙爱, 等. 鱼类对晶体氨基酸利用的研究进展[J]. 水生生物学报, 2009, 33(1): 119-123. LENG X J, LI X Q, CHEN B A, et al. Recent advance of utilizing crystalline amino acids by fish[J]. Acta Hydrobiologica Sinica, 2009, 33(1): 119-123. |
| [20] |
冷向军, 王冠, 李小勤, 等. 饲料中添加晶体或包膜氨基酸对异育银鲫生长和血清游离氨基酸水平的影响[J]. 水产学报, 2007, 31(6): 743-748. LENG X J, WANG G, LI X Q, et al. Supplemental effects of crystalline or coated amino acids on growth performance and serum free amino acids of allogynogenetic crucian carp[J]. Journal of Fisheries of China, 2007, 31(6): 743-748. |
| [21] |
柳旭东, 梁萌青, 张利民, 等. 饲料中添加水解鱼蛋白对半滑舌鳎稚鱼生长及生理生化指标的影响[J]. 水生生物学报, 2010, 34(2): 242-249. LIU X D, LIANG M Q, ZHANG L M, et al. Effect of fish protein hydrolysate levels on growth performance and biological and physiological parameters in tongue sole (Cynoglossus semilaevis Günther, 1873) post-larvae[J]. Acta Hydrobiologica Sinica, 2010, 34(2): 242-249. |
| [22] |
张莉莉, 梁萌青, 徐后国, 等. 饲料中添加磷虾水解物对大菱鲆幼鱼生长性能、体组成及相关酶活性的影响[J]. 水生生物学报, 2017, 41(3): 497-505. ZHANG L L, LIANG M Q, XU H G, et al. Effects of dietary krill hydrolysates on growth performance, body composition and related enzyme activities of juvenile turbot (Scophthalmus maximus L.)[J]. Acta Hydrobiologica Sinica, 2017, 41(3): 497-505. |
| [23] |
GABER M M A. The effect of different levels of krill meal supplementation of soybean-based diets on feed intake, digestibility, and chemical composition of juvenile Nile Tilapia Oreochromis niloticus, L[J]. Journal of the World Aquaculture Society, 2005, 36(3): 346-353. |
| [24] |
KOLKOVSKI S, CZESNY S, DABROWSKI K. Use of krill hydrolysate as a feed attractant for fish larvae and juveniles[J]. Journal of the World Aquaculture Society, 2000, 31(1): 81-88. DOI:10.1111/j.1749-7345.2000.tb00701.x |
| [25] |
TOFTEN H, ARNESEN A M, JOBLING M. Feed intake, growth and ionoregulation in Atlantic salmon (Salmo salar L.) smolts in relation to dietary addition of a feeding stimulant and time of seawater transfer[J]. Aquaculture, 2003, 217(1/4): 647-662. |
| [26] |
LI M, LAI H, LI Q, et al. Effects of dietary taurine on growth, immunity and hyperammonemia in juvenile yellow catfish Pelteobagrus fulvidraco fed all-plant protein diets[J]. Aquaculture, 2016, 450: 349-355. DOI:10.1016/j.aquaculture.2015.08.013 |
| [27] |
MATSUNARI H, FURUITA H, YAMAMOTO T, et al. Effect of dietary taurine and cystine on growth performance of juvenile red sea bream Pagrus major[J]. Aquaculture, 2008, 274(1): 142-147. DOI:10.1016/j.aquaculture.2007.11.002 |
| [28] |
LIASET B, JULSHAMN K, ESPE M. Chemical composition and theoretical nutritional evaluation of the produced fractions from enzymic hydrolysis of salmon frames with ProtamexTM[J]. Process Biochemistry, 2003, 38(12): 1747-1759. DOI:10.1016/S0032-9592(02)00251-0 |
| [29] |
代伟伟. 半滑舌鳎赖氨酸需求及其蛋白源替代研究[D]. 青岛: 中国海洋大学, 2011. DAI W W. Lysine requirement and fish meal replacement in diets of tongue sole, Cynoglossus semilaevis Günther[D]. Qingdao: Ocean University of China, 2011. |
| [30] |
KADER M A, BULBUL M, KOSHIO S, et al. Effect of complete replacement of fishmeal by dehulled soybean meal with crude attractants supplementation in diets for red sea bream, Pagrus major[J]. Aquaculture, 2012, 350-353: 109-116. DOI:10.1016/j.aquaculture.2012.04.009 |
| [31] |
胡亮, 薛敏, 王彬, 等. 晶体氨基酸提高混合动物蛋白替代花鲈饲料中鱼粉的潜力[J]. 水产学报, 2011, 35(2): 268-275. HU L, XUE M, WANG B, et al. Supplementations of crystallized amino acids improve potential of animal protein blend replacing fish meal in diet of Japanese sea bass (Lateolabrax japonicus)[J]. Journal of Fisheries of China, 2011, 35(2): 268-275. |
| [32] |
CHOTIKACHINDA R, TANTIKITTI C, BENJAKUL S, et al. Production of protein hydrolysates from skipjack tuna (Katsuwonus pelamis) viscera as feeding attractants for Asian seabass (Lates calcarifer)[J]. Aquaculture Nutrition, 2013, 19(5): 773-784. DOI:10.1111/anu.12024 |
| [33] |
SWANEPOEL J C, GOOSEN N J. Evaluation of fish protein hydrolysates in juvenile African catfish (Clarias gariepinus) diets[J]. Aquaculture, 2018, 496: 262-269. DOI:10.1016/j.aquaculture.2018.06.084 |
| [34] |
XU H G, MU Y C, ZHANG Y, et al. Graded levels of fish protein hydrolysate in high plant diets for turbot (Scophthalmus maximus): effects on growth performance and lipid accumulation[J]. Aquaculture, 2016, 454: 140-147. DOI:10.1016/j.aquaculture.2015.12.006 |
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


