2. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306;
3. 河北省湿地生态与保护重点实验室, 河北 衡水 053000;
4. 衡水学院, 河北 衡水 053000
随着人们生活水平的提高,滨海水产养殖业迅速发展,养殖污水肆意排放,引起水体富营养化,对滨海水环境存在潜在威胁[1]。目前,针对现有滨海含盐养殖污水的处理方法,主要有物理化学及生物方法,物理化学方法去除速度快,效果较好,但不宜持续使用且易造成二次污染,传统生物法由于盐离子对微生物的抑制,严重影响处理效果[3]。人工湿地(constructed wetland,CWs)具有低耗能、投资少、稳定性强、操作简单、维护方便等优点,是一种结合物理化学及生物方法的水处理技术,已被应用于多类水体净化[4-7]。但在处理滨海养殖污水时,CWs处理效果不佳(当水力停留时间为7 d时,总氮去除率为63%~ 80%,总磷去除率约为80%)[8]。不同植物对人工湿地处理效果不尽相同,植物对氮、磷的吸收受到水体C/N/P的影响。其中:污染物的去除随着C/N的增加逐渐降低,C/N为5时,去除效果最佳[9];N/P亦会影响植物的吸收,N/P大于9.5时植物会受到磷胁迫,N/P为2.0 ~ 9.5时植物对氮、磷的吸收会随着N/P的增加而增加[10]。此外植物在CWs中可以通过根系传输氧气,形成局部的厌氧好氧环境,提高硝化-反硝化作用。植物根系能够产生分泌物,也能促进根系微生物的富集。菖蒲、美人蕉作为常规湿地植物,广泛应用于CWs中,淡水养殖污水中菖蒲、美人蕉对总氮、总磷的去除率分别约为42%、36%和48%、44%[11],由于盐胁迫,上述植物生长受到一定影响,去除率下降,而千屈菜对盐度有一定的耐受性,可以用来处理滨海养殖污水。
因此,本文采用菖蒲、美人蕉和千屈菜分别与基质、微生物协同处理滨海养殖污水,通过驯化和培养植物和微生物来改良人工湿地装置,提高总氮、总磷、COD等的去除率,探究人工湿地处理滨海低盐度养殖水的可行性,为今后人工湿地处理滨海养殖污水的净化提供理论与技术支撑。
1 材料与方法 1.1 人工湿地装置的构建垂直流人工湿地装置为45 cm×20 cm×30 cm的PVC材质实验箱(图 1),在实验箱底部设有出水口,以两种粒径的石英砂作为填充介质,大粒径(φ=4 ~ 8 mm)填于上下层,小粒径(φ=2 ~ 4 mm)在中层,下层填充5 cm,上中层分别填充20 cm,幼苗期植物(美人蕉、菖蒲、千屈菜)栽种在距顶部10 cm处,种植密度为30株/m2。在实验初期先把海参养殖场的养殖水接种至装置内共3次(每两天接种1次);在装置中培养两周后,再加入模拟的养殖污水进行驯化,确保实验装置运行稳定。
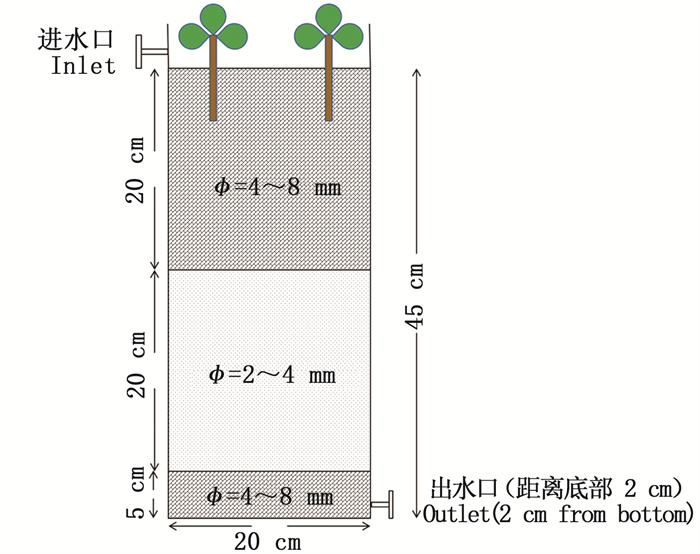
|
图 1 人工湿地实验装置图 Fig. 1 Diagram of CWs experimental device |
参照海水水质标准(GB 3097—1997)及国家地表水环境质量标准(GB 3838—2002),并根据实际低盐度养殖废水水质配制实验污水(氯化钠、硫酸铵、硝酸钾、磷酸二氢钾、葡萄糖及微量元素)[12]。设定不同进水C/N/P为50/10/1、25/5/1、25/5/2、25/5/3,其中COD浓度为50 mg/L,总氮浓度为10 mg/L(硝氮浓度为5 mg/L,氨氮浓度为5 mg/L),总磷浓度分别为1 mg/L、2 mg/L、4 mg/L、6 mg/L,以研究不同进水C/N/P下,湿地植物对CWs处理效果的影响。滨海养殖污水存在盐胁迫影响,而过高盐度会致使人工湿地无法发挥功能,针对滨海盐胁迫特征,设置了3个较为适宜的盐度梯度(0.5,1.0,2.0)[13]。
1.3 实验装置运行2018年5月到10月,在上海海洋大学室外实验基地开展,主要环境参数为:气温15 ~ 35 ℃,相对湿度50% ~ 90%。根据不同盐度和不同植物设计装置,分别命名为CK(装置内无植物)、CW-P1(P1代表植物美人蕉)、CW-P2(P2代表植物菖蒲)和CW-P3(P3代表植物千屈菜),并设置1个实验组和2个平行组,装置进水盐度见表 1。

|
表 1 人工湿地实验装置进水盐度 Tab.1 Influent salinity of CWs device |
实验采用模拟低盐度养殖废水进行接种,每隔3天接种1次,在装置中连续培养1个月,待出水稳定后,根据水力停留时间,取系统处理后的水样,进行检测。人工湿地运行方式采用间歇式进水,水力停留时间为1 d、2 d、3 d和4 d。每组设置2个平行人工湿地,每个实验周期重复3次。
1.4 检测方法主要检测指标包括:pH、温度、溶解氧(DO)、盐度、氧化还原电位(HQd便携式多参数水质分析仪)、NH3-N(纳氏试剂光度法)、NO3-N(紫外分光光度法)、NO2-N[N-(1-萘基)-乙二胺光度法]、COD(重铬酸钾法)、PO43-(钼锑抗分光光度法)、氨基酸(茚三酮,紫外分光光度法)、植物酶活性(分光光度法,南京建成生物试剂盒)和微生物多样性测序(高通量测序)。模拟低盐度养殖水水质参考海水水质标准(GB 3097—1997)、国家地表水环境质量标准(GB 3838—2002)和水产养殖废水排放要求(DB 33/453—2006)。设置1个平行和3次重复。
采用分光光度法测定植物体内超氧化物歧化酶活性(植物组织0.2 g);采用硫代巴比妥酸(TBA)法测定植物体内丙二醛含量(植物组织0.2 g);采用茚三酮-紫外分光光度法测定植物中的氨基酸含量(盐度为0和1.0;种植植物的装置)。
微生物多样性测序(盐度为0和1.0的装置):微生物样品采集,选取CWs装置内距底部10 cm处的石英砂(装置与平行装置内样品混合)10 g。对16S rRNA基因V4-V5区的引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,采用Illumina MiSeq平台对群落DNA片段进行双端(Paired-end)测序,通过QIIME软件调用USEARCH检查并剔除疑问序列,从而获得样品有效序列,采用可操作分类单元(operational taxonomic unit,OTU)和主成分分析(principal components analysis,PCA)进行分析。OTU根据某一人为设定的序列相似度阈值,将来自一个或多个样本的序列进行归并,彼此间相似度高于该阈值的序列都将归并为一个OTU[14]。OTU的划分可以简化数据结构,有利于在某一确定的分类水平,对不同来源的微生物群落样本进行互相比较。
1.5 数据分析与制图采用单因素法分析实验室测试数据的差异显著性,使用SPSS 21、Excel 2013对所得数据进行绘图与分析。
2 结果与分析 2.1 总氮、总磷和化学需氧量去除率实验期间,进水:水温22.5 ~ 24.9 ℃,pH为6.58 ~ 7.66,DO含量为9.17 ~ 9.94 mg/L,氧化还原电位为110.5 ~ 152.1 mV,经过4 d(HRT=4 d)后取样。出水:水温20.1~27.0 ℃,pH为6.34~8.90,DO含量为1.90~3.94 mg/L,氧化还原电位为54.3~121.5 mV。进而对不同浓度进水条件中总氮、总磷和COD的去除率进行分析,结果见图 2。
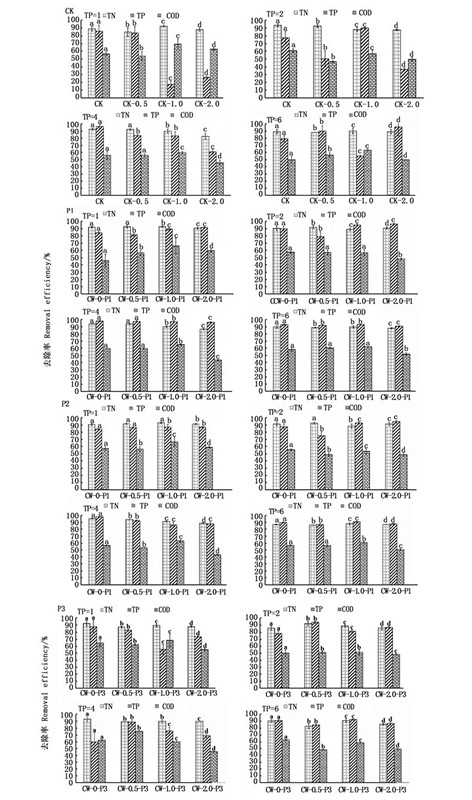
|
图中字母表示不同装置对同一污染物去除率的显著性差异(n=3, P < 0.05) The letters in the figure indicate the significant difference in the removal rate of the same pollutant by different devices(n=3,P < 0.05) 图 2 不同进水条件下人工湿地处理低盐度养殖废水效果 Fig. 2 Effect of CW on treatment of low-salinity culture wastewater under different water inlet conditions |
在同一盐度下,人工湿地对TN、TP和COD的去除效果差异显著,当进水C/N/P为25/5/2(即总磷质量浓度为4 mg/L)时,各人工湿地装置对总磷的去除率较高(图 2)。在不同盐胁迫浓度下,种植不同植物的人工湿地对污染物的去除效果差异显著。其中,当进水盐度为1时,种植美人蕉的人工湿地对总氮、总磷和化学需氧量的去除效果最佳,去除率分别为90%、97%和65%。这可能是由于低盐度对人工湿地去除污染物有促进作用,提高了植物的耐受性,而当盐度过高时则限制了植物和微生物的生长,对污染物的去除效果较差[15]。
2.2 各水力停留时间下出水中氮、磷的含量在盐度为1.0、进水C/N/P为25/5/2(即总磷质量浓度为4 mg/L)的条件下,分析不同水力停留时间的出水氨氮、硝态氮、亚硝态氮和磷酸盐含量的变化情况(图 3)。可知,随着水力停留时间的增加,除了亚硝态氮外,人工湿地对污染物的去除整体呈上升规律。当水力停留时间为1 d时,种植不同植物的人工湿地出水中的氨氮、硝态氮、亚硝态氮和磷酸盐含量差异都不显著;当水力停留时间为2 d时,种植不同植物的人工湿地中的氨氮、硝态氮和磷酸盐浓度降低,亚硝氮由于硝化作用浓度增加[16];当水力停留时间为3 d时,种植不同植物的人工湿地出水中的氨氮含量差异显著,此时出水中的亚硝态氮含量较高;当水力停留时间为4 d时,不同人工湿地之间出水中的磷酸盐含量差异显著,其中种植美人蕉的人工湿地装置中出水氨氮、硝态氮、亚硝态氮和磷酸盐质量浓度分别为0.518 mg/L、0.381 mg/L、0.00963 mg/L、0.636 mg/L。在盐度为1.0、进水C/N/P为25/5/2、HRT=4时,人工湿地装置对污水的处理效果较好。
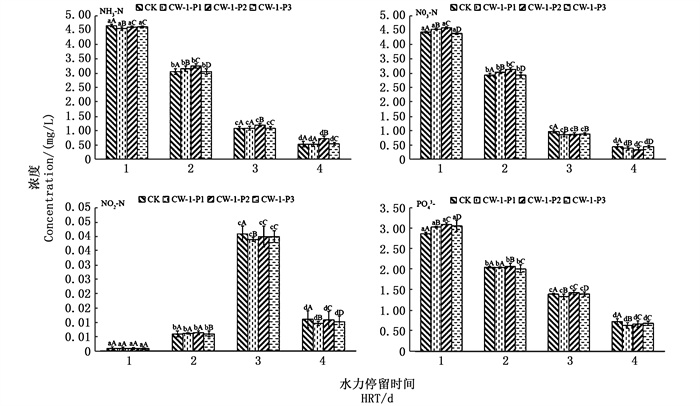
|
图中表示不同水力停留时间下不同污染物出水浓度的显著性差异(n=3),第一个字母表示同一装置不同水力停留时间的显著性差异,第二个字母表示不同装置同一个水力停留时间的显著性差异(P<0.05) The figure indicates the significant difference in the concentration of different pollutants under different HRT(n=3). The first letter indicates the significant difference at the different hydraulic residence time of the same device; the second letter indicates the significant difference at the same hydraulic residence time of the different devices (P<0.05)) 图 3 不同水力停留时间下人工湿地处理养殖水效果(盐度为1,C/N/P为25/5/2) Fig. 3 Effects of CW on treatment of cultured water at different hydraulic residence time(salinity=1, C/N/P=25/5/2) |
植物通过对氮磷自身组织的吸收、根系的滞留明显改善了人工湿地净化效果,根系区域的硝化与反硝化作用得到增强,根系环境改善能提高装置内微生物的降解活性,从而提高CWs装置整体处理能力[17-19]。酶活性可以反映植物生长状况,SOD有着特殊生理活性,能够清除超氧阴离子自由基(O2-),可直观地反映出植物衰败程度;MDA表示细胞膜脂质过氧化的程度和植物对逆境条件的反应强弱,其含量越高对植物生长越不利。图 4表明不同装置间植物SOD/MDA酶活性差异性明显,千屈菜中SOD酶活性浓度不高,说明千屈菜对环境适应性差,美人蕉、菖蒲SOD值较高,适应能力好。千屈菜中MDA酶活性浓度较高,可能是千屈菜处于逆境胁迫中,其体内细胞膜系统受到伤害,使浓度上升,不利于千屈菜生长。
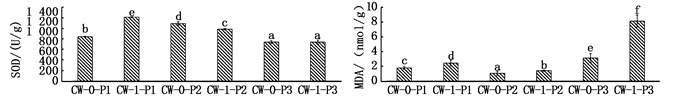
|
图中表示CWs装置中不同酶活性的显著性差异(n=3),第一个字母表示不同装置中酶活性浓度的显著性差异,第二个字母表示同一装置的显著性差异(P<0.05)。 The figure indicates significant different enzyme activity in the CWs(n=3). The first letter indicates a significant difference of the concentration of chlorophyll SPAD value/enzyme activity in different devices, and the second letter indicates a significant difference between the leaves and stems of the same device (P<0.05). 图 4 不同人工湿地装置间植物体内酶活性变化情况 Fig. 4 Changes of enzyme activity in plants at different CW treatment |
氨基酸是植物生长所必需的营养物质,参与植物的氮代谢过程并调节碳氮平衡,其组成特征表示有机质在系统中的降解程度。当植物缺乏某些难溶性元素时,生长受到影响。氨基酸可与一些难溶性元素发生螯合反应,生成溶解度好、易被植物吸收的螯合物[20]。图 5表明,在盐胁迫下,植物体内氨基酸略低,植物生长受到抑制,但美人蕉装置中氨基酸总浓度较高,美人蕉长势良好,说明在实验中美人蕉对盐离子耐受性较好。不同氨基酸对植物生长影响也不同,精氨酸(Arg)能吸收氮元素,参与植物生长发育等生理化过程,同时提高植物抗盐胁迫能力;脯氨酸(Pro)增加植物对渗透胁迫的耐性,提高植物抗逆性。各装置中植物体内的精氨酸含量相差不大,其中美人蕉体内总氨基酸含量比另两种植物的含量高,且美人蕉所含脯氨酸含量相较其他氨基酸含量略高,美人蕉对环境耐受性更好,生长状况佳,有利于在人工湿地净化过程中发挥作用。
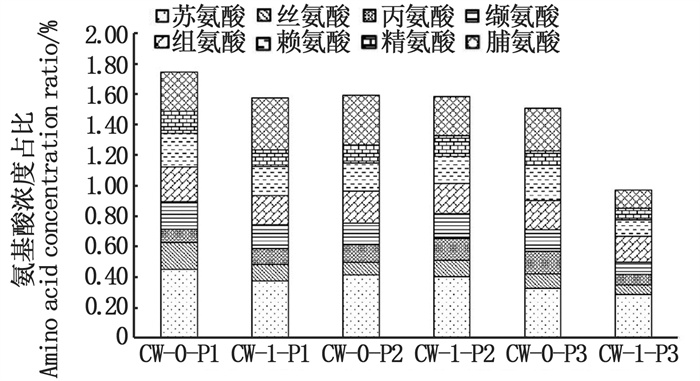
|
图中用百分比表示植物体内氨基酸占比。 The percentage in the figure represents the proportion of amino acids in plants. 图 5 不同人工湿地装置中植物体内各种氨基酸的含量 Fig. 5 The content of various amino acids in different constructed wetland plants |
人工湿地由基质、植物和微生物组成,基质能为微生物生长提供依附载体,人工湿地植物根系能够产生分泌物,促进根系微生物的富集。在一般情况下,硝化-反硝化是实现脱氮的主要途径,硝化过程主要由硝化细菌完成氨氮到硝酸盐氮的转化,反硝化过程则在电子供体的参与下以反硝化细菌来实现脱氮。实验中,基质样品表面提取了338 568条有效细菌序列,进行OTU划分(表 2),CW-1-P1中的各种类OTU值都较大,说明美人蕉装置中微生物所提取的有效信息较多,富集丰度较大,微生物种类较多,受盐胁迫影响较小。
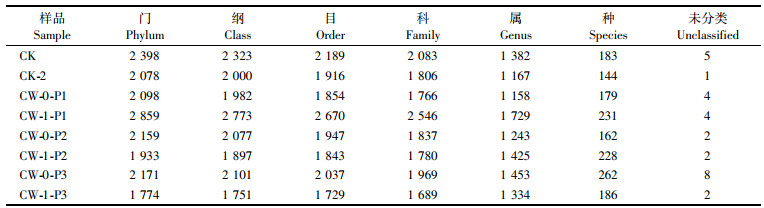
|
表 2 OTU划分和分类地位鉴定结果统计表 Tab.2 Statistical chart of the results of OTU division and classification status appraisal |
人工湿地内微生物的分布受到进水水质状况、基质种类和其所在环境变化等因素的影响。图 6表明,变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、浮霉菌门(Planctonmycetes)、放线菌门(Actinobacteria)的序列总和占了全部序列的75.6%,这些微生物是优势菌群,为人工湿地装置的有效运行提供良好的生物降解条件。CW-1-P1装置中,纲分类学水平上主要细菌菌群有α-变形菌纲(Alphaproteobacteria)、β-变形菌纲(Betaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、蓝藻门(Cyanobacteria)分支中蓝藻菌纲(Cyanobacteria),分别占25.8%、21.3%、12.4%和6.3%;目分类学水平上主要细菌菌群有丛毛单胞菌科(Comamonadaceae)、红杆菌科(Rhodobacteraceae)占25.8%和21.3%,其中:变形菌类是污水处理中的优势菌种,其丰度越大,数量越多,微生物能在处理过程中发挥的作用越大[21];蓝藻菌门对盐离子较敏感,在低盐度下菌群的丰度得到积累,可能是盐离子对菌群的生长有一定的促进作用,因此CWs能够适应一定盐胁迫环境,装置内微生物具有较好的耐受性;浮霉菌类在缺氧环境下利用亚硝酸盐氧化铵离子生产氮气来获取能量[22],促进氮的去除;放线菌类主要是促使土壤中的动物和植物遗骸腐烂,使处理过程中的藻类腐烂分解。此类细菌能提高美人蕉装置处理效果,与图 2分析结果一致。
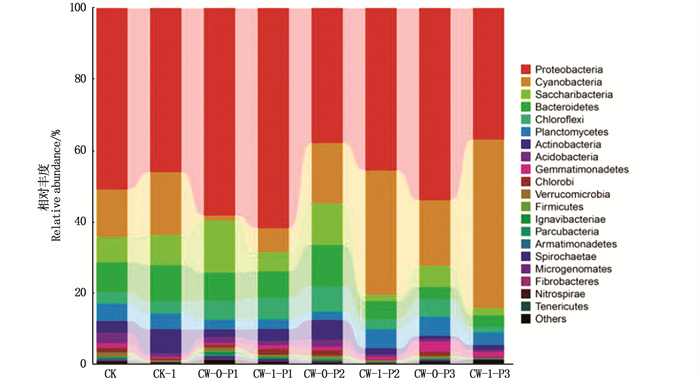
|
图 6 人工湿地装置中微生物群落分类学组成和丰度分布图 Fig. 6 Taxonomic composition and abundance distribution of microbial communities in CWs |
在微生物群落多样性分析中,群落丰度等级曲线可以反映群落中的丰度和稀有OTU的数量,从而了解装置间微生物群落的组成均匀度和丰度差异。由图 7可知,CW-1-P1装置中的折线较长且平稳,该群落中的OTU数多,群落组成的均匀度高[23]。结合上述分析可推测,当微生物群落组成均匀度较高且微生物群落多样性高时,有利于优化人工湿地系统中微生物群落的组成,改善装置净水效果,使美人蕉-人工湿地中基质和植物协同处理污染物。
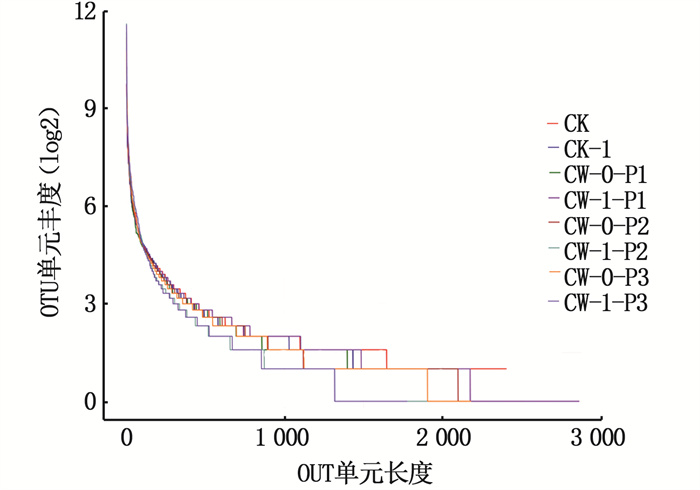
|
图 7 人工湿地装置中微生物群落丰度等级曲线图 Fig. 7 Abundance grade curve of microbial community in CWs |
本实验采用人工湿地小试装置进行室外实验,研究不同植物对滨海区域低盐度养殖水的处理效果,通过对出水水质、植物理化指标和微生物测序结果的分析,可知装置运行良好,处理效果显著,得到以下结论:
(1) 当进水盐度为1.0、C/N/P为25/5/2(COD为50 mg/L、总氮浓度为10 mg/L、总磷浓度为4 mg/L)时,不同植物的人工湿地对各污染物的去除效果比对照组好,美人蕉-人工湿地中TN、TP的去除率达到了90 %、97 %,COD的去除率为65%。
(2) 进水盐度为1.0、C/N/P为25/5/2、HRT=4 d时,美人蕉-人工湿地系统处理效果最佳,装置中美人蕉体内叶绿素(SPAD值)、超氧化物歧化酶、丙二醛含量分别为40.6、1 212 U/g和2.45 nmol/g,氨基酸含量为1.82 %。
(3) 通过装置内微生物数量、活性及微生物功能多样性等分析可知,利用美人蕉人工湿地处理滨海低盐度养殖废水,在进水盐度为1.0、C/N/P为25/5/2、HRT=4 d条件下能强化人工湿地处理效果,提高植物-微生物的协同去污能力和盐度耐受性,为滨海水体修复提供技术支撑。
| [1] |
TOVAR A, MORENO C, MANUEL-Vez M P, et al. Environmental impacts of intensive aquaculture in marine waters[J]. Water Research, 2000, 34(1): 334-342. DOI:10.1016/S0043-1354(99)00102-5 |
| [2] |
TANNER C C, KADLEC R H, GIBBS M M, et al. Nitrogen processing gradients in subsurface-flow treatment wetlands[J]. Ecological Engineering, 2002, 18: 499-520. DOI:10.1016/S0925-8574(02)00011-3 |
| [3] |
杨丹菁, 靖元孝. 植物在水产养殖废水处理中的研究进展[J]. 生态科学, 2008, 27(6): 522-526. YANG D Q, JING Y X. Advances in plants in aquaculture wastewater treatment[J]. Ecological Science, 2008, 27(6): 522-526. DOI:10.3969/j.issn.1008-8873.2008.06.015 |
| [4] |
ZHAO Z M, SONG X S, XIAO Y P, et al. Influences of seasons, N/P ratios and chemical compounds on phosphorus removal performance in algal pond combined with constructed wetlands[J]. The Science of the total environment, 2016, 573: 906-914. DOI:10.1016/j.scitotenv.2016.08.148 |
| [5] |
ZHAO Z M, SONG X S, et al. 2016. Influences of iron and CaCO3 on wastewater treatment performances of algae based reactors.[J]. Bioresource Technology, 2016, 216: 1-11. DOI:10.1016/j.biortech.2016.05.043 |
| [6] |
徐琦. 人工湿地: 污水处理新出路[J]. 环境经济, 2005(s1): 78-80. XU Q. Constructed wetland: a new way of sewage treatment[J]. Environmental Economy, 2005(z1): 78-80. |
| [7] |
赵思, 江云, 纪荣平. 垂直流人工湿地净化处理水产养殖废水[J]. 扬州大学学报(自然科学版), 2015, 18(4): 79-82. ZHAO X, JIANG Y, JI R P. The effect of purifying aquaculture wastewater by vertical flow constructed wetland[J]. Journal of Yangzhou University(Natural Science Edition), 2015, 18(4): 79-82. |
| [8] |
LIANG Y, ZHU H, et al. Removal of nutrients in saline wastewater using constructed wetlands: Plant species, influent loads and salinity levels as influencing factors[J]. Chemosphere, 2017, 187: 52-61. DOI:10.1016/j.chemosphere.2017.08.087 |
| [9] |
赵小蓉, 林启美, 李保国. C、N源及C/N比对微生物溶磷的影响[J]. 植物营养与肥料学报, 2002(2): 197-204. ZHAO X R, LIN Q M, LI B G. Effect of C, N sources and C/N ratio on the solubilization of rock phosphate by some microorganisms[J]. Plant Natrition and Fertilizen Science, 2002(2): 197-204. DOI:10.3321/j.issn:1008-505X.2002.02.013 |
| [10] |
徐治国, 何岩, 闫百兴, 等. 植物N/P与土壤pH值对湿地植物物种丰富度的影响[J]. 中国环境科学, 2006, 26(3): 346-349. XU Z G, HE Y, YAN B X, et al. The influence of plant N/P, soil pH value on wetland plant species richness[J]. China Environmental Science, 2006, 26(3): 346-349. DOI:10.3321/j.issn:1000-6923.2006.03.021 |
| [11] |
陈龙, 李杰, 钟成华, 等. 植物床人工湿地处理养殖废水研究[J]. 环境工程学报, 2011, 5(7): 1542-1547. CHEN L, LI J, ZHONG C H, et al. Treatment of breeding wastewater using constructed wetland with plant bed[J]. Chinese Journal of Environmental Engineering, 2011, 5(7): 1542-1547. |
| [12] |
SHINYA M, AKIHIKO T, SATOSHI T. Modeling of membrane-aerated biofilm: Effects of C/N ratio, biofilm thickness and surface loading of oxygen on feasibility of simultaneous nitrification and denitrification[J]. Biochemical Engineering Journal, 2007, 37(1): 98-107. DOI:10.1016/j.bej.2007.03.013 |
| [13] |
刘亚飞. 垂直流人工湿地处理含盐富营养化水效果与脱氮菌群分析[D]. 天津: 天津大学, 2017. LIU Y F. Performance and denitrifier microbial analysis for vertical flow constructed wetland treating eutrophic brackish water[D]. Tianjin: Tianjin University, 2017. |
| [14] |
BLAXTER M, MANN J, CHAPMAN T, et al. Defining operational taxonomic units using DNA barcode data. Philosophical transactions - Royal Society[J]. Biological Sciences2005, 2005, 360: 1935-1943. DOI:10.1098/rstb.2005.1725 |
| [15] |
N D O' LUANAIGH, GOODHUE R, Gill L W. Nutrient removal from on-site domestic wastewater in horizontal subsurface flow reed beds in Ireland[J]. Ecological Engineering, 2010, 36(10): 1266-1276. DOI:10.1016/j.ecoleng.2010.06.002 |
| [16] |
刘曦, 陈芳清, 杨丹, 等. 垂直流人工湿地系统中氮去除影响因素的研究[J]. 安徽农业科学, 2015, 484(15): 226-228. LIU X, CHEN F Q, YANG D, et al. Study on the factors influencing nitrogen removal in vertical flow constructed wetlands system[J]. Journal of Anhui Agricultural Sciences, 2015, 484(15): 226-228. DOI:10.3969/j.issn.0517-6611.2015.15.081 |
| [17] |
ZHANG R, LI G, ZHOU Q, et al. Relationships between loading rates and nitrogen removal effectiveness in subsurface flow constructed wetlands[J]. Journal of Environmental Science and Engineering, 2008, 27(2): 253. DOI:10.1007/s11783-008-0002-3 |
| [18] |
ZHAI L N, DING W M, LU Y F, et al. Comparison among of pollutant removal rates in sewage by several Wetland plants in spring season[J]. Pollution Control Technology, 2007. |
| [19] |
WANG Q H, DUAN L S, WU J Y, et al. Growth vitality and pollutants-removal ability of plants in constructed wetland in Beijing region[J]. The Journal of Applied Ecology, 2008, 19(5): 1131-1137. |
| [20] |
徐杰, 白学良, 田桂泉, 等. 干旱半干旱地区生物结皮层藓类植物氨基酸和营养物质组成特征及适应性分析[J]. 生态学报, 2005, 25(6): 1247-1255. XU J, BAI X L, TIAN G Q, et al. Study on moss: the content of amino acid, the feature of nutritive elements and its resistance to draught in the biotic crusts in arid and semi-arid regions[J]. Acta Ecologica Sinica, 2005, 25(6): 1247-1255. DOI:10.3321/j.issn:1000-0933.2005.06.003 |
| [21] |
赵志淼. 铁-碳酸钙对复合人工湿地生物化学调控研究[D]. 上海: 东华大学, 2017. ZHAO Z M. Study of biochemical monitoring by iron and calcium-carbonate in integrated constructed wetland[D]. Shanghai: Donghua University, 2017. |
| [22] |
BONDOSO J, BALAGUE V, GASO J M, et al. Community composition of the planctomycetes associated with different macroalgae[J]. Microbiol Ecology, 2014, 88: 445-456. DOI:10.1111/1574-6941.12258 |
| [23] |
张饮江, 张筱, 程梦雨, 等. 人工湿地处理滨海养殖水效果及机理[J]. 上海海洋大学学报, 2019, 28(5): 643-650. ZHANG Y J, ZHANG X, CHENG M Y., et al. Preliminary study on improving performance and removal mechanism of coastal aquaculture water by constructed wetlands[J]. Journal of Shanghai Ocean University, 2019, 28(5): 643-650. |
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
3. Hebei Key Laboratory of Wetland Ecology and Conservation, Hengshui 053000, Hebei, China;
4. Hengshui University, Hengshui 053000, Hebei, China
 2021,
Vol. 30
2021,
Vol. 30


