2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266071;
3. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
4. 国家远洋渔业工程技术研究中心, 上海 201306;
5. 农业农村部大洋渔业开发重点实验室, 上海 201306
海洋酸化是指海水pH逐年降低的现象,已经成为继全球变暖以外倍受人们关注的热点气候问题[1-3]。已有研究[4]发现,海洋中渔业资源生物受到海洋酸化影响不仅包含了空间分布的改变,同时也包括了资源量的变动。如:MUNDAY等[5]发现海洋酸化会使珊瑚礁区域的鱼类更容易被其捕食者发现,同时种群的补充成功率也会降低;KAWAGUCHI等[6]研究表明,南极水域CO2质量浓度的升高会影响到南极磷虾(Euphausia superba)幼体的存活率,进而导致整体资源量的减少;海洋酸化会影响到红帝王蟹(Paralithodes camtschaticus)和蓝蟹(P. platypus)摄食行为和耗氧量, 从而降低其生长率增加死亡率,因此种群的资源量可能发生下降[7]。
东白令海位于亚北极,有着丰富的渔业资源[3]。已有研究[8]发现,海洋酸化的空间分布趋势将从低纬度至高纬度逐渐加剧,其中北极是最容易发生酸化的区域。MATHIS等[9]研究发现,未来在白令海东部沿岸各地受到海洋酸化的潜在风险较高,其中以南部区域最高。对于东白令海区域,现有海洋酸化对渔业资源丰度的影响研究还很缺乏,不清楚是正面影响还是负面影响,影响程度有多大。目前仅有的研究只是对重要的经济种类(红帝王蟹)的资源评估模型中加入了海洋酸化的因子[10]。因此,本研究基于1982—2014年东白令海大陆架底层拖网的调查数据,以海水pH变动作为海洋酸化的指标,利用动态回归模型探究pH变动对鱼类、甲壳类和软体动物资源丰度的影响,研究将有利于了解海洋酸化对不同物种的影响差异,为后续海洋酸化乃至气候变化下的渔业管理提供基础支撑,为东白令海渔业资源的可持续开发和科学管理提供参考。
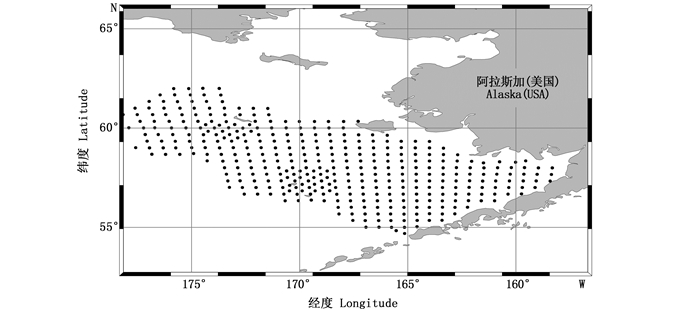
1 材料与方法 1.1 数据来源渔业调查数据来源于阿拉斯加渔业科学中心网站(Alaska fisheries science center,https://www.fisheries.noaa.gov/alaska/),为1982—2014年历年5—9月在东白令海大陆架区域底层拖网的渔获调查数据,数据包含了调查的时间、经纬度、渔获深度、渔获物种的种名(一些种类只鉴定到属)及其对应的单位捕捞努力量渔获量(catch per unit effort,CPUE,单位kg/km2),调查位置的总体分布范围见图 1,涵盖了整个东白令海大陆架区域。对调查数据进行整理,共计70个种类,其中,鱼类36种(格陵兰岛大菱鲆Reinhardtius hippoglossoides、刺黄盖蝶Limanda aspera等),甲壳类15种(红帝王蟹Paralithodes camtschaticus、雪蟹Chionoecetes opilio等),软体动物(不包含头足类)19种(如阿拉斯加扇贝Patinopecten caurinus等)。
|
图 1 1982—2014年历年5—9月在东白令海大陆架区域底层拖网的渔获调查站点分布 Fig. 1 Ground fish trawl survey map in the East Bering Sea continental shelf water from 1982 to 2014 |
底层pH数据下载自世界气候研究计划的网站(World Climate Research Programme,WCRP,https://esgf-node.llnl.gov/search/cmip6/),为NOAA地球流体力学实验室GFDL-ESM4模型基于历史观测资料对1982—2014年全球海水pH的模拟结果以及基于该模型对2015—2050年全球海水的预测结果。预测结果中的2种情景:ssp1-2.6情景和ssp5-8.5情景,分别代表了未来海洋酸化发生最为缓和及最为剧烈的2种情况,数据的时间分辨率为月,空间分辨率为1°×1°。
1.2 数据的预处理将相同时间位置的pH数据与渔业数据相匹配。基于年、月、经纬度和渔获深度的数据,利用广义线性模型(general liner model,GLM)对CPUE进行标准化[11-12],在模型的建立过程中,对进入模型的CPUE进行对数化处理[ln(CPUE+1)],提取年际CPUE标准化值作为物种的资源丰度指标。
1.3 分析方法 1.3.1 物种栖息地pH和适宜pH面积的计算研究假设,pH变动会以2种方式对渔业资源丰度变动产生影响:第一,所处海水的pH大小变化;第二,改变物种适宜的栖息地范围。以物种栖息地pH(pHhabitat)和适宜pH面积(AreapH)分别作为这2种方式的指标,计算方法:(1)pHhabitat:根据每年鱼种的空间分布的界限(4个方向上的经纬度值),计算该范围内5—9月pH的平均值,最后将5个月的pH再次平均。(2)AreapH:对各物种CPUE在pH上的分布频次采用拟合正态分布的方法获取物种的适宜pH范围(3σ原则)[13],根据这个范围计算各年5—9月海域内(图 1)适宜pH的面积,最后将5个月的适宜pH的面积进行平均。
1.3.2 动态回归模型资源变动在时间序列上通常存在着内部的联系,渔业资源的变动主要受到3种因素的影响:种群自身的调控、捕捞因素和环境变动,3种因素的变动最终会反映到资源丰度的时间变动上[14]。基于这个原理,研究采用动态回归模型进行分析。动态回归模型分析中认为模型的误差是随时间变动的函数,研究假设种群调控和捕捞因素包含于时间变动内,pH变动包含于环境变动内,因此以资源丰度为因变量,AreapH或pHhabitat为自变量进行分析,相关模型原理及方法见文献[15-17]。
为了验证研究的假设,对于每一个鱼种都有4种模型形式(表 1),其中:模型1为只包含时间的模型,表示了种群自身的调控和捕捞因素对资源丰度的影响;模型2~4加入了单个或多个pH因子,表示了环境变动对资源丰度的影响。对于各鱼种的4种模型形式,基于不同的时间长度拟合10种时间序列模型,分别为1982—2004、1982—2005、1982—2006、1982—2007、1982—2008、1982—2009、1982—2010、1982—2011、1982—2012和1982—2013,每一个时间序列的后面一年为验证年份。

|
表 1 不同时间序列模型形式 Tab.1 Different types of time series model in this study |
研究通过模型拟合精度和预测精度对假设进行验证:对于一个鱼种,计算每一个模型的对应模拟时间序列的均方根误差(root mean square error,RMSE),当一个模型(模型2~4,表 1)10个不同时间序列模型的RMSE显著低于不包含pH因子的模型1时(t检验,单尾),该模型为合格模型,然后在这些合格模型中选取RMSE最低的模型作为最优模型。利用最优模型分别预测10个不同时间序列的后一年资源丰度(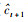
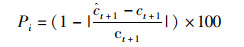 (1)
(1)
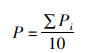 (2)
(2)
当P>65%时认为模型有效,即假设成立,认为物种栖息地pH和(或)适宜pH面积的变动能够显著地影响该物种的资源丰度变化。
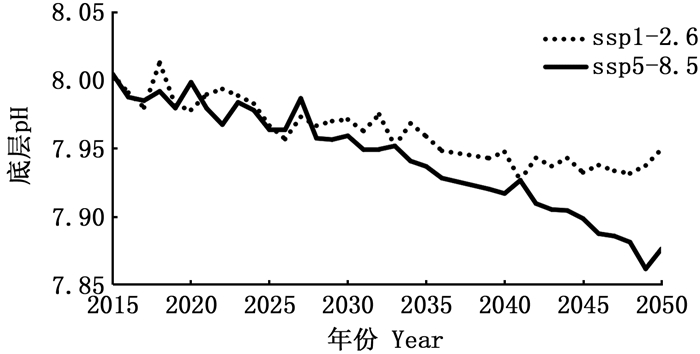
1.3.3 pH变动对资源丰度的影响分析为研究pH变动对资源丰度的影响,对假设成立的物种,利用1982—2014年时间序列的资源丰度进行建模。根据CMIP6模型的研究结果(图 2),2050年在海洋酸化最严重的ssp5-8.5情景下,白令海大陆架海域的底层pH下降了0.12;在海洋酸化最缓和的ssp1-2.6情景下,底层pH下降了0.05,因此,研究以ssp1-2.6情景下2015年海域pH情况为基准,模拟2015年如果pH下降了0、0.04、0.08和0.12时,物种资源丰度的变化,通过对比分析pH变动对资源丰度的影响。
|
图 2 2015—2050年不同情景模式下东白令海大陆架海域底层pH变动情况 Fig. 2 Simulated results for the bottom pH under different scenarios in the East Bering Sea continental shelf waters from 2015 to 2050 |
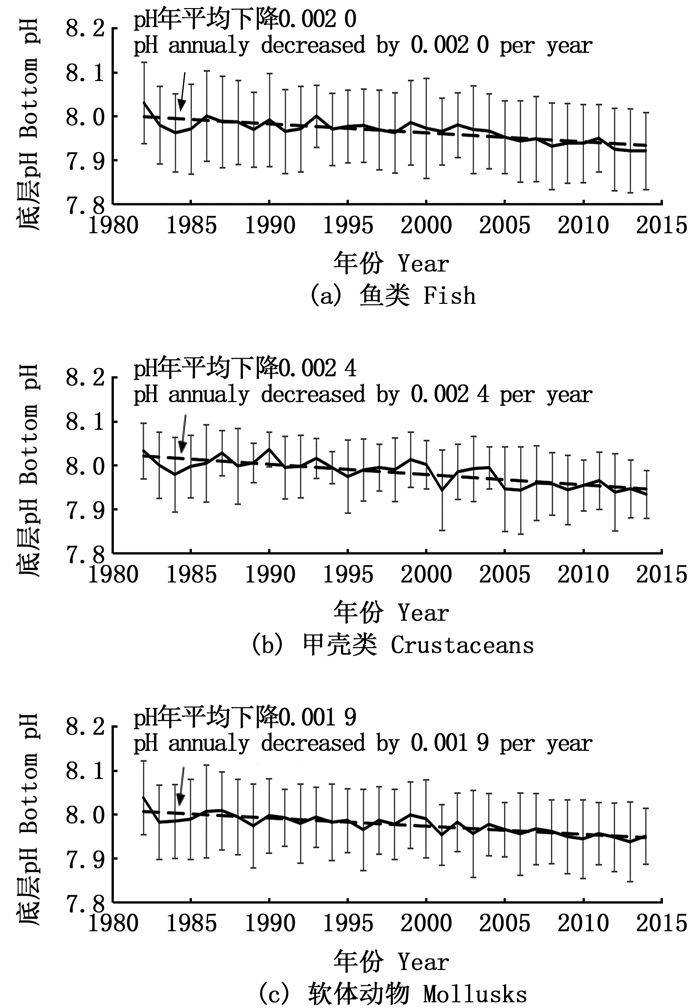
1982—2014年鱼类、甲壳类和软体动物的栖息地pH都存在着下降的趋势(图 3),其中,鱼类的栖息地pH年均下降0.002 0,甲壳类下降0.002 4,软体动物下降0.001 9。
|
实线和虚线分别表示pH平均值年变化和1982—2014年pH平均下降趋势;误差线表示pH的标准差。 Solid lines and dotted lines represent the annual pH in each year and the average downward trend from 1982 to 2014; error bars represent the standard deviation of pH. 图 3 1982—2014年东白令海大陆架区域渔业资源栖息地pH变动 Fig. 3 Habitat pH variation in the East Bering Sea continental shelf waters from 1982 to 2014 |
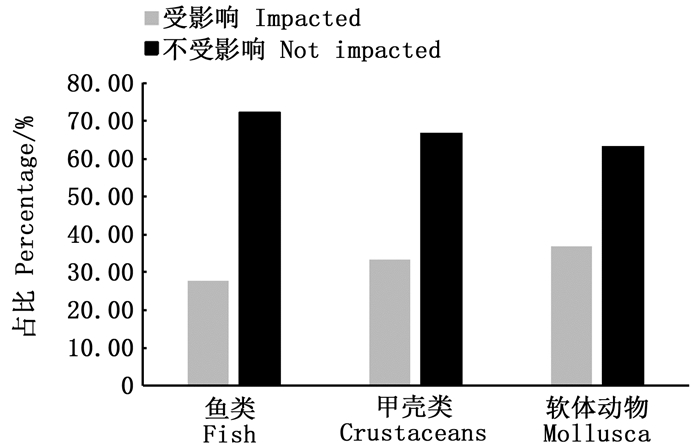
共发现22个种类在加入pH因素后RMSE显著低于不包含pH因子的模型1,即pH变动对其资源丰度变动存在着影响,占所有研究物种的31.42%。其中鱼类最多,为10种,占所有研究鱼类的27.78%;软体动物为7种,占所有研究软体动物的36.84%;甲壳类最少,为5种,占所有研究甲壳类的33.33%(图 4)。
|
图 4 目前东白令海大陆架水域物种受pH变动影响情况 Fig. 4 Species influenced by the pH variations in the East Bering Sea continental shelf water |
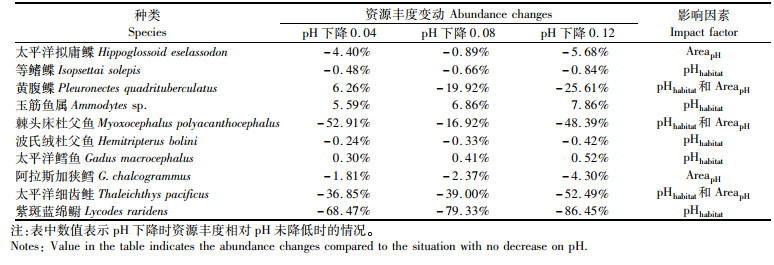
分析发现,pH降低对不同鱼类的作用不同(表 2)。首先,pH降低对种类的影响程度不同,例如在pH下降0.08个单位时,黄腹鲽(Pleuronectes quadrituberculatus)、棘头床杜父鱼(Myoxocephalus polyacanthocephalus)、太平洋细齿鲑(Thaleichthys pacificus)和紫斑蓝绵鳚(Lycodes raridens)的资源丰度下降了10%以上,而对太平洋鳕鱼和等鳍鲽(Isopsetta isolepis)资源丰度的影响程度则不超过1%;其次,pH的降低并不一定对鱼类产生负影响,例如对于太平洋鳕鱼(Gadus macrocephalus)和玉筋鱼属(Ammodytes sp.),pH的降低会使得资源丰度处于增加的趋势;一些种类在pH降低时资源丰度反映出现先增加后减少的趋势(如黄腹鲽);从影响因素来看,不同鱼种受到pH下降的作用因素不同,例如太平洋拟庸鲽(Hippoglossoid eselassodon)和阿拉斯加狭鳕(G. chalcogrammus)的资源丰度降低是由于pH降低导致了适宜栖息地范围的改变;黄腹鲽、棘头床杜父鱼和太平洋细齿鲑的资源丰度降低是由于适宜栖息地范围的改变和栖息地pH降低2个因素共同造成的;其他种类则是受到栖息地pH降低的影响。
|
表 2 pH下降对鱼类的影响 Tab.2 Influence of bottom pH decrease to fish species |
与鱼类相反,甲壳类的资源丰度在pH下降0.12时均表现为降低的现象(表 3);同样,不同种类受到pH下降的影响程度不同,其中:北极琴蟹(Hyas coarctatus)和头盔蟹(Telmessus cheiragonus)受到的影响最为严重,资源丰度在pH下降0.12时分别降低了59.20%和55.22%;北方长额虾(Pandalus goniurus)和雪蟹(C.opilio)的资源丰度随着pH降低先上升后下降。从影响因素来看,所有种类的模型都包含了pHhabitat这一因子,即栖息地pH降低对甲壳类产生了影响。
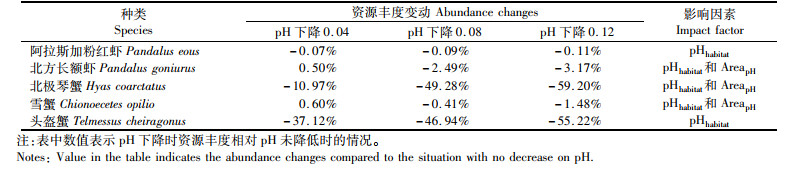
|
表 3 pH下降对甲壳类的影响 Tab.3 Influence of bottom pH decrease to crustaceans species |
随着pH的降低,软体动物的资源丰度都处于下降的趋势(表 4),只有头盔螺(Clinopegma magnum)在pH下降0.04时资源丰度有所增加。不同种类受到pH下降的影响程度不同,其中:峨螺属种类(Colus sp.)和厚虾夷法螺(Neptunea heros)受到的影响最为严重,资源丰度在pH下降0.12时分别降低了57.63%和49.21%。从影响因素来看,所有种类的模型都包含了AreapH,即pH降低导致的栖息地范围改变对软体动物产生了影响。
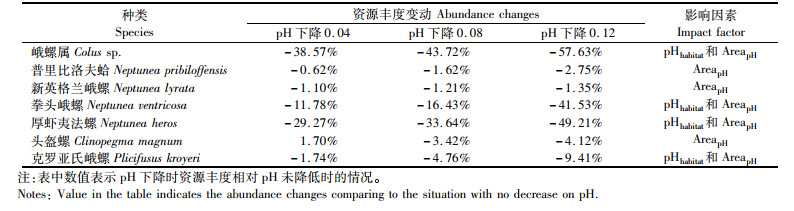
|
表 4 pH下降对软体动物的影响 Tab.4 Influence of bottom pH decrease to mollusks species |
在1982—2014年东白令海海域的鱼类、甲壳类和软体动物的栖息地pH都呈现下降的趋势(图 3),这样的背景下所有物种中只有31.42%的种类受到pH变动的影响,未发现影响的物种占了68.58%(图 4)。未发现影响的物种占了大多数,但是该结果不能说明未来的海洋酸化情况不会对他们产生影响,主要有以下几个原因:首先,本研究是基于历史调查和pH数据(1982—2014年)进行的,所包含的海水pH变化可能还未对物种产生影响,物种受到的影响需要在pH下降一定程度后才能发生,例如在石笔海胆(Eucidaris tribuloides)和硬壳蛤(Mercenari amercenaria)的钙化率研究中,发现只有在海水文石饱和度(aragonite saturation,Ωar)降低到一定值时钙化率才会降低[18];其次,未来的海洋酸化可能会对生态系统产生影响,物种受到海洋酸化资源丰度的增加和减少会对其关联的捕食和被捕食者产生影响,例如MARSHALL等[19]对海洋酸化情况下加利福尼亚沿岸生态系统的物种进行模拟研究发现,鲨鱼种类自身的资源量变动不易受到海洋酸化的直接影响,但是由于捕食饵料生物资源量降低间接影响它们的资源量在海洋酸化情境下也是降低的;最后,物种在海洋酸化的条件下也可能存在驯化和适应性进化的机制[20]。
3.2 pH影响下物种资源丰度变动特征及解释随着pH的下降(表 2~4),绝大多数的甲壳类和软体动物的资源丰度都呈现着下降的趋势,但是鱼类中的玉筋鱼属和太平洋鳕鱼的资源丰度呈现上升趋势。甲壳类和软体动物(除头足类)的身体存在着钙化的外壳,海洋酸化会导致其外壳的溶解[21-22]。WITTMANN等[23]总结了前人的实验结果发现,海洋生物中最易受到海洋酸化影响的种类为珊瑚礁类和软体动物,其次为甲壳类,然后是鱼类。相较于软体动物和甲壳类,鱼类的活动能力是最强的,能够通过游动迁移到适宜的栖息地以避免海水pH下降造成的影响。同时研究发现,物种所处的海水pH变化以及pH变动造成适宜栖息地范围的改变都会对物种资源丰度产生影响,将甲壳类和软体动物进行对比(表 3和表 4),发现所有受影响甲壳类的模型都包含了pHhabitat,即栖息地pH降低对甲壳类产生了影响,而所有受影响软体动物的模型都包含了AreapH,即pH降低导致的栖息地面积变化对软体动物产生了影响,这与这两个种类的生活特性相适应:本研究中的软体动物都为栖息在海底的贝类,未包含栖息在水层中的头足类,活动能力较弱,因此适宜栖息地面积的变化能够直接影响到软体动物的资源丰度变动;而甲壳类与软体动物相比拥有更强的活动能力,在栖息地不适宜的情况下能够发生迁移,因此栖息地pH的高低对资源丰度的影响更为重要。
pH降低对不同鱼类的作用不同,对比鱼类中的2个物种(表 2),pH下降0.04~0.12时,等鳍鲽的资源丰度只下降了不到1%,而紫斑蓝绵鳚的资源丰度在pH下降0.04时就已经下降了68.47%,当pH下降了0.12时其下降比例达到了86.45%,即物种资源丰度的响应程度不同。这可能是由于物种不同的响应机制导致的:在200 d相同的实验条件培养下(pH=7.8)[7],红帝王蟹外壳的钙含量与对照组(pH=8.0)没有显著的变化(P>0.05),而红眼雪蟹(Chionoecetes bairdi)外壳的钙含量则极显著的低于对照组(P < 0.01),研究发现红眼雪蟹在pH下降时体内的能量更多用于维持生长发育,而红帝王蟹则会将能量用于生成因为pH降低而溶解的外壳。
研究发现,物种的资源丰度随着pH下降并不是只表现为下降的形式,不仅存在着资源丰度上升的物种(如太平洋鳕鱼和玉筋鱼属),也有物种(如黄腹鲽)的资源丰度先上升后下降。此外,棘头床杜父鱼的资源丰度在pH下降时虽然都表现为减少,但是资源丰度在pH下降0.08时(16.92%)比下降0.04时(56.91%)减少的程度要低(表 2),即物种的资源丰度在pH下降时的响应形式不同,对海洋酸化下钙化海洋生物钙化率反应分析中也发现了相似结果(正效应或是负效应,以及抛物线形式等)[18],这可能是食物网关系和物种自身的生活特性等因素造成的:pH降低可能导致一些物种饵料生物的增加,SSWAT等[24]模拟了21世纪末高CO2质量浓度海水下的海洋中型生态系统,发现其中大西洋鲱鱼(Clupea harengus)的生物量增加的现象,对其主要饵料生物(浮游动植物种类)的生物量进行统计发现,高CO2质量浓度海水由于提供了充足的光合作用来源导致了这些种类生物量的升高,这为大西洋鲱鱼带来了丰富的饵料环境。本研究也发现了玉筋鱼属的种类资源丰度随着pH降低时而增加的现象,已有研究[25]发现,它们的食物组成主要为低营养级的浮游动物,主要为桡足类,在生态系统模拟研究中曾发现海洋酸化下桡足类生物量会增加的情况[26]。由此可见,pH下降会通过食物网关系对相关联物种的资源丰度产生间接影响;其次,物种都存在着适宜环境因子范围和最适范围[27],当pH下降一定程度时,物种可能还处于适宜pH范围或最适合范围内。该现象可能还与物种的应对策略有关,例如BIGNAMI等[28]发现,鲯鳅(Coryphaena hippurus)仔鱼在高CO2质量浓度海水中,能够降低游泳速度和新陈代谢速率,同时体质量上升以便储存能量维持生存,即资源丰度的升高是物种对pH下降这种不利环境的应对策略。
3.3 总结研究通过对东白令海大陆架水域渔业资源丰度与pH关系分析发现,pH变动对各物种资源丰度的影响存在种类的特异性,其中对软体动物(不包含头足类)和甲壳类均易产生负的影响。同时,物种资源丰度对pH下降的响应程度和形式(包含了上升、下降和先上升后下降3种)不同。研究认为,pH的变动可通过所处水域pH变化以及pH变动改变鱼种适宜栖息地范围,从而对物种资源丰度产生影响。该研究结果在一定程度上预示着在海洋酸化不断加剧的情况下未来物种资源丰度的发展变化趋势,可为后续的研究与分析提供参考。但是分析也发现,仅单独分析pH对物种资源丰度的影响是不够的,食物网[19, 24, 26]、物种生活史[18]、其他环境及气候变化[22, 27, 29]都会对物种的资源丰度造成影响,后续研究将结合这些因素综合分析,为进一步研究和了解未来物种资源丰度变动提供更有力的依据。
| [1] |
CALDEIRAK, WICKETT M E. Oceanography: anthropogenic carbon and ocean pH[J]. Nature, 2003, 425(6956): 365. DOI:10.1038/425365a |
| [2] |
陈芃, 陈新军, 陈长胜, 等. 基于文献计量的全球海洋酸化研究状况分析[J]. 生态学报, 2018, 38(10): 3368-3381. CHEN P, CHEN X J, CHEN C S, et al. Bibliometric analysis of the global study on ocean acidification[J]. Acta Ecologica Sinica, 2018, 38(10): 3368-3381. |
| [3] |
FAO. The State of World Fisheries and Aquaculture 2016. Contributing to food security and nutrition for all[R]. Rome: FAO, 2016.
|
| [4] |
LAM V W Y, CHEUNG W W L, SUMAILA U R. Marine capture fisheries in the Arctic: winners or losers under climate change and ocean acidification?[J]. Fish and Fisheries, 2016, 17(2): 335-357. DOI:10.1111/faf.12106 |
| [5] |
MUNDAY P L, DIXSON D L, MCCORMICK M I, et al. Replenishment of fish populations is threatened by ocean acidification[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(29): 12930-12934. DOI:10.1073/pnas.1004519107 |
| [6] |
KAWAGUCHI S, ISHIDA A, KING R, et al. Risk maps for Antarctic krill under projected Southern Ocean acidification[J]. Nature Climate Change, 2013, 3(9): 843-847. DOI:10.1038/nclimate1937 |
| [7] |
LONG W C, PRUISNER P, SWINEY K M, et al. Effects of ocean acidification on the respiration and feeding of juvenile red and blue king crabs (Paralithodes camtschaticus and P. platypus)[J]. ICES Journal of Marine Science, 2019, 76(5): 1335-1343. |
| [8] |
FEELY R A, DONEY S C, COOLEYS R. Ocean acidification: present conditions and future changes in a high-CO2world[J]. Oceanography, 2009, 22(4): 36-47. DOI:10.5670/oceanog.2009.95 |
| [9] |
MATHIS J T, COOLEY S R, LUCEY N, et al. Ocean acidification risk assessment for Alaska's fishery sector[J]. Progress in Oceanography, 2015, 136: 71-91. DOI:10.1016/j.pocean.2014.07.001 |
| [10] |
PUNTA E, POLJAK D, DALTON M G, et al. Evaluating the impact of ocean acidification on fishery yields and profits: The example of red king crab in Bristol Bay[J]. Ecological Modelling, 2014, 285: 39-53. DOI:10.1016/j.ecolmodel.2014.04.017 |
| [11] |
XU L L, CHEN X J, GUAN W J, et al. The impact of spatial autocorrelation on CPUE standardization between two different fisheries[J]. Journal of Oceanology and Limnology, 2018, 36(3): 973-980. DOI:10.1007/s00343-018-6294-7 |
| [12] |
官文江, 陈新军, 高峰, 等. GLM模型和回归树模型在CPUE标准化中的比较分析[J]. 上海海洋大学学报, 2014, 23(1): 123-130. GUAN W J, CHEN X J, GAO F, et al. Comparisons of regression tree and GLM performance in CPUE standardization[J]. Journal of Shanghai Ocean University, 2014, 23(1): 123-130. |
| [13] |
陈新军, 刘必林, 田思泉, 等. 利用基于表温因子的栖息地模型预测西北太平洋柔鱼(Ommastrephes bartramii)渔场[J]. 海洋与湖沼, 2009, 40(6): 707-713. CHEN X J, LIU B L, TIAN S Q, et al. Forecasting the fishing ground of Ommastrephes bartramii with SST-Based habitat suitability modelling in northwestern Pacific[J]. Oceanologiaet Limnologia Sinica, 2009, 40(6): 707-713. DOI:10.3321/j.issn:0029-814X.2009.06.006 |
| [14] |
陈新军. 渔业资源与渔场学[M]. 北京: 海洋出版社, 2004: 1-173. CHEN X J. Fisheries biology and oceanography[M]. Beijing: Ocean Press, 2004: 1-173. |
| [15] |
HYNDMAN R J, ATHANASOPOULOS G. Forecasting: Principles and Practice, 2nd ed[M/OL]. (2018-04-01)[2020-03-04]. https://otexts.com/fpp2/.
|
| [16] |
曲明辉. 基于动态回归模型的组合模型研究[D]. 大连: 大连海事大学, 2016. QU M H. Combination model research based on dynamic regression model[D]. Dalian: Dalian Maritime University, 2016. |
| [17] |
SAKAMOTO Y, ISHIGURO M, KITAGAWA G. Akaike information criterion statistics[M]. Dordrecht, The Netherlands: D. Reidel, 1986.
|
| [18] |
RIES J B, COHEN A L, MCCORKLE D C. Marine calcifiers exhibit mixed responses to CO2-induced ocean acidification[J]. Geology, 2009, 37(12): 1131-1134. DOI:10.1130/G30210A.1 |
| [19] |
MARSHALL K N, KAPLAN I C, HODGSON E E, et al. Risks of ocean acidification in the California Current food web and fisheries: ecosystem model projections[J]. Global Change Biology, 2017, 23(4): 1525-1539. DOI:10.1111/gcb.13594 |
| [20] |
SUNDAY J M, CALOSI P, DUPONT S, et al. Evolution in an acidifying ocean[J]. Trends in Ecology & Evolution, 2014, 29(2): 117-125. |
| [21] |
CHAN N C S, CONNOLLY S R. Sensitivity of coral calcification to ocean acidification: a meta-analysis[J]. Global Change Biology, 2013, 19(1): 282-290. DOI:10.1111/gcb.12011 |
| [22] |
GILBSON R N, ATKINSON R J A, GORDON J D M, et al. Impact of ocean warming and ocean acidification on marine invertebrate life history stages: vulnerabilities and potential for persistence in a changing ocean[J]. Oceanography and Marine Biology: An Annual Review, 2011, 49: 1-42. |
| [23] |
WITTMANN A C, PÖETNER H O. Sensitivities of extant animal taxa to ocean acidification[J]. Nature Climate Change, 2013, 3(11): 995-1001. DOI:10.1038/nclimate1982 |
| [24] |
SSWAT M, STUASNY M H, TAUCHER J, et al. Food web changes under ocean acidification promote herring larvae survival[J]. Nature Ecology & Evolution, 2018, 2(5): 836-840. |
| [25] |
MONTELEONE D M, PETERSON W T. Feeding ecology of American sand lance Ammodytes americanus larvae from Long Island Sound[J]. Marine Ecology Progress Series, 1986, 30: 133-143. DOI:10.3354/meps030133 |
| [26] |
FAY G, LINK J S, HARE J A. Assessing the effects of ocean acidification in the Northeast US using an end-to-end marine ecosystem model[J]. Ecological Modelling, 2017, 347: 1-10. DOI:10.1016/j.ecolmodel.2016.12.016 |
| [27] |
王易帆, 陈新军. 西北太平洋柔鱼产卵场时空分布及最适水温范围的推测[J]. 上海海洋大学学报, 2019, 28(3): 448-455. WANG Y F, CHEN X J. Suitable environmental conditions for spawning ground affecting the abundance of neon flying squid in northwestern Pacific Ocean[J]. Journal of Shanghai Ocean University, 2019, 28(3): 448-455. |
| [28] |
BIGNAMI S, SPONAUGLE S, COWEN R K. Effects of ocean acidification on the larvae of a high-value pelagic fisheries species, mahi-mahi Coryphaenahippurus[J]. Aquatic Biology, 2014, 21(3): 249-260. DOI:10.3354/ab00598 |
| [29] |
杨香帅, 邹晓荣, 徐香香, 等. ENSO现象对东南太平洋智利竹荚鱼资源丰度及其渔场变动的影响[J]. 上海海洋大学学报, 2019, 28(2): 290-297. YANG X S, ZOU X R, XU X X, et al. Effects of ENSO on abundance index and spatial-temporal change of Chilean jack mackerel in the Southeast Pacific Ocean[J]. Journal of Shanghai Ocean University, 2019, 28(2): 290-297. |
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, Shandong, China;
3. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
5. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


