2. 上海海洋大学 上海水产养殖工程技术研究中心, 上海 201306;
3. 上海海洋大学 水产动物遗传育种中心上海市协同创新中心, 上海 201306;
4. 上海青浦现代农业园区发展有限公司, 上海 201717;
5. 连云港市海洋与渔业发展促进中心, 江苏 连云港 222000
弗氏柠檬酸杆菌(Citrobacter freundii)是一种人鱼共患致病菌[1],具有耐热肠毒素、志贺样毒素等多种毒力因子,可通过定居、繁殖及释放大量毒素引起溶血和细胞坏死[2],不仅能够导致人类发生腹泻、食物中毒,还可以引起三疣梭子蟹(Portunus trituberculatus)、克氏原螯虾(Procambarus clarkii)、花鳗鲡(Anguilla marmorata)等多种水产动物大量发病死亡[3-5],严重影响了水产养殖业的健康持续发展与人类健康。因此,弗氏柠檬酸杆菌的控制应予以重点关注。芽孢杆菌是水产养殖中最常见的一类益生菌,具有抑制病原菌生长、降解多余有机质、维持水生动物肠道微生态平衡、提高机体免疫能力的作用[6]。目前,我国在水产养殖中具有潜在应用价值的芽孢杆菌主要有枯草芽孢杆菌(Bacillus subtilis)、巨大芽孢杆菌(Bacillus megaterium)、嗜碱性芽孢杆菌(Bacillus basophilus)、蜡样芽孢杆菌(Bacillus cereus)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、甲基营养型芽孢杆菌(Bacillus methylotrophicus)等[7-10],尤其是解淀粉酶芽孢杆菌X3-3、甲基营养型芽孢杆菌X4-1和巨大芽孢杆菌X4-5等优良菌株具有良好的抗菌活性[11],极大地丰富了芽孢杆菌作为水产养殖用生物防控制剂开发的微生物资源。然而,从现有文献资料来看,鲜见关于芽孢杆菌拮抗水产致病性弗氏柠檬酸杆菌的报道。本实验以1株蟹源致病性弗氏柠檬酸杆菌C1作为筛选指示菌,从养殖淤泥中分离筛选了1株抗弗氏柠檬酸杆菌的优良芽孢杆菌菌株,对其进行了生理生化鉴定与16S rRNA序列分析,并参照《HJ/T 415—2008环保用微生物菌剂环境安全评价导则》《NY/T 1444—2007微生物饲料添加剂评价通则》等国家标准,从毒力因子和耐药性对小球藻生长的影响以及对斑马鱼和中华绒螯蟹的致病性等方面分析了其安全性,以期丰富弗氏柠檬酸杆菌拮抗菌的菌种资源,为其在中华绒螯蟹(Eriocheir sinensis)弗氏柠檬酸杆菌病生物防控中的安全应用提供理论依据。
1 材料与方法 1.1 材料养殖淤泥采集于江苏连云港某养殖场;弗氏柠檬酸杆菌C1分离自患黑鳃病的中华绒螯蟹[12];致病性蜡样芽孢杆菌BYK17047由上海海洋大学国家水生动物病原库提供;小球藻(Chlorella sp.)由中国水产科学研究院长江水产研究所提供;藻类培养基,参照《化学品藻类生长抑制试验》(GB/T 21805—2008)[13]自制;标准稀释水,由本实验室参照《GB/T13267—1991水质物质对淡水鱼(斑马鱼)急性毒性测定方法》[14]自制;斑马鱼(Danio rerio)平均体质量为(0.3 ± 0.1)g,参照《GB/T13267—1991水质物质对淡水鱼(斑马鱼)急性毒性测定方法》[14]在实验室暂养14 d,健康无伤病,由上海海洋大学鱼类学实验室提供;中华绒螯蟹平均体质量为(28.0 ± 2.5) g,参照尹晓静等[15]的方法在实验室暂养14 d,健康无伤病,由江苏连云港某养殖场提供。
1.2 抗菌芽孢杆菌优良菌株的分离与筛选参照CAO等[16]的方法进行抗菌芽孢杆菌优良菌株的分离与筛选,即称取养殖污泥1.0 g混悬于9 mL无菌水中,振荡混匀后于80 ℃水浴静置10 min,然后采用稀释涂布平板法和划线平板法[17]在营养琼脂培养基上进行芽孢杆菌菌株的分离与纯化。将分离的芽孢杆菌菌株分别接种至无菌营养肉汤后,在30 ℃、200 r/min条件下摇床振荡培养18~24 h后制成终浓度为1.0×106 CFU/mL的菌悬液,然后采用牛津杯法[18]测定芽孢杆菌菌株对弗氏柠檬酸杆菌C1的拮抗活性,并根据LATEGAN等[19]对优良拮抗菌株的判定标准,将抑菌圈直径(> 12.0 mm)最大的芽孢杆菌菌株作为抗菌芽孢杆菌优良菌株。
1.3 抗菌芽孢杆菌优良菌株对蟹源弗氏柠檬酸杆菌的抑菌效果参照薛明洋[20]的方法进行抗菌芽孢杆菌优良菌株对弗氏柠檬酸杆菌的抑菌效果分析。即将抗菌芽孢杆菌优良菌株和弗氏柠檬酸杆菌C1分别加入200 mL无菌营养肉汤中至终浓度为1.0×105 CFU/mL,然后于30 ℃、150 r/min摇床振荡培养,分别在振荡培养后的0、24、48、72、96、120 h取样测定弗氏柠檬酸杆菌C1的浓度,并以相同条件下单独培养的弗氏柠檬酸杆菌C1作为对照。其中,弗氏柠檬酸杆菌C1浓度的测定采用稀释涂布平板法。
1.4 抗菌芽孢杆菌优良菌株的鉴定 1.4.1 分子鉴定将抗菌芽孢杆菌优良菌株接种到100 mL无菌营养肉汤中,在30 ℃、200 r/min条件下摇床振荡培养24 h后,于4 ℃、12 000 r/min离心1 min,弃上清,采用Ezup柱式基因组DNA抽提试剂盒(细菌)进行抗菌芽孢杆菌优良菌株的基因组DNA的提取,然后以基因组DNA为模板,对其16S rRNA进行PCR扩增。其中:正向引物为27F:5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物为1 492R:5′-GGTTACCTTGTTACGACTT-3′;PCR的扩增条件:94 ℃ 3 min;94 ℃ 1 min;60 ℃ 1 min;72 ℃ 1 min;共35个循环。由上海迈浦生物科技有限公司对抗菌芽孢杆菌优良菌株的16S rRNA基因测序后,利用Mega 5.0软件采用邻接法构建系统发育树。
1.4.2 生理生化鉴定参照《常见细菌系统鉴定手册》[21]和《伯杰细菌鉴定手册》[22]对抗菌芽孢杆菌优良菌株进行生理生化鉴定。
1.5 抗菌芽孢杆菌优良菌株的毒力因子检测将抗菌芽孢杆菌优良菌株和对照菌株(蜡样芽孢杆菌BYK17047)分别接种到100 mL无菌营养肉汤中,在30 ℃、200 r/min条件下摇床振荡培养24 h后于4 ℃、12 000 r/min离心1 min,弃上清,然后采用Ezup柱式基因组DNA抽提试剂盒[天根生化科技有限公司(北京)]提取基因组DNA,并进一步以基因组DNA为模板,参照王琰等[23]的方法采用PCR扩增试剂盒[天根生化科技有限公司(北京)]对溶血素BL (hblC) 基因、肠毒素Nhe (nheA)基因、肠毒素T (bceT) 基因、肠毒素FM (entFM) 基因、细胞毒素K (cytK) 基因、呕吐(ces) 基因、多效调控因子(plcR) 进行PCR检测。其中:溶血素BL基因、肠毒素Nhe基因、肠毒素T基因、肠毒素FM基因、细胞毒素K基因、呕吐基因、多效调控因子的PCR扩增引物(表 1)由上海迈浦生物科技有限公司参照文献[16]合成;PCR扩增反应体系[24]总体积25 μL,包括DNA模板2 μL,引物(10 pmol/L) 各1 μL,dNTP(每份10 mmol/L)0.5 μL,dUTP 0.5 μL,10×PCR buffer 2.5 μL,双蒸水17.0 μL,Ex-Taq DNA聚合酶(2.5 U/μL) 0.5 μL。PCR产物经10 g/L琼脂糖凝胶电泳,于凝胶成像系统下观察并拍照记录结果。
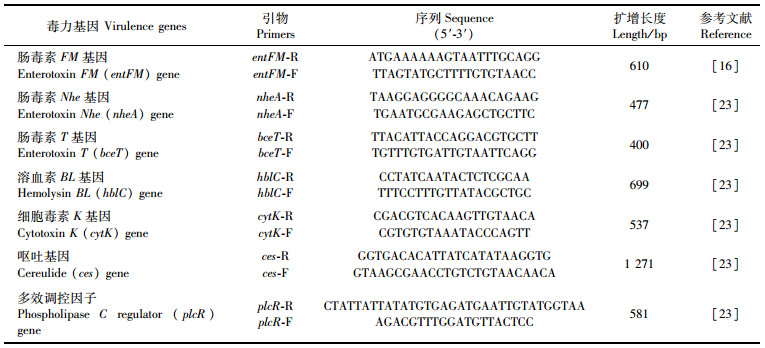
|
表 1 毒力基因的扩增引物 Tab.1 Amplification primers for virulence genes |
采用纸片扩散法[25]测定抗菌芽孢杆菌优良菌株对13种药敏纸片(杭州滨河微生物试剂有限公司)的敏感性,并根据杭州滨河微生物试剂有限公司的《纸片法药敏试验抑菌圈直径判断标准》判定其对各种抗生素的耐药性。
1.7 抗菌芽孢杆菌优良菌株对小球藻生长的影响参照张洪玉等[26]的方法将抗菌芽孢杆菌优良菌株接种到400 mL无菌营养肉汤中,在30 ℃、200 r/min条件下摇床振荡培养24 h后于4 ℃、12, 000 r/min离心10 min,弃上清,加入无菌生理盐水制成浓度为1.0×1011 CFU/mL的菌悬液,然后无菌操作将抗菌芽孢杆菌优良菌株的菌悬液分别加入100 mL无菌藻类培养基中至终浓度为0、2.0×104、2.0×105、2.0×106、2.0×107、2.0×108 CFU/mL,同时加入小球藻至终浓度为104个/mL,然后分别在25 ℃、连续均匀光照(8 000 lx)、150 r/min条件下连续培养3 d后分别取样测定663 nm处的光吸收值(A663)和645 nm处的光吸收值(A645),并根据《GB/T 21805—2008化学品藻类生长抑制试验》[13]中的公式,计算各组小球藻的叶绿素a质量浓度(C)。每个处理3个平行。
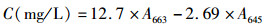 (1)
(1)
式中:A663和A645分别为样品在663 nm和645 nm处的光吸收值。
1.8 抗菌芽孢杆菌优良菌株对斑马鱼和中华绒螯蟹的致病性 1.8.1 抗菌芽孢杆菌优良菌株对斑马鱼的致病性参照陈薇等[27]的方法分析抗菌芽孢杆菌优良菌株对斑马鱼的致病性。试验设1个对照组和5个实验组,每组3个平行,分别在盛有0.1 m3标准稀释水的玻璃水族缸(22 cm×18 cm×25 cm)中放入健康斑马鱼10尾。试验组斑马鱼加入抗菌芽孢杆菌优良菌株分别至终浓度为2.0×104、2.0×105、2.0×106、2.0×107、2.0×108 CFU/mL,对照组不加任何物质。连续浸泡斑马鱼7 d,观察鱼体反应能力、游动能力和呼吸能力等,并记录各组斑马鱼的死亡数目,采用BLISS法[28]计算抗菌芽孢杆菌优良菌株对斑马鱼的半数致死浓度(LC50)。试验期间水温控制在23 ℃、DO>4 mg/L、pH为7.2。
1.8.2 抗菌芽孢杆菌优良菌株对中华绒螯蟹的致病性参照尹晓静等[15]的方法分析抗菌芽孢杆菌优良菌株对中华绒螯蟹的致病性。试验设1个对照组和5个实验组,每组3个平行,分别在盛有60 L曝气自来水的塑料水族缸(76 cm×45 cm×55 cm)中放入健康中华绒螯蟹10只,水温控制在28 ℃。试验组中华绒螯蟹参照朱越雄等[29]的方法分别在第3步足基部注射终浓度为2.0×104、2.0×105、2.0×106、2.0×107、2.0×108 CFU/g的抗菌芽孢杆菌优良菌株;对照组注射等量的无菌生理盐水。试验周期为7 d,试验期间每天记录试验中华绒螯蟹的死亡数量。采用BLISS法[28]计算抗菌芽孢杆菌优良菌株对中华绒螯蟹的半数致死浓度(LC50)。
1.9 数据分析方法实验数据以平均值±标准差(Mean±SD)表示,采用SPSS 19.0软件进行统计学分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果 2.1 抗菌芽孢杆菌优良菌株的筛选与鉴定从养殖淤泥中分离了6株抗菌芽孢杆菌,其中菌株PNB3的拮抗活性最强,其对蟹源弗氏柠檬酸杆菌C1的抑菌圈直径为18.3 mm(图 1)。通过NCBI网站中的BLASTN软件对菌株PNB3进行同源性比较,发现菌株PNB3的16S rRNA基因序列(GenBank登录号: MN900668)与GenBank数据库中地衣芽孢杆菌菌株的16S rRNA序列自然聚类,同源性达到99%以上,而且通过邻接法构建的系统发育树(图 2)进一步表明,菌株PNB3与地衣芽孢杆菌菌株LTW7(GenBank登录号:KM289130)的亲缘关系最近[21-22, 30]。此外,菌株PNB3与地衣芽孢杆菌参考菌株的生理生化特性(表 2)完全一致。结合传统的生理生化鉴定以及16S rRNA基因系统发育分析的结果,判定菌株PNB3为地衣芽孢杆菌(Bacillus licheniformis)。
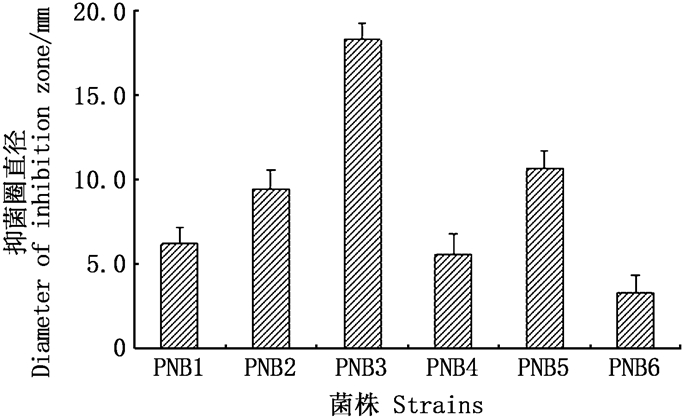
|
图 1 芽孢杆菌分离株对蟹源弗氏柠檬酸杆菌C1的抑菌圈直径 Fig. 1 Diameters of inhibition zones of Bacillus isolates against Citrobacter freundii C1 |
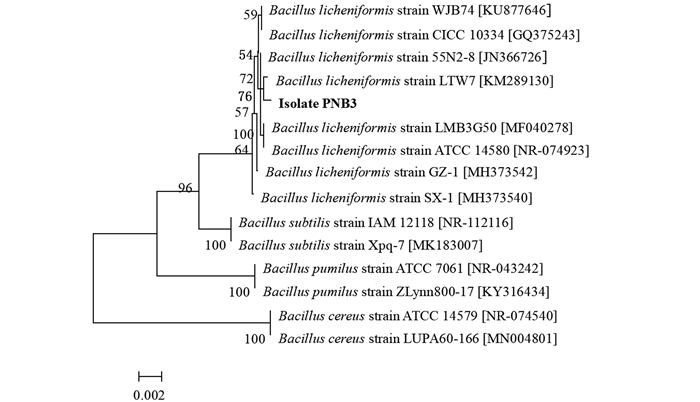
|
括号中的序号代表菌株的GenBank登录号;分支点上的数字代表bootstrap值;标尺刻度代表碱基替代率。 Sequence number in the bracket means the GenBank accession number of the strain; the number at the node means the bootstrap values; the scale bar means nucleotide substitution ratio. 图 2 基于菌株PNB3及相关菌株16S rRNA基因序列的系统发育树 Fig. 2 Phylogenetic tree based on 16S rRNA gene sequences of strain PNB3 and other related strains |

|
表 2 菌株PNB3的生理生化特征 Tab.2 Phenotypic characterization of isolate PNB3 |
实验结果(图 3)表明,菌株PNB3对弗氏柠檬酸杆菌C1具有良好的抑菌效果。弗氏柠檬酸杆菌C1与菌株PNB3共培养24、48、72、96、120 h,其浓度分别较单独培养时降低了95.56%(P<0.01)、99.52%(P<0.01)、99.88%(P<0.01)、99.98%(P<0.05)和99.99%(P<0.05),说明菌株PNB3能够显著抑制弗氏柠檬酸杆菌C1的生长。
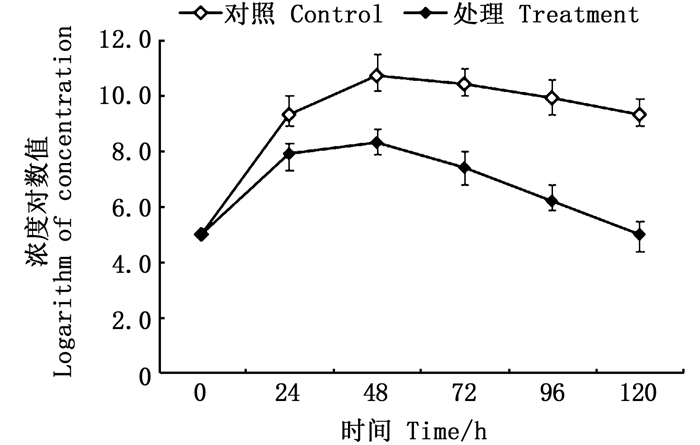
|
图 3 菌株PNB3对弗氏柠檬酸杆菌C1的抑菌效果 Fig. 3 Inhibitory effect of isolate PNB3 against Citrobacter freundii C1 |
以菌株PNB3和蜡样芽孢杆菌BYK17047的基因组DNA为模板,采用文献[16]报道的特异性引物进行PCR扩增后电泳结果见图 4。实验结果表明:菌株PNB3基因组DNA经特异性PCR扩增后,未观察到阳性电泳条带,说明菌株PNB3不含溶血素BL基因、肠毒素Nhe基因、肠毒素T基因、肠毒素FM基因、细胞毒素K基因、呕吐基因和多效调控因子等毒力基因;而对照蜡样芽孢杆菌BYK17047的基因组DNA经特异性PCR扩增后,出现了各毒力基因的特异性阳性条带,而且其毒力基因的特异性PCR扩增产物的大小与文献[23-24]报道一致,说明蜡样芽孢杆菌BYK17047携带溶血素BL基因、肠毒素Nhe基因、肠毒素T基因、肠毒素FM基因、细胞毒素K基因、呕吐基因和多效调控因子。
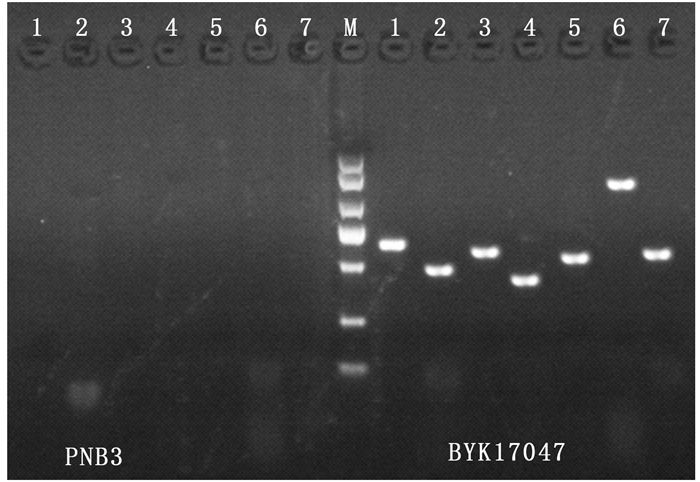
|
M. DL2 000 DNA marker;1~7. hblC、NheA、entFM、bceT、cytK、ces、plcR基因。 M. DL2 000 DNA Marker; 1-7. hblC, nheA, entFM, bceT, cytK, ces, plcR genes. 图 4 菌株PNB3毒力基因的PCR检测结果 Fig. 4 PCR detection of virulence genes from isolate PNB3 |
实验结果(表 3)表明,菌株PNB3仅对链霉素耐药,对多西环素、四环素等2种抗生素中度敏感,对复方新诺明、氨苄西林、诺氟沙星、卡那霉素、多粘菌素B、氟苯尼考、庆大霉素、依诺沙星、头孢拉定、青霉素等10种抗生素高度敏感。
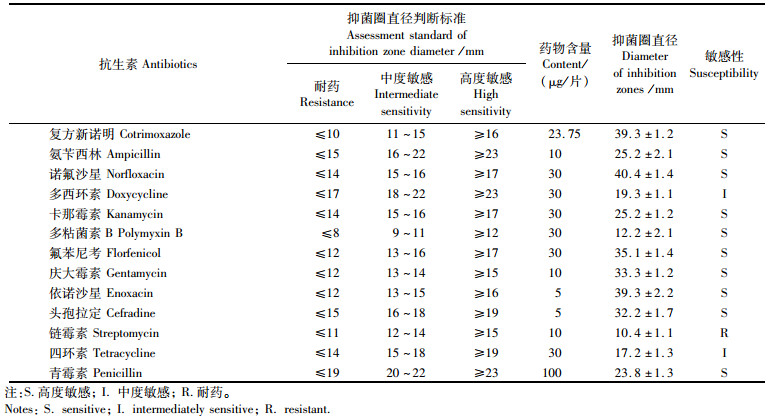
|
表 3 菌株PNB3的药敏特性 Tab.3 Antibiotic susceptibility of isolate PNB3 |
实验结果(图 5)表明,菌株PNB3在终浓度为2.0×104~2.0×108 CFU/mL时对小球藻生长没有产生抑制作用。菌株PNB3与小球藻共培养72 h,随着菌株PNB3浓度的增加,小球藻叶绿素a质量浓度分别较小球藻单独培养时升高了28.1%(P<0.01)、24.6%(P<0.05)、24.2%(P<0.05)、14.1%(P<0.05)和4.9%(P>0.05)。由此说明,菌株PNB3能够促进小球藻的生长,但随着浓度的增加,菌株PNB3对小球藻的促生长作用减弱。
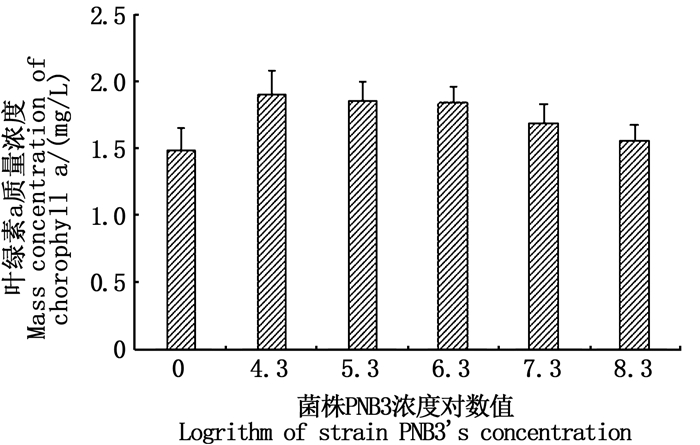
|
图 5 菌株PNB3对小球藻叶绿素a质量浓度的影响 Fig. 5 Influence of isolate PNB3 on the mass concentration of chlorophyll a from Chlorella sp. |
菌株PNB3对斑马鱼的致病性结果表明,在终浓度为2.0×104~2.0×108 CFU/mL的菌株PNB3中连续浸泡7 d,斑马鱼均生长良好,游动和呼吸能力正常,未出现鱼体侧翻、反应迟缓等不正常现象与死亡,而且对照组中的斑马鱼也生长良好,未存在死亡现象,说明菌株PNB3对斑马鱼的LC50>2.0×108 CFU/mL。此外,菌株PNB3对中华绒螯蟹致病性的结果也表明,以终浓度为2.0×104~2.0×108 CFU/g的菌株PNB3注射健康中华绒螯蟹,中华绒螯蟹摄食正常,应激敏捷,未出现附肢无力、打斗和死亡现象,而且对照组也未出现任何死亡与不正常现象,说明菌株PNB3对中华绒螯蟹的LC50>2.0×108 CFU/g。
3 讨论 3.1 地衣芽孢杆菌的鉴定目前,生理生化鉴定和16S rRNA序列分析方法是芽孢杆菌分类鉴定最常用的方法,但这2种方法依然存在缺陷:生理生化鉴定容易出现假阳性结果,而且费时费力[30];16S rRNA基因序列分析无法完全区分相似率极高的近缘种[31]。因此,将生理生化鉴定和16S rRNA序列分析方法相结合,才能使鉴定结果更可靠、更准确[32]。本实验在鉴定菌株PNB3时,结合了生理生化鉴定和16S rRNA序列分析结果,最终确定菌株PNB3为地衣芽孢杆菌。然而,本实验发现地衣芽孢杆菌不同菌株之间在生理生化特性方面具有差异性,与魏振等[33]分离的地衣芽孢杆菌在木糖、甘露醇等的发酵特性有所不同,可能与地衣芽孢杆菌菌株之间的地理差异以及生长环境条件不同有关[34]。
3.2 地衣芽孢杆菌的安全性相关研究[24, 35]表明,芽孢杆菌含有溶血素BL基因、非溶血性的肠毒素基因、肠毒素基因、细胞毒素K基因、呕吐基因和多效调控因子等多种毒力因子,能够导致刺参(Apostichopus japonicus)“腐皮综合征”[36]、鲫(Carassius auratus)体内腹腔严重出血[37]、鲤(Cyprinus carpio)鳃弓坏死症[38]、凡纳滨对虾(Litopenaeus vannamei)细菌性白斑病[39],对水产养殖动物具有潜在的安全风险。因此,毒力基因检测、致病性是评价芽孢杆菌安全性的重要内容[35-36]。本实验证实菌株PNB3不含溶血素BL基因、肠毒素Nhe基因、肠毒素T基因、肠毒素FM基因、细胞毒素K基因、呕吐基因、多效调控因子等毒力基因,这与LIU等[40]关于益生芽孢杆菌不存在毒力基因的观点相同,而且本实验人工感染试验结果也表明菌株PNB3对斑马鱼和中华绒螯蟹无致病性,根据MITTAL等[41]对菌株毒力的判定标准属于无毒菌株,具备在水产养殖中应用的安全性。此外,藻类生长抑制试验也是评价芽孢杆菌安全性的重要内容。本实验发现菌株PNB3在浓度2.0×104~2.0×108 CFU/mL时对小球藻没有毒性作用,能够促进小球藻的生长,这与张洪玉等[26]的研究结论相同。然而,本实验也发现,随着菌株PNB3浓度的增加,菌株PNB3对小球藻的促生长作用减弱,这与曹海鹏等[42]的研究发现相同,可能是因为随着浓度增大,小球藻和菌株之间形成营养竞争,从而抑制了小球藻的生长[43]。
3.3 地衣芽孢杆菌的应用价值地衣芽孢杆菌是一种水产养殖常见的益生菌,具有良好的抑菌、促生长、抗氧化免疫等功效[44]。邓书香[45]研究表明地衣芽孢杆菌对副溶血弧菌具有良好的抑制作用;刘强强等[46]证实地衣芽孢杆菌能够增强凡纳滨对虾的肝胰腺超氧化物歧化酶活性和总抗氧化能力,降低凡纳滨对虾的肝胰腺中丙二醛的含量;CAI等[47]试验表明地衣芽孢杆菌能有效促进凡纳滨对虾的生长、提高机体相关免疫酶活性和抗病力。本实验证实蟹源弗氏柠檬酸杆菌拮抗菌-地衣芽孢杆菌PNB3不含溶血素BL基因、肠毒素Nhe基因、肠毒素T基因、肠毒素FM基因、细胞毒素K基因、呕吐基因、多效调控因子等毒力基因,对复方新诺明、氨苄西林、诺氟沙星、卡那霉素、多粘菌素B、氟苯尼考、庆大霉素、依诺沙星、头孢拉定、青霉素等10种抗生素高度敏感,在终浓度为2.0×104~2.0×108 CFU/mL时对小球藻的生长有促进作用,对斑马鱼和中华绒螯蟹无致病性,是一株具有潜在安全性的弗氏柠檬酸杆菌拮抗菌,预示着地衣芽孢杆菌PNB3在防控中华绒螯蟹弗氏柠檬酸杆菌病的安全应用中具有潜在的应用价值。
| [1] |
薛巧, 赵战勤, 刘会胜, 等. 弗氏柠檬酸杆菌对动物和人致病性研究进展[J]. 动物医学进展, 2015, 36(7): 81-85. XUE Q, ZHAO Z Q, LIU H S, et al. Progress on Citrobacter freundii pathogenicity in animals and humans[J]. Progress in Veterinary Medicine, 2015, 36(7): 81-85. DOI:10.3969/j.issn.1007-5038.2015.07.018 |
| [2] |
HOSSAIN S, WIMALASENA S H M P, HEO G J. Virulence factors and antimicrobial resistance pattern of Citrobacter freundii isolated from healthy pet turtles and their environment[J]. Asian Journal of Animal and Veterinary Advances, 2017, 12(1): 10-16. |
| [3] |
阎斌伦, 张晓君, 梁利国, 等. 三疣梭子蟹病原弗氏柠檬酸杆菌的分离鉴定及定居因子抗原基因检测[J]. 水产学报, 2012, 36(3): 391-398. YAN B L, ZHANG X J, LIANG L G, et al. Detection of cfa gene and isolation and identification of the pathogen Citrobacter freundii isolated from Portunus trituberculatus[J]. Journal of Fisheries of China, 2012, 36(3): 391-398. |
| [4] |
肖宁, 孔令严, 周昊, 等. 克氏原螯虾病原弗氏柠檬酸杆菌的分离鉴定及其药敏与黏附特性[J]. 水产学报, 2016, 40(6): 946-955. XIAO N, KONG L Y, ZHOU H, et al. Isolation and identification of Citrobacter freundii from diseased Procambarus clarkii and its antibiotics susceptibility and adhesion characteristics[J]. Journal of Fisheries of China, 2016, 40(6): 946-955. |
| [5] |
杨方园, 关瑞章, 李忠琴, 等. 花鳗鲡病原菌弗氏柠檬酸杆菌的鉴定[J]. 集美大学学报(自然科学版), 2013, 18(2): 81-87. YANG F Y, GUAN R Z, LI Z Q, et al. Identification of pathogenic Citrobacter freundii isolated from Anguilla marmorata[J]. Journal of Jimei University (Natural Science), 2013, 18(2): 81-87. DOI:10.3969/j.issn.1007-7405.2013.02.001 |
| [6] |
宋文龙. 枯草芽孢杆菌微生态制剂的研制[D]. 大连: 大连工业大学, 2013. SONG W L. Preparation of the Bacillus subtilis microecological probiotics[D]. Dalian: Dalian Polytechnic University, 2013. |
| [7] |
辛美丽, 宋爱环, 王志刚, 等. 芽孢杆菌组合对海水养殖水体COD的降解效果[J]. 广西科学院学报, 2016, 32(3): 215-220. XIN M L, SONG A H, WANG Z G, et al. Study on COD degradation capability of Bacillus combinations[J]. Journal of Guangxi Academy of Sciences, 2016, 32(3): 215-220. |
| [8] |
张皎皎. 一株高产淀粉酶菌株的筛选鉴定及其应用研究[D]. 重庆: 西南大学, 2018. ZHANG J J. Screening and identification of a high amylase-producing strain and its application[D]. Chongqing: Southwest University, 2018. |
| [9] |
游龙, 韩茵, 张凯, 等. 芽孢杆菌产胞外酶的活性分析及其对凡纳滨对虾的作用[J]. 中国海洋大学学报, 2018, 48(3): 80-87. YOU L, HAN Y, ZHANG K, et al. Profiling the enzyme activities of Bacillus cultures and their dietary effects on growth and digestive enzymes of Litopenaeus vannamei[J]. Periodical of Ocean University of China, 2018, 48(3): 80-87. DOI:10.3969/j.issn.1672-335X.2018.03.012 |
| [10] |
张妙宜, 云天艳, 周登博, 等. 甲基营养型芽胞杆菌的研究进展[J]. 热带农业科学, 2017, 37(9): 66-71. ZHANG M Y, YUN T Y, ZHOU D B, et al. Research advances on Bacillus methylotrophicus[J]. Chinese Journal of Tropical Agriculture, 2017, 37(9): 66-71. |
| [11] |
田良. 仿刺参消化道中产酶菌株的筛选鉴定及其在仿刺参饲料中的应用[D]. 厦门: 集美大学, 2015. TIAN L. To select strains with higher enzyme activity from the distinguishment of A. Japonicus and its application in feed[D]. Xiamen: Jimei University, 2015. |
| [12] |
黄晓东, 周慧华, 安健, 等. 中华绒螯蟹致病性弗氏柠檬酸杆菌的分离鉴定及其药敏特性[J]. 南方农业学报, 2019, 50(7): 1613-1619. HUANG X D, ZHOU H H, AN J, et al. Isolation, identification and antibiotic susceptibility of pathogenic Citrobacter freundii from Eriocheir sinensis[J]. Journal of Southern Agriculture, 2019, 50(7): 1613-1619. DOI:10.3969/j.issn.2095-1191.2019.07.00 |
| [13] |
周红, 菅小东, 马馨, 等. GB/T 21805-2008化学品藻类生长抑制试验[S]. 北京: 中国标准出版社, 2008: 2-8. ZHOU H, JIAN X D, MA X, et al. GB/T 21805-2008 Chemicals-Alga growth inhibition test[S]. Beijing: Standards Press of China, 2008: 2-8. |
| [14] |
谢凤君, 陈惠志, 赵幼一. GB/T 13267-1991水质物质对淡水鱼(斑马鱼)急性毒性测定方法[S]. 北京: 中国标准出版社, 1992: 9-14. XIE F J, CHEN H Z, ZHAO Y Y. GB/T 13267-1991 Water quality-determination of the acute toxicity of substances to a freshwater fish (Brachydanio rerio Hamilton-Buchanan)[S]. Beijing: Standards Press of China, 1992: 9-14. |
| [15] |
尹晓静, 周静华, 王杰. 一种中华绒螯蟹病原: 腐败希瓦氏菌[J]. 水产养殖, 2019(8): 45-47. YIN X J, ZHOU J H, WANG J. A pathogen of Eriocheir sinensis: Shewanella putrefaciens[J]. Journal of Aquaculture, 2019(8): 45-47. DOI:10.3969/j.issn.1004-2091.2019.08.020 |
| [16] |
CAO H P, HE S, WEI R P, et al. Bacillus amyloliquefaciens G1:a potential antagonistic bacterium against eel-pathogenic Aeromonas hydrophila[J]. Evidence-based Complementary and Alternative Medicine, 2011, 2011: 824104. |
| [17] |
徐伟芳, 黄涛杨, 周敏, 等. 一株脂肪酶产生菌的筛选鉴定及其酶学性质研究[J]. 西南大学学报(自然科学版), 2017, 39(5): 62-69. XU W F, HUANG T Y, ZHOU M, et al. Research on screening and identification of a lipase-producing bacterial strain and its enzymatic properties[J]. Journal of Southwest University (Natural Science Edition), 2017, 39(5): 62-69. |
| [18] |
唐建中, 戴求仲, 周旺平. 两种益生芽孢杆菌体外抑菌活性及其耐药性研究[J]. 兽药与饲料添加剂, 2009, 14(5): 8-10. TANG J Z, DAI Q Z, ZHOU W P. Studies on the antimicrobial activities in vitro and drug resistances of two strains of useful bacillus[J]. Veterinary Pharmaceuticals & Feed Additives, 2009, 14(5): 8-10. |
| [19] |
LATEGAN M J, TORPY F R, GIBSON L F. Control of saprolegniosis in the eel Anguilla australis Richardson, by Aeromonas media strain A199[J]. Aquaculture, 2004, 240(1/4): 19-27. |
| [20] |
薛明洋. 草鱼肠道微生物拮抗嗜水气单胞菌研究[D]. 杨凌: 西北农林科技大学, 2018. XUE M Y. Study on the intestinal microorganisms of grass carp antagonise Aeromonas hydrophila[D]. Yangling: Northwest A&F University, 2018. |
| [21] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 43-65. DONG X Z, CAI M Y. Systematic identification manual for common bacteria[M]. Beijing: Science Press, 2001: 43-65. |
| [22] |
布坎南R E, 吉本斯N E. 伯杰细菌鉴定手册[M]. 8版. 北京: 科学出版社, 1984. Buchanan R E, Gibbons N E. Bergey's manual of determinative bacteriology[M]. 8th ed. Beijing: Science Press, 1984. |
| [23] |
王琰, 高四合, 单建杰, 等. 半滑舌鳎源蜡样芽孢杆菌毒性检测及药敏试验[J]. 水产科学, 2018, 37(1): 59-65. WANG Y, GAO S H, SHAN J J, et al. Virulence and drug susceptibility of a pathogenic bacterium from half-smooth tongue-sole[J]. Fisheries Science, 2018, 37(1): 59-65. |
| [24] |
安健, 曹海鹏, 陈百尧, 等. 解淀粉芽胞杆菌的安全性分析[J]. 动物医学进展, 2013, 34(1): 16-19. AN J, CAO H P, CHEN B Y, et al. Safety analysis of Bacillus amyloliquefaciens[J]. Progress in Veterinary Medicine, 2013, 34(1): 16-19. |
| [25] |
JOSEPH N M, SISTLA S, DUTTA T K, et al. Reliability of kirby-bauer disk diffusion method for detecting meropenem resistance among non-fermenting gram-negative bacilli[J]. Indian Journal of Pathology and Microbiology, 2011, 54(3): 556-560. |
| [26] |
张洪玉, 王海波, 杨移斌, 等. 虾源蜡样芽孢杆菌D7的生态安全性评价[J]. 浙江农业学报, 2018, 30(9): 1585-1591. ZHANG H Y, WANG H B, YANG Y B, et al. Ecological safety assessment of Bcillus cereus D7 isolated from shrimp[J]. Acta Agriculturae Zhejiangensis, 2018, 30(9): 1585-1591. |
| [27] |
陈薇, 丁祥力, 吴迎奔, 等. 水产养殖用复合微生态制剂的安全性评价[J]. 贵州农业科学, 2013, 41(2): 138-140. CHEN W, DING X L, WU Y B, et al. Security evaluation of a compound probiotics used for aquaculture[J]. Guizhou Agricultural Sciences, 2013, 41(2): 138-140. |
| [28] |
董雪红, 田敏, 季策, 等. 两种LD50计算方法对副溶血性弧菌毒力的比较研究[J]. 上海海洋大学学报, 2016, 25(1): 86-96. DONG X H, TIAN M, JI C, et al. The comparative study on the LD50 to evaluate the virulence of Vibrio parahaemolyticus using two calculation methods[J]. Journal of Shanghai Ocean University, 2016, 25(1): 86-96. |
| [29] |
朱越雄, 贡成良, 薛仁宇, 等. 中华绒螯蟹组织中一株类志贺邻单胞菌的分离与特性分析[J]. 中国微生态学杂志, 2001, 13(5): 263-264. ZHU Y X, GONG C L, XUE R Y, et al. Isolation and characteristics of Plesiomonas shigelloides from tissue of Eriocheir sinensis[J]. Chinese Journal of Microecology, 2001, 13(5): 263-264. |
| [30] |
李明振, 廖学文, 屈汶辉, 等. 一株抑菌型地衣芽孢杆菌的快速分离与鉴定及其对4株耐药致病菌的抑制作用[J]. 南京农业大学学报, 2017, 40(2): 325-331. LI M Z, LIAO X W, QU W H, et al. Rapid isolation and identification of Bacillus licheniformis with bacteriostatic ability and its antibacterial activity against four resistant pathogens[J]. Journal of Nanjing Agricultural University, 2017, 40(2): 325-331. |
| [31] |
WANG L T, LEE F L, TAI C J, et al. Comparison of gyrB gene sequences, 16S rRNA gene sequences and DNA-DNA hybridization in the Bacillus subtilis group[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(8): 1846-1850. |
| [32] |
严婉荣, 肖敏, 陈圆, 等. 芽孢杆菌基本特征、16S rRNA对比分析及特异性基因挖掘[J]. 基因组学与应用生物学, 2017, 36(11): 4686-4692. YAN W R, XIAO M, CHEN Y, et al. Comparative analysis between basic characteristics and 16S rRNA, and specific gene discovery of Bacillus[J]. Genomics and Applied Biology, 2017, 36(11): 4686-4692. |
| [33] |
魏振, 柯静, 崔荷枫, 等. 一株兔源地衣芽孢杆菌的分离鉴定及生物学特性研究[J]. 饲料工业, 2015, 36(8): 46-50. WEI Z, KE J, CUI H F, et al. Isolation and identification of an isolated Bacillus licheniformis from the rabbits and preliminary study on the effects of its probiotics[J]. Feed Industry, 2015, 36(8): 46-50. |
| [34] |
DHAKAL R, CHAUHAN K, SEALE R B, et al. Genotyping of dairy Bacillus licheniformis isolates by high resolution melt analysis of multiple variable number tandem repeat loci[J]. Food Microbiology, 2013, 34(2): 344-351. |
| [35] |
庄子慧, 何丽, 郭云昌, 等. 我国食源性蜡样芽孢杆菌毒力基因和药物敏感性研究[J]. 中国食品卫生杂志, 2013, 25(3): 198-201. ZHUANG Z H, HE L, GUO Y C, et al. Virulent gene profiles and antibiotic susceptibility of foodborne Bacillus cereus in China[J]. Chinese Journal of Food Hygiene, 2013, 25(3): 198-201. |
| [36] |
艾海新, 于晶晶, 郑方亮, 等. 刺参"腐皮综合症"致病菌LNUB415的分离及防治的初步研究[J]. 微生物学杂志, 2012, 32(2): 68-72. AI H X, YU J J, ZHENG F L, et al. Isolation and control of pathogen bacteria LNUB415 that caused "skin ulcer syndrome" on spinous sea cucumber (Apostichopus japonicus)[J]. Journal of Microbiology, 2012, 32(2): 68-72. |
| [37] |
陈丰, 黄亚冬, 孙敬锋, 等. 鲫鱼肠道蜡样芽孢杆菌的分离鉴定及生物学特征[J]. 江苏农业科学, 2019, 47(18): 191-194, 203. CHEN F, HUANG Y D, SUN J F, et al. Isolation, identification and biological characteristics of Bacillus cereus from intestine of Carassius auratus[J]. Jiangsu Agricultural Sciences, 2019, 47(18): 191-194, 203. |
| [38] |
PYCHYNSKI T, MALANOWSKA T, KOZLOWSKI M. Bacterial flora in branchionecrosis of Carp (particularly Bacillus cereus and Bacillus subtilis)[J]. Medycyna Weterynaryjna, 1981, 37(12): 742-743. |
| [39] |
崔浩. 养殖凡纳滨对虾(Litopenaeus vannamei)细菌性白斑病的发生及其病原学病理学研究[D]. 上海: 上海海洋大学, 2017. CUI H. Occurrence of bacterial white spot disease (BWSD) in cultured shrimp Litopenaeus vannamei and its etiological and pathology analysis[D]. Shanghai: Shanghai Ocean University, 2017. |
| [40] |
LIU J, FANG C H, JIANG Y L, et al. Characterization of a hemolysin gene ytjA from Bacillus subtilis[J]. Current Microbiology, 2009, 58(6): 642-647. DOI:10.1007/s00284-009-9383-1 |
| [41] |
MITTAL K R, LALONDE G, LEBLANC D, et al. Aeromonas hydrophila in rainbow trout: relation between virulence and surface characteristics[J]. Canadian Journal of Microbiology, 1980, 26(12): 1501-1503. |
| [42] |
曹海鹏, 周呈祥, 何珊, 等. 具有降解亚硝酸盐活性的解淀粉芽孢杆菌的分离与安全性分析[J]. 环境污染与防治, 2013, 35(6): 16-21. CAO H P, ZHOU C X, HE S, et al. Isolation and safety analysis of Bacillus amylolique faciens with nitrite removal activity[J]. Environmental Pollution and Control, 2013, 35(6): 16-21. |
| [43] |
任舒天, 邵蓬, 王祎哲, 等. 水生环境中微藻与细菌相互作用机制及应用研究进展[J]. 河北渔业, 2019(12): 50-53. REN S T, SHAO P, WANG Y Z, et al. Research progress and trends of mechanism and application of microalgae and bacteria in aquatic environments[J]. Hebei Fisheries, 2019(12): 50-53. |
| [44] |
苏艳莉, 孙盛明, 朱健, 等. 枯草芽孢杆菌在水产养殖中的研究进展[J]. 中国渔业质量与标准, 2016, 6(6): 32-39. SU Y L, SUN S M, ZHU J, et al. Advances of Bacillus subtilis application in aquaculture[J]. China Fishery Quality and Standards, 2016, 6(6): 32-39. |
| [45] |
邓书香. 一株水产副溶血弧菌拮抗菌筛选的研究[D]. 南京: 南京农业大学, 2015. DENG S X. Study on the selection of a bacterium strain to against Vibrio parahaemolyticus[D]. Nanjing: Nanjing Agricultural University, 2015. |
| [46] |
刘强强, 陈旭, 谢家俊, 等. 饲料或养殖水体中添加地衣芽孢杆菌对凡纳滨对虾生长性能和免疫力的影响[J]. 动物营养学报, 2017, 29(8): 2808-2816. LIU Q Q, CHEN X, XIE J J, et al. Effects of adding Baclicus lincheniformi to diet or aquaculture water on growth performance and immunity of Litopenaeus vannamei[J]. Chinese Journal of Animal Nutrition, 2017, 29(8): 2808-2816. |
| [47] |
CAI Y, YUAN W, WANG S F, et al. In vitro screening of putative probiotics and their dual beneficial effects: to white shrimp (Litopenaeus vannamei) postlarvae and to the rearing water[J]. Aquaculture, 2019, 498: 61-71. |
2. Shanghai Engineering Research Center for Aquaculture, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306, China;
4. Shanghai Qingpu Modern Agricultural Park Development Co., Ltd, Shanghai 201717, China;
5. Lianyungang City Oceanic and Fishery Development Center, Lianyungang 222000, Jiangsu, China
 2021,
Vol. 30
2021,
Vol. 30


