2. 中国水产科学研究院珠江水产研究所 农业农村部热带亚热带水产资源利用与养殖重点实验室, 广东 广州 510380
粮食安全问题一直是全球关注的焦点问题,是现代农业所面临的一大挑战。水稻是重要的粮食作物,其产量直接影响粮食安全。得益于现代农业技术的发展,稻田面积大幅度增加,但由此引发的环境问题和公共安全问题也日益突出,阻碍了水稻种植业的进一步发展,改良、提升水稻种植模式是促进水稻可持续发展的目标和方向[1-2]。为此,稻鱼共生模式进入了公共的视野。稻鱼共生(rice-fish co-culture)是将水稻种植与水产养殖相结合,使水资源和土地资源实现最大化利用的一种模式[3],被指定为"全球重要的农业遗产系统"[4]。在这一复合系统中,水稻为鱼类提供生长、生存环境和食物,鱼类摄食田间杂草及水生生物,排泄的粪便流入稻田土壤,为水稻提供生长所需的养分;同时,水稻吸收鱼类粪便作为肥料,又反过来净化了水质,相较于池塘养殖,稻田能减少鱼类排泄物带来的水环境污染,同时也提高了鱼类食用安全性[5-6]。
肠道作为机体与外界接触的第一道屏障,其结构及内部菌群组成随摄入食物和生长环境的不同会发生明显变化[7],靳雅琦等[8]研究发现摄食草粉、蚕豆和普通饲料的草鱼肠道微生物菌群有明显差异。肠道微生物是动物体重要的"微生物器官",对宿主生长发育、营养消化吸收和疾病预防都起到重要作用[9-10]。肠道中的菌群丰度与机体健康有密切关系[11]。同时,肠道血清中一些理化指标的变化可以间接反映出机体的健康状况[12]。稻田鱼的健康状况直接关系到农民的收益,进而影响稻鱼共生模式的推广。目前关于稻鱼共生模式的研究主要集中在生态环境方面,如水体[13]、土壤[14-15]、温室气体[16]等。关于肠道结构和菌群组成的变化还鲜有报道。本试验对比分析了稻田和池塘中同期养殖的鲤血清生化指标、肠道显微结构变化,运用高通量测序技术,分析稻田环境下鲤肠道菌群的变化,为分析评价鲤的健康状况提供理论基础,也为推进传统稻鱼共生模式的改进和合理化养殖提供科学依据。
1 材料与方法 1.1 试验地点概况试验地点位于广东省清远市连南瑶族自治县(112°11′49″E,24°38′15″N),该地区以传统梯田稻鱼共生模式为主。试验选取该地区3块规格接近的梯田作为稻鱼共生组,栽培品种为当地品种"象牙香占",水稻移栽前施1次基肥。在水稻移栽15 d后,每公项放养(10.0±0.5) g的鲤苗种4 500尾。在稻田附近选取1块未种植水稻的浅水池塘为对照组。2组水源相同,均是山泉流水。
1.2 试验方法 1.2.1 试验动物与饲养管理于2019年6月22日向2组池塘放养体质量为(10.0±0.5) g的鱼苗。养殖期间均不喂食、不施肥、不喷洒农药。养殖周期为3个月。
1.2.2 样品采集试验结束后,在稻田养鱼试验组和池塘对照组分别抽选15尾鲤,抽取原池水,并在池边充氧后快速带回实验室进行采样。首先,每组取5尾鲤,用抹布擦去表面水分,测量体长,称量体质量。随后,每组分别取3尾规格接近的鲤,用1 mL注射器进行尾静脉采血,装于2 mL离心管,放至4 ℃冰箱静置3 h后,在4 ℃条件下,3 500 r/min离心10 min,吸取上清液,转移至2 mL冻存管后,-80 ℃低温保存待测。另分别取3尾鲤置于冰盘进行解剖,用灭菌后的镊子剥离出肠道,剔除壁上脂肪,取0.5 cm中肠放于质量分数为4%的多聚甲醛中用于制作肠道切片。剩余肠道放于2 mL冻存管,-80 ℃冰箱低温保存用于提取肠道微生物DNA。
1.2.3 血清生化指标酶活等的测定总胆固醇(total cholesterol, TC)、甘油三酯(triglyeride, TG)、谷草转氨酶(aspartate aminotransferase, AST)、谷丙转氨酶(alanine aminotransferase, ALT)均采用全自动生化分析仪(迈瑞BS430)测定。超氧化物歧化酶(superoxide dismutase, SOD)、补体C3、补体C4、丙二醛(malondialdehyde, MDA)的含量采用南京建成生物工程研究所试剂盒进行测定。
1.2.4 肠道组织切片在取材并固定后,进行脱水透明、浸蜡包埋、切片及贴片。得到的石蜡切片进行苏木精-伊红(hematoxylin-eosin, H.E)染色,主要步骤包括脱蜡、覆水、苏木精染色、5%乙酸分化、伊红染色、脱水、滴中性树胶后封片。
1.2.5 肠道DNA提取及质量检测取出于-80 ℃保存的2组鲤的肠道组织,每份准确称取0.2 g置于2 mL离心管,采用细菌DNA提取试剂盒(MN NucleoSpin 96 Soi)提取细菌DNA,超微量紫外分光光度计测定各样品DNA浓度,1%琼脂糖凝胶电泳检测纯度,后将DNA样品送北京百迈客生物科技有限公司测序分析。
1.2.6 Illumina-HiSeq高通量测序根据16S rDNA基因的V3+V4保守区设计通用引物:338F 5′- ACTCCTACGGGAGGCAGCA-3′; 806R 5′- GGACTACHVGGGTWTCTAAT-3′。
目标区域PCR 10 μL体系:基因组DNA 50 ng,上下游引物(10 μmol/L)各0.3 μL,KOD FX Neo Buffer 5 μL,dNTP 2 μL,KOD FX Neo 0.2 μL,ddH2O补至10 μL。
PCR反应条件:95 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,共25个循环;72 ℃延伸7 min,最后4 ℃保存。已扩增的目的片段引入桥式PCR兼容引物,经Solexa PCR进一步扩增,得到的产物用1.8%琼脂糖凝胶电泳检测目标条带,后用试剂盒切胶回收和纯化,上机测序(Hiseq 2500 PE 250平台)。
1.3 统计分析 1.3.1 测序基本数据处理使用Flash软件对原始数据进行拼接,拼接得到的序列采用Trimmomatic进行质量过滤,UCHIME去除嵌合体,最终得到高质量的Tags序列。在相似性97%的水平上对序列进行聚类,以测序所有序列数的0.005%作为阈值过滤OUT。
1.3.2 物种注释分类及功能基因预测数据库选择细菌16S: Silva(Release128, http://www.arb-silva.de)采用RDP-Classifier(http://sourceforge.net/projects/rdpclassifier/)对OTU代表序列进行注释。基于OTUs和物种注释结果进行样品物种丰度及差异分析。功能基因的KEGG通路预测使用PICRUSt完成。
1.3.3 统计分析所有数据均表示为平均值±标准差(Means±SD)。数据处理在SPSS 22.0中进行,采用方差分析(ANOVA)和独立样本t检验进行分析。P<0.05表示差异显著。利用Graph Pad Prism 8及R3.6.1(ggplot2包)进行绘图。肠道组织结构高度的测量在Photoshop CC2019中进行。
2 结果 2.1 稻田环境对鲤生长特性的影响如表 1所示,养殖结束后,稻鱼共生组鲤体长和体质量均极显著高于对照组鲤体长和体质量(P<0.01)。
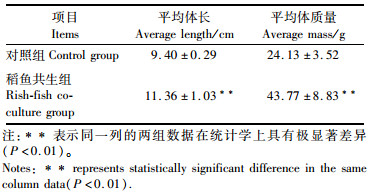
|
表 1 稻田环境对鲤生长性能的影响 Tab.1 Effect of rice field environment on growth performance of carp |
如图 1所示,与对照组相比:稻鱼共生组鲤血清中的TC、TG、补体C3和补体C4的质量分数分别提高了62.76%、38.82%、297%和9.29%,但两组间差异不显著(P>0.05);稻鱼共生组鲤ALT活性显著低于对照组(P<0.05),AST、MDA和SOD酶活性也低于对照组,分别平均降低了49.94%、30.62%和1.99%,但两组间无显著差异(P>0.05)。
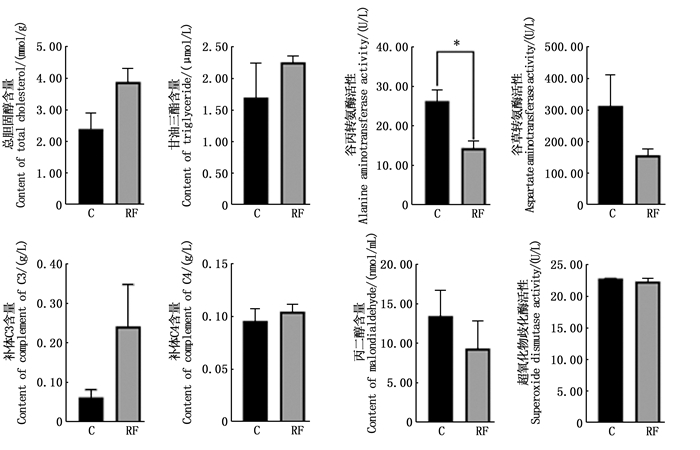
|
C.对照组;RF.稻鱼共生组;*表示两组数据在统计学上具有显著性差异(P<0.05)。 C.Control group; RF.Rice-fish co-culture group; * represents significant difference between the two groups of data (P < 0.05). 图 1 稻田环境对鲤血清生化指标及酶活性的影响 Fig. 1 Effect of paddy field environment on serum biochemical indexes and enzyme activities of common carp |
如表 2所示: 稻鱼共生组鲤中肠黏膜皱襞高度及上皮细胞高度高于对照组,但无显著差异(P>0.05);稻鱼共生组鲤中肠微绒毛高度显著低于对照组(P<0.05)。2组鲤中肠组织切片见图版,稻鱼共生组鲤中肠皱襞高而细,排列紧密, 上皮细胞区别不明显。
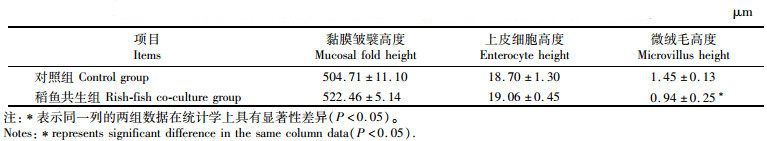
|
表 2 稻田环境对鲤中肠组织结构的影响 Tab.2 Effect of rice field environment on midgut tissue structure of common carp |
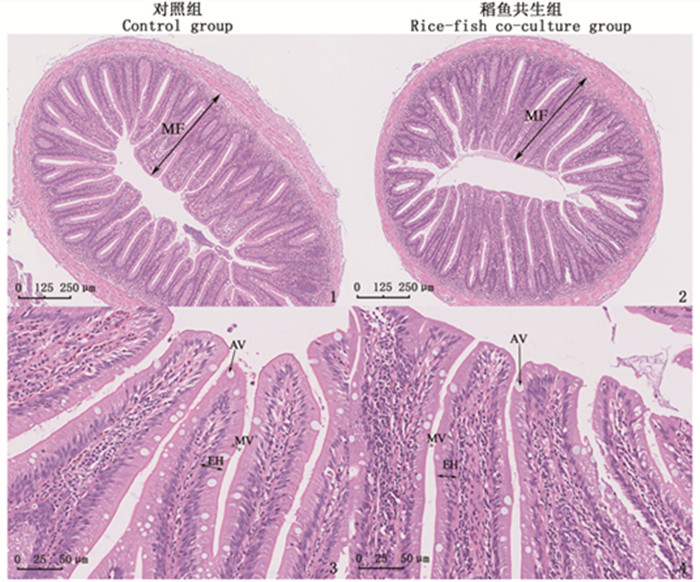
|
1和3分别为对照组鲤肠道横切面示意图;2和4为稻鱼共生组鲤肠道横切面示意图;MF.黏膜皱襞;EH.肠上皮细胞;MV.微绒毛;AV.吸收性的液泡。 1 and 3 are tissue slices of midgut of common carp within of the control group, respectively; 2 and 4 are tissue slices of midgut of common carp within the rice-fish co-culture group, respectively; MF. mucosal fold; EH. enterocyte; MV. microvillu; AV.Absorptive vacuoles. 图版 鲤中肠组织切片 Plate Tissue slices of midgut of common carp |
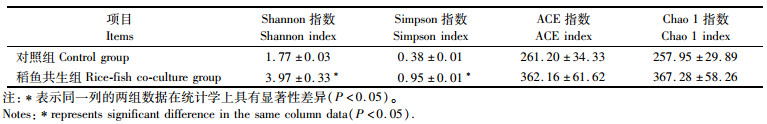
如表 3所示,稻鱼共生组鲤肠道内微生物群落Shannon指数和Simpson指数显著高于对照组(P<0.05),稻鱼共生组的ACE指数和Chao 1指数要高于对照组,但差异不显著(P>0.05)。
|
表 3 稻田环境对鲤肠道微生物菌群Alpha多样性的影响 Tab.3 Effect of rice field environment on the Alpha diversity of intestinal microbial flora of carp |
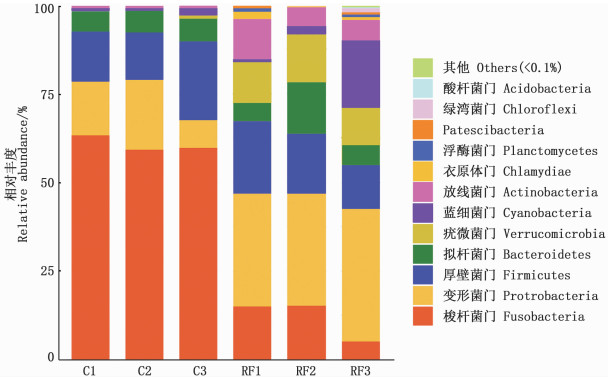
根据测序结果,6个样品在门水平上共分为16个菌门。如图 2所示,丰度超过0.1%的菌门有12个。2组样品的优势菌门均为梭杆菌门(Fusobacteria)、变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)。对照组丰度最高的3个菌门:梭杆菌门占60.56%,厚壁菌门占16.51%,变形菌门占14.27%。稻鱼共生组丰度最高的3个菌门:变形菌门占33.55%,厚壁菌门占16.67%,梭杆菌门占11.65%。与对照组相比,稻田环境显著降低了鲤肠道梭杆菌门的丰度(P<0.05),显著增高了疣微菌门和变形菌门的丰度(P<0.05)。
|
C.对照组;RF.稻鱼共生组。 C.Control group; RF.Rice-fish co-culture group. 图 2 两组鲤肠道菌群在门水平上的分布情况 Fig. 2 Distribution of intestinal microflora at the phylum level in two groups of common carp |
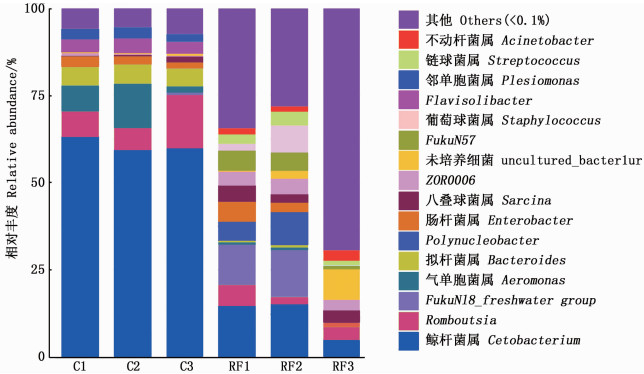
根据测序结果,6个样品在属水平上共鉴定出272个菌属,如图 3所示,丰度超过1%的有16个菌属。其中,对照组的优势菌属分别是:鲸杆菌属(Cetobacterium)占60.56%,Romboutsia占9.45%,气单胞菌属(Aeromonas)占7.34%。稻鱼共生组的优势菌属:鲸杆菌属(Cetobacterium)占11.61%,FukuN18_freshwater group占8.31%,Polynucleobacter占5.22%。
|
C.对照组;RF.稻鱼共生组。 C.Control group; RF.Rice-fish co-culture group. 图 3 两组鲤肠道菌群在属水平上的分布情况 Fig. 3 Distribution of intestinal flora at genus level in two groups of common carp |
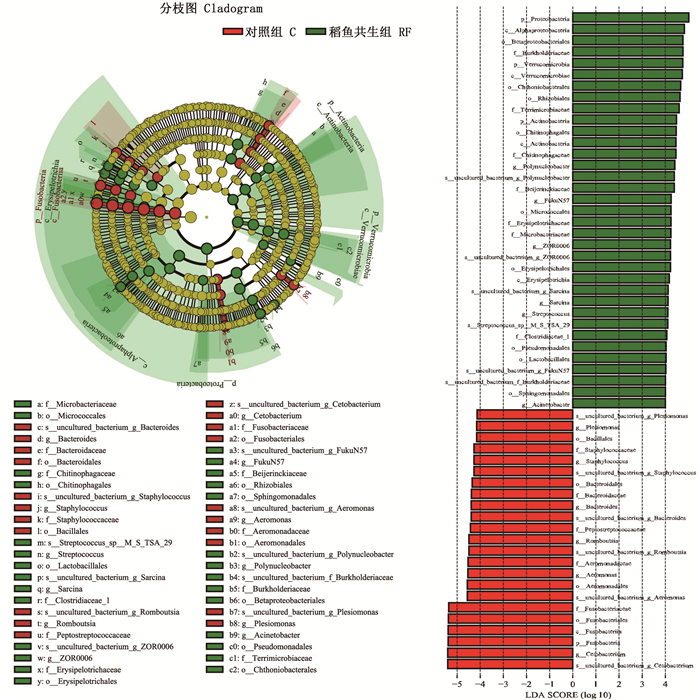
LEfSe [Line Discriminant Analysis (LDA) Effect Size] 能够在不同组间寻找具有统计学差异的菌群。图 4显示的是从门到种的LEfSe分析进化分枝图,图中右侧部分为2组间丰度存在显著差异的菌属(P<0.05),本试验LDA阈值设为4。结果显示,在属水平上,ZOR0006、Polynucleobacter、FukuN57、不动杆菌属(Acinetobacter)、八叠球菌属(Sarcina)、链球菌属(Streptococcus)在稻鱼共生组发生富集。鲸杆菌属、邻单胞菌属(Plesiomonas)、葡萄球菌属(Staphylococcus)、气单胞菌属、拟杆菌属(Bacteroides)、Romboutsia在对照组发生富集。
|
图 4 稻鱼共生组与对照组细菌丰度显著差异图 Fig. 4 Significant difference of bacterial abundance between rice-fish co-culture group and control group |
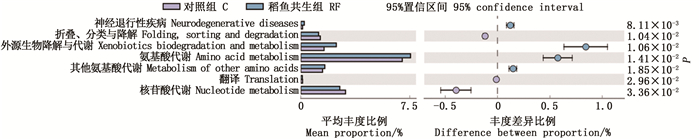
通过KEGG代谢途径的差异分析,可以观测不同组别的样品之间细菌16S群落的功能基因在代谢途径上的差异和变化如图 5所示,在二级功能分类水平上共获得了46个KEGG功能簇,占主导作用的功能有Global and overview maps、碳水化合物代谢(carbohydrate metabolism)、氨基酸代谢(amino acid metabolism)、能量代谢(energy metabolism)等与代谢及调节相关基因。其中Global and overview maps功能基因在稻鱼共生和对照组中的丰度均超过了40%,占绝对优势。图 6显示稻鱼共生组与对照组在KEGG功能基因数量上具有显著差异的通路类型。其中,稻鱼共生组在与神经退行性疾病(neurodegenerative diseases)、外源生物降解与代谢(xenobiotics biodegradation and metabolism)、氨基酸代谢、其他氨基酸代谢(metabolism of other amino acids)等相关的功能基因数量上显著高于对照组(P<0.05),在折叠、分类与降解(folding,sorting and degradation)、转录(transcription)、核苷酸代谢(nucleotide metabolism)相关的功能基因数量上显著低于对照组(P<0.05)。

|
C.对照组;RF.稻鱼共生组。 C.Control group; RF.Rice-fish co-culture group. 图 5 KEGG通路柱状图 Fig. 5 Histogram of KEGG pathway |
|
图 6 KEGG通路功能基因差异分析 Fig. 6 Functional gene difference analysis of KEGG pathway |
本试验选取杂食性鲤作为养殖对象,它能够摄食稻田中的杂草、水生动物和小型昆虫等。与对照组相比,稻鱼共生组鲤的生长性能显著提高,这可能与稻田中可获得的食物更加丰富有关[17]。
血清AST、ALT酶是诊断肝功能和损伤的重要参数,受损肝细胞的通透性增加会导致AST、ALT酶释放到血液中[18],低水平的血清AST和ALT酶活性对鱼类生长有积极作用[19]。与对照组相比,稻鱼共生组降低了血清AST和ALT酶的活性,由此推测稻田中养殖的鲤肝功能良好,该结果与其生长性能结果相吻合。与张雯等[20]关于池塘养殖鲤血清指标测定结果相比,本试验中稻鱼共生模式下的鲤血清AST和ALT含量都明显降低,这可能是由于稻鱼共生模式下水质更优[21],有利于鲤的健康生长。补体C3和C4激活后具有机体靶细胞溶解和调理作用,是鱼类抵抗微生物感染的重要成分[22]。本试验结果显示稻田环境升高了鲤血清的补体C3、C4含量,但无显著差异,可以推测稻鱼共生在一定程度上有利于增强鱼类的抗感染能力。MDA是氧化过程中最重要的产物之一,经常被用作生物样品和食品中氧化损伤的标记物[23]。稻鱼共生组鲤的血清MDA低于对照组,反映出稻田环境能够降低鱼类的氧化损伤程度。血清生化指标和酶活结果说明稻田环境在一定程度上提高了鲤的健康水平。
肠道是营养物质消化吸收的主要场所,肠道黏膜皱襞高度、上皮细胞高度、微绒毛高度是评价肠道组织形态变化的重要指标[24]。黏膜皱襞高度和微绒毛高度越高,肠道面积就越大,更利于对营养物质的吸收。稻鱼共生组在微绒毛高度上显著低于对照组,表明稻田环境不利于鲤肠道对营养物质的吸收。可以考虑在下一步稻田养殖过程中适当补充一些功能性饲料或者添加剂,或许对提升鱼类的健康状况和养殖效益更为有益。
在微生物多样性的分析研究中,常以Shannon指数、Simpson指数、ACE指数和Chao 1指数来反映样本Alpha多样性。Shannon指数越高,多样性越丰富[25]。稻田环境显著升高了肠道内微生物Shannon指数,反映出稻田中的鲤肠道菌群更加多样化。SAIKIA等[26]研究报告提出,稻田中鲤所食用的食物来源丰富,包括浮游植物、附生植物(绿藻科、蓝藻科、硅藻科)和浮游动物(枝角类、轮虫)。鱼类食物种类的增加会导致肠道微生物群落的多样化[27]。这可能是导致稻田中的鲤肠道菌群种类显著高于对照组的一个原因。此外,肠道微生物群落可辅助生物体吸收营养物质。稻田中养殖的鲤肠道微绒毛较短,对营养物质吸收能力降低。但肠道微生物群落多样性提高可以弥补宿主对营养物质的代谢和吸收,以保证营养需求,促进养殖对象的生长。本试验采用Illumination Hiseq测序技术,分析了在门和属2个水平上的物种丰度差异变化。在门水平上,稻鱼共生组的主要优势菌门为厚壁菌门和变形菌门,该结果与聂志娟等[28]对云南哈尼梯田稻田鲤的肠道微生物菌群分析结果一致。此外,稻田环境显著增高了鲤肠道疣微菌门和变形菌门的丰度,二者主要出现在水和土壤环境中[29-30]。在水稻生长各阶段,根际微生物中都包含较多的变形菌门和疣微菌门[31-32],WU等[33]的研究报告显示草鱼肠道内容物中的细菌群落与养殖水体和沉积物中的细菌群落最为相似。由此推测稻鱼共生组的鲤因其生活在稻田中,变形菌门和疣微菌门细菌可通过鲤拱泥摄食进入鱼体肠道。CAHILL[34]的研究认为鱼类肠道中的微生物部分来自其生活环境,本研究在稻鱼共生模式下进一步证实了这个结论。本试验中稻鱼共生组鲤梭杆菌门相对丰度显著降低,与石焱等[35]对水雍菜浮床养殖模式下黄颡鱼肠道菌群的分析结果一致。在属水平上,鲸杆菌属是梭杆菌纲下的肠道有益菌属,RAMÍREZ等[36]研究发现,在缺氧水域条件下,鱼类肠道中鲸杆菌属丰度更高,本研究中稻田环境显著降低了鲸杆菌属的丰度,究其原因可能是稻田水体环境中溶氧更充足。气单胞菌属[37]、邻单胞菌属和拟杆菌属[38]包含许多条件致病菌,本试验中稻鱼共生模式显著降低了此类条件致病菌属的丰度,推测由于水稻根部通过吸收利用鱼类粪便,从而净化了稻田鲤生长的水体环境,进而减少了条件致病菌的滋生。稻鱼共生组相对丰度小于1%但能被检出的菌属超过40%,远高于对照组,非优势菌属的差异也更加显著,这与微生物多样性结果一致,推测这可能与稻田复杂的摄食环境和所施基肥有关。
对KEGG通路结果进行分析,发现稻鱼共生模式下,肠道细菌代谢活动十分活跃。有研究表明细菌在消化道中的生存活动依赖于饮食和宿主衍生的蛋白质及氨基酸,与此同时,肠道内菌群代谢活动也可能影响宿主氨基酸稳态及健康水平[39]。肠道氨基酸代谢为肠黏膜细胞和肠腔内微生物合成蛋白质、氨基酸、谷胱甘肽、多胺、提供氮源和碳骨架,并在调节肠道内微生物多样性方面发挥重要作用[40]。稻田环境显著提高了鲤肠道氨基酸代谢和其他氨基酸代谢通路的功能基因丰度,这可能是由于稻田环境为鲤提供了富含蛋白质及氨基酸的食物,为加快新陈代谢,含氨基酸代谢功能基因最多的放线菌门(13.87%)菌群增多,进而维持宿主氨基酸稳态与健康。此外,KEGG注释结果分析发现在变形菌门中含有最丰富的参与外源生物降解与代谢的功能基因(5.44%),功能基因预测结果与物种在门水平的相对丰度结果一致。核苷酸代谢也是能量代谢的一部分,苗新[41]研究发现,饲料中添加核苷酸能够改善大黄鱼消化道形态,提高小肠微绒毛高度。稻田环境显著降低了鲤肠道核苷酸代谢功能基因丰度,推测由于核苷酸代谢水平降低,核苷酸合成受到抑制,从而缩短了肠道微绒毛高度,与本试验中肠道显微结构部分的结果一致。
| [1] |
ALLEN P. Facing food security[J]. Journal of Rural Studies, 2013, 29: 135-138. DOI:10.1016/j.jrurstud.2012.12.002 |
| [2] |
NAYAK P K, NAYAK A K, PANDA B B, et al. Ecological mechanism and diversity in rice based integrated farming system[J]. Ecological Indicators, 2018, 91: 359-375. DOI:10.1016/j.ecolind.2018.04.025 |
| [3] |
XIE J, WU X, TANG J J, et al. Conservation of traditional rice varieties in a Globally Important Agricultural Heritage System (GIAHS): rice-fish co-culture[J]. Agricultural Sciences in China, 2011, 10(5): 754-761. DOI:10.1016/S1671-2927(11)60059-X |
| [4] |
LU J B, LI X. Review of rice-fish-farming systems in China-one of the Globally Important Ingenious Agricultural Heritage Systems (GIAHS)[J]. Aquaculture, 2006, 260(1/4): 106-113. |
| [5] |
FREI M, BECKER K. A greenhouse experiment on growth and yield effects in integrated rice-fish culture[J]. Aquaculture, 2005, 244(1/4): 119-128. |
| [6] |
XIE J, HU L L, TANG J J, et al. Ecological mechanisms underlying the sustainability of the agricultural heritage rice-fish coculture system[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(50): E1381-E1387. DOI:10.1073/pnas.1111043108 |
| [7] |
WANG N, JIANG M, ZHANG P J, et al. Amelioration of Cd-induced bioaccumulation, oxidative stress and intestinal microbiota by Bacillus cereus in Carassius auratus gibelio[J]. Chemosphere, 2020, 245: 125613. DOI:10.1016/j.chemosphere.2019.125613 |
| [8] |
靳雅琦, 郁二蒙, 张凯, 等. 三种饵料对草鱼血清酶活性和肠道组织结构及细菌菌群的影响[J]. 农业生物技术学报, 2019, 27(9): 1652-1663. JIN Y Q, YU E M, ZHANG K, et al. Effects of three feeds on serum enzyme activity, intestinal structure and bacterial flora of Ctenopharyngodon idellus[J]. Journal of Agricultural Biotechnology, 2019, 27(9): 1652-1663. |
| [9] |
LU L, LUO T, ZHAO Y, et al. Interaction between microplastics and microorganism as well as gut microbiota: a consideration on environmental animal and human health[J]. Science of the Total Environment, 2019, 667: 94-100. DOI:10.1016/j.scitotenv.2019.02.380 |
| [10] |
MACFARLANE G T, MACFARLANE S. Human Colonic Microbiota: ecology, physiology and metabolic potential of intestinal bacteria[J]. Scandinavian Journal of Gastroenterology, 1997, 32(S222): 3-9. |
| [11] |
DAI Z L, WU G Y, ZHU W Y. Amino acid metabolism in intestinal bacteria: links between gut ecology and host health[J]. Frontiers in Bioscience, 2011, 16: 1768-1786. DOI:10.2741/3820 |
| [12] |
张振男, 郁二蒙, 谢骏, 等. 不同脆化阶段草鱼肠道菌群动态变化、血清酶指标及生长性能[J]. 农业生物技术学报, 2015, 23(2): 151-160. ZHANG Z N, YU E M, XIE J, et al. Intestinal microflora dynamic change, serum enzyme and growth performance of the grass carp (Ctenopharyngodon idellus) at different stages of feeding broad bean (Vicia faba)[J]. Journal of Agricultural Biotechnology, 2015, 23(2): 151-160. DOI:10.3969/j.issn.1674-7968.2015.02.002 |
| [13] |
赵翔刚. 稻田养殖沙塘鳢对稻田微生物、水质及大米性状的影响[D]. 上海: 上海海洋大学, 2016: 24-32. ZHAO X G. Influence of the cultured Odontobutis obscurus to the microbial community、water quality and rice traits in rice-fish system[D]. Shanghai: Shanghai Ocean University, 2016: 24-32. |
| [14] |
安辉. 不同稻蟹生产模式土壤有机碳特征及综合效益的研究[D]. 沈阳: 沈阳农业大学, 2012: 23-47. AN H. Study on the carbon properties of soil and benefits of different rice-crab production modes[D]. Shenyang: Shenyang Agricultural University, 2012: 23-47. |
| [15] |
佀国涵, 彭成林, 徐祥玉, 等. 稻虾共作模式对涝渍稻田土壤理化性状的影响[J]. 中国生态农业学报, 2017, 25(1): 61-68. SI G H, PENG C L, XU X Y, et al. Effect of integrated rice-crayfish farming system on soil physico-chemical properties in waterlogged paddy soils[J]. Chinese Journal of Eco-Agriculture, 2017, 25(1): 61-68. |
| [16] |
LI F B, FENG J F, ZHOU X Y, et al. Impact of rice-fish/shrimp co-culture on the N2O emission and NH3 volatilization in intensive aquaculture ponds[J]. Science of the Total Environment, 2019, 655: 284-291. DOI:10.1016/j.scitotenv.2018.10.440 |
| [17] |
ROTHUIS A J, VROMANT N, XUAN V T, et al. The effect of rice seeding rate on rice and fish production, and weed abundance in direct-seeded rice-fish culture[J]. Aquaculture, 1999, 172(3/4): 255-274. |
| [18] |
SUÁREZ M D, TRENZADO C E, GARCíA-GALLEGO M, et al. Interaction of dietary energy levels and culture density on growth performance and metabolic and oxidative status of rainbow trout (Oncorhynchus mykiss)[J]. Aquacultural Engineering, 2015, 67: 59-66. DOI:10.1016/j.aquaeng.2015.06.001 |
| [19] |
HOSEINI S M, MIRGHAED A T, IRI Y, et al. Effects of dietary cineole administration on growth performance, hematological and biochemical parameters of rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2018, 495: 766-772. DOI:10.1016/j.aquaculture.2018.06.073 |
| [20] |
张雯, 钟雷, 李南充, 等. 微生态制剂对池养建鲤体成分、血清指标、消化酶活性以及肠道菌群组成的影响[J]. 水产科学, 2015, 34(12): 741-749. ZHANG W, ZHONG L, LI N C, et al. Effects of probiotics on body composition, serum biochemical parameters, digestive enzyme activity and intestinal flora of juvenile Jian Carp (Cyprinus carpio var. Jian)[J]. Fisheries Science, 2015, 34(12): 741-749. |
| [21] |
秦琳, 刘耀斌, 李凤博, 等. 稻鱼共作对养殖池塘沉积物-水界面微观剖面理化性质的影响[J]. 中国水稻科学, 2016, 30(6): 647-652. QIN L, LIU Y B, LI F B, et al. Impacts of rice-fish co-culture on the physical and chemical variables of the microprofiles at sediments-water interface in an intensive-culture pond[J]. Chinese Journal of Rice Science, 2016, 30(6): 647-652. |
| [22] |
郇志利, 毛盼, 何蓝波, 等. 黄鳝SOD, AKP, 补体C3、C4组织分布研究[J]. 盐城工学院学报(自然科学版), 2012, 25(2): 56-59, 69. HUAN Z L, MAO P, HE L B, et al. Tisssue distribution of the superoxide dismutase, phosphatases and complement components in monopterus ablus[J]. Journal of Yancheng Institute of Technology (Natural Science Edition), 2012, 25(2): 56-59, 69. DOI:10.3969/j.issn.1671-5322.2012.02.015 |
| [23] |
MENDES R, CARDOSO C, PESTANA C. Measurement of malondialdehyde in fish: A comparison study between HPLC methods and the traditional spectrophotometric test[J]. Food Chemistry, 2009, 112(4): 1038-1045. DOI:10.1016/j.foodchem.2008.06.052 |
| [24] |
郭斌, 梁萌青, 徐后国, 等. 江蓠、浒苔、藻渣和菌渣替代鱼粉对大菱鲆幼鱼生长性能、血清和肝脏生化指标、体组成和肠道组织结构的影响[J]. 动物营养学报, 2018, 30(1): 299-312. GUO B, LIANG M Q, XU H G, et al. Effects of Gracilaria verrucosa, Enteromorpha prolifera, algae residue and fungi residue on growth performance, serum and liver biochemical indices, body composition and intestinal histological morphology of juvenile turbot (Scophthalmus maximus L.)[J]. Chinese Journal of Animal Nutrition, 2018, 30(1): 299-312. DOI:10.3969/j.issn.1006-267x.2018.01.036 |
| [25] |
SMITH B, WILSON J B. A consumer's guide to evenness indices[J]. Oikos, 1996, 76(1): 70-82. DOI:10.2307/3545749 |
| [26] |
SAIKIA S K, DAS D N. Feeding ecology of common carp (Cyprinus carpio L.) in a rice-fish culture system of the Apatani plateau (Arunachal Pradesh, India)[J]. Aquatic Ecology, 2009, 43(2): 559-568. DOI:10.1007/s10452-008-9174-y |
| [27] |
孟晓林, 李文均, 聂国兴. 鱼类肠道菌群影响因子研究进展[J]. 水产学报, 2019, 43(1): 143-155. MENG X L, LI W J, NIE G X. Effect of different factors on the fish intestinal microbiota[J]. Journal of Fisheries of China, 2019, 43(1): 143-155. |
| [28] |
聂志娟, 李非凡, 赵文武, 等. 哈尼梯田稻鲤共作模式下的微生物群落结构[J]. 水产学报, 2020, 44(3): 469-479. NIE Z J, LI F F, ZHAO W W, et al. Microbial community structure of the rice-carp co-culture systems in Hani Terraces[J]. Journal of Fisheries of China, 2020, 44(3): 469-479. |
| [29] |
LEE K C, WEBB R I, JANSSEN P H, et al. Phylum Verrucomicrobia representatives share a compartmentalized cell plan with members of bacterial phylum Planctomycetes[J]. BMC Microbiology, 2009, 9: 5. DOI:10.1186/1471-2180-9-5 |
| [30] |
黄红丽, 周永健, 郑啼婴, 等. 肠道菌群在非酒精性脂肪性肝病大鼠中的变化及意义[J]. 广东医学, 2016, 37(9): 1283-1286. HUANG H L, ZHOU Y J, ZHENG T Y, et al. Changes of intestinal flora in rats with non-alcoholic fatty liver disease and its significance[J]. Guangdong Medical Journal, 2016, 37(9): 1283-1286. |
| [31] |
WU Z H, LIU Q S, LI Z Y, et al. Environmental factors shaping the diversity of bacterial communities that promote rice production[J]. BMC Microbiology, 2018, 18: 51. DOI:10.1186/s12866-018-1174-z |
| [32] |
张静, 可文静, 刘娟, 等. 不同深度土壤控水对稻田土壤微生物区系及细菌群落多样性的影响[J]. 中国生态农业学报, 2019, 27(2): 277-285. ZHANG J, KE W J, LIU J, et al. Influence of water controlling depth on soil microflora and bacterial community diversity in paddy soil[J]. Chinese Journal of Eco-Agriculture, 2019, 27(2): 277-285. |
| [33] |
WU S G, WANG G T, ANGERT E R, et al. Composition, diversity, and origin of the bacterial community in grass carp intestine[J]. PLoS One, 2012, 7(2): e30440. DOI:10.1371/journal.pone.0030440 |
| [34] |
CAHILL M M. Bacterial flora of fishes: a review[J]. Microbial Ecology, 1990, 19(1): 21-41. DOI:10.1007/BF02015051 |
| [35] |
石焱, 马徐发, 吴志新, 等. 水雍菜浮床养殖模式下黄颡鱼肠道菌群结构分析[J]. 华中农业大学学报, 2016, 35(2): 69-76. SHI Y, MA X F, WU Z X, et al. Intestinal microbial communities of yellow catfish (Pseudobagrus fulvidraco) in pond with Ipomoea aquatica forsk planted on artificial floating beds[J]. Journal of Huazhong Agricultural University, 2016, 35(2): 69-76. |
| [36] |
RAMÍREZ C, CORONADO J, SILVA A, et al. Cetobacterium is a major component of the microbiome of giant Amazonian fish (Arapaima gigas) in Ecuador[J]. Animals, 2018, 8(11): 189. DOI:10.3390/ani8110189 |
| [37] |
彭开松, 佘锐萍. 彩虹鲷致病性嗜温气单胞菌的分离鉴定与药敏试验[J]. 中国兽医杂志, 2005, 41(1): 54-56. PENG K S, SHE R P. Isolation, identification and drug sensitivity test of pathogenic Aeromonas thermophilafrom Sparus macrocephalus[J]. Chinese Journal of Veterinary Medicine, 2005, 41(1): 54-56. DOI:10.3969/j.issn.0529-6005.2005.01.025 |
| [38] |
刘红柏, 张颖, 杨雨辉, 等. 5种中草药作为饲料添加剂对鲤肠内细菌及生长的影响[J]. 大连水产学院学报, 2004, 19(1): 16-20. LIU H B, ZHANG Y, YANG Y H, et al. Effects of five Chinese herb medicines as additive in feed on the growth and intestinal microflora in common carp (Cyprinus carpio)[J]. Journal of Dalian Fisheries University, 2004, 19(1): 16-20. DOI:10.3969/j.issn.1000-9957.2004.01.004 |
| [39] |
NEIS E P J G, DEJONG C H C, RENSEN S S. The role of microbial amino acid metabolism in host metabolism[J]. Nutrients, 2015, 7(4): 2930-2946. DOI:10.3390/nu7042930 |
| [40] |
伍国耀. 小肠氨基酸的代谢: 动物营养的新视角[J]. 饲料工业, 2011, 32(22): 52-58. WU G Y. Metabolism of amino acids in small intestine: a new perspective of animal nutrition[J]. Feed Industry, 2011, 32(22): 52-58. DOI:10.3969/j.issn.1001-991X.2011.22.015 |
| [41] |
苗新. 大黄鱼对豆粕和双低菜粕的耐受性研究[D]. 青岛: 中国海洋大学, 2014: 61-62. MIAO X. Studies on the tolerance of large yellow croaker (Larimichthys croceus) to dietary soybean meal and canola meal[D]. Qingdao: Ocean University of China, 2014: 61-62. |
2. Key Laboratory of Tropical & Subtropical Fishery Resource Application and Cultivation, Ministry of Agriculture and Rural Affairs, Pearl River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510380, Guangdong, China
 2021,
Vol. 30
2021,
Vol. 30


