2. 中国水产科学研究院黑龙江水产研究所农业农村部水产基因组学重点实验室, 黑龙江 哈尔滨 150070;
3. 上海海洋大学水产动物遗传育种中心上海市协同创新中心, 上海 201306
镜鲤疱疹病毒Ⅲ型(Cyprinid herpesvirus 3, CyHV-3)是由锦鲤疱疹病毒(Koi Herpesvirus, KHV)引起的鲤和锦鲤(Cyprinus carpio) 传染并致死性病毒,是一种在鲤和锦鲤中常见的致命疾病的病原。CyHV-3的基因组是295 kb的线性双链DNA分子,编码156个潜在的蛋白质开放阅读框(ORF), 包含其中8个末端重复ORF, 是基因组最大的疱疹病毒[1]。CyHV-3主要感染锦鲤和普通鲤及其变种,死亡率高达75%~ 95%[2], 严重地威胁了鲤和锦鲤养殖业的发展。
目前,人们对于该病毒的研究,在基因水平上主要以TK(thymidine kinase)和ORF72为标志基因。TK[3]是参与核苷酸合成的重要病毒产物,是一种参与DNA合成所必需的核苷酸代谢的酶,由大多数疱疹病毒和其他DNA病毒编码,包括非洲猪瘟病毒(ASFV)、牛痘病毒(VACV)和几种痘病毒[4-5]。ORF72基因属于GIY-YIG核酸内切酶家族,有研究[6]报道推测其与病毒DNA的复制有关。TU等[7]、ZHANG等[8]、OUYANG等[9]和柯浩等[10]对CyHV-3病毒进行了广泛的研究,其中对CyHV-3的衣壳蛋白进行了详细阐述,研究表明,ORF72单克隆抗体可以作为免疫组织临床样本检测中CyHV-3的诊断工具[11]。因此本研究选择CyHV-3的胸腺嘧啶核苷激酶TK、衣壳蛋白ORF72为目的基因,研究病毒感染后在鱼体内病毒的表达情况。
2001年,鲤疱疹病毒在我国首次暴发后,次年入侵台湾以及广东地区,造成了大量鲤、锦鲤死亡[12], 死亡率高达80%~100%[13-14]。2008年我国将锦鲤疱疹病毒病(KHVD)列为必须报告的疾病[15]。对此,国内外开展了不同疾病的抗病新品种选育的研究,白珊珊等[16]进行了CyHV-3感染镜鲤选育世代免疫基因表达及抗病能力比较的研究,表明F3的病毒载量显著高于F1、F2(P < 0.05), 而F2高于F1但两者间无显著性差异(P > 0.05), 说明F3抗病性状已经处于一个稳定的状态[16]。在F3的基础上,目前已经选育到了F4, 通过病毒感染实验表明F4抗病性能已达到稳定,但目前对于病毒感染后,在机体内病毒的表达模式及选育对病毒表达的作用并不清楚,且未见选育种在抗病性状上选育达到一个稳定阶段的相关研究,所以本研究应用镜鲤F4抗病品系作为实验对象,利用TK和ORF72这2个病毒基因进行抗病品系F4在不同感染阶段病毒表达量的研究,并分析其抗病选育效果及病毒表达模式,以期为其他鱼类抗病毒选育提供理论指导。
1 材料与方法 1.1 实验材料本研究所用实验鱼为德国镜鲤抗病选育品系F4和未选育德国镜鲤,均来自中国水产科学研究院黑龙江水产研究所宽甸水产试验站。
1.2 实验设计攻毒分为选育组和未选育组,所用实验鱼体长为10~15 cm, 体质量为(72.13±10.30)g, 在大小为1.6 m×1.2 m×0.6 m的水箱中各投放300尾鱼,水温保持在25 ℃, 并每天以3%体质量喂食。
1.3 实验样品采集待实验鱼进入水箱稳定后,攻毒实验按照ADAMEK等[17]的方法,将养殖场中所采集的携带病毒个体的内脏组织,进行液氮研磨后平均投放至2组实验鱼中,进行攻毒感染实验。攻毒实验开始后每24 h进行脾、肾组织的样品采集,直至鱼停止死亡,其中选育组与未选育组均在144 h达到死亡高峰,选育组成活率87.3%、未选育组成活率62.3%。分别采集选育组、未选育组中实验鱼的脾脏和肾脏,各采集3尾,且每组设2个平行,采集样品用于RNA提取。所有采集样本的内脏组织均立即储存在RNAlater中,在4 ℃下12 h之后储存在-20 ℃冰箱,之后转移至实验室-80 ℃超低温冰箱中保存备用。
1.4 实验方法利用实时荧光定量PCR技术,以18S RNA为内参基因,用OIE推荐的CyHV-3的衣壳蛋白ORF72(Capsid triplex protein ORF72)[18]和胸腺嘧啶核苷激酶TK(Thymidine kinase)[3]为目的基因,比较选育组与未选组鱼CyHV-3病毒感染后不同阶段表达量的变化趋势。
使用Applied Biosystems 7300仪器(Applied Biosystems, USA)和Fast Start Universal SYBR Green Master(ROX)(Roche Diagnostics GmbH, Germany)进行PCR反应。所有引物均由生工生物工程(上海)有限公司提供,引物信息见表 1, 实时荧光定量PCR反应体系为25 μL, 2×UItra SYBR Mixture (highROX)12.5 μL, 上游引物(10 μmol/L)0.5 μL, 下游引物(10 μmol/L)0.5 μL, 基因组RNA 1 μL/cDNA 0.5 μL, ddH2O补足25 μL。PCR程序:预变性95 ℃, 5 min; 94 ℃, 变性30 s; 56 ℃/63 ℃, 退火30 s; 72 ℃, 延伸30 s, 30~35个循环;72 ℃后延伸5 min, 4 ℃终止反应。

|
表 1 荧光定量PCR引物 Tab.1 Primers used in quantitative real-time PCR |
使用2-ΔΔCt法[19]处理荧光定量实验数据计算出相对表达量。使用SPSS 17.0软件单因素方差分析(One-Way ANOVA)进行显著性差异分析。
2 结果 2.1 不同感染阶段病毒表达情况在人工攻毒感染实验采集的样品中,脾、肾组织中均检测到了病毒基因的表达。在脾、肾组织中,选育组TK基因和ORF72基因的表达量在24~144 h均呈现上升趋势,144~288 h呈现下降趋势。
在脾组织中,选育组TK基因和ORF72基因在144 h与120、168 h相比,病毒的表达量达到了显著性差异水平(P < 0.05), 见图 1a和b; 未选育组TK基因和ORF72基因在144 h与120、168 h相比,病毒的表达量达到了极显著差异(P < 0.01), 见图 1c和d。
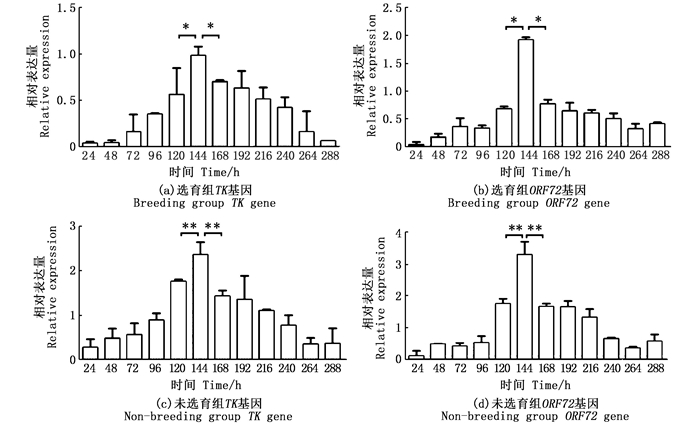
|
标记*不同表示组内存在显著性差异(*P < 0.05, **P < 0.01)。 Marked * indicates significant differences within groups (*P < 0.05, * * P < 0.01). 图 1 不同感染阶段脾组织中TK基因和ORF72基因相对表达情况 Fig. 1 Relative expression of TK gene and ORF72 gene in spleen tissue at different infection stages |
在肾组织中,选育组和未选育组的TK基因在144 h与120、168 h相比病毒的表达量达到了显著性差异的水平(P < 0.05), 见图 2a和c; 选育组和未选育组的ORF72基因在144 h与120、168 h相比,病毒的表达量达到了极显著差异(P < 0.01), 见图 2b和d。
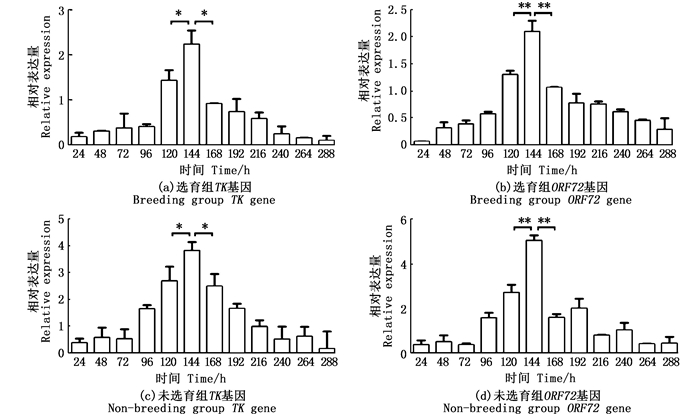
|
标记*不同表示组内存在显著性差异(*P < 0.05, **P < 0.01)。 Marked * indicates significant differences within groups (*P < 0.05, * * P < 0.01). 图 2 不同感染阶段肾组织中TK基因和ORF72基因相对表达情况 Fig. 2 Relative expression of TK gene and ORF72 gene in kidney tissue at different infection stages |
将TK基因和ORF72基因脾、肾组织病毒的表达量进行对比,2个基因的脾组织的病毒表达量总体趋势较肾组织低,且均在96、120、144 h具有显著性差异。
在选育组中,TK基因的表达量在96 h脾组织显著低于肾组织(P < 0.05), 在120、144 h差异达到极显著水平(P < 0.01), 见图 3a; ORF72基因的表达量在96、144 h这2个感染时期,脾组织显著低于肾组织(P < 0.05), 其中在120 h达到差异极显著(P < 0.01), 见图 3b。
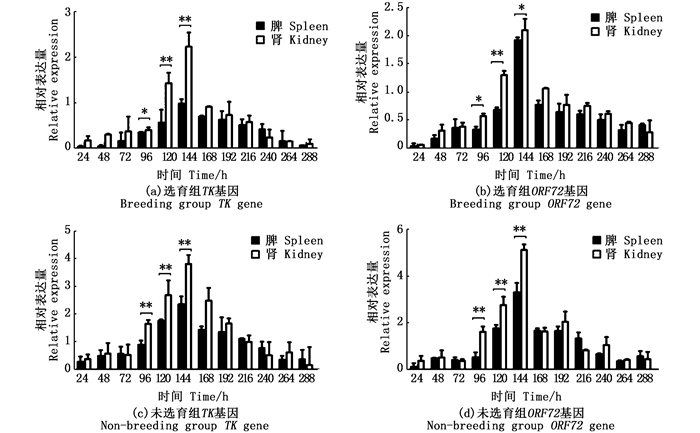
|
标记*不同表示组内存在显著性差异(*P < 0.05, **P < 0.01)。 Marked * indicates significant differences within groups (*P < 0.05, * * P < 0.01). 图 3 对比不同感染阶段不同组别脾、肾组织中TK基因和ORF72基因相对表达情况 Fig. 3 Comparison of relative expression of TK gene and ORF72gene in spleen and kidney tissue at different infection stages |
在未选育组中,TK基因和ORF72基因的表达量均在96、120、144 h这3个感染时期,脾组织极显著低于肾组织(P < 0.01), 见图 3c和d。
2.3 选育组与未选育组病毒表达量比较将TK基因和ORF72基因选育组和未选育组比较,在脾、肾组织中2个基因在选育组的病毒表达量均低于未选育组。
在脾组织中,TK基因在96、120、144、168 h选育组表达量相比未选育组,差异极显著(P < 0.01), 见图 4a; ORF72基因在96、120、144、168、192、216 h选育组表达量极显著低于未选育组(P < 0.01), 见图 4b。
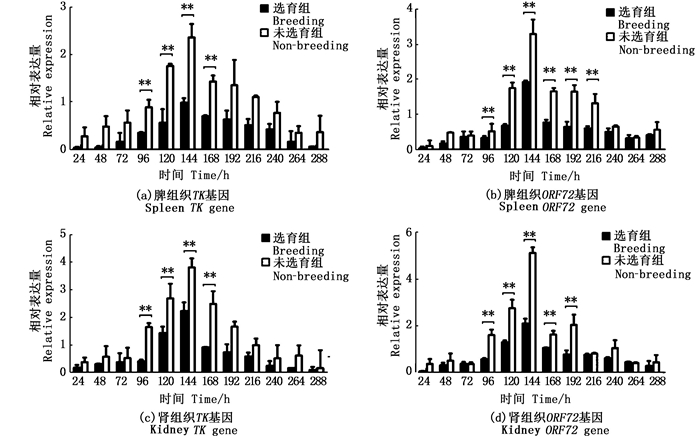
|
标记*不同表示组内存在显著性差异(*P < 0.05, **P < 0.01)。 Marked * indicates significant differences within groups (*P < 0.05, * * P < 0.01). 图 4 对比不同感染阶段脾、肾组织中TK基因和ORF72基因在两组中相对表达情况 Fig. 4 Comparison of relative expression of TK gene and ORF72 gene in spleen and kidney tissues at different infection stages in two kinds of fish |
在肾组织中,TK基因在96、120、144、168 h选育组表达量相比未选育组,差异极显著(P < 0.01), 见图 4c; ORF72基因在96、120、144、168、192 h选育组表达量相比未选育组,差异极显著(P < 0.01), 见图 4d。
3 讨论 3.1 TK基因和ORF72基因病毒表达量比较目前TK基因和ORF72基因都是对病毒进行研究的标志基因。SANFORD等[4]用TK基因研究得出,TK基因缺失的突变体通常具有复制缺陷性,并且不会因体内神经元组织的潜伏期而重新激活,TK基因通过影响原发性、急性感染以及潜伏感染的建立和再激活期间的病毒特性,因此TK基因可以随着病毒表达量升高而升高。ORF72基因属于GIY-YIG核酸内切酶家族,有研究[6]推测其与病毒DNA的复制有关。王世会等[18]通过克隆锦鲤疱疹病毒衣壳蛋白基因ORF72, 分析其蛋白结构与功能,成功获得ORF72基因开放阅读框共1 113 bp, 主要由α螺旋、β折叠、无规则卷曲3种二级结构组成。锦鲤疱疹病毒衣壳蛋白是病毒的重要组成部分[7-10]。
本研究发现,TK基因和ORF72基因的选育组和未选育组的相对表达量趋势相同,都是从24~144 h呈现上升趋势,144~288 h呈现下降趋势,其中144 h与120、168 h相比,病毒的表达量达到了显著性差异水平(P < 0.05)。2组都在144 h时病毒的表达量达到最高值,且选育组和未选育组趋势相同,说明病毒在体内增殖和表达的过程当中,机体对病毒产生了抗病免疫反应并逐渐增强,而在144 h之后,机体内脾、肾组织抗病毒的免疫性能达到最高程度,开始抑制病毒的表达,机体逐渐不再发病和出现死亡情况。比较TK基因和ORF72基因在不同感染阶段病毒的表达量时,在肾组织中TK基因在144 h时相较其他感染时期具有显著差异(P < 0.05), ORF72基因在144 h时相较其他感染时期具有极显著差异(P < 0.01), TK基因和ORF72基因表达量趋势相同,但是显著性水平不同,推测2个基因执行不同的功能。ORF72基因比TK基因显著性差异更大,说明应用ORF72基因研究病毒表达检测敏感性更高。
3.2 脾、肾组织中CyHV-3病毒表达量比较研究发现,鲤感染CyHV-3后在全身多个器官组织中均能检测到该病毒[20], 主要是在鲤的鳃、脾、肾中[21-22], 而脾、肾组织是鲤疱疹病毒感染的2个主要免疫组织[23], 因此本研究比较了脾、肾中病毒表达量情况。
结果显示,比较脾、肾组织在选育组与未选育组的表达量时,选育组与未选育组脾组织的表达量均低于肾组织,说明脾组织对疱疹病毒抗病性能强于肾组织。比较选育组与未选育组,未选育组在2个基因96、120、144 h时均达到了极显著水平,而在选育组中TK基因在96 h、ORF72基因在96 h和144 h均为显著性水平,说明经选育脾、肾2个组织对病毒免疫抗病性存在显著差异,其中肾组织选育效果更强,抗病免疫能力更高,因而下一步研究应以肾组织为主要研究对象,探讨鲤在疱疹病毒感染中免疫抗病机制,从而为其他鲤抗疱疹病毒新品种选育奠定重要基础。
3.3 选育组与未选育组病毒表达量比较白珊珊等[16]利用荧光定量PCR技术比较了F1、F2、F3世代选育免疫基因表达以及鲤疱疹病毒的病毒表达量。其结果表明,随抗病成活率的增加,在感染组F1、F2、F3中,CyHV-3病毒载量呈下降趋势,F3显著高于F1、F2(P < 0.05), 说明随着选育的进行和抗病性能的提高,病毒载量逐渐降低,F3的抗病力高且已经达到稳定阶段。
本研究以F4为研究对象,其抗病力更高,抗病性状更加稳定。研究结果显示,在脾、肾组织中ORF72和TK2个基因在选育组的病毒表达量均低于未选育组,由此可见选育组对病毒基因表达起到了显著免疫抗病作用,机体抑制病毒表达量能力能反映其抗病毒能力,说明选育对镜鲤抗疱疹病毒取得了显著的效果,选育组的抗病能力强于未选育组。比较选育组及未选育组在2个组织不同采样点的表达量,96~216 h, 2个基因表达量达到了极显著的差异,说明在此感染阶段中,选育组镜鲤抗疱疹病毒性能得到了显著提高,216 h后,选育组与未选育组无显著差异,并逐渐达到稳定。对TK基因,选育组与未选育组脾、肾组织均在96~168 h极显著差异表达,而ORF72基因脾组织在96~216 h、肾组织在96~192 h差异表达,不同基因显著差异表达与病毒基因功能有关,也进一步说明ORF72基因检测敏感性高于TK基因。以上研究结果说明,选育组免疫抗病性能较未选育组得到了极显著提高,说明F4抗病品系具有较高的抗病性能。
| [1] |
AOKI T, HIRONO I, KUROKAWA K, et al. Genome se-quences of three koi Herpesvirus isolates representing the expanding distribution of an emerging disease threatening koi and common carp worldwide[J]. Journal of Virology, 2007, 81(10): 5058-5065. DOI:10.1128/JVI.00146-07 |
| [2] |
PERELBERG A, SMIRNOV M, HUTORAN M, et al. Epidemiological description of a new viral disease afflicting cultured Cyprinus carpio in Israel[J]. The Israeli Journal of Aquaculture-Bamidgeh, 2003, 55(1): 5-12. |
| [3] |
张艳, 孟庆峰, 钱爱东, 等. 锦鲤疱疹病毒荧光定量PCR检测方法的建立[J]. 吉林畜牧兽医, 2010, 31(4): 11-14. ZHANG Y, MENG Q F, QIAN A D, et al. Establishment of a Flurogenic quantitative polymerase chain reaction assay for detection of Kio Hepesvirus[J]. Jilin Animal Husbandry and Veterinary Medicine, 2010, 31(4): 11-14. DOI:10.3969/j.issn.1672-2078.2010.04.004 |
| [4] |
SANFORD B, HOLINKA L G, O′DONNELL V, et al. Deletion of the thymidine kinase gene induces complete attenuation of the Georgia isolate of African swine fever virus[J]. Virus Research, 2016, 213: 165-171. DOI:10.1016/j.virusres.2015.12.002 |
| [5] |
GOMES NOLL J C, JOSHI L R, DO NASCIMENTO G M, et al. Deletion of the thymidine kinase gene attenuates Caprine alphaherpesvirus 1 in goats[J]. Veterinary Microbiology, 2019, 237: 108370. DOI:10.1016/j.vetmic.2019.07.022 |
| [6] |
李娜, 李恩杰, 王青华, 等. 美国白蛾核型多角体病毒ORF72原核表达载体的构建、表达及纯化[J]. 林业科学研究, 2018, 31(5): 57-63. LI N, LI E J, WANG Q H, et al. Construction, expression and purification of prokaryotic expression vector of Hyphantria cunea Nuclear Polyhedrosis virus ORF72[J]. Forest Research, 2018, 31(5): 57-63. |
| [7] |
TU C, LU Y P, HSIEH C Y, et al. Production of monoclonal antibody against ORF72 of Koi Herpesvirus Isolated in Taiwan[J]. Folia Microbiologica, 2014, 59(2): 159-165. DOI:10.1007/s12223-013-0261-7 |
| [8] |
ZHANG Y N, WU S Q, WANG J C, et al. Expression and purification of the Nucleocapsid protein of Schmallenberg virus, and preparation and characterization of a monoclonal antibody against this protein[J]. Protein Expression and Purification, 2013, 92(1): 1-8. DOI:10.1016/j.pep.2013.08.012 |
| [9] |
OUYANG P, RAKUS K, BOUTIER M, et al. The IL-10 homologue encoded by cyprinid Herpesvirus 3 is essential neither for viral replication in vitro nor for virulence in vivo[J]. Veterinary Research, 2013, 44(1): 53. DOI:10.1186/1297-9716-44-53 |
| [10] |
柯浩, 刘振兴, 林敏, 等. 锦鲤疱疹病毒囊膜蛋白ORF59的克隆、分析及其主要B细胞表位区的原核表达[J]. 南方水产, 2010, 6(4): 56-62. KE H, LIU Z X, LIN M, et al. Cloning, analysis of Koi herpesvirus envelope protein ORF59 and prokaryotic expression of major B cell epitope domain[J]. South China Fisheries Science, 2010, 6(4): 56-62. DOI:10.3969/j.issn.1673-2227.2010.04.010 |
| [11] |
KONG S Y, JIANG Y S, WANG Q, et al. Detection methods of cyprinid Herpesvirus 2 infection in silver Crucian Carp (Carassius auratus gibelio) via a pORF 72 monoclonal antibody[J]. Journal of Fish Diseases, 2017, 40(12): 1791-1798. DOI:10.1111/jfd.12648 |
| [12] |
李盈, 刘振兴, 马艳平, 等. 基于鲤疱疹病毒3型ORF65基因的DNA疫苗对建鲤鱼苗的免疫保护研究[J]. 南方水产科学, 2019, 15(4): 122-126. LI Y, LIU Z X, MA Y P, et al. Protection of Jian carp with immunization of CyHV-3 ORF65 DNA vaccine[J]. South China Fisheries Science, 2019, 15(4): 122-126. |
| [13] |
朱霞, 王好, 李新伟, 等. 锦鲤疱疹病毒病的研究进展[J]. 中国兽医科学, 2011, 41(1): 106-110. ZHU X, WANG H, LI X W, et al. Advances in koi herpesvirus disease[J]. Veterinary Science in China, 2011, 41(1): 106-110. |
| [14] |
朱日同. 鲤鱼疱疹病毒病的防控技术[J]. 河南水产, 2018(1): 14-15, 17. ZHU R T. Prevention and control techniques of carp herpesvirus disease[J]. Henan Fisheries, 2018(1): 14-15, 17. |
| [15] |
TAYLOR N G H, DIXON P F, JEFFERY K R, et al. Koi Herpesvirus: distribution and prospects for control in England and Wales[J]. Journal of Fish Diseases, 2010, 33(3): 221-230. DOI:10.1111/j.1365-2761.2009.01111.x |
| [16] |
白姗姗, 贾智英, 郎延贺, 等. CyHV-3感染镜鲤选育世代免疫基因表达及抗病能力比较[J]. 上海海洋大学学报, 2017, 26(5): 651-657. BAI S S, JIA Z Y, LANG Y H, et al. Comparisons of the immune gene expression and disease resistance between mirror carp breeding generations after CyHV-3 infection[J]. Journal of Shanghai Ocean University, 2017, 26(5): 651-657. |
| [17] |
ADAMEK M, SYAKURI H, HARRIS S, et al. Cyprinid Herpesvirus 3 infection disrupts the skin barrier of common carp (Cyprinus carpio L.)[J]. Veterinary Microbiology, 2013, 162(2/4): 456-470. |
| [18] |
王世会, 贾智英, 李池陶, 等. 锦鲤疱疹病毒ORF72基因克隆及结构功能分析[J]. 水产学杂志, 2016, 29(3): 9-15. WANG S H, JIA Z Y, LI C T, et al. Cloning and functional analysis of ORF72 gene in koi herpes virus[J]. Chinese Journal of Fisheries, 2016, 29(3): 9-15. DOI:10.3969/j.issn.1005-3832.2016.03.002 |
| [19] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [20] |
包卫空, 沈锦玉. 锦鲤疱疹病毒的鉴定及预防[J]. 水产养殖, 2015, 36(4): 45-48. BAO W K, SHEN J Y. Identification and prevention of Koi herpes virus disease[J]. Journal of Aquaculture, 2015, 36(4): 45-48. DOI:10.3969/j.issn.1004-2091.2015.04.009 |
| [21] |
GILAD O, YUN S S, ANDREE K B, et al. Initial characteristics of koi Herpesvirus and development of a polymerase chain reaction assay to detect the virus in Koi, Cyprinus carpio koi[J]. Diseases of Aquatic Organisms, 2002, 48(2): 101-108. |
| [22] |
周永灿, 袁军法, 任武泽, 等. 锦鲤疱疹病毒的检测与人工感染试验[J]. 武汉大学学报(理学版), 2005, 51(s2): 249-252. ZHOU Y C, YUAN J F, REN W Z, et al. Detection and experimental infection of koi Herpesvirus[J]. Journal of Wuhan University(Natural Science Edition), 2005, 51(s2): 249-252. |
| [23] |
白姗姗. 镜鲤不同选育世代对疱疹病毒(CyHV-3)抗病力评估[D]. 上海: 上海海洋大学, 2017. BAI S S. Evaluation of the resistance of different mirror carp breeding generations to CyHV-3[D]. Shanghai: Shanghai Ocean University, 2017. |
2. Key Laboratory of Aquatic Genomics, Ministry of Agriculture and Rural Affairs, Heilongjiang River Fisheries Research Institute, Harbin 150070, Heilongjiang, China;
3. Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


